2023-2024学年高一化学下学期期末复习 重难点04化学反应速率及平衡图像问题的分析(辽宁专用)(含解析)
文档属性
| 名称 | 2023-2024学年高一化学下学期期末复习 重难点04化学反应速率及平衡图像问题的分析(辽宁专用)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 10:46:24 | ||
图片预览




文档简介
重难点04 化学反应速率及平衡图像问题的分析
(21-22高一下·河北衡水·期末)
1.一定条件下,将3molX和1molY混合于2L恒容的密闭容器中,发生反应:。2min末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示。下列判断正确的是
A.当混合气体的密度不再改变时,该反应达到平衡状态
B.2min后,升温会使正反应速率增大,逆反应速率减小
C.从1min到2min过程中,气体的压强没有变化
D.反应过程中X和Y的转化率之比为3∶1
(22-23高一下·广东汕头·期末)
2.某温度下,在的恒容密闭容器中充入与的混合气体发生上述反应:与随时间的变化如图所示,下列说法正确的是
A.内,用表示该反应的平均反应速率
B.容器中混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
C.时,v(正)=v(逆)
D.的转化率:x点>y点
(22-23高一下·河北张家口·期末)
3.某研究小组为探究影响化学反应速率的因素,以反应为研究对象设计如下实验:在恒容密闭容器中,改变实验条件,得到反应物的浓度随反应时间的变化情况如图所示,已知初始时的起始浓度为0.下列说法错误的是
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.若实验②③只有一个条件不同,则实验③使用了催化剂
C.比较实验②④得出:升高温度,化学反应速率加快
D.内,实验②的平均反应速率
(22-23高一下·河南开封·期末)
4.一定条件下的密闭容器中,发生反应,和的物质的量浓度变化如图,下列说法正确的是
A.0~时间段的平均速率
B.平衡时:
C.时间段内,生成HI的物质的量为0.8mol
D.时刻时,的正反应速率大于逆反应速率
(22-23高一下·河南商丘·期末)
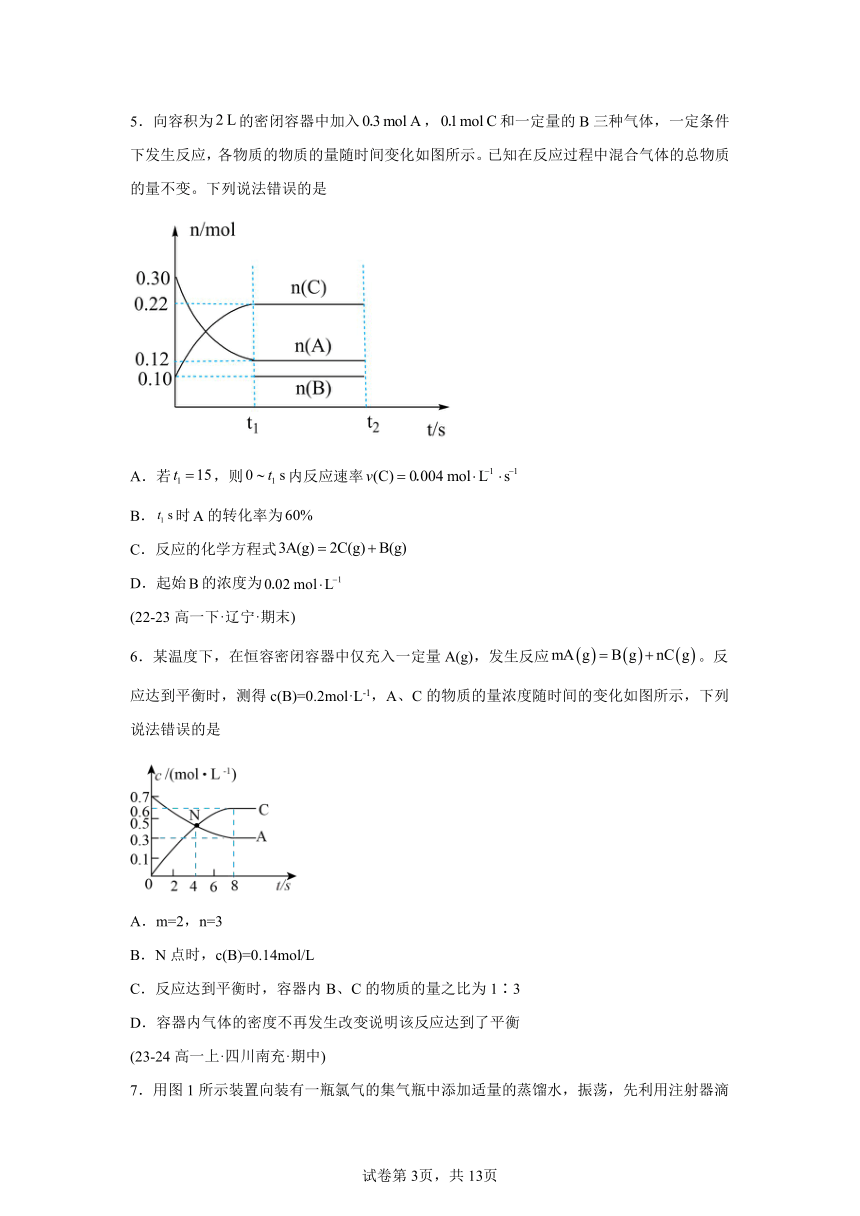
5.向容积为的密闭容器中加入,和一定量的B三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图所示。已知在反应过程中混合气体的总物质的量不变。下列说法错误的是
A.若,则内反应速率
B.时的转化率为
C.反应的化学方程式
D.起始的浓度为
(22-23高一下·辽宁·期末)
6.某温度下,在恒容密闭容器中仅充入一定量A(g),发生反应。反应达到平衡时,测得c(B)=0.2mol·L-1,A、C的物质的量浓度随时间的变化如图所示,下列说法错误的是
A.m=2,n=3
B.N点时,c(B)=0.14mol/L
C.反应达到平衡时,容器内B、C的物质的量之比为1∶3
D.容器内气体的密度不再发生改变说明该反应达到了平衡
(23-24高一上·四川南充·期中)
7.用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法不正确的是
A.阶段①说明氯气可溶于水,溶于水的氯气全部与水反应
B.阶段②的压强变小,该过程发生了氧化还原反应
C.阶段③发生反应的化学方程式为:2HCl+NaClO=Cl2↑+H2O+NaCl
D.若将Cl2换成CO2,所得的压强变化趋势与图2相似
(21-22高一下·四川广安·期末)
8.T℃时,在2L的密闭容器中,气体X、Y和Z三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是
A.容器中化学反应为
B.0~10s,Z表示的平均化学反应速率为
C.平衡时,体系内的压强与初始状态的压强相等
D.0~10s内,X的转化率为33.3%
(22-23高一下·湖南株洲·期末)
9.在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是
A.a点:正反应速率小于逆反应速率
B.b点:净反应速率等于零
C.上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2
D.该可逆反应在该反应条件下达到最大限度时,Y的平衡转化率为40%
(22-23高一下·重庆·期末)
10.,在密闭容器中投入一定量A、B,发生反应:。时反应达到平衡,生成C的物质的量为,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
A.前内,A的平均反应速率为
B.内,A和B反应放出的热量为
C.后,A的消耗速率等于B的生成速率
D.气体平均相对分子质量不再变化说明反应达到平衡状态
(22-23高一下·安徽芜湖·期末)
11.180℃时将和通入恒容密闭容器中,反应生成甲醇蒸气和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法正确的是
A.达到平衡时,和的转化率相等
B.内的平均反应速率为
C.在内,反应仍未达到平衡状态
D.当容器内混合气体压强不再变化时,不能表明反应已经达到平衡状态
(22-23高一下·浙江台州·期末)
12.在一定条件下,将SO2与足量O2置于恒温恒容密闭容器中发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,下列说法正确的是
A.反应的化学方程式为
B.2 min时,SO2的消耗速率等于SO2的产生速率
C.当容器内压强不再改变时,说明该反应达到了最大限度
D.0-6 min容器内的气体密度经历了从变化到不变的过程
(22-23高一下·河北沧州·期末)
13.还原钼矿(主要成分为)制备单质钼,能防止污染,反应原理为。在盛有一定比例的、粉末混合物的真空恒容密闭容器中通入,使其起始浓度为,发生上述反应,测得反应达到平衡状态时,气态物质的浓度随温度的变化如图所示。下列说法正确的是
A.曲线乙为不同温度时的浓度变化曲线
B.1300℃时,若达到平衡所需时间为ts,则
C.升高温度能加快该反应的反应速率
D.若缩小容器容积,压强增大,反应速率降低
(22-23高一下·江西南昌·期末)
14.用和催化合成乙烯的反应原理为:,向1L恒容密闭的催化反应器中充入和,测得温度对的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
A.容器内气体密度不变可以作为判断反应达到平衡状态的标志
B.生成乙烯的速率:M点一定大于N点
C.250℃时,反应5min后达到平衡状态,则5min内
D.升高温度,催化剂的催化效率降低
(22-23高一下·湖南益阳·期末)
15.某温度时,在0.5 L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
(1)该反应的化学方程式为 。
(2)第4 min时,正、逆反应速率的大小关系为:v(正) v(逆),(填“>”“<”或“=”)。
(3)下列措施能加快反应速率的是_______。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(22-23高一下·四川泸州·期末)
16.2023年政府工作报告提出要稳步推进节能降碳,工业上可将CO2与合成气(CO和H2)在催化剂作用下合成甲醇,以减少CO2的排放。有关反应的热化学方程式如下:
①;
②;
③。
回答下列问题:
(1)上述反应符合“原子经济性”的是 (选填序号)。
(2)计算c= (用a、b表示)。
(3)恒容密闭容器中,对于③反应,下列措施不能加快反应速率的是___________。
A.增加CO2浓度 B.加入催化剂 C.升高温度 D.降低压强
(4)在一定温度下,在体积为2L的密闭容器中,充入1molCO2和3molH2,控制条件按②反应进行,测得CH3OH的物质的量随时间变化如图。
①下列叙述能表示该反应达到平衡状态的是 (填标号)。
A. B.CO2的转化率不再改变
B.混合气体的密度不再改变 D.CO2与H2物质的量比不再变化
②CH3OH在0~5min内的平均反应速率为 mol/(L·min);比较0~5min与5min~15min两个时间段的平均反应速率大小并解释其变化的原因 。
(21-22高一下·福建三明·期末)
17.、、CO都是重要的能源物质,也是重要的化工原料。
(1)用一定质量的Zn跟足量的稀硫酸反应制氢气,实验过程如图所示。
①OE、EF、FG三段中, 段化学反应最块, 段收集的氢气最多。
②为了降低反应的速率且不影响氢气的量,可向溶液中加入的物质有 (填标号)。
a.蒸馏水 b.溶液 c.固体 d.固体
(2)已知:断裂1molH-H、1molO=O,1molH-O键吸收的能量依次为436kJ、498kJ、467kJ。在反应中,44.8L(标准状况)完全反应放出的能量为 。
(3)工业上可用CO和为原料制备,反应方程式为:。在体积固定的密闭容器中充入一定量的CO和,下列叙述能说明反应达到平衡状态的是_______(填标号)。
A.CO与的物质的量之比为1:1
B.混合气体的总压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mol
D.在混合气体中的质量分数保持不变
(4)为减少温室效应,有效利用,工业上可用生产甲醇。在体积为2L的密闭容器中充入1mol和3mol,一定条件下发生反应:,测得CHOH和的物质的量随时间变化如下图所示。
①从反应开始到平衡,的平均反应速率 。
②达到平衡时,的浓度为 。
(22-23高一下·黑龙江哈尔滨·期末)
18.以制备甲醇是实现“双碳”目标的重要途径。在体积为的密闭容器中,充入和,180℃下反应得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图如图:
(1)和化学反应方程式为 。
(2)内,氢气的平均反应速率为 。
(3)时,正反应速率 逆反应速率(填“>”“<”或“=”)。
(4)能说明上述反应达到平衡状态的是___________(填字母)。
A.的生成速率是生成速率的3倍
B.混合气体的密度不随时间的变化而变化
C.反应中与的物质的量浓度之比为
D.混合气体的平均相对分子质量不随时间的变化而变化
(5)上述体系达到平衡时,混合气体中甲醇的体积分数为 。(保留三位有效数字)
(6)其他条件不变,将该恒容容器改为体积可变的恒压容器,初始体积为。某时刻,测得的转化率为60%,此时容器体积为,则等于 。
(22-23高一下·甘肃临夏·期末)
19.甲醇()既是重要的化工原料,也是性能优良的能源,利用生产甲醇是实现“碳中和”的重要途径之一。在体积为2L的恒容密闭容器中,充入1.0mol 和3.0mol ,一定条件下发生反应,测得和的物质的量随时间的变化如图所示。
(1)t=3 min时,M点正反应速率 逆反应速率(填“>”“<”或“=”,下同),t=15 min时,正反应速率 逆反应速率。
(2)反应达到平衡时,消耗的物质的量为 mol,的转化率为 ,的体积分数为 。
(3)下列事实能说明该反应达到平衡状态的是_______(填字母)。
A. B.体系压强不再变化
C.容器内气体的密度不再变化 D.容器内混合气体的平均摩尔质量不再变化
(4)若其他条件不变,反应开始充入2 mol氦气,反应达到最大限度所需时间t 10 min(填“>”“<”或“=”)。
(22-23高一下·湖南邵阳·期末)
20.I.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为两种无毒气体。T ℃时,将0.8 mol NO和0.8 mol CO充入容积为2 L的密闭容器中,模拟汽车尾气转化,容器中NO的物质的量随时间变化如图所示。
(1)NO、CO转化为两种无毒气体的化学方程式是 。
(2)反应开始至10 min,v(NO)= mol/(L·min)。
(3)下列说法正确的是 。
a.新型催化剂可以加快NO、CO的转化
b.该反应进行到10 min时达到化学平衡状态
c.平衡时CO的浓度是0.4 mol/L
Ⅱ.在恒温下,将4mol的H2(g)和2mol的CO(g)充入1L恒容的密闭容器中发生如下反应:CO(g) + 2H2(g)CH3OH(g)。下图是CO(g)和 CH3OH(g)的浓度随时间变化的关系图,
回答下列问题:
(4)0-5min内,H2 (g)的平均反应速率是 mol/(L·min)。
(5)12min时,v正 v逆(填“>”“<”或“=”)。
(6)设起始压强为P,平衡时压强为P0,则的值为 。
(7)根据反应原理下列描述能说明反应达到最大限度的是___________。
A.CO(g)、H2(g)、CH3OH(g)的物质的量比为1∶2∶1
B.混合气体的压强不随时间的变化而改变
C.单位时间内每消耗2amolH2(g),同时生成amolCH3OH(g)
D.反应速率:v(H2)=2v(CO)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.Z为固体,反应前后气体的密度是变量,因此当混合气体的密度不再改变时,该反应一定达到平衡状态,故A正确;
B.升温正、逆反应速率都增大,故B错误;
C.从到过程中,生成固体Z,且化学计量数减小,气体压强会减小,故C错误;
D.将和两种气体混合于固定容积为的密闭容器中,A和B是按照化学计量数之比3:1通入的,所以反应过程中X和Y的转化率之比为1∶1,故D错误;
故答案选A。
2.B
【详解】A.由图可知,内,用表示该反应的平均反应速率,A错误;
B.混合气体的平均摩尔质量为M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,B正确;
C.后甲烷量仍继续增加,故时,v(正)>v(逆),C错误;
D.y点反应的二氧化碳的量更大,故的转化率:x点故选B。
3.D
【详解】A.实验①②温度相同,时间相同,反应物浓度不同,浓度越大反应速率快,故增大反应物浓度,化学反应速率加快,A正确;
B.实验②③温度相同,时间相同,实验③速率快,则是使用了催化剂,B正确;
C.实验②④对比,④温度高,先平衡,则升高温度,化学反应速率加快,C正确;
D.0 10min内,实验②的平均反应速率v(HI)=反应速率之比等于化学计量数之比,则v(H2)=v(HI)=0.01mol L 1 min 1 ,D错误;
故答案为:D。
4.D
【详解】A.速率之比等于计量系数之比,,则平均速率,故A错误;
B.时刻浓度不再变化,说明达到平衡,题目中未知,所以平衡时不一定有,故B错误;
C.时间段内,HI的物质的量浓度增加了0.8 mol/L,体积未知,无法求算HI的物质的量,故C错误;
D.时刻时,未达到平衡,根据图中信息得到该反应是正向建立平衡,则的正反应速率大于逆反应速率,故D正确。
综上所述,答案为D。
5.C
【分析】可结合题目信息列出三段式:
【详解】A.由分析知,,A不符合题意;
B.时A的转化率为,B不符合题意;
C.该反应的化学方程式为,为可逆反应,C符合题意;
D.起始B的物质的量为,则浓度为,D不符合题意;
故选C。
6.D
【详解】A.反应达到平衡时,测得c(B)=2mol·L-1,故可知
0.7-0.2m=0.3,0.2n=0.6,故m=2,n=3,A正确;
B.N点时,A、C两个物质的浓度相同,设A消耗了2x mol/L,则C应该生成3x mol/L,B应该生成x mol,则有0.7-2x=3x,x=0.14mol/L,故c(B)=0.14mol/L,B正确;
C.反应达到平衡时,容器内B、C的浓度分别为0.2mol/L、0.6mol/L,由于体积相同,故物质的量之比为1∶3,C正确;
D.气体的总质量不变,恒容容器说明体积不变,故密度一直不变,因此当密度不再发生改变不能说明该反应达到了平衡,D错误;
故选D。
7.A
【详解】A.阶段①说明氯气溶于水,但溶于水的氨气只是部分与水反应生成盐酸和次氯酸,A错误;
B.阶段②的压强变小,是因为氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,该过程中Cl元素的化合价发生了变化,因此发生了氧化还原反应,B正确;
C.阶段③压强又逐渐增大,说明有气体生成,该气体是氯气,根据原子守恒、电子守恒,可知发生反应的化学方程式为:2HCl+NaClO=Cl2↑+H2O+NaCl ,C正确;
D.若将Cl2换成CO2,二氧化碳能溶于水,但溶解度不大,加入氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,最后加入盐酸又产生二氧化碳,因此所得的压强变化趋势与图2相似,D正确;
故合理选项是A。
8.C
【详解】A.由图象可知,反应在10s时达到化学平衡,此时X、Y分别减少了0.8mol、0.8mol,为反应物,Z增加了1.6mol,为生成物,结合物质的量变化量之比等于化学计量数之比可知,反应的化学方程式为:X(g)+Y(g) 2Z(g),A错误;
B.0~10 s,Z表示的平均化学反应速率为=,B错误;
C.由方程式X(g)+Y(g) 2Z(g)可知,该反应为反应前后气体分子数不变的反应,因此平衡时,体系内的压强与初始状态的压强相等,C正确;
D.由图象可知,X的初始物质的量为1.2mol,0~10s内,X的转化量为0.8mol,X的转化率为100%≈66.7%,D错误;
答案选C。
9.A
【详解】A.a点未达到平衡,正反应速率大于逆反应速率,A项错误;
B.b点达到平衡,正,逆反应速率相等,净反应速率等于0,B项正确;
C.根据速率之比等于化学计量数之比知,X,Y,Z的化学计量数之比为0.6:0.2:0.4=3:1:2,C项正确;
D.达到平衡时Y消耗0.2mol/L,Y的转化率为40%,D项正确;
答案选A。
10.D
【详解】A.由图可知,前12s内A浓度变化0.6mol/L,则平均反应速率,故A错误;
B.前12s内,A浓度变化0.6mol/L,A物质的量变化0.6mol/L×2L=1.2mol,根据,则12s内A和B反应放出的热量为,故B错误;
C.由图可知12s内,A浓度变化0.6mol/L,B浓度变化0.2mol/L,C浓度变化,三者浓度变化比值为3:1:2,说明b=1、c=2,则反应为,12s后反应达到平衡,各物质正逆反应速率比等于计量数之比,则,故C错误;
D.结合选项C分析可知 正反应方向为物质的量减小的反应,而反应过程中气体总质量不变,根据可知气体平均相对分子质量为变量,不再变化说明反应达到平衡状态,故D正确;
答案选D。
11.B
【分析】由题图知,消耗n(CO2)=(1-0.9)mol=0.1mol,消耗n(H2)=(0.5-0.2)mol=0.3mol,生成n(CH3OH)=0.1mol,同一反应中参加反应的各物质的物质的量之比等于其化学计量数之比,则参加反应的n(CO2):n(H2):n(CH,OH)=0.1mol:0.3mol:0.1mol=1:3:1,根据原子守恒知,还生成H2O,所以化学方程式为,在3min时各物质的物质的量保持不变,反应达到平衡状态,据此分析解答。
【详解】A.在3min时各物质的物质的量保持不变,反应达到平衡状态,此时和的转化率分别为、,二者转化率不相等,A错误;
B.内的平均反应速率为,B正确;
C.在3min时各物质的物质的量不变,反应达到平衡状态,则在内,反应达到平衡状态,C错误;
D.反应前后气体总质量不变、容器体积不变,则反应前后气体密度始终不变,所以气体密度不能作为平衡状态的判断标准,D错误;
故选B。
12.C
【详解】A.由图像知反应体系中反应物和生成物共存,故该反应为可逆反应,A错误;
B.2min时该反应并未达到平衡,从正反应方向建立平衡,故SO2的消耗速率大于SO2的产生速率,B错误;
C.恒温恒容体系压强与气体物质的量成正比且该反应为非等体积反应,当容器内压强不再改变时,说明该反应达到了该条件下的平衡状态即最大限度,C正确;
D.,恒容容器V不变,反应只涉及气体遵循化学反应的质量守恒即m不变,故密度始终是个定值,D错误;
故选C。
13.C
【分析】反应物只有一种气体,生成物有两种气体,图像描述的是平衡后的气态物质的浓度随温度的变化,甲和乙的变化趋势相同,故甲和乙代表的是生成物,又因为水蒸气的浓度是一氧化碳浓度的两倍,故甲代表水蒸气,乙代表一氧化碳,据此作答;
【详解】A.由分析可知,甲为的浓度变化曲线,乙是的浓度变化曲线,A错误;
B.1300℃时,,,B错误;
C.任何化学反应,升温能加快反应速率,C项正确;
D.若缩小容器容积,则气体物质的浓度增大,反应速率加快,D错误;
故选C。
14.C
【详解】A.,m、V不变,密度不可以作为判断反应达到平衡状态的标志,A错误;
B.温度升高使反应速率增大的程度与催化剂失去活性使反应速率减小的程度无法比较大小,则N点和M点生成乙烯速率快慢无法判断,B错误;
C.根据题意,H2和CO2的投料比等于改反应的系数之比,则平衡是图示CO2平衡转化率50%,H2平衡转化率也为50%,故,C正确;
D.250℃之前,温度升高,催化剂的催化效率升高,D错误;
故选C。
15.(1)3A(g)2B(g)
(2)>
(3)BD
【详解】(1)根据图像可知:在从反应开始至不再变化时,A物质的量减小0.6 mol,B物质的量增加了0.4 mol,后来两种物质都存在,且它们的物质的量不再发生变化,说明A是反应物,B是生成物,它们发生反应的物质的量的比是3:2,且该反应是可逆反应,故反应方程式为:3A(g)2B(g);
(2)根据图像可知:反应在第4min时,A的物质的量还在减少,B的物质的量还在增加,说明4 min 时反应正向进行,未达到平衡状态,故此时正、逆反应速率的大小关系为:v(正)>v(逆);
(3)A.恒温恒容充入He气,反应混合物中各组分气体的浓度不变,化学反应速率不变,A不符合题意;
B.缩小体积,使压强增大,导致气体物质的浓度增大,反应速率加快,B符合题意;
C.恒温恒压充入He气,会使容器的容积扩大,反应混合物的浓度减小,反应速率减慢,C不符合题意;
D.使用催化剂,会使反应速率成千上万倍的扩大,故反应速率加快,D符合题意;
故合理选项是BD。
16.(1)①
(2)b-a
(3)D
(4) AB 0.06mol·L-1·min-1 0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢
【详解】(1)原子经济性是反应物的原子有多少进入产物,进入越多原子经济性越高,只有反应①中所有原子都进入产物,原子经济性为100%,故最高;
故答案为:①。
(2)根据盖斯定律可知,反应③可以由②-①得到,故c=b-a;
故答案为:b-a。
(3)A.恒容密闭容器中,对于③反应,增加CO2浓度,反应物浓度增加,反应速率增加,A不符合;
B.恒容密闭容器中,对于③反应,加入催化剂,可以加快反应速率,B不符合;
C.恒容密闭容器中,对于③反应,温度升高,反应速率加快,C不符合;
D.恒容密闭容器中,对于③反应,降低压强,只能降低浓度,故反应速率降低,D符合;
故答案为:D。
(4)A.根据反应②可知,3v正(CO2)=v正(H2) ,当3v正(CO2)=v逆(H2) 时,则v正(H2) =v逆(H2) ,则反应达到平衡,A正确;
B.CO2的转化率不再改变,说明生成物的浓度不改变,则反应达到平衡,B正确;
C.反应容器为恒容,反应物和生成物都是气体,反应前后质量不变,体积不变,混合气体的密度一直不变,无法判断是否平衡,C错误;
D.CO2与H2投料比和化学计量数之比相等,物质的量比一直不变,D错误;
综上所述AB正确;
CH3OH在0~5min内的平均反应速率为;0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢;
故答案为:AB;0.06mol·L-1·min-1;0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢。
17.(1) EF EF ab
(2)498kJ
(3)BD
(4) 0.0375 0.375
【详解】(1)①OE、EF、FG三段中,从图中曲线的斜率可看出,EF段化学反应最块,三段中EF段的纵坐标升高最大,EF段收集的氢气最多;
②a.蒸馏水,稀释氢离子浓度,反应速率下降,且总量不变,符合题意; b.溶液,稀释氢离子浓度,反应速率下降,且总量不变,符合题意;c.固体,溶液生成HNO3,反应得到NO,H2的量减少,不符合题意;d.固体,得到Cu2+先与Zn反应,Zn的量减少,氢气总量下降,不符合题意;故选ab。
(2)依题意,44.8L(标准状况)物质的量为2mol,完全反应放出的能量为形成生成物放出总能量减去断裂反应物吸收总能量,即467kJ×2×2-436kJ×2-498kJ=498kJ。
(3)A. CO与的物质的量之比为1:1,不能说明其量保持不变,故不能说明反应达到平衡状态,A不符合题意;
B. 该反应气体分子说发生改变,容器体积固定,故混合气体的总压强不随时间的变化而变化,说明反应达到平衡状态,B符合题意;
C. 单位时间内每消耗1molCO,同时生成1mol,二者均是指正反应速率,不能说明正逆反应速率相等,故不能说明反应达到平衡状态,C不符合题意;
D. 是生成物,其在混合气体中的质量分数保持不变,说明反应达到平衡状态,D符合题意;
故选BD。
(4)①从反应开始到平衡,的改变量是1.00-0.25=0.75(mol),用时10min,容器体积为2L,故平均反应速率=0.0375mol·L-1·min-1;
②达到平衡时,CO2减少了0.75mol,则减少了0.75×3=2.25(mol),则平衡时H2的物质的量为3-2.25=0.75(mol),其浓度为=0.375mol/L。
18.(1)
(2)
(3)=
(4)AD
(5)7.69%
(6)
【详解】(1)根据图示之比等于计量系数之比以及元素守恒可知和化学反应方程式为;
(2)内,氢气的平均反应速率为;
(3)由图可知,6min时反应达到平衡状态,正反应速率=逆反应速率;
(4)A.H2的生成速率是H2O生成速率的3倍,即v逆 (H2) =3v正 (H2O),正逆反应速率之比符合反应计量数之比,反应达到平衡状态,故A正确; B.反应体系中各物质均为气体,则混合气体的密度始终不变,即混合气体的密度不随时间的变化而变化的状态不一定是平衡状态,故B错误; C.反应中CO2与CH3OH的物质的量浓度之比为1:1的状态不一定是平衡状态,与反应物的起始量和转化率有关,故C错误; D.正反应是气体分子数减小的反应,混合气体的质量不变,则混合气体的平均相对分子质量不随时间的变化而变化的状态是平衡状态,故D正确
(5)达到平衡时n (CH3OH) =0.1mol,反应物总量为1.5mol,反应为,则混合气体的变化量,则混合气体的总量为,甲醇的体积分数为;
(6)起始时反应物总量为1.5mol,某时刻,测得H2的转化率为60%,即,反应为,则混合气体的变化量,则混合气体的总量为1.5mol-0.2mol=1.3mol,恒温恒压条件下气体的体积之比等于其物质的量之比,所以=1.5mol:1.3mol=15:13。
19.(1) > =
(2) 0.75 75% 30%
(3)BD
(4)=
【详解】(1)从图中可知,3min时,M点CH3OH的物质的量呈增大的趋势,CO2物质的量呈减小的趋势,说明此时反应仍正向进行,正反应速率>逆反应速率。15min时,反应达到平衡,正逆反应速率相等。
(2)CO2初始物质的量为1mol,平衡时物质的量为0.25mol,消耗CO2的物质的量为0.75mol。反应从开始到平衡消耗CO20.75mol,则根据方程式可知消耗H22.25mol,氢气的转化率为2.25mol÷3mol=75%。平衡时有CH3OH0.75mol,CO20.25mol,H20.75mol,H2O0.75mol,则CH3OH的体积分数为0.75mol÷(0.25mol+0.75mol+0.75mol+0.75mol)=30%。
(3)A.v正(CO2)=v逆(CH3OH)=0,说明反应已经停止,未达到平衡状态,A错误;
B.该反应不是等体积反应且在恒容密闭容器中进行,随着反应进行,容器内压强不断变化,压强不变说明反应达到平衡,B正确;
C.该反应在恒容密闭容器中进行且反应物和生成物都是气体,无论是否达到平衡,气体的密度始终不变,C错误;
D.该反应不是等体积反应,随着反应进行,容器内混合气体的平均摩尔质量不断变化,混合气体平均摩尔质量不变说明反应达到平衡,D正确;
故答案选BD。
(4)其他条件不变,反应开始时充入2mol氦气,反应物和生成物的浓度均不变,且氦气不参与反应,故反应速率不变,化学平衡不移动,反应达到最大限度所需时间t=10min。
20.(1)2CO+2NON2+2CO2
(2)0.02
(3)ab
(4)0.4
(5)=
(6)或0.5
(7)B
【详解】(1)NO、CO转化为两种无毒气体,产物为CO2和N2,反应的化学方程式是2CO+2NON2+2CO2;
(2)反应开始至10 min,NO的物质的量减少0.4mol,v(NO)= 0.02mol/(L·min)。
(3)a.催化剂能加快反应速率,新型催化剂可以加快NO、CO的转化,故a正确;
b.根据图示,该反应进行到10 min时NO物质的量不再改变,反应达到化学平衡状态,故b正确;
c.反应开始到平衡消耗0.4molNO,则同时消耗0.4molCO,平衡时CO的浓度是=0.2 mol/L,故c错误;
选ab;
(4)0-5min内,CO的浓度降低1.0mol/L,则H2的浓度降低2mol/L,H2 (g)的平均反应速率是mol/(L·min)。
(5)根据图示,12min时,各位置浓度不再改变,反应达到平衡状态,v正=v逆。
(6)将4mol的H2(g)和2mol的CO(g)充入1L恒容的密闭容器中发生反应:CO(g) + 2H2(g)CH3OH(g),达到平衡状态甲醇的物质的量为1.5mol。
设起始压强为P,平衡时压强为P0,同温同体积,压强比等于物质的量比,则的值为。
(7)A.反应达到平衡状态,各物质的量浓度不再改变,CO(g)、H2(g)、CH3OH(g)的物质的量比为1∶2∶1,不能判断物质的量是否还发生改变,反应不一定平衡,故不选A;
B.反应前后气体系数和不同,压强是变量,混合气体的压强不随时间的变化而改变,反应一定达到平衡状态,故选B;
C.单位时间内每消耗2amolH2(g),同时生成amolCH3OH(g),不能判断正逆反应速率是否相等,反应不一定平衡,故不选C;
D.反应速率:v(H2)=2v(CO),不能判断正逆反应速率是否相等,反应不一定平衡,故不选D;
选B。
答案第1页,共2页
答案第1页,共2页
(21-22高一下·河北衡水·期末)
1.一定条件下,将3molX和1molY混合于2L恒容的密闭容器中,发生反应:。2min末该反应达到平衡,生成W的物质的量随时间的变化情况如图所示。下列判断正确的是
A.当混合气体的密度不再改变时,该反应达到平衡状态
B.2min后,升温会使正反应速率增大,逆反应速率减小
C.从1min到2min过程中,气体的压强没有变化
D.反应过程中X和Y的转化率之比为3∶1
(22-23高一下·广东汕头·期末)
2.某温度下,在的恒容密闭容器中充入与的混合气体发生上述反应:与随时间的变化如图所示,下列说法正确的是
A.内,用表示该反应的平均反应速率
B.容器中混合气体的平均相对分子质量不再发生改变时,该反应达到平衡
C.时,v(正)=v(逆)
D.的转化率:x点>y点
(22-23高一下·河北张家口·期末)
3.某研究小组为探究影响化学反应速率的因素,以反应为研究对象设计如下实验:在恒容密闭容器中,改变实验条件,得到反应物的浓度随反应时间的变化情况如图所示,已知初始时的起始浓度为0.下列说法错误的是
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.若实验②③只有一个条件不同,则实验③使用了催化剂
C.比较实验②④得出:升高温度,化学反应速率加快
D.内,实验②的平均反应速率
(22-23高一下·河南开封·期末)
4.一定条件下的密闭容器中,发生反应,和的物质的量浓度变化如图,下列说法正确的是
A.0~时间段的平均速率
B.平衡时:
C.时间段内,生成HI的物质的量为0.8mol
D.时刻时,的正反应速率大于逆反应速率
(22-23高一下·河南商丘·期末)
5.向容积为的密闭容器中加入,和一定量的B三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图所示。已知在反应过程中混合气体的总物质的量不变。下列说法错误的是
A.若,则内反应速率
B.时的转化率为
C.反应的化学方程式
D.起始的浓度为
(22-23高一下·辽宁·期末)
6.某温度下,在恒容密闭容器中仅充入一定量A(g),发生反应。反应达到平衡时,测得c(B)=0.2mol·L-1,A、C的物质的量浓度随时间的变化如图所示,下列说法错误的是
A.m=2,n=3
B.N点时,c(B)=0.14mol/L
C.反应达到平衡时,容器内B、C的物质的量之比为1∶3
D.容器内气体的密度不再发生改变说明该反应达到了平衡
(23-24高一上·四川南充·期中)
7.用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加NaOH溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法不正确的是
A.阶段①说明氯气可溶于水,溶于水的氯气全部与水反应
B.阶段②的压强变小,该过程发生了氧化还原反应
C.阶段③发生反应的化学方程式为:2HCl+NaClO=Cl2↑+H2O+NaCl
D.若将Cl2换成CO2,所得的压强变化趋势与图2相似
(21-22高一下·四川广安·期末)
8.T℃时,在2L的密闭容器中,气体X、Y和Z三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是
A.容器中化学反应为
B.0~10s,Z表示的平均化学反应速率为
C.平衡时,体系内的压强与初始状态的压强相等
D.0~10s内,X的转化率为33.3%
(22-23高一下·湖南株洲·期末)
9.在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是
A.a点:正反应速率小于逆反应速率
B.b点:净反应速率等于零
C.上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2
D.该可逆反应在该反应条件下达到最大限度时,Y的平衡转化率为40%
(22-23高一下·重庆·期末)
10.,在密闭容器中投入一定量A、B,发生反应:。时反应达到平衡,生成C的物质的量为,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是
A.前内,A的平均反应速率为
B.内,A和B反应放出的热量为
C.后,A的消耗速率等于B的生成速率
D.气体平均相对分子质量不再变化说明反应达到平衡状态
(22-23高一下·安徽芜湖·期末)
11.180℃时将和通入恒容密闭容器中,反应生成甲醇蒸气和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法正确的是
A.达到平衡时,和的转化率相等
B.内的平均反应速率为
C.在内,反应仍未达到平衡状态
D.当容器内混合气体压强不再变化时,不能表明反应已经达到平衡状态
(22-23高一下·浙江台州·期末)
12.在一定条件下,将SO2与足量O2置于恒温恒容密闭容器中发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,下列说法正确的是
A.反应的化学方程式为
B.2 min时,SO2的消耗速率等于SO2的产生速率
C.当容器内压强不再改变时,说明该反应达到了最大限度
D.0-6 min容器内的气体密度经历了从变化到不变的过程
(22-23高一下·河北沧州·期末)
13.还原钼矿(主要成分为)制备单质钼,能防止污染,反应原理为。在盛有一定比例的、粉末混合物的真空恒容密闭容器中通入,使其起始浓度为,发生上述反应,测得反应达到平衡状态时,气态物质的浓度随温度的变化如图所示。下列说法正确的是
A.曲线乙为不同温度时的浓度变化曲线
B.1300℃时,若达到平衡所需时间为ts,则
C.升高温度能加快该反应的反应速率
D.若缩小容器容积,压强增大,反应速率降低
(22-23高一下·江西南昌·期末)
14.用和催化合成乙烯的反应原理为:,向1L恒容密闭的催化反应器中充入和,测得温度对的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
A.容器内气体密度不变可以作为判断反应达到平衡状态的标志
B.生成乙烯的速率:M点一定大于N点
C.250℃时,反应5min后达到平衡状态,则5min内
D.升高温度,催化剂的催化效率降低
(22-23高一下·湖南益阳·期末)
15.某温度时,在0.5 L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:
(1)该反应的化学方程式为 。
(2)第4 min时,正、逆反应速率的大小关系为:v(正) v(逆),(填“>”“<”或“=”)。
(3)下列措施能加快反应速率的是_______。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(22-23高一下·四川泸州·期末)
16.2023年政府工作报告提出要稳步推进节能降碳,工业上可将CO2与合成气(CO和H2)在催化剂作用下合成甲醇,以减少CO2的排放。有关反应的热化学方程式如下:
①;
②;
③。
回答下列问题:
(1)上述反应符合“原子经济性”的是 (选填序号)。
(2)计算c= (用a、b表示)。
(3)恒容密闭容器中,对于③反应,下列措施不能加快反应速率的是___________。
A.增加CO2浓度 B.加入催化剂 C.升高温度 D.降低压强
(4)在一定温度下,在体积为2L的密闭容器中,充入1molCO2和3molH2,控制条件按②反应进行,测得CH3OH的物质的量随时间变化如图。
①下列叙述能表示该反应达到平衡状态的是 (填标号)。
A. B.CO2的转化率不再改变
B.混合气体的密度不再改变 D.CO2与H2物质的量比不再变化
②CH3OH在0~5min内的平均反应速率为 mol/(L·min);比较0~5min与5min~15min两个时间段的平均反应速率大小并解释其变化的原因 。
(21-22高一下·福建三明·期末)
17.、、CO都是重要的能源物质,也是重要的化工原料。
(1)用一定质量的Zn跟足量的稀硫酸反应制氢气,实验过程如图所示。
①OE、EF、FG三段中, 段化学反应最块, 段收集的氢气最多。
②为了降低反应的速率且不影响氢气的量,可向溶液中加入的物质有 (填标号)。
a.蒸馏水 b.溶液 c.固体 d.固体
(2)已知:断裂1molH-H、1molO=O,1molH-O键吸收的能量依次为436kJ、498kJ、467kJ。在反应中,44.8L(标准状况)完全反应放出的能量为 。
(3)工业上可用CO和为原料制备,反应方程式为:。在体积固定的密闭容器中充入一定量的CO和,下列叙述能说明反应达到平衡状态的是_______(填标号)。
A.CO与的物质的量之比为1:1
B.混合气体的总压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mol
D.在混合气体中的质量分数保持不变
(4)为减少温室效应,有效利用,工业上可用生产甲醇。在体积为2L的密闭容器中充入1mol和3mol,一定条件下发生反应:,测得CHOH和的物质的量随时间变化如下图所示。
①从反应开始到平衡,的平均反应速率 。
②达到平衡时,的浓度为 。
(22-23高一下·黑龙江哈尔滨·期末)
18.以制备甲醇是实现“双碳”目标的重要途径。在体积为的密闭容器中,充入和,180℃下反应得甲醇(沸点64.7℃)和物质X,测得各物质物质的量随时间的部分变化图如图:
(1)和化学反应方程式为 。
(2)内,氢气的平均反应速率为 。
(3)时,正反应速率 逆反应速率(填“>”“<”或“=”)。
(4)能说明上述反应达到平衡状态的是___________(填字母)。
A.的生成速率是生成速率的3倍
B.混合气体的密度不随时间的变化而变化
C.反应中与的物质的量浓度之比为
D.混合气体的平均相对分子质量不随时间的变化而变化
(5)上述体系达到平衡时,混合气体中甲醇的体积分数为 。(保留三位有效数字)
(6)其他条件不变,将该恒容容器改为体积可变的恒压容器,初始体积为。某时刻,测得的转化率为60%,此时容器体积为,则等于 。
(22-23高一下·甘肃临夏·期末)
19.甲醇()既是重要的化工原料,也是性能优良的能源,利用生产甲醇是实现“碳中和”的重要途径之一。在体积为2L的恒容密闭容器中,充入1.0mol 和3.0mol ,一定条件下发生反应,测得和的物质的量随时间的变化如图所示。
(1)t=3 min时,M点正反应速率 逆反应速率(填“>”“<”或“=”,下同),t=15 min时,正反应速率 逆反应速率。
(2)反应达到平衡时,消耗的物质的量为 mol,的转化率为 ,的体积分数为 。
(3)下列事实能说明该反应达到平衡状态的是_______(填字母)。
A. B.体系压强不再变化
C.容器内气体的密度不再变化 D.容器内混合气体的平均摩尔质量不再变化
(4)若其他条件不变,反应开始充入2 mol氦气,反应达到最大限度所需时间t 10 min(填“>”“<”或“=”)。
(22-23高一下·湖南邵阳·期末)
20.I.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为两种无毒气体。T ℃时,将0.8 mol NO和0.8 mol CO充入容积为2 L的密闭容器中,模拟汽车尾气转化,容器中NO的物质的量随时间变化如图所示。
(1)NO、CO转化为两种无毒气体的化学方程式是 。
(2)反应开始至10 min,v(NO)= mol/(L·min)。
(3)下列说法正确的是 。
a.新型催化剂可以加快NO、CO的转化
b.该反应进行到10 min时达到化学平衡状态
c.平衡时CO的浓度是0.4 mol/L
Ⅱ.在恒温下,将4mol的H2(g)和2mol的CO(g)充入1L恒容的密闭容器中发生如下反应:CO(g) + 2H2(g)CH3OH(g)。下图是CO(g)和 CH3OH(g)的浓度随时间变化的关系图,
回答下列问题:
(4)0-5min内,H2 (g)的平均反应速率是 mol/(L·min)。
(5)12min时,v正 v逆(填“>”“<”或“=”)。
(6)设起始压强为P,平衡时压强为P0,则的值为 。
(7)根据反应原理下列描述能说明反应达到最大限度的是___________。
A.CO(g)、H2(g)、CH3OH(g)的物质的量比为1∶2∶1
B.混合气体的压强不随时间的变化而改变
C.单位时间内每消耗2amolH2(g),同时生成amolCH3OH(g)
D.反应速率:v(H2)=2v(CO)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.Z为固体,反应前后气体的密度是变量,因此当混合气体的密度不再改变时,该反应一定达到平衡状态,故A正确;
B.升温正、逆反应速率都增大,故B错误;
C.从到过程中,生成固体Z,且化学计量数减小,气体压强会减小,故C错误;
D.将和两种气体混合于固定容积为的密闭容器中,A和B是按照化学计量数之比3:1通入的,所以反应过程中X和Y的转化率之比为1∶1,故D错误;
故答案选A。
2.B
【详解】A.由图可知,内,用表示该反应的平均反应速率,A错误;
B.混合气体的平均摩尔质量为M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,B正确;
C.后甲烷量仍继续增加,故时,v(正)>v(逆),C错误;
D.y点反应的二氧化碳的量更大,故的转化率:x点
3.D
【详解】A.实验①②温度相同,时间相同,反应物浓度不同,浓度越大反应速率快,故增大反应物浓度,化学反应速率加快,A正确;
B.实验②③温度相同,时间相同,实验③速率快,则是使用了催化剂,B正确;
C.实验②④对比,④温度高,先平衡,则升高温度,化学反应速率加快,C正确;
D.0 10min内,实验②的平均反应速率v(HI)=反应速率之比等于化学计量数之比,则v(H2)=v(HI)=0.01mol L 1 min 1 ,D错误;
故答案为:D。
4.D
【详解】A.速率之比等于计量系数之比,,则平均速率,故A错误;
B.时刻浓度不再变化,说明达到平衡,题目中未知,所以平衡时不一定有,故B错误;
C.时间段内,HI的物质的量浓度增加了0.8 mol/L,体积未知,无法求算HI的物质的量,故C错误;
D.时刻时,未达到平衡,根据图中信息得到该反应是正向建立平衡,则的正反应速率大于逆反应速率,故D正确。
综上所述,答案为D。
5.C
【分析】可结合题目信息列出三段式:
【详解】A.由分析知,,A不符合题意;
B.时A的转化率为,B不符合题意;
C.该反应的化学方程式为,为可逆反应,C符合题意;
D.起始B的物质的量为,则浓度为,D不符合题意;
故选C。
6.D
【详解】A.反应达到平衡时,测得c(B)=2mol·L-1,故可知
0.7-0.2m=0.3,0.2n=0.6,故m=2,n=3,A正确;
B.N点时,A、C两个物质的浓度相同,设A消耗了2x mol/L,则C应该生成3x mol/L,B应该生成x mol,则有0.7-2x=3x,x=0.14mol/L,故c(B)=0.14mol/L,B正确;
C.反应达到平衡时,容器内B、C的浓度分别为0.2mol/L、0.6mol/L,由于体积相同,故物质的量之比为1∶3,C正确;
D.气体的总质量不变,恒容容器说明体积不变,故密度一直不变,因此当密度不再发生改变不能说明该反应达到了平衡,D错误;
故选D。
7.A
【详解】A.阶段①说明氯气溶于水,但溶于水的氨气只是部分与水反应生成盐酸和次氯酸,A错误;
B.阶段②的压强变小,是因为氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,该过程中Cl元素的化合价发生了变化,因此发生了氧化还原反应,B正确;
C.阶段③压强又逐渐增大,说明有气体生成,该气体是氯气,根据原子守恒、电子守恒,可知发生反应的化学方程式为:2HCl+NaClO=Cl2↑+H2O+NaCl ,C正确;
D.若将Cl2换成CO2,二氧化碳能溶于水,但溶解度不大,加入氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,最后加入盐酸又产生二氧化碳,因此所得的压强变化趋势与图2相似,D正确;
故合理选项是A。
8.C
【详解】A.由图象可知,反应在10s时达到化学平衡,此时X、Y分别减少了0.8mol、0.8mol,为反应物,Z增加了1.6mol,为生成物,结合物质的量变化量之比等于化学计量数之比可知,反应的化学方程式为:X(g)+Y(g) 2Z(g),A错误;
B.0~10 s,Z表示的平均化学反应速率为=,B错误;
C.由方程式X(g)+Y(g) 2Z(g)可知,该反应为反应前后气体分子数不变的反应,因此平衡时,体系内的压强与初始状态的压强相等,C正确;
D.由图象可知,X的初始物质的量为1.2mol,0~10s内,X的转化量为0.8mol,X的转化率为100%≈66.7%,D错误;
答案选C。
9.A
【详解】A.a点未达到平衡,正反应速率大于逆反应速率,A项错误;
B.b点达到平衡,正,逆反应速率相等,净反应速率等于0,B项正确;
C.根据速率之比等于化学计量数之比知,X,Y,Z的化学计量数之比为0.6:0.2:0.4=3:1:2,C项正确;
D.达到平衡时Y消耗0.2mol/L,Y的转化率为40%,D项正确;
答案选A。
10.D
【详解】A.由图可知,前12s内A浓度变化0.6mol/L,则平均反应速率,故A错误;
B.前12s内,A浓度变化0.6mol/L,A物质的量变化0.6mol/L×2L=1.2mol,根据,则12s内A和B反应放出的热量为,故B错误;
C.由图可知12s内,A浓度变化0.6mol/L,B浓度变化0.2mol/L,C浓度变化,三者浓度变化比值为3:1:2,说明b=1、c=2,则反应为,12s后反应达到平衡,各物质正逆反应速率比等于计量数之比,则,故C错误;
D.结合选项C分析可知 正反应方向为物质的量减小的反应,而反应过程中气体总质量不变,根据可知气体平均相对分子质量为变量,不再变化说明反应达到平衡状态,故D正确;
答案选D。
11.B
【分析】由题图知,消耗n(CO2)=(1-0.9)mol=0.1mol,消耗n(H2)=(0.5-0.2)mol=0.3mol,生成n(CH3OH)=0.1mol,同一反应中参加反应的各物质的物质的量之比等于其化学计量数之比,则参加反应的n(CO2):n(H2):n(CH,OH)=0.1mol:0.3mol:0.1mol=1:3:1,根据原子守恒知,还生成H2O,所以化学方程式为,在3min时各物质的物质的量保持不变,反应达到平衡状态,据此分析解答。
【详解】A.在3min时各物质的物质的量保持不变,反应达到平衡状态,此时和的转化率分别为、,二者转化率不相等,A错误;
B.内的平均反应速率为,B正确;
C.在3min时各物质的物质的量不变,反应达到平衡状态,则在内,反应达到平衡状态,C错误;
D.反应前后气体总质量不变、容器体积不变,则反应前后气体密度始终不变,所以气体密度不能作为平衡状态的判断标准,D错误;
故选B。
12.C
【详解】A.由图像知反应体系中反应物和生成物共存,故该反应为可逆反应,A错误;
B.2min时该反应并未达到平衡,从正反应方向建立平衡,故SO2的消耗速率大于SO2的产生速率,B错误;
C.恒温恒容体系压强与气体物质的量成正比且该反应为非等体积反应,当容器内压强不再改变时,说明该反应达到了该条件下的平衡状态即最大限度,C正确;
D.,恒容容器V不变,反应只涉及气体遵循化学反应的质量守恒即m不变,故密度始终是个定值,D错误;
故选C。
13.C
【分析】反应物只有一种气体,生成物有两种气体,图像描述的是平衡后的气态物质的浓度随温度的变化,甲和乙的变化趋势相同,故甲和乙代表的是生成物,又因为水蒸气的浓度是一氧化碳浓度的两倍,故甲代表水蒸气,乙代表一氧化碳,据此作答;
【详解】A.由分析可知,甲为的浓度变化曲线,乙是的浓度变化曲线,A错误;
B.1300℃时,,,B错误;
C.任何化学反应,升温能加快反应速率,C项正确;
D.若缩小容器容积,则气体物质的浓度增大,反应速率加快,D错误;
故选C。
14.C
【详解】A.,m、V不变,密度不可以作为判断反应达到平衡状态的标志,A错误;
B.温度升高使反应速率增大的程度与催化剂失去活性使反应速率减小的程度无法比较大小,则N点和M点生成乙烯速率快慢无法判断,B错误;
C.根据题意,H2和CO2的投料比等于改反应的系数之比,则平衡是图示CO2平衡转化率50%,H2平衡转化率也为50%,故,C正确;
D.250℃之前,温度升高,催化剂的催化效率升高,D错误;
故选C。
15.(1)3A(g)2B(g)
(2)>
(3)BD
【详解】(1)根据图像可知:在从反应开始至不再变化时,A物质的量减小0.6 mol,B物质的量增加了0.4 mol,后来两种物质都存在,且它们的物质的量不再发生变化,说明A是反应物,B是生成物,它们发生反应的物质的量的比是3:2,且该反应是可逆反应,故反应方程式为:3A(g)2B(g);
(2)根据图像可知:反应在第4min时,A的物质的量还在减少,B的物质的量还在增加,说明4 min 时反应正向进行,未达到平衡状态,故此时正、逆反应速率的大小关系为:v(正)>v(逆);
(3)A.恒温恒容充入He气,反应混合物中各组分气体的浓度不变,化学反应速率不变,A不符合题意;
B.缩小体积,使压强增大,导致气体物质的浓度增大,反应速率加快,B符合题意;
C.恒温恒压充入He气,会使容器的容积扩大,反应混合物的浓度减小,反应速率减慢,C不符合题意;
D.使用催化剂,会使反应速率成千上万倍的扩大,故反应速率加快,D符合题意;
故合理选项是BD。
16.(1)①
(2)b-a
(3)D
(4) AB 0.06mol·L-1·min-1 0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢
【详解】(1)原子经济性是反应物的原子有多少进入产物,进入越多原子经济性越高,只有反应①中所有原子都进入产物,原子经济性为100%,故最高;
故答案为:①。
(2)根据盖斯定律可知,反应③可以由②-①得到,故c=b-a;
故答案为:b-a。
(3)A.恒容密闭容器中,对于③反应,增加CO2浓度,反应物浓度增加,反应速率增加,A不符合;
B.恒容密闭容器中,对于③反应,加入催化剂,可以加快反应速率,B不符合;
C.恒容密闭容器中,对于③反应,温度升高,反应速率加快,C不符合;
D.恒容密闭容器中,对于③反应,降低压强,只能降低浓度,故反应速率降低,D符合;
故答案为:D。
(4)A.根据反应②可知,3v正(CO2)=v正(H2) ,当3v正(CO2)=v逆(H2) 时,则v正(H2) =v逆(H2) ,则反应达到平衡,A正确;
B.CO2的转化率不再改变,说明生成物的浓度不改变,则反应达到平衡,B正确;
C.反应容器为恒容,反应物和生成物都是气体,反应前后质量不变,体积不变,混合气体的密度一直不变,无法判断是否平衡,C错误;
D.CO2与H2投料比和化学计量数之比相等,物质的量比一直不变,D错误;
综上所述AB正确;
CH3OH在0~5min内的平均反应速率为;0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢;
故答案为:AB;0.06mol·L-1·min-1;0~5min浓度大,反应速率快,5min~15min浓度降低反应速率变慢。
17.(1) EF EF ab
(2)498kJ
(3)BD
(4) 0.0375 0.375
【详解】(1)①OE、EF、FG三段中,从图中曲线的斜率可看出,EF段化学反应最块,三段中EF段的纵坐标升高最大,EF段收集的氢气最多;
②a.蒸馏水,稀释氢离子浓度,反应速率下降,且总量不变,符合题意; b.溶液,稀释氢离子浓度,反应速率下降,且总量不变,符合题意;c.固体,溶液生成HNO3,反应得到NO,H2的量减少,不符合题意;d.固体,得到Cu2+先与Zn反应,Zn的量减少,氢气总量下降,不符合题意;故选ab。
(2)依题意,44.8L(标准状况)物质的量为2mol,完全反应放出的能量为形成生成物放出总能量减去断裂反应物吸收总能量,即467kJ×2×2-436kJ×2-498kJ=498kJ。
(3)A. CO与的物质的量之比为1:1,不能说明其量保持不变,故不能说明反应达到平衡状态,A不符合题意;
B. 该反应气体分子说发生改变,容器体积固定,故混合气体的总压强不随时间的变化而变化,说明反应达到平衡状态,B符合题意;
C. 单位时间内每消耗1molCO,同时生成1mol,二者均是指正反应速率,不能说明正逆反应速率相等,故不能说明反应达到平衡状态,C不符合题意;
D. 是生成物,其在混合气体中的质量分数保持不变,说明反应达到平衡状态,D符合题意;
故选BD。
(4)①从反应开始到平衡,的改变量是1.00-0.25=0.75(mol),用时10min,容器体积为2L,故平均反应速率=0.0375mol·L-1·min-1;
②达到平衡时,CO2减少了0.75mol,则减少了0.75×3=2.25(mol),则平衡时H2的物质的量为3-2.25=0.75(mol),其浓度为=0.375mol/L。
18.(1)
(2)
(3)=
(4)AD
(5)7.69%
(6)
【详解】(1)根据图示之比等于计量系数之比以及元素守恒可知和化学反应方程式为;
(2)内,氢气的平均反应速率为;
(3)由图可知,6min时反应达到平衡状态,正反应速率=逆反应速率;
(4)A.H2的生成速率是H2O生成速率的3倍,即v逆 (H2) =3v正 (H2O),正逆反应速率之比符合反应计量数之比,反应达到平衡状态,故A正确; B.反应体系中各物质均为气体,则混合气体的密度始终不变,即混合气体的密度不随时间的变化而变化的状态不一定是平衡状态,故B错误; C.反应中CO2与CH3OH的物质的量浓度之比为1:1的状态不一定是平衡状态,与反应物的起始量和转化率有关,故C错误; D.正反应是气体分子数减小的反应,混合气体的质量不变,则混合气体的平均相对分子质量不随时间的变化而变化的状态是平衡状态,故D正确
(5)达到平衡时n (CH3OH) =0.1mol,反应物总量为1.5mol,反应为,则混合气体的变化量,则混合气体的总量为,甲醇的体积分数为;
(6)起始时反应物总量为1.5mol,某时刻,测得H2的转化率为60%,即,反应为,则混合气体的变化量,则混合气体的总量为1.5mol-0.2mol=1.3mol,恒温恒压条件下气体的体积之比等于其物质的量之比,所以=1.5mol:1.3mol=15:13。
19.(1) > =
(2) 0.75 75% 30%
(3)BD
(4)=
【详解】(1)从图中可知,3min时,M点CH3OH的物质的量呈增大的趋势,CO2物质的量呈减小的趋势,说明此时反应仍正向进行,正反应速率>逆反应速率。15min时,反应达到平衡,正逆反应速率相等。
(2)CO2初始物质的量为1mol,平衡时物质的量为0.25mol,消耗CO2的物质的量为0.75mol。反应从开始到平衡消耗CO20.75mol,则根据方程式可知消耗H22.25mol,氢气的转化率为2.25mol÷3mol=75%。平衡时有CH3OH0.75mol,CO20.25mol,H20.75mol,H2O0.75mol,则CH3OH的体积分数为0.75mol÷(0.25mol+0.75mol+0.75mol+0.75mol)=30%。
(3)A.v正(CO2)=v逆(CH3OH)=0,说明反应已经停止,未达到平衡状态,A错误;
B.该反应不是等体积反应且在恒容密闭容器中进行,随着反应进行,容器内压强不断变化,压强不变说明反应达到平衡,B正确;
C.该反应在恒容密闭容器中进行且反应物和生成物都是气体,无论是否达到平衡,气体的密度始终不变,C错误;
D.该反应不是等体积反应,随着反应进行,容器内混合气体的平均摩尔质量不断变化,混合气体平均摩尔质量不变说明反应达到平衡,D正确;
故答案选BD。
(4)其他条件不变,反应开始时充入2mol氦气,反应物和生成物的浓度均不变,且氦气不参与反应,故反应速率不变,化学平衡不移动,反应达到最大限度所需时间t=10min。
20.(1)2CO+2NON2+2CO2
(2)0.02
(3)ab
(4)0.4
(5)=
(6)或0.5
(7)B
【详解】(1)NO、CO转化为两种无毒气体,产物为CO2和N2,反应的化学方程式是2CO+2NON2+2CO2;
(2)反应开始至10 min,NO的物质的量减少0.4mol,v(NO)= 0.02mol/(L·min)。
(3)a.催化剂能加快反应速率,新型催化剂可以加快NO、CO的转化,故a正确;
b.根据图示,该反应进行到10 min时NO物质的量不再改变,反应达到化学平衡状态,故b正确;
c.反应开始到平衡消耗0.4molNO,则同时消耗0.4molCO,平衡时CO的浓度是=0.2 mol/L,故c错误;
选ab;
(4)0-5min内,CO的浓度降低1.0mol/L,则H2的浓度降低2mol/L,H2 (g)的平均反应速率是mol/(L·min)。
(5)根据图示,12min时,各位置浓度不再改变,反应达到平衡状态,v正=v逆。
(6)将4mol的H2(g)和2mol的CO(g)充入1L恒容的密闭容器中发生反应:CO(g) + 2H2(g)CH3OH(g),达到平衡状态甲醇的物质的量为1.5mol。
设起始压强为P,平衡时压强为P0,同温同体积,压强比等于物质的量比,则的值为。
(7)A.反应达到平衡状态,各物质的量浓度不再改变,CO(g)、H2(g)、CH3OH(g)的物质的量比为1∶2∶1,不能判断物质的量是否还发生改变,反应不一定平衡,故不选A;
B.反应前后气体系数和不同,压强是变量,混合气体的压强不随时间的变化而改变,反应一定达到平衡状态,故选B;
C.单位时间内每消耗2amolH2(g),同时生成amolCH3OH(g),不能判断正逆反应速率是否相等,反应不一定平衡,故不选C;
D.反应速率:v(H2)=2v(CO),不能判断正逆反应速率是否相等,反应不一定平衡,故不选D;
选B。
答案第1页,共2页
答案第1页,共2页
同课章节目录
