2024中考化学二轮复习专题特训--推断题(含解析)
文档属性
| 名称 | 2024中考化学二轮复习专题特训--推断题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 365.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-17 20:45:01 | ||
图片预览


文档简介
2024中考化学二轮复习专题特训--推断题
1.A-F表示初中化学常见物质,B、C、D、F分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前世界年产量最高的金属,B是可溶性银盐,D与E发生的反应属于中和反应(图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可转化为另一种物质,部分反应物和生成物及反应条件已略去,图中各部分反应需在溶液中进行)。
请回答下列问题:
(1)A的化学式为 。
(2)C的一种用途是 。
(3)反应①的化学方程式为 。
(4)图中未涉及的基本反应类型为 。
2.现有一包固体粉末,可能含有NaOH、CuSO4、C粉、CaCO3、NH4HCO3、Fe粉中的种或几种。现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含 。
(2)另取少量固体溶于足量水中,温度明显升高,则原固体中一定含有 。过滤,得到无色澄清溶液和黑色固体,则原固体中一定不含 、 。
(3)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有 ,没有 。
3.有限的元素可组成种类紧多的物质,依据表中的元素回答下列问题。
元素名称 氢 碳 氧 氯 钠 铁
元素符号 H C O Cl Na Fe
(1)某物质为厨房中的常见盐类调味品,该物质的化学式为 。
(2)若两种氧化物发生反应时,元素有化合价改变,写出其中一种氧化物的化学式 。
(3)A、B、C、D、E是五种不同类别的常见物质,且都由表中的元素组成。其中A被认为是最理想的清洁、高能燃料,D是一种最常用的溶剂,B的俗称为纯碱。图中“→”表示物质间的一步转化关系(已知转化过程中所涉及到的物质均由上表中的元素组成,部分反应物,生成物及反应条件已省略)。
①反应C→A属于 (填基本反应类型)。
②写出物质B与C发生反应的化学方程式 。
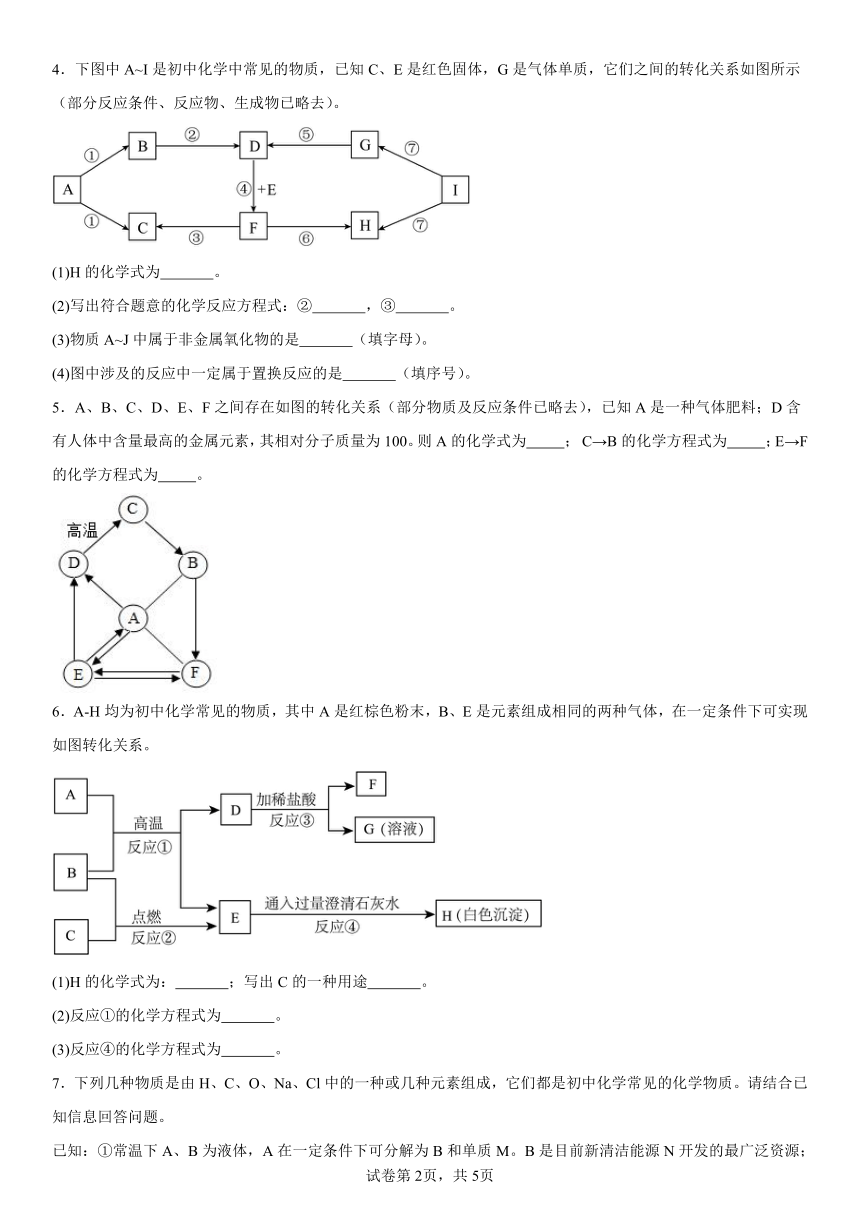
4.下图中A~I是初中化学中常见的物质,已知C、E是红色固体,G是气体单质,它们之间的转化关系如图所示(部分反应条件、反应物、生成物已略去)。
(1)H的化学式为 。
(2)写出符合题意的化学反应方程式:② ,③ 。
(3)物质A~J中属于非金属氧化物的是 (填字母)。
(4)图中涉及的反应中一定属于置换反应的是 (填序号)。
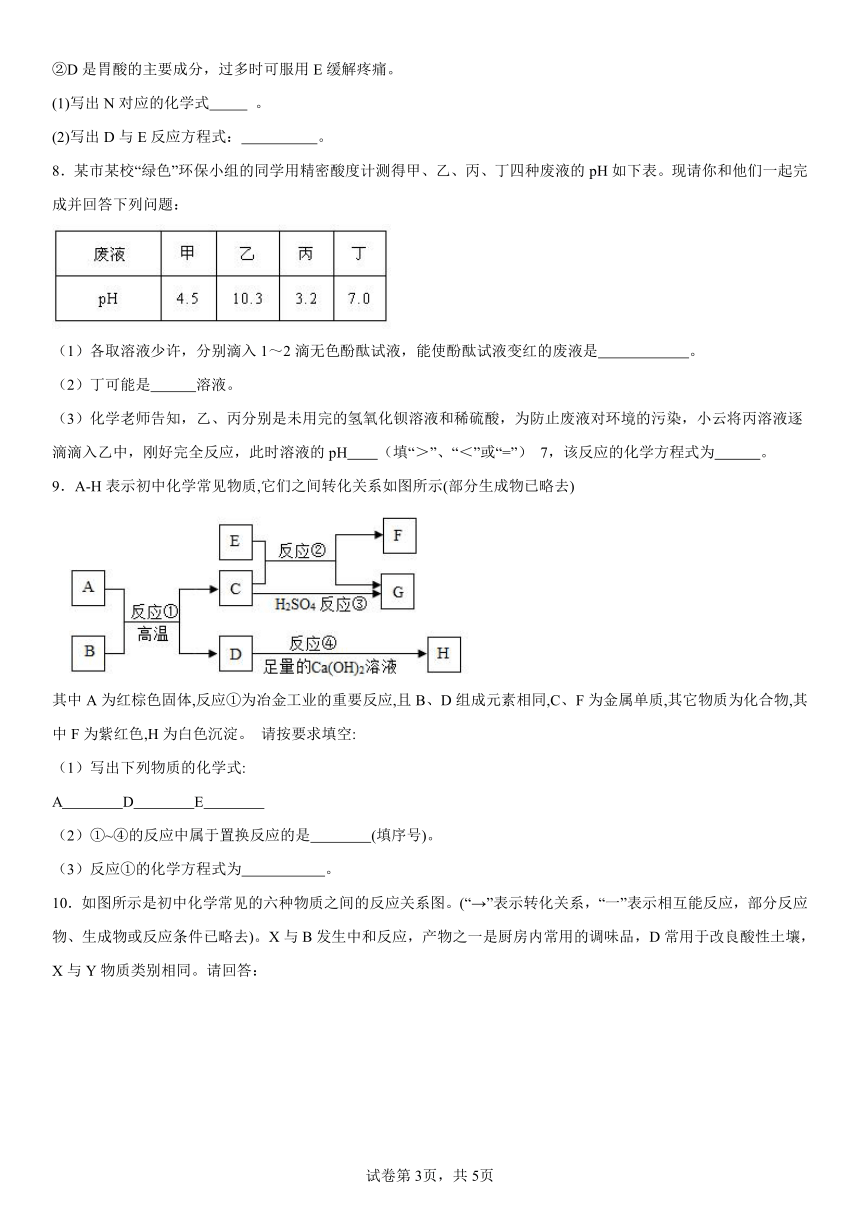
5.A、B、C、D、E、F之间存在如图的转化关系(部分物质及反应条件已略去),已知A是一种气体肥料;D含有人体中含量最高的金属元素,其相对分子质量为100。则A的化学式为 ; C→B的化学方程式为 ;E→F的化学方程式为 。
6.A-H均为初中化学常见的物质,其中A是红棕色粉末,B、E是元素组成相同的两种气体,在一定条件下可实现如图转化关系。
(1)H的化学式为: ;写出C的一种用途 。
(2)反应①的化学方程式为 。
(3)反应④的化学方程式为 。
7.下列几种物质是由H、C、O、Na、Cl中的一种或几种元素组成,它们都是初中化学常见的化学物质。请结合已知信息回答问题。
已知:①常温下A、B为液体,A在一定条件下可分解为B和单质M。B是目前新清洁能源N开发的最广泛资源;②D是胃酸的主要成分,过多时可服用E缓解疼痛。
(1)写出N对应的化学式 。
(2)写出D与E反应方程式: 。
8.某市某校“绿色”环保小组的同学用精密酸度计测得甲、乙、丙、丁四种废液的pH如下表。现请你和他们一起完成并回答下列问题:
(1)各取溶液少许,分别滴入1~2滴无色酚酞试液,能使酚酞试液变红的废液是 。
(2)丁可能是 溶液。
(3)化学老师告知,乙、丙分别是未用完的氢氧化钡溶液和稀硫酸,为防止废液对环境的污染,小云将丙溶液逐滴滴入乙中,刚好完全反应,此时溶液的pH (填“>”、“<”或“=”) 7,该反应的化学方程式为 。
9.A-H表示初中化学常见物质,它们之间转化关系如图所示(部分生成物已略去)
其中A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,C、F为金属单质,其它物质为化合物,其中F为紫红色,H为白色沉淀。 请按要求填空:
(1)写出下列物质的化学式:
A D E
(2)①~④的反应中属于置换反应的是 (填序号)。
(3)反应①的化学方程式为 。
10.如图所示是初中化学常见的六种物质之间的反应关系图。(“→”表示转化关系,“一”表示相互能反应,部分反应物、生成物或反应条件已略去)。X与B发生中和反应,产物之一是厨房内常用的调味品,D常用于改良酸性土壤,X与Y物质类别相同。请回答:
(1)B的俗称是 ;C的化学式是 。
(2)写出D→A反应的化学方程式 (要求该反应不属于复分解反应)。
(3)写出Y→X反应的化学方程式 。
11.图中A-I表示几种初中化学常见的物质,“→”表示物质间存在相应.的转化关系,部分反应物和生成物及反应条件已略去。已知左圈中的转化均为分解反应,右圈中的转化均为化合反应。D和G是常见的非金属单质,组成化合物E和H的元素种类相同;组成化合物F和I的元素种类也相同。A常用来与硫黄混合刷在树干底部,防冻伤并杀虫卵。请回答下列问题:
(1)写出B的化学式
(2)写出H→G的化学反应方程式 ;
(3)F+D→I的化学反应方程式 。
12.下图中A~H是初中化学常见的物质。A俗称纯碱;C可用作补钙剂;G是一种常见的氮肥,含氮量为35%;H、F物质类别相同。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)写出化学式:G 。
(2)写出化学方程式:
A转化为H的反应 ,E和C的反应 。
(3)若E与G的组成元素相同,则E的名称为 。
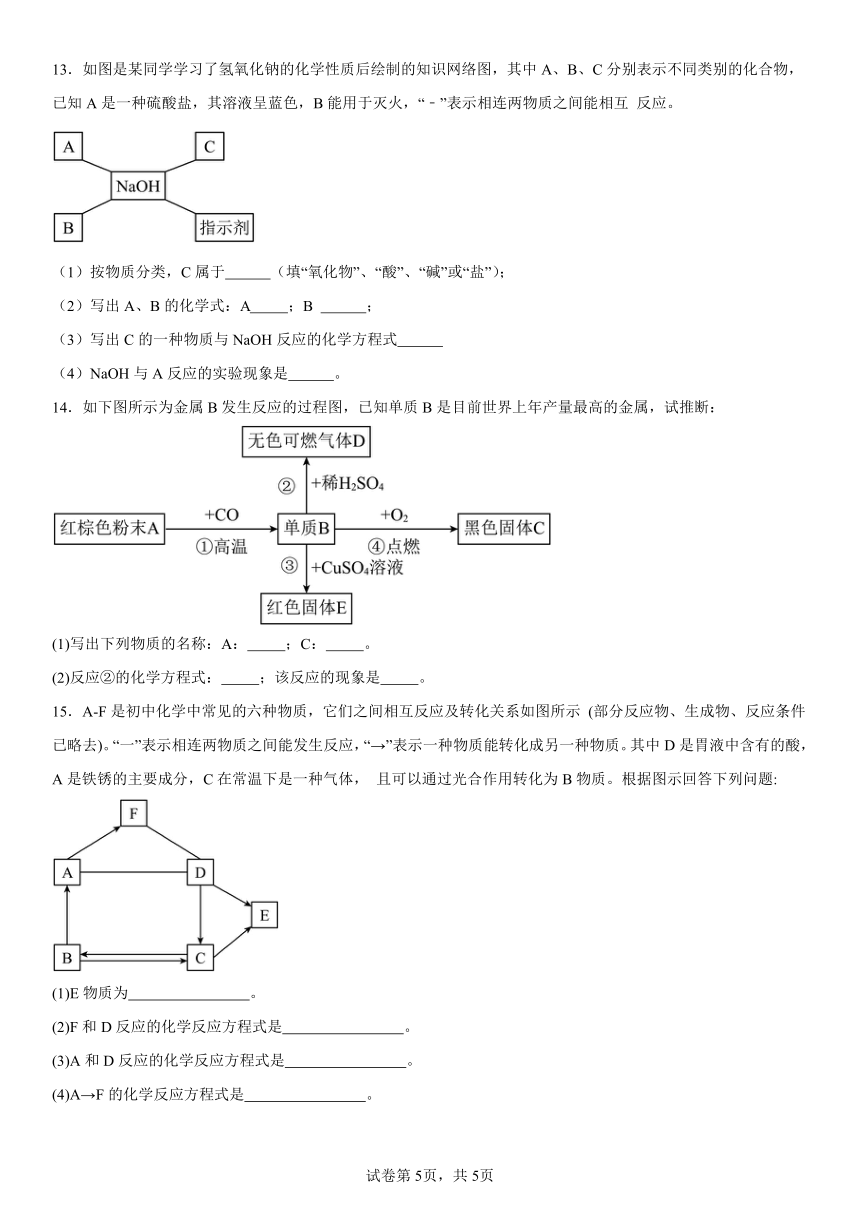
13.如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“﹣”表示相连两物质之间能相互 反应。
(1)按物质分类,C属于 (填“氧化物”、“酸”、“碱”或“盐”);
(2)写出A、B的化学式:A ;B ;
(3)写出C的一种物质与NaOH反应的化学方程式
(4)NaOH与A反应的实验现象是 。
14.如下图所示为金属B发生反应的过程图,已知单质B是目前世界上年产量最高的金属,试推断:
(1)写出下列物质的名称:A: ;C: 。
(2)反应②的化学方程式: ;该反应的现象是 。
15.A-F是初中化学中常见的六种物质,它们之间相互反应及转化关系如图所示 (部分反应物、生成物、反应条件已略去)。“一”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质。其中D是胃液中含有的酸,A是铁锈的主要成分,C在常温下是一种气体, 且可以通过光合作用转化为B物质。根据图示回答下列问题:
(1)E物质为 。
(2)F和D反应的化学反应方程式是 。
(3)A和D反应的化学反应方程式是 。
(4)A→F的化学反应方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. Fe 除铁锈 分解反应
【详解】B、C、D、F分别属于酸、碱、盐和氧化物四种类别的一种,A是目前世界上年产量最高的金属,所以A是铁,B是可溶性银盐,所以B是硝酸银,D与E发生反应属于中和反应,A会与E反应,所以E可以是硫酸,E会转化成F,F会转化成D,D是碱,所以D是氢氧化钙,F是水,硫酸转化成C会与硝酸银反应,所以C是盐酸,经过验证,推到正确;
(1)A是铁,化学式为Fe;
(2)C是盐酸,可用于除铁锈;
(3)反应①是D和E反应,D是氢氧化钙,E是硫酸,D和E反应的化学方程式为;
(4)反应A和B是铁和硝酸银,A和E是铁和硫酸均为置换反应;反应B和C是硝酸银和稀盐酸,E到C是硫酸转化为稀盐酸,E到F是硫酸转化为水,D和E是氢氧化钙和稀硫酸反应,均为复分解反应;反应F到D是水和氧化钙反应生成氢氧化钙,属于化合反应,上述反应中没有出现分解反应。
2. NH4HCO3 NaOH CaCO3 CuSO4 Fe粉 C粉
【详解】(1)已知NH4HCO3受热易分解,有产生氨气,取少量固体加热,无氨味,没有氨气产生,则原固体中一定不含NH4HCO3。
(2)另取少量固体溶于足量水中,温度明显升高,则原固体中一定含有NaOH,因为NaOH溶于水会放出大量的热。过滤,得到无色澄清溶液和黑色固体,则原固体中一定不含CaCO3和CuSO4,因为CaCO3是白色固体,CuSO4溶液为蓝色。
(3)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有Fe粉,铁能与盐酸反应产生氢气,一定没有 C粉,碳不与盐酸反应,会有黑色固体剩余。
3.(1)NaCl
(2)CO或Fe2O3(合理即可)
(3) 置换反应
【详解】(1)食盐是氯化钠的俗称,属于盐类物质,是厨房中常用的一种调味品,其化学式为:NaCl。
(2)根据两种氧化物发生反应时,元素有化合价改变,结合图中所给元素分析可知,该反应为CO和Fe2O3在高温条件下生成Fe和CO2,CO和Fe2O3均为氧化物,C元素的化合价从+2变到+4,Fe元素的化合价从+3变到0,符合题意。
(3)根据题目给出的信息可知:A是H2,B是Na2CO3,D是H2O,结合题中框图可知:C能转化为H2,C也能转化为H2O,则C是HCl;由于A、B、C、D、E是五种不同类别的常见物质,则E为碱,且E既能转化为Na2CO3,也能转化为H2O,则E是NaOH。反应C→A,即HCl与活泼金属反应生成H2和盐,是单质和化合物生成单质和化合物的反应,属于置换反应;物质B与C发生的反应,即Na2CO3和HCl反应生成NaCl、H2O和CO2,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
【点睛】本题考点属于物质的推断题,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在;解题时应注意只能从给出的元素中选择来组成物质,结合题中给出的题眼信息及框图进行解答。本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题,本题属于第一种类型。
4.(1)H2
(2) (答案不唯一)
(3)BDI
(4)③⑥/⑥③
【分析】下图中A~I是初中化学中常见的物质,已知C、是红色固体,由于铜和氧化铁是红色固体,则C和E分别是铜和氧化铁中的一种,G是气体单质,G能反应生成D,D能与E反应生成F,F能反应生成C,则推测G为氧气,碳和氧气点燃生成一氧化碳,一氧化碳高温下还原氧化铁生成铁和二氧化碳,铁和硫酸铜反应生成硫酸亚铁和铜,则D为一氧化碳,E为氧化铁,F为铁,C为铜,I能反应生成G(氧气)和H,F(铁)能生成H,即水通电分解生成氢气和氧气,铁和硫酸反应生成硫酸亚铁和氢气,故I为水,H为氢气,A能反应生成B和C(铜),B能生成D(一氧化碳),一氧化碳在加热条件下还原氧化铜生成铜和二氧化碳,二氧化碳和碳高温下反应生成一氧化碳,故A为氧化铜,B为二氧化碳。代入验证,推论合理。
【详解】(1)H为氢气,化学式为H2;
(2)②可以为碳和二氧化碳高温下反应生成一氧化碳,化学方程式为:;
③可以为铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:;
(3)由分析可知,A为氧化铜,B为二氧化碳,C为铜,D为一氧化碳,E为氧化铁,F为铁,G为氧气,H为氢气,I为水,其中BDI属于非金属氧化物;
(4)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,则③铁和硫酸铜反应生成硫酸亚铁和铜、⑥铁和硫酸反应生成硫酸亚铁和氢气,一定属于置换反应。
5. CO2 CaO+H2 O═Ca(OH)2 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【详解】二氧化碳是一种气体肥料,因此A是二氧化碳;
人体中含量最高的金属元素是钙元素,碳酸钙的相对分子质量为100,因此D是碳酸钙;
碳酸钙在高温条件下分解生成氧化钙和二氧化碳,因此C是氧化钙;
氧化钙能和水反应生成氢氧化钙,氢氧化钙能和二氧化碳反应生成碳酸钙和水,因此B是氢氧化钙;
氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠,氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠能和氢氧化钙反应生成碳酸钙和氢氧化钠,因此F是氢氧化钠,E是碳酸钠;
所以,A的化学式是CO2;
C→B的化学方程式为:CaO+H2 O═Ca(OH)2;
E→F的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
6.(1) CaCO3 供给呼吸
(2)
(3)
【分析】E通入澄清的石灰水中生成白色沉淀,推出E为二氧化碳,A是红棕色粉末,在高温的条件下生成二氧化碳,推出A为氧化铁,又B、E是元素组成相同的两种气体,推出B为一氧化碳,D为铁,铁与稀盐酸反应生成氢气和氯化亚铁,推出F为氢气,G为氯化亚铁溶液,一氧化碳点燃生成二氧化碳,推出C为氧气,所以A为氧化铁,B为一氧化碳,C为氧气,D为铁,E为二氧化碳,F为氢气,G为氯化亚铁,H为碳酸钙。
【详解】(1)H为碳酸钙,C为氧气,用途为供给呼吸,故填:CaCO3;供给呼吸;
(2)一氧化碳在高温的条件下还原氧化铁生成铁和二氧化碳,化学方程式为:;故填: ;
(3)二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为:;故填: 。
【点睛】根据物质的特征颜色入手推出,然后结合各反应的特征将物质一一推出。
7.(1)H2
(2)
【分析】几种物质是由H、C、O、Na、Cl中的一种或几种元素组成,都是初中化学常见的化学物质,B是目前新清洁能源N开发的最广泛资源,所以B是水,N是氢气,常温下A、B为液体,A在一定条件下可分解为B和单质M,所以A是过氧化氢溶液,M是氧气,D是胃酸的主要成分,过多时可服用E缓解疼痛,所以D是盐酸,E是碳酸氢钠,经过验证,推导正确。
【详解】(1)N是氢气,化学式为H2;
(2)D为盐酸,E为碳酸氢钠,盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,该反应方程式为:。
8. 乙 NaCl(答案合理即可) = Ba(OH)2+H2SO4===BaSO4↓+2H2O
【详解】(1)显碱性的溶液能使无色的酚酞试液变红色,所以分别滴入1-2滴无色酚酞溶液,能使酚酞溶液变红的废液是乙溶液;
(2)氯化钠的水溶液呈中性,pH=7;
(3)氢氧化钡和硫酸反应生成硫酸钡沉淀和水,水溶液呈中性,pH=7,化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O。
9. Fe2O3 CO2 CuSO4 ②③ 3CO+Fe2O32Fe+3CO2
【分析】A~H表示初中化学常见物质,A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,所以A是氧化铁,B是一氧化碳,D是二氧化碳,C是铁,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,H为白色沉淀,所以H是碳酸钙,C、F为金属单质,其它物质为化合物,F为紫红色,所以F是铜,铁和稀硫酸反应生成硫酸亚铁和氢气,所以G是硫酸亚铁,E和铁反应会生成硫酸亚铁和铜,所以E是硫酸铜,经过验证,推导正确,
【详解】(1)所以A是Fe2O3,D是CO2,E是CuSO4;
(2)①是一氧化碳和氧化铁高温生成铁和二氧化碳,不属于置换反应,②是铁和硫酸铜反应生成硫酸亚铁和铜,属于置换反应,③是铁和稀硫酸反应生成硫酸亚铁和氢气,属于置换反应,④是二氧化碳和氢氧化钙生成碳酸钙沉淀和水,不属于置换反应,所以①~④的反应中属于置换反应的是②③;
(3)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O32Fe+3CO2。
10.(1) 烧碱、火碱、苛性钠 Na2CO3
(2)Ca(OH)2+CO2=CaCO3↓+H2O(合理即可)
(3)BaCl2+H2SO4=BaSO4↓+2HCl
【分析】根据初中化学常见的六种物质之间的反应关系图,X与B发生中和反应,产物之一是厨房内常用的调味品,所以X、B是盐酸、氢氧化钠中的一种,D常用于改良酸性土壤,所以D是氢氧化钙,且X、Y是同类物质,氢氧化钙会与X反应,所以X是盐酸,B是氢氧化钠,A会与氢氧化钙互相转化,所以A是水,Y会转化成水、盐酸,所以Y是硫酸,氢氧化钠转化成的C会与氢氧化钙反应,所以C是碳酸钠,然后将推出的物质进行验证即可。
【详解】(1)由分析可知,B是氢氧化钠,C是碳酸钠,所以B的俗称是烧碱、火碱、苛性钠;C的化学式是Na2CO3;
(2)由分析可知,D是氢氧化钙,A是水,D→A且不属于复分解反应的可以是氢氧化钙与二氧化碳反应,生成碳酸钙和水,该反应)化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
(3)由分析可知,Y是硫酸,X是盐酸,所以Y→X是硫酸与氯化钡反应生成硫酸钡和氯化氢,反应的化学方程式是:BaCl2+H2SO4=BaSO4↓+2HCl。
11.(1)CaCO3
(2)
(3)
【分析】A常用来与硫黄混合刷在树干底部,防冻伤并杀虫卵,所以A就是氢氧化钙,组成化合物E和H的元素种类相同,H和E发生的是分解反应,所以H是过氧化氢,E是水,E和H分解反应都会生成G,所以G是氧气。右圈中的转化均为化合反应,D是常见的非金属单质,组成化合物F和I的元素种类也相同,F会与氢氧化钙反应,所以F是二氧化碳,I是一氧化碳,D是碳,B就是碳酸钙。
【详解】(1)由分析可知,B就是碳酸钙,化学式为:CaCO3;
(2)由分析可知,H是过氧化氢,G是氧气,故H→G可以为过氧化氢在二氧化锰的作用下分解生成氢气和氧气,化学方程式为:;
(3)由分析可知,F是二氧化碳,I是一氧化碳,D是碳,故F+D→I为二氧化碳和碳在高温条件下化合生成一氧化碳,化学反应方程式为:。
12. NH4NO3 Na2CO3+2HCl═2NaCl+CO2↑+H2O CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑(合理均可) 硝酸
【分析】A~H是初中化学常见的物质,A俗称纯碱,所以A是碳酸钠,A和B反应会转化成C和D,C可用作补钙剂,所以C是碳酸钙,B是氢氧化钙,D是氢氧化钠,G是一种常见的氮肥,含氮量为35%,所以G是硝酸铵,H、F物质类别相同,碳酸钙生成的F会与氢氧化钠反应,所以F是二氧化碳,碳酸钠生成的H会转化成B,所以H是水,E会与碳酸钠、碳酸钙反应,所以E可以是硝酸、盐酸等常见的酸,经过验证,推断正确。
【详解】(1)由分析可知,G是NH4NO3;
(2) A转化为H的反应是碳酸钠和稀盐酸反应生成氯化钠、二氧化碳、水,反应的化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
E和C的反应可以是碳酸钙和稀硝酸反应生成硝酸钙和水、二氧化碳,反应的化学方程式为:CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑;
(3)若E与G的组成元素相同,则E的名称为硝酸。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
13. 酸 CuSO4 CO2 产生蓝色沉淀
【分析】A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,可推出A为硫酸铜,硫酸铜属于盐,B能用于灭火,则B为二氧化碳,二氧化碳属于氧化物,则C属于酸。
【详解】(1)由分析可知,C属于酸;
(2)A为硫酸铜,化学式为:CuSO4;B为二氧化碳,化学式为:CO2;
(3)C属于酸,如盐酸,盐酸与氢氧化钠反应生成氯化钠和水,该反应的化学方程式为:;
(4)A为硫酸铜,氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,实验现象为:产生蓝色沉淀。
14.(1) 氧化铁/三氧化二铁 四氧化三铁
(2) 产生气泡,固体减少,放热,溶液(由无色)变为浅绿色
【分析】单质B是生活中常见且世界年产量最高的金属,则B为铁;A是红棕色粉末,则A为氧化铁;B(铁)与氧气燃烧后生成黑色固体C,则C为四氧化三铁;单质B(铁)与稀硫酸反应生成无色可燃气体D,则D为氢气;单质B(铁)与硫酸铜反应生成红色固体E,则E为铜。
【详解】(1)由分析可知,A为氧化铁(三氧化二铁),C为四氧化三铁;
(2)①B为铁,D为氢气,则反应②是铁与稀硫酸反应生成硫酸亚铁和氢气,故反应的化学方程式写为:Fe+H2SO4=FeSO4+H2↑;
②铁与稀硫酸反应生成硫酸亚铁和氢气的现象为:产生气泡,固体减少,放热,溶液(由无色)变为浅绿色。
15. H2O
【分析】A~F是初中化学中常见的六种物质,D是胃液中含有的酸,所以D是盐酸,A是铁锈的主要成分,所以A是氧化铁,C在常温下是一种气体,且可以通过光合作用转化为B物质,所以C是二氧化碳,B是氧气,氧气和酸都会生成E,所以E是水,氧化铁转化成的F会与盐酸反应,所以F是铁,经过验证,推导正确。
【详解】(1)E物质是水,化学式为H2O;
(2)F和D的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式是:Fe+2HCl═FeCl2+H2↑;
(3)A和D的反应是氧化铁和盐酸反应生成氯化铁和水,化学方程式是;Fe2O3+6HCl═2FeCl3+3H2O;
(4)A→F的反应是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式是:3CO+Fe2O32Fe+3CO2。
故答案为:(1)H2O;
(2)Fe+2HCl═FeCl2+H2↑;
(3)Fe2O3+6HCl═2FeCl3+3H2O;
(4)3CO+Fe2O32Fe+3CO2。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
答案第1页,共2页
答案第1页,共2页
1.A-F表示初中化学常见物质,B、C、D、F分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前世界年产量最高的金属,B是可溶性银盐,D与E发生的反应属于中和反应(图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可转化为另一种物质,部分反应物和生成物及反应条件已略去,图中各部分反应需在溶液中进行)。
请回答下列问题:
(1)A的化学式为 。
(2)C的一种用途是 。
(3)反应①的化学方程式为 。
(4)图中未涉及的基本反应类型为 。
2.现有一包固体粉末,可能含有NaOH、CuSO4、C粉、CaCO3、NH4HCO3、Fe粉中的种或几种。现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含 。
(2)另取少量固体溶于足量水中,温度明显升高,则原固体中一定含有 。过滤,得到无色澄清溶液和黑色固体,则原固体中一定不含 、 。
(3)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有 ,没有 。
3.有限的元素可组成种类紧多的物质,依据表中的元素回答下列问题。
元素名称 氢 碳 氧 氯 钠 铁
元素符号 H C O Cl Na Fe
(1)某物质为厨房中的常见盐类调味品,该物质的化学式为 。
(2)若两种氧化物发生反应时,元素有化合价改变,写出其中一种氧化物的化学式 。
(3)A、B、C、D、E是五种不同类别的常见物质,且都由表中的元素组成。其中A被认为是最理想的清洁、高能燃料,D是一种最常用的溶剂,B的俗称为纯碱。图中“→”表示物质间的一步转化关系(已知转化过程中所涉及到的物质均由上表中的元素组成,部分反应物,生成物及反应条件已省略)。
①反应C→A属于 (填基本反应类型)。
②写出物质B与C发生反应的化学方程式 。
4.下图中A~I是初中化学中常见的物质,已知C、E是红色固体,G是气体单质,它们之间的转化关系如图所示(部分反应条件、反应物、生成物已略去)。
(1)H的化学式为 。
(2)写出符合题意的化学反应方程式:② ,③ 。
(3)物质A~J中属于非金属氧化物的是 (填字母)。
(4)图中涉及的反应中一定属于置换反应的是 (填序号)。
5.A、B、C、D、E、F之间存在如图的转化关系(部分物质及反应条件已略去),已知A是一种气体肥料;D含有人体中含量最高的金属元素,其相对分子质量为100。则A的化学式为 ; C→B的化学方程式为 ;E→F的化学方程式为 。
6.A-H均为初中化学常见的物质,其中A是红棕色粉末,B、E是元素组成相同的两种气体,在一定条件下可实现如图转化关系。
(1)H的化学式为: ;写出C的一种用途 。
(2)反应①的化学方程式为 。
(3)反应④的化学方程式为 。
7.下列几种物质是由H、C、O、Na、Cl中的一种或几种元素组成,它们都是初中化学常见的化学物质。请结合已知信息回答问题。
已知:①常温下A、B为液体,A在一定条件下可分解为B和单质M。B是目前新清洁能源N开发的最广泛资源;②D是胃酸的主要成分,过多时可服用E缓解疼痛。
(1)写出N对应的化学式 。
(2)写出D与E反应方程式: 。
8.某市某校“绿色”环保小组的同学用精密酸度计测得甲、乙、丙、丁四种废液的pH如下表。现请你和他们一起完成并回答下列问题:
(1)各取溶液少许,分别滴入1~2滴无色酚酞试液,能使酚酞试液变红的废液是 。
(2)丁可能是 溶液。
(3)化学老师告知,乙、丙分别是未用完的氢氧化钡溶液和稀硫酸,为防止废液对环境的污染,小云将丙溶液逐滴滴入乙中,刚好完全反应,此时溶液的pH (填“>”、“<”或“=”) 7,该反应的化学方程式为 。
9.A-H表示初中化学常见物质,它们之间转化关系如图所示(部分生成物已略去)
其中A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,C、F为金属单质,其它物质为化合物,其中F为紫红色,H为白色沉淀。 请按要求填空:
(1)写出下列物质的化学式:
A D E
(2)①~④的反应中属于置换反应的是 (填序号)。
(3)反应①的化学方程式为 。
10.如图所示是初中化学常见的六种物质之间的反应关系图。(“→”表示转化关系,“一”表示相互能反应,部分反应物、生成物或反应条件已略去)。X与B发生中和反应,产物之一是厨房内常用的调味品,D常用于改良酸性土壤,X与Y物质类别相同。请回答:
(1)B的俗称是 ;C的化学式是 。
(2)写出D→A反应的化学方程式 (要求该反应不属于复分解反应)。
(3)写出Y→X反应的化学方程式 。
11.图中A-I表示几种初中化学常见的物质,“→”表示物质间存在相应.的转化关系,部分反应物和生成物及反应条件已略去。已知左圈中的转化均为分解反应,右圈中的转化均为化合反应。D和G是常见的非金属单质,组成化合物E和H的元素种类相同;组成化合物F和I的元素种类也相同。A常用来与硫黄混合刷在树干底部,防冻伤并杀虫卵。请回答下列问题:
(1)写出B的化学式
(2)写出H→G的化学反应方程式 ;
(3)F+D→I的化学反应方程式 。
12.下图中A~H是初中化学常见的物质。A俗称纯碱;C可用作补钙剂;G是一种常见的氮肥,含氮量为35%;H、F物质类别相同。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)写出化学式:G 。
(2)写出化学方程式:
A转化为H的反应 ,E和C的反应 。
(3)若E与G的组成元素相同,则E的名称为 。
13.如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“﹣”表示相连两物质之间能相互 反应。
(1)按物质分类,C属于 (填“氧化物”、“酸”、“碱”或“盐”);
(2)写出A、B的化学式:A ;B ;
(3)写出C的一种物质与NaOH反应的化学方程式
(4)NaOH与A反应的实验现象是 。
14.如下图所示为金属B发生反应的过程图,已知单质B是目前世界上年产量最高的金属,试推断:
(1)写出下列物质的名称:A: ;C: 。
(2)反应②的化学方程式: ;该反应的现象是 。
15.A-F是初中化学中常见的六种物质,它们之间相互反应及转化关系如图所示 (部分反应物、生成物、反应条件已略去)。“一”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质。其中D是胃液中含有的酸,A是铁锈的主要成分,C在常温下是一种气体, 且可以通过光合作用转化为B物质。根据图示回答下列问题:
(1)E物质为 。
(2)F和D反应的化学反应方程式是 。
(3)A和D反应的化学反应方程式是 。
(4)A→F的化学反应方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. Fe 除铁锈 分解反应
【详解】B、C、D、F分别属于酸、碱、盐和氧化物四种类别的一种,A是目前世界上年产量最高的金属,所以A是铁,B是可溶性银盐,所以B是硝酸银,D与E发生反应属于中和反应,A会与E反应,所以E可以是硫酸,E会转化成F,F会转化成D,D是碱,所以D是氢氧化钙,F是水,硫酸转化成C会与硝酸银反应,所以C是盐酸,经过验证,推到正确;
(1)A是铁,化学式为Fe;
(2)C是盐酸,可用于除铁锈;
(3)反应①是D和E反应,D是氢氧化钙,E是硫酸,D和E反应的化学方程式为;
(4)反应A和B是铁和硝酸银,A和E是铁和硫酸均为置换反应;反应B和C是硝酸银和稀盐酸,E到C是硫酸转化为稀盐酸,E到F是硫酸转化为水,D和E是氢氧化钙和稀硫酸反应,均为复分解反应;反应F到D是水和氧化钙反应生成氢氧化钙,属于化合反应,上述反应中没有出现分解反应。
2. NH4HCO3 NaOH CaCO3 CuSO4 Fe粉 C粉
【详解】(1)已知NH4HCO3受热易分解,有产生氨气,取少量固体加热,无氨味,没有氨气产生,则原固体中一定不含NH4HCO3。
(2)另取少量固体溶于足量水中,温度明显升高,则原固体中一定含有NaOH,因为NaOH溶于水会放出大量的热。过滤,得到无色澄清溶液和黑色固体,则原固体中一定不含CaCO3和CuSO4,因为CaCO3是白色固体,CuSO4溶液为蓝色。
(3)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有Fe粉,铁能与盐酸反应产生氢气,一定没有 C粉,碳不与盐酸反应,会有黑色固体剩余。
3.(1)NaCl
(2)CO或Fe2O3(合理即可)
(3) 置换反应
【详解】(1)食盐是氯化钠的俗称,属于盐类物质,是厨房中常用的一种调味品,其化学式为:NaCl。
(2)根据两种氧化物发生反应时,元素有化合价改变,结合图中所给元素分析可知,该反应为CO和Fe2O3在高温条件下生成Fe和CO2,CO和Fe2O3均为氧化物,C元素的化合价从+2变到+4,Fe元素的化合价从+3变到0,符合题意。
(3)根据题目给出的信息可知:A是H2,B是Na2CO3,D是H2O,结合题中框图可知:C能转化为H2,C也能转化为H2O,则C是HCl;由于A、B、C、D、E是五种不同类别的常见物质,则E为碱,且E既能转化为Na2CO3,也能转化为H2O,则E是NaOH。反应C→A,即HCl与活泼金属反应生成H2和盐,是单质和化合物生成单质和化合物的反应,属于置换反应;物质B与C发生的反应,即Na2CO3和HCl反应生成NaCl、H2O和CO2,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
【点睛】本题考点属于物质的推断题,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在;解题时应注意只能从给出的元素中选择来组成物质,结合题中给出的题眼信息及框图进行解答。本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题,本题属于第一种类型。
4.(1)H2
(2) (答案不唯一)
(3)BDI
(4)③⑥/⑥③
【分析】下图中A~I是初中化学中常见的物质,已知C、是红色固体,由于铜和氧化铁是红色固体,则C和E分别是铜和氧化铁中的一种,G是气体单质,G能反应生成D,D能与E反应生成F,F能反应生成C,则推测G为氧气,碳和氧气点燃生成一氧化碳,一氧化碳高温下还原氧化铁生成铁和二氧化碳,铁和硫酸铜反应生成硫酸亚铁和铜,则D为一氧化碳,E为氧化铁,F为铁,C为铜,I能反应生成G(氧气)和H,F(铁)能生成H,即水通电分解生成氢气和氧气,铁和硫酸反应生成硫酸亚铁和氢气,故I为水,H为氢气,A能反应生成B和C(铜),B能生成D(一氧化碳),一氧化碳在加热条件下还原氧化铜生成铜和二氧化碳,二氧化碳和碳高温下反应生成一氧化碳,故A为氧化铜,B为二氧化碳。代入验证,推论合理。
【详解】(1)H为氢气,化学式为H2;
(2)②可以为碳和二氧化碳高温下反应生成一氧化碳,化学方程式为:;
③可以为铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:;
(3)由分析可知,A为氧化铜,B为二氧化碳,C为铜,D为一氧化碳,E为氧化铁,F为铁,G为氧气,H为氢气,I为水,其中BDI属于非金属氧化物;
(4)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,则③铁和硫酸铜反应生成硫酸亚铁和铜、⑥铁和硫酸反应生成硫酸亚铁和氢气,一定属于置换反应。
5. CO2 CaO+H2 O═Ca(OH)2 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【详解】二氧化碳是一种气体肥料,因此A是二氧化碳;
人体中含量最高的金属元素是钙元素,碳酸钙的相对分子质量为100,因此D是碳酸钙;
碳酸钙在高温条件下分解生成氧化钙和二氧化碳,因此C是氧化钙;
氧化钙能和水反应生成氢氧化钙,氢氧化钙能和二氧化碳反应生成碳酸钙和水,因此B是氢氧化钙;
氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠,氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠能和氢氧化钙反应生成碳酸钙和氢氧化钠,因此F是氢氧化钠,E是碳酸钠;
所以,A的化学式是CO2;
C→B的化学方程式为:CaO+H2 O═Ca(OH)2;
E→F的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
6.(1) CaCO3 供给呼吸
(2)
(3)
【分析】E通入澄清的石灰水中生成白色沉淀,推出E为二氧化碳,A是红棕色粉末,在高温的条件下生成二氧化碳,推出A为氧化铁,又B、E是元素组成相同的两种气体,推出B为一氧化碳,D为铁,铁与稀盐酸反应生成氢气和氯化亚铁,推出F为氢气,G为氯化亚铁溶液,一氧化碳点燃生成二氧化碳,推出C为氧气,所以A为氧化铁,B为一氧化碳,C为氧气,D为铁,E为二氧化碳,F为氢气,G为氯化亚铁,H为碳酸钙。
【详解】(1)H为碳酸钙,C为氧气,用途为供给呼吸,故填:CaCO3;供给呼吸;
(2)一氧化碳在高温的条件下还原氧化铁生成铁和二氧化碳,化学方程式为:;故填: ;
(3)二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为:;故填: 。
【点睛】根据物质的特征颜色入手推出,然后结合各反应的特征将物质一一推出。
7.(1)H2
(2)
【分析】几种物质是由H、C、O、Na、Cl中的一种或几种元素组成,都是初中化学常见的化学物质,B是目前新清洁能源N开发的最广泛资源,所以B是水,N是氢气,常温下A、B为液体,A在一定条件下可分解为B和单质M,所以A是过氧化氢溶液,M是氧气,D是胃酸的主要成分,过多时可服用E缓解疼痛,所以D是盐酸,E是碳酸氢钠,经过验证,推导正确。
【详解】(1)N是氢气,化学式为H2;
(2)D为盐酸,E为碳酸氢钠,盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,该反应方程式为:。
8. 乙 NaCl(答案合理即可) = Ba(OH)2+H2SO4===BaSO4↓+2H2O
【详解】(1)显碱性的溶液能使无色的酚酞试液变红色,所以分别滴入1-2滴无色酚酞溶液,能使酚酞溶液变红的废液是乙溶液;
(2)氯化钠的水溶液呈中性,pH=7;
(3)氢氧化钡和硫酸反应生成硫酸钡沉淀和水,水溶液呈中性,pH=7,化学方程式为:Ba(OH)2+H2SO4=BaSO4↓+2H2O。
9. Fe2O3 CO2 CuSO4 ②③ 3CO+Fe2O32Fe+3CO2
【分析】A~H表示初中化学常见物质,A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,所以A是氧化铁,B是一氧化碳,D是二氧化碳,C是铁,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,H为白色沉淀,所以H是碳酸钙,C、F为金属单质,其它物质为化合物,F为紫红色,所以F是铜,铁和稀硫酸反应生成硫酸亚铁和氢气,所以G是硫酸亚铁,E和铁反应会生成硫酸亚铁和铜,所以E是硫酸铜,经过验证,推导正确,
【详解】(1)所以A是Fe2O3,D是CO2,E是CuSO4;
(2)①是一氧化碳和氧化铁高温生成铁和二氧化碳,不属于置换反应,②是铁和硫酸铜反应生成硫酸亚铁和铜,属于置换反应,③是铁和稀硫酸反应生成硫酸亚铁和氢气,属于置换反应,④是二氧化碳和氢氧化钙生成碳酸钙沉淀和水,不属于置换反应,所以①~④的反应中属于置换反应的是②③;
(3)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O32Fe+3CO2。
10.(1) 烧碱、火碱、苛性钠 Na2CO3
(2)Ca(OH)2+CO2=CaCO3↓+H2O(合理即可)
(3)BaCl2+H2SO4=BaSO4↓+2HCl
【分析】根据初中化学常见的六种物质之间的反应关系图,X与B发生中和反应,产物之一是厨房内常用的调味品,所以X、B是盐酸、氢氧化钠中的一种,D常用于改良酸性土壤,所以D是氢氧化钙,且X、Y是同类物质,氢氧化钙会与X反应,所以X是盐酸,B是氢氧化钠,A会与氢氧化钙互相转化,所以A是水,Y会转化成水、盐酸,所以Y是硫酸,氢氧化钠转化成的C会与氢氧化钙反应,所以C是碳酸钠,然后将推出的物质进行验证即可。
【详解】(1)由分析可知,B是氢氧化钠,C是碳酸钠,所以B的俗称是烧碱、火碱、苛性钠;C的化学式是Na2CO3;
(2)由分析可知,D是氢氧化钙,A是水,D→A且不属于复分解反应的可以是氢氧化钙与二氧化碳反应,生成碳酸钙和水,该反应)化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
(3)由分析可知,Y是硫酸,X是盐酸,所以Y→X是硫酸与氯化钡反应生成硫酸钡和氯化氢,反应的化学方程式是:BaCl2+H2SO4=BaSO4↓+2HCl。
11.(1)CaCO3
(2)
(3)
【分析】A常用来与硫黄混合刷在树干底部,防冻伤并杀虫卵,所以A就是氢氧化钙,组成化合物E和H的元素种类相同,H和E发生的是分解反应,所以H是过氧化氢,E是水,E和H分解反应都会生成G,所以G是氧气。右圈中的转化均为化合反应,D是常见的非金属单质,组成化合物F和I的元素种类也相同,F会与氢氧化钙反应,所以F是二氧化碳,I是一氧化碳,D是碳,B就是碳酸钙。
【详解】(1)由分析可知,B就是碳酸钙,化学式为:CaCO3;
(2)由分析可知,H是过氧化氢,G是氧气,故H→G可以为过氧化氢在二氧化锰的作用下分解生成氢气和氧气,化学方程式为:;
(3)由分析可知,F是二氧化碳,I是一氧化碳,D是碳,故F+D→I为二氧化碳和碳在高温条件下化合生成一氧化碳,化学反应方程式为:。
12. NH4NO3 Na2CO3+2HCl═2NaCl+CO2↑+H2O CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑(合理均可) 硝酸
【分析】A~H是初中化学常见的物质,A俗称纯碱,所以A是碳酸钠,A和B反应会转化成C和D,C可用作补钙剂,所以C是碳酸钙,B是氢氧化钙,D是氢氧化钠,G是一种常见的氮肥,含氮量为35%,所以G是硝酸铵,H、F物质类别相同,碳酸钙生成的F会与氢氧化钠反应,所以F是二氧化碳,碳酸钠生成的H会转化成B,所以H是水,E会与碳酸钠、碳酸钙反应,所以E可以是硝酸、盐酸等常见的酸,经过验证,推断正确。
【详解】(1)由分析可知,G是NH4NO3;
(2) A转化为H的反应是碳酸钠和稀盐酸反应生成氯化钠、二氧化碳、水,反应的化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
E和C的反应可以是碳酸钙和稀硝酸反应生成硝酸钙和水、二氧化碳,反应的化学方程式为:CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑;
(3)若E与G的组成元素相同,则E的名称为硝酸。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
13. 酸 CuSO4 CO2 产生蓝色沉淀
【分析】A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,可推出A为硫酸铜,硫酸铜属于盐,B能用于灭火,则B为二氧化碳,二氧化碳属于氧化物,则C属于酸。
【详解】(1)由分析可知,C属于酸;
(2)A为硫酸铜,化学式为:CuSO4;B为二氧化碳,化学式为:CO2;
(3)C属于酸,如盐酸,盐酸与氢氧化钠反应生成氯化钠和水,该反应的化学方程式为:;
(4)A为硫酸铜,氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,实验现象为:产生蓝色沉淀。
14.(1) 氧化铁/三氧化二铁 四氧化三铁
(2) 产生气泡,固体减少,放热,溶液(由无色)变为浅绿色
【分析】单质B是生活中常见且世界年产量最高的金属,则B为铁;A是红棕色粉末,则A为氧化铁;B(铁)与氧气燃烧后生成黑色固体C,则C为四氧化三铁;单质B(铁)与稀硫酸反应生成无色可燃气体D,则D为氢气;单质B(铁)与硫酸铜反应生成红色固体E,则E为铜。
【详解】(1)由分析可知,A为氧化铁(三氧化二铁),C为四氧化三铁;
(2)①B为铁,D为氢气,则反应②是铁与稀硫酸反应生成硫酸亚铁和氢气,故反应的化学方程式写为:Fe+H2SO4=FeSO4+H2↑;
②铁与稀硫酸反应生成硫酸亚铁和氢气的现象为:产生气泡,固体减少,放热,溶液(由无色)变为浅绿色。
15. H2O
【分析】A~F是初中化学中常见的六种物质,D是胃液中含有的酸,所以D是盐酸,A是铁锈的主要成分,所以A是氧化铁,C在常温下是一种气体,且可以通过光合作用转化为B物质,所以C是二氧化碳,B是氧气,氧气和酸都会生成E,所以E是水,氧化铁转化成的F会与盐酸反应,所以F是铁,经过验证,推导正确。
【详解】(1)E物质是水,化学式为H2O;
(2)F和D的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式是:Fe+2HCl═FeCl2+H2↑;
(3)A和D的反应是氧化铁和盐酸反应生成氯化铁和水,化学方程式是;Fe2O3+6HCl═2FeCl3+3H2O;
(4)A→F的反应是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式是:3CO+Fe2O32Fe+3CO2。
故答案为:(1)H2O;
(2)Fe+2HCl═FeCl2+H2↑;
(3)Fe2O3+6HCl═2FeCl3+3H2O;
(4)3CO+Fe2O32Fe+3CO2。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
答案第1页,共2页
答案第1页,共2页
同课章节目录
