2024中考化学备战二轮复习---推断题(含解析)
文档属性
| 名称 | 2024中考化学备战二轮复习---推断题(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 470.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-18 00:00:00 | ||
图片预览



文档简介
2024中考化学备战二轮复习---推断题
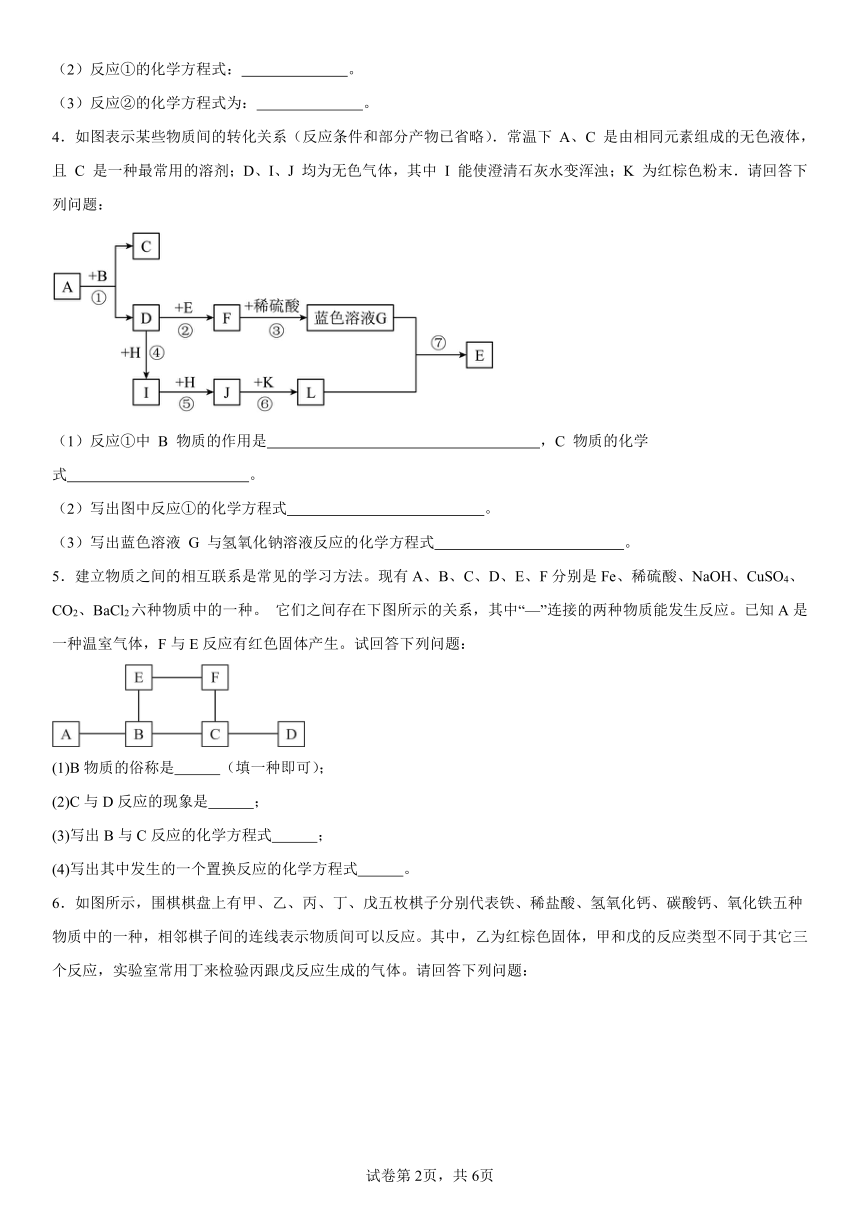
1.现欲探究一固体混合物 A 的成分,已知其中可能含有 CaCO3、MgSO4、NH4Cl、Cu 四种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体 E 的化学式为 。
(2)写出实验过程①中一定发生反应的化学方程式: 。
(3)混合沉淀 C 中至少含有 种物质。
(4)混合物A 中,还不能确定存在的物质是 (写化学式)。要进一步确定其是否存在,可用无色溶液 D 进行再实验,请补充完整实验操作步骤、发生的现象及结论:取少量溶液 D 于试管中, 。
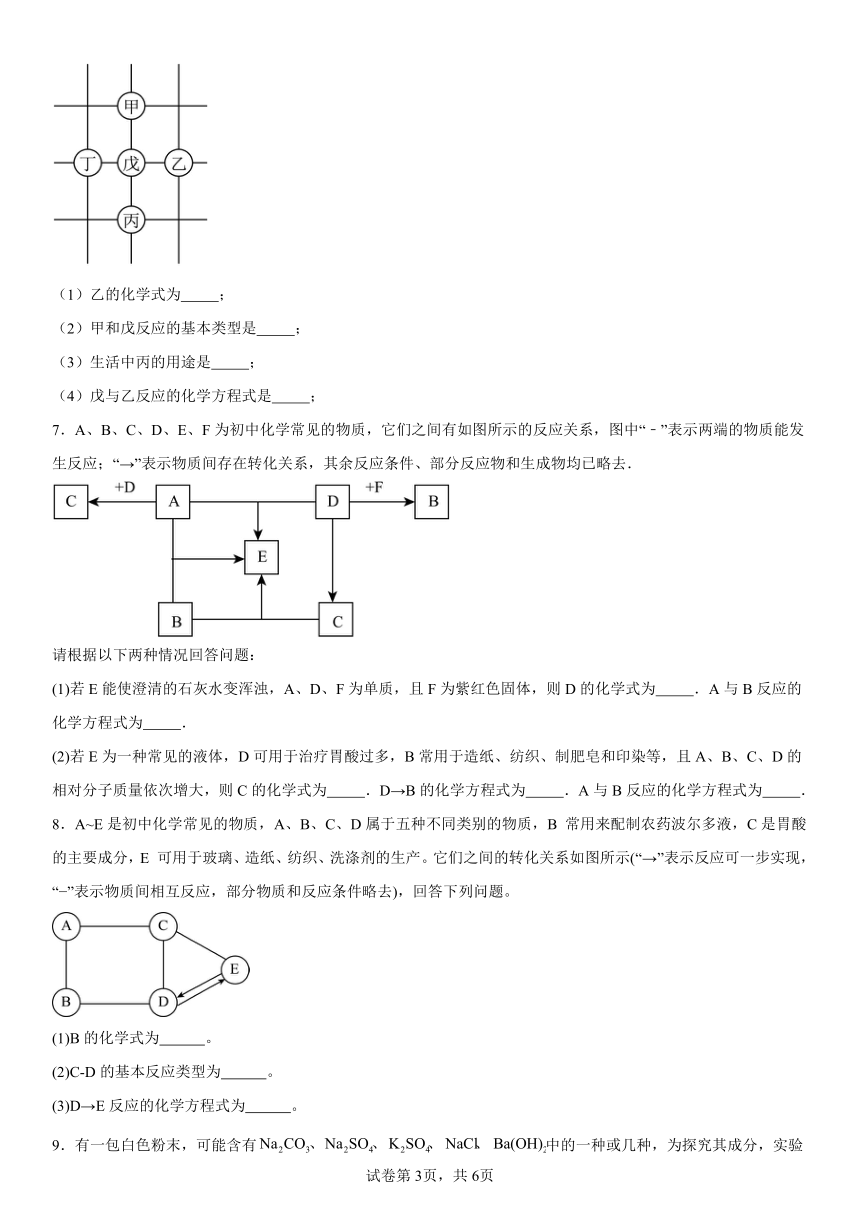
2.下图是初中化学中常见物质间的转化关系,其中在通常情况下,F、G是组成元素相同的两种气体,Q是铁锈的主要成份,R是黑色固体(部分反应条件和生成物已略去),请回答下列问题:
(1)G的化学式为 。
(2)若E是生活中常用的调味剂、防腐剂,则D的化学式为 。
反应②的化学方程式为 。
(3)反应⑤在工业生产中的用途为 。
3.A-G表示初中化学常见的物质,它们之间的转化关系如图所示(部分生成物已略去)。其中A、B、C中均含有同一种元素,D是温室气体,G是重要调味品。请回答下列问题:
(1)G的化学式为 。
(2)反应①的化学方程式: 。
(3)反应②的化学方程式为: 。
4.如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下 A、C 是由相同元素组成的无色液体,且 C 是一种最常用的溶剂;D、I、J 均为无色气体,其中 I 能使澄清石灰水变浑浊;K 为红棕色粉末.请回答下列问题:
(1)反应①中 B 物质的作用是 ,C 物质的化学式 。
(2)写出图中反应①的化学方程式 。
(3)写出蓝色溶液 G 与氢氧化钠溶液反应的化学方程式 。
5.建立物质之间的相互联系是常见的学习方法。现有A、B、C、D、E、F分别是Fe、稀硫酸、NaOH、CuSO4、CO2、BaCl2六种物质中的一种。 它们之间存在下图所示的关系,其中“—”连接的两种物质能发生反应。已知A是一种温室气体,F与E反应有红色固体产生。试回答下列问题:
(1)B物质的俗称是 (填一种即可);
(2)C与D反应的现象是 ;
(3)写出B与C反应的化学方程式 ;
(4)写出其中发生的一个置换反应的化学方程式 。
6.如图所示,围棋棋盘上有甲、乙、丙、丁、戊五枚棋子分别代表铁、稀盐酸、氢氧化钙、碳酸钙、氧化铁五种物质中的一种,相邻棋子间的连线表示物质间可以反应。其中,乙为红棕色固体,甲和戊的反应类型不同于其它三个反应,实验室常用丁来检验丙跟戊反应生成的气体。请回答下列问题:
(1)乙的化学式为 ;
(2)甲和戊反应的基本类型是 ;
(3)生活中丙的用途是 ;
(4)戊与乙反应的化学方程式是 ;
7.A、B、C、D、E、F为初中化学常见的物质,它们之间有如图所示的反应关系,图中“﹣”表示两端的物质能发生反应;“→”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去.
请根据以下两种情况回答问题:
(1)若E能使澄清的石灰水变浑浊,A、D、F为单质,且F为紫红色固体,则D的化学式为 .A与B反应的化学方程式为 .
(2)若E为一种常见的液体,D可用于治疗胃酸过多,B常用于造纸、纺织、制肥皂和印染等,且A、B、C、D的相对分子质量依次增大,则C的化学式为 .D→B的化学方程式为 .A与B反应的化学方程式为 .
8.A~E是初中化学常见的物质,A、B、C、D属于五种不同类别的物质,B 常用来配制农药波尔多液,C是胃酸的主要成分,E 可用于玻璃、造纸、纺织、洗涤剂的生产。它们之间的转化关系如图所示(“→”表示反应可一步实现,“ ”表示物质间相互反应,部分物质和反应条件略去),回答下列问题。
(1)B的化学式为 。
(2)C-D的基本反应类型为 。
(3)D→E反应的化学方程式为 。
9.有一包白色粉末,可能含有中的一种或几种,为探究其成分,实验过程如图所示:
请回答:
(1)由步骤Ⅰ可知,原白色粉末中一定含有 (填化学式)。
(2)若步骤Ⅱ中沉淀不溶解,写出产生沉淀的化学反应方程式 。
(3)若步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有 种情况。
10.垃圾回收,分类的关键确定垃圾的成分,是对垃圾进行分类的前提。某校化学实验室收集到一包固体废弃物,可能是由碳、镁、铁、铜中的一种或者几种组成,为了确定其成分,在老师的指导下,同学们取样进行了如下实验,并观察到溶液A为浅绿色,溶液B为蓝色:
(1)气体 A 是 (填名称);
(2)加酸溶解废弃物时,需要通风并远离火源,原因是: ;
(3)操作 Ⅰ、操作Ⅱ 均为 操作,此操作中用到的玻璃仪器有 。
(4)请写出固体A与AgNO3反应的化学方程式: ;
(5)请写出气体C与澄清石灰水反应的化学方程式: ;
(6)样品中一定含有 (填化学式),可能含有 (填化学式)。
11.A~F均为初中化学常见的物质,它们之间的关系如图所示(部分物质和反应条件已略去)。A、B、C均含同一种金属元素,C是大理石的主要成分,D、E为组成元素完全相同的氧化物,F为黑色单质。试回答下列问题:
(1)写出B的一种用途: 。
(2)A转化为C的化学方程式为 。
(3)D和密度最小的气体在高温条件下反应生成E和另一种常见的氧化物,反应的化学方程式为 。
12.A~E为初中化学常见不同类别的物质,A、B、C均含有同一种元素且A为红色的金属单质,C物质的水溶液为蓝色,其中金属元素的质量分数为40%。它们之间的相互关系如图所示(其中“→”表示反应一步实现,“-”表示相互反应,部分条件已略去)。
(1)D属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)C→A的基本反应类型是 。
(3)E→C的化学方程式为 。
13.A、B、C、D、E、F是初中化学常见的6种物质,如图是这些物质间的相互反应及转化关系。其中A、C均为氧化物,B俗称纯碱,F是大理石的主要成分。图中“一”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去)。请根据上述条件进行推断并完成下列问题。
(1)写出C的一种用途 。
(2) B→A的反应属于基本反应类型中的 反应。
(3)写出D的化学式 。
(4)写出E→F的反应方程式 。
14.现欲通过实验确定一固体混合物A的成分,已知其中可能含有Fe2O3、Na2CO3、BaSO4三种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体B是 (写化学式)。
(2)溶液C中,一定存在的阴离子是 (写离子符号)。
(3)现象E为 ,步骤③所发生反应的化学方程式为 。
(4)根据上述现象,固体混合物A中一定含有 种物质。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. CO2 2 MgSO4 滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4
【详解】(1)将气体E通入澄清石灰水中,澄清石灰水变浑浊,说明气体E是二氧化碳,化学式为:CO2;
(2)混合物A中加入氢氧化钠,有气体生成,且该气体能使紫色石蕊溶液变蓝,可推出气体B为氨气,说明混合物中含氯化铵,氯化铵与氢氧化钠反应生成氨气、氯化钠和水,故实验过程①中一定发生反应的化学方程式为:;
(3)向混合物A中加入稀盐酸,有二氧化碳气体生成,说明混合物中含碳酸钙,因为碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,有固体F产生,铜不与稀盐酸反应,故F为铜,向混合物中加入氢氧化钠,有氨气产生,说明含氯化铵,无法确定是否含硫酸镁,故混合沉淀 C 中至少含有碳酸钙、铜两种物质;
(4)由以上分析可知,混合物A 中,还不能确定存在的物质是:MgSO4;
硫酸根离子可与钡离子结合成硫酸钡沉淀,故为确定是否含硫酸镁,可取少量溶液 D 于试管中,滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4。
2. CO CaCO3 Na2CO3+2HCl==2NaCl+H2O+CO2↑ 高炉炼铁
【详解】F、G是组成元素相同的两种气体,所以F、G可能为二氧化碳或一氧化碳,D高温会生成F,所以D可能是碳酸钙,F可能是二氧化碳,G可能是一氧化碳; R是黑色固体,F与R能反应生成G,则R是碳;Q是铁锈的主要成份,则Q是氧化铁;E是生活中常用的调味剂、防腐剂,所以E为氯化钠,A和B反应产生碳酸钙和氯化钠,所以A和B是碳酸钠和氯化钙中的一种,B和C反应产生氯化钠和二氧化碳,所以B是碳酸钠,C是盐酸,A就是氯化钙。(1)由分析可知,G为一氧化碳,故G的化学式为CO;(2) 由分析可知,D是碳酸钙,化学式为CaCO3;反应②是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;(3)反应⑤是一氧化碳与氧化铜的反应,在工业生产中的用途为高炉炼铁。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
3. NaCl 2HCl+Ca(OH)2=CaCl2+2H2O CaCl2+Na2CO3=CaCO3↓+2NaCl
【分析】A~G表示初中化学常见的物质,其中A、B、C中均含有同一种元素,D是温室气体,则以D是二氧化碳;G是重要调味品,则G是氯化钠;二氧化碳和C反应会生成F,则C是氢氧化钠,F是碳酸钠;B和氢氧化钠会生成氯化钠,则B是盐酸;碳酸钠和E反应会生成氯化钠,则E是氯化钙;A和盐酸反应生成氯化钙,则A是氢氧化钙,然后将推出的物质进行验证准确。
【详解】(1)根分析G的化学式为:NaCl;
(2)反应①是盐酸和氢氧化钙反应生成氯化钙和水,2HCl+Ca(OH)2=CaCl2+2H2O;
(3)反应②是E、F反应生成G,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl。
4. 催化作用 H2O 2H2O22H2O+O2↑ CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
【详解】(1)常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂,所以C是水,A分解会生成C和无色气体D,所以A是过氧化氢溶液,D是氧气,B就是二氧化锰,I能使澄清的石灰水变浑浊,所以I是二氧化碳,氧气和H会生成二氧化碳,二氧化碳和H会生成J,所以H是木炭,J是一氧化碳,F和稀硫酸会生成蓝色溶液G,所以G是硫酸铜溶液,氧气和E会生成F,所以F是氧化铜,E是铜,一氧化碳和红色粉末K会生成L,所以K是氧化铁,L就是铁,铁和硫酸铜反应生成铜和硫酸亚铁,经过验证,推导正确,所以反应①中B物质的作用是催化作用,C物质的化学式H2O;
(2)反应①是过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O22H2O+O2↑;
(3)蓝色溶液G与氢氧化钠溶液的反应是硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
故答案为(1)催化作用,H2O;
(2)2H2O22H2O+O2↑;
(3)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
5.(1)火碱/烧碱/苛性钠
(2)产生白色沉淀
(3)2NaOH + H2SO4 = Na2SO4 + 2H2O
(4)Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑
【分析】A是一种温室气体,为二氧化碳,二氧化碳和氢氧化钠能反应,B为氢氧化钠,F与E反应有红色固体产生,铁和硫酸铜生成硫酸亚铁和铜,一个是硫酸铜,一个是铁,硫酸铜可以和氢氧化钠反应,E为硫酸铜,F为铁,硫酸可以和铁反应,C为硫酸,剩下D为氯化钡,带入转化关系,符合题意。
【详解】(1)由分析可知,B为氢氧化钠,俗称火碱、烧碱、苛性钠。
(2)C硫酸和D氯化钡生成硫酸钡沉淀和盐酸,故填:产生白色沉淀。
(3)B氢氧化钠和C硫酸生成硫酸钠和水,故填:2NaOH + H2SO4 = Na2SO4 + 2H2O。
(4)铁和硫酸铜生成硫酸亚铁和铜,铁和硫酸生成硫酸亚铁和氢气,属于置换反应,故填:Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑。
6. Fe2O3 置换反应 建筑材料或补钙剂 Fe2O3+6HCl=FeCl3+3H2O
【分析】乙为红棕色固体,故乙是氧化铁,常用丁来检验丙跟戊反应生成的气体。则丁可能是氢氧化钙,丙跟戊反应生成的气体可能是二氧化碳,故丙戊即为稀盐酸和碳酸钙两种中的一种,故甲是铁,据此分析解答即可;
【详解】乙为红棕色固体,故乙是氧化铁,常用丁来检验丙跟戊反应生成的气体。则丁可能是氢氧化钙,丙跟戊反应生成的气体可能是二氧化碳,故丙戊即为稀盐酸和碳酸钙两种中的一种,故甲是铁,铁和戊能够反应,戊是稀盐酸,丙是碳酸钙,甲和戊的反应类型是置换反应,其它三个反应均是复分解反应;
(1)由分析知乙是氧化铁,化学式为:Fe2O3;
(2)甲和戊是铁和稀盐酸的反应,其类型是置换反应;
(3)丙是碳酸钙,生活中常用来做建筑材料或补钙剂;
(4)戊与乙反应的化学方程式是:Fe2O3+6HCl=FeCl3+3H2O
7. O2 C+2CuO2Cu+CO2↑ CO2 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH HCl+NaOH=NaCl+H2O
【详解】本题推断题。解答这类框图推断题的关键是找好突破口,缩小范围之后根据已推出的作为源头根据题中信息结合物质的性质导出其他的物质;做推断题要根据信息敢于假设。
(1)根据“若E能使澄清的石灰水变浑浊”,则E为二氧化碳,“A、D、F为单质,且F为紫红色固体”,F为铜,A与D能生成二氧化碳,D能与铜反应,则A可能为碳、D可能为氧气,B可能为氧化铜;氧气能生成C,C能与氧化铜生成二氧化碳,C可能为一氧化碳,碳与氧化铜能生成二氧化碳,碳与氧气能生成一氧化碳。代入检验,符合题意。D为氧气,其化学式为O2;A与B反应为碳与氧化铜的反应生成铜和二氧化碳,其化学方程式为C+2CuO2Cu+CO2↑;
(2)E为一种常见的液体,E可能水,D可用于治疗胃酸过多,D可能是碳酸钠;B常用于造纸、纺织、制肥皂和印染等,B可能是氢氧化钠,根据框图和“A、B、C、D的相对分子质量依次增大”则可推测:A可能为稀盐酸、C可能为二氧化碳、F可能为氢氧化钙。代入框图检验,符合题意。物质C为二氧化碳,其化学式为CO2;反应D→B为碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;反应A与B为氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。
8.(1)CuSO4
(2)复分解反应
(3)
【分析】C是胃酸的主要成分,所以C是盐酸;E广泛用于玻璃、造纸、纺织和洗涤剂的生产,所以E是碳酸钠,D和E(碳酸钠)可以相互转化,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠和水,所以D是氢氧化钠;B 常用来配制农药波尔多液,B是氢氧化钙和硫酸铜中的一种,B能与D(氢氧化钠)反应,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,不能与氢氧化钙反应,则B是硫酸铜,A、B、C、D属于五种不同类别的物质,B(硫酸铜)属于盐,D(氢氧化钠)属于碱,C是盐酸属于酸,则A是单质或氧化物,A能与B(硫酸铜)反应,则A是活动性强于铜的金属(除K、Ca、Na)。经过验证,推导正确,
【详解】(1)B硫酸铜,化学式为CuSO4;
(2)C-D的反应是盐酸与氢氧化钠反应生成氯化钠和水,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;
(3)D→E的反应是氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式为。
9.(1)Ba(OH)2
(2)Na2SO4+Ba(OH)2=BaSO4↓+2NaOH/K2SO4+Ba(OH)2=BaSO4↓+2KOH
(3)6
【详解】(1)将白色粉末加足量的水,得到溶液和沉淀,而硫酸钠或硫酸钾均能与氢氧化钡反应生成硫酸钡沉淀,碳酸钠和氢氧化钡反应生成碳酸钡沉淀,则说明白色粉末中一定含有氢氧化钡,化学式为Ba(OH)2。
(2)若得到的沉淀不溶于稀硝酸中,而碳酸钡能溶于硝酸中,硫酸钡不溶于硝酸中,则说明沉淀为硫酸钡,则产生沉淀的化学方程式为Na2SO4+Ba(OH)2=BaSO4↓+2NaOH或K2SO4+Ba(OH)2=BaSO4↓+2KOH。
(3)若得到的沉淀部分溶于稀硝酸中,则说明沉淀为碳酸钡和硫酸钡,则该白色粉末中一定含有碳酸钠和氢氧化钡,至少含有硫酸钠和硫酸钾中的一种,可能含有氯化钠,则可能为氢氧化钡、碳酸钠、硫酸钠或氢氧化钡、碳酸钠、硫酸钠、氯化钠或氢氧化钡、碳酸钠、硫酸钾或氢氧化钡、碳酸钠、硫酸钾、氯化钠或氢氧化钡、碳酸钠、硫酸钠、硫酸钾或氢氧化钡、碳酸钠、硫酸钠、硫酸钾、氯化钠,则组成共6种。
10. 氢气 该反应生成的氢气具有可燃性,遇明火易发生爆炸 过滤 漏斗、烧杯、玻璃棒 C、Cu、Fe Mg
【解析】样品加入过量稀盐酸产生气体A,镁、铁都能和稀盐酸反应生成氢气,故气体A是氢气,生成溶液A是浅绿是,分析是氯化亚铁,所以样品中一定有铁,可能含有镁,得到的固体A与过量AgNO3反应生成蓝色的溶液B,分析蓝色溶液B为Cu(NO3)2,所以样品中一定有铜,固体B和足量的O2反应生成能使澄清石灰水变白的气体,所以气体C是CO2,固体B中有C,所以样品中一定含有炭,固体C是Cu和AgNO3反应置换出的Ag。
【详解】(1)根据分析,气体A是氢气,故填:氢气;
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是反应生成物的氢气具有可燃性,遇到明火易发生爆炸,故填:该反应生成的氢气具有可燃性,遇明火易发生爆炸;
(3)有图可以看出,操作Ⅰ、操作Ⅱ后固液分离,故操作为过滤,在过滤操作中用到的玻璃仪器有漏斗、烧杯、玻璃棒,故填:过滤,漏斗、烧杯、玻璃棒;
(4)根据分析固体A与AgNO3反应是Cu和AgNO3反应,反应的化学方程式为:Cu+2AgNO3=2Ag+Cu(NO3)2 ,故填:Cu+2AgNO3=2Ag+Cu(NO3)2;
(5)根据分析,C是CO2,与澄清石灰水反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,故填:CO2+Ca(OH)2=CaCO3↓+H2O。
(6)根据分析,样品中一定含有C、Cu、Fe,可能含有Mg,故填:C、Cu、Fe,Mg。
【点睛】本题为物质推断题,根据题意涉及可能的四种物质,结合过程图进行分析,本题的突破口在固体与稀盐酸反应产生气体,溶液A为浅蓝色,溶液B为蓝色,推导出固体中有铁和铜;最后的固体B灼烧产生能使澄清石灰水变浑浊的气体,该气体是二氧化碳,推导出一定含有碳单质,因此物质推断题解答时,找准突破口是关键。
11.(1)作食品干燥剂
(2)
(3)
【分析】A~F均为初中化学常见的物质,A、B、C均含同一种金属元素,C是大理石的主要成分,可推出C为碳酸钙,A能转化为C,C能转化为B,B能转化为A,可推出B为氧化钙,A为氢氧化钙,D、E为组成元素完全相同的氧化物,C能与D相互转化,可推出D为二氧化碳,D能与E相互转化,可推出E为一氧化碳,F为黑色单质,F能转化为D、E,可推出F为碳,代入验证,符合题意。
【详解】(1)由分析可知,B为氧化钙,氧化钙能与水反应生成氢氧化钙,可作食品干燥剂;
(2)A转化为C的反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(3)D为二氧化碳,密度最小的气体是氢气,E为一氧化碳,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含C、H、O,生成物中含C、O,故生成物中还应含氢元素,故生成的另一种氧化物是水,该反应的化学方程式为:。
12. 碱 置换反应 H2SO4+CuO=CuSO4+H2O
【分析】A为红色的金属单质,则A为Cu;C物质的水溶液为蓝色,其中金属元素的质量分数为40%,则C为CuSO4;A、B、C均含有同一种元素,且Cu可转化为B、B可转化为CuSO4,则B为CuO;A~E为初中化学常见不同类别的物质,A为单质、B为氧化物、C为盐,故D、E分别为酸、碱中的一种,CuSO4可与D反应,所以D为可溶性碱,例如NaOH等,E属于酸且可转化为硫酸铜,则E为稀硫酸。
【详解】(1)分析可知,D为可溶性碱,属于碱。
(2)A为Cu、C为CuSO4,CuSO4可被活动性比Cu强的金属单质置换出Cu,则CuSO4→Cu为置换反应。
(3)C为CuSO4、E为稀硫酸,稀硫酸与CuO可转化为CuSO4和水,即稀硫酸→CuSO4的化学方程式为H2SO4+CuO=CuSO4+H2O。
13. 灭火(合理即可) 复分解反应 HCl(合理即可)
【分析】A、B、C、D、E、F是初中化学常见的6种物质,B俗称纯碱,故B为碳酸钠,F是大理石的主要成分,故F是碳酸钙,C能和碳酸钠相互转化,且C能转化为碳酸钙,可推出C为二氧化碳,D能转化为二氧化碳,且D能和碳酸钙反应,可推出D为酸,如盐酸,E能与碳酸钠、酸反应,且E可转化为碳酸钙,可推出E为氢氧化钙,碳酸钠能转化为A,A能转化为氢氧化钙,且A为氧化物,可推出A为水。
【详解】(1)C为二氧化碳,二氧化碳可用于光合作用,灭火等;
(2)B为碳酸钠,A为水,碳酸钠可与盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
(3)D为酸,如盐酸,化学式为:HCl(合理即可)
(4)E为氢氧化钙,F为碳酸钙,氢氧化钙可与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:。
【点睛】四大基本反应类型
化合反应:由两种或两种以上的物质生成另一种物质的反应;
分解反应:由一种反应物生成两种或两种以上其他物质的反应;
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应。
14. CO2 Cl- 产生红褐色沉淀 3
【详解】(1)可能存在的物质包含碳酸钠,与盐酸反应会产生气体二氧化碳,二氧化碳可使澄清石灰水变浑浊,所以B为二氧化碳;
(2)此时溶液为黄色,说明含有铁离子,是因为盐酸与氧化铁可以反应生成氯化铁,另外盐酸与碳酸钠反应会生成氯化钠,因此一定存在的阴离子为氯离子;
(3)氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,氢氧化铁为红色沉淀,因此可以看到有红褐色沉淀产生,反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(4)步骤①确定了碳酸钠存在,步骤②确定氧化铁存在,步骤③确定了硫酸钡存在,所以有3种物质存在。
答案第1页,共2页
答案第1页,共2页
1.现欲探究一固体混合物 A 的成分,已知其中可能含有 CaCO3、MgSO4、NH4Cl、Cu 四种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体 E 的化学式为 。
(2)写出实验过程①中一定发生反应的化学方程式: 。
(3)混合沉淀 C 中至少含有 种物质。
(4)混合物A 中,还不能确定存在的物质是 (写化学式)。要进一步确定其是否存在,可用无色溶液 D 进行再实验,请补充完整实验操作步骤、发生的现象及结论:取少量溶液 D 于试管中, 。
2.下图是初中化学中常见物质间的转化关系,其中在通常情况下,F、G是组成元素相同的两种气体,Q是铁锈的主要成份,R是黑色固体(部分反应条件和生成物已略去),请回答下列问题:
(1)G的化学式为 。
(2)若E是生活中常用的调味剂、防腐剂,则D的化学式为 。
反应②的化学方程式为 。
(3)反应⑤在工业生产中的用途为 。
3.A-G表示初中化学常见的物质,它们之间的转化关系如图所示(部分生成物已略去)。其中A、B、C中均含有同一种元素,D是温室气体,G是重要调味品。请回答下列问题:
(1)G的化学式为 。
(2)反应①的化学方程式: 。
(3)反应②的化学方程式为: 。
4.如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下 A、C 是由相同元素组成的无色液体,且 C 是一种最常用的溶剂;D、I、J 均为无色气体,其中 I 能使澄清石灰水变浑浊;K 为红棕色粉末.请回答下列问题:
(1)反应①中 B 物质的作用是 ,C 物质的化学式 。
(2)写出图中反应①的化学方程式 。
(3)写出蓝色溶液 G 与氢氧化钠溶液反应的化学方程式 。
5.建立物质之间的相互联系是常见的学习方法。现有A、B、C、D、E、F分别是Fe、稀硫酸、NaOH、CuSO4、CO2、BaCl2六种物质中的一种。 它们之间存在下图所示的关系,其中“—”连接的两种物质能发生反应。已知A是一种温室气体,F与E反应有红色固体产生。试回答下列问题:
(1)B物质的俗称是 (填一种即可);
(2)C与D反应的现象是 ;
(3)写出B与C反应的化学方程式 ;
(4)写出其中发生的一个置换反应的化学方程式 。
6.如图所示,围棋棋盘上有甲、乙、丙、丁、戊五枚棋子分别代表铁、稀盐酸、氢氧化钙、碳酸钙、氧化铁五种物质中的一种,相邻棋子间的连线表示物质间可以反应。其中,乙为红棕色固体,甲和戊的反应类型不同于其它三个反应,实验室常用丁来检验丙跟戊反应生成的气体。请回答下列问题:
(1)乙的化学式为 ;
(2)甲和戊反应的基本类型是 ;
(3)生活中丙的用途是 ;
(4)戊与乙反应的化学方程式是 ;
7.A、B、C、D、E、F为初中化学常见的物质,它们之间有如图所示的反应关系,图中“﹣”表示两端的物质能发生反应;“→”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去.
请根据以下两种情况回答问题:
(1)若E能使澄清的石灰水变浑浊,A、D、F为单质,且F为紫红色固体,则D的化学式为 .A与B反应的化学方程式为 .
(2)若E为一种常见的液体,D可用于治疗胃酸过多,B常用于造纸、纺织、制肥皂和印染等,且A、B、C、D的相对分子质量依次增大,则C的化学式为 .D→B的化学方程式为 .A与B反应的化学方程式为 .
8.A~E是初中化学常见的物质,A、B、C、D属于五种不同类别的物质,B 常用来配制农药波尔多液,C是胃酸的主要成分,E 可用于玻璃、造纸、纺织、洗涤剂的生产。它们之间的转化关系如图所示(“→”表示反应可一步实现,“ ”表示物质间相互反应,部分物质和反应条件略去),回答下列问题。
(1)B的化学式为 。
(2)C-D的基本反应类型为 。
(3)D→E反应的化学方程式为 。
9.有一包白色粉末,可能含有中的一种或几种,为探究其成分,实验过程如图所示:
请回答:
(1)由步骤Ⅰ可知,原白色粉末中一定含有 (填化学式)。
(2)若步骤Ⅱ中沉淀不溶解,写出产生沉淀的化学反应方程式 。
(3)若步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有 种情况。
10.垃圾回收,分类的关键确定垃圾的成分,是对垃圾进行分类的前提。某校化学实验室收集到一包固体废弃物,可能是由碳、镁、铁、铜中的一种或者几种组成,为了确定其成分,在老师的指导下,同学们取样进行了如下实验,并观察到溶液A为浅绿色,溶液B为蓝色:
(1)气体 A 是 (填名称);
(2)加酸溶解废弃物时,需要通风并远离火源,原因是: ;
(3)操作 Ⅰ、操作Ⅱ 均为 操作,此操作中用到的玻璃仪器有 。
(4)请写出固体A与AgNO3反应的化学方程式: ;
(5)请写出气体C与澄清石灰水反应的化学方程式: ;
(6)样品中一定含有 (填化学式),可能含有 (填化学式)。
11.A~F均为初中化学常见的物质,它们之间的关系如图所示(部分物质和反应条件已略去)。A、B、C均含同一种金属元素,C是大理石的主要成分,D、E为组成元素完全相同的氧化物,F为黑色单质。试回答下列问题:
(1)写出B的一种用途: 。
(2)A转化为C的化学方程式为 。
(3)D和密度最小的气体在高温条件下反应生成E和另一种常见的氧化物,反应的化学方程式为 。
12.A~E为初中化学常见不同类别的物质,A、B、C均含有同一种元素且A为红色的金属单质,C物质的水溶液为蓝色,其中金属元素的质量分数为40%。它们之间的相互关系如图所示(其中“→”表示反应一步实现,“-”表示相互反应,部分条件已略去)。
(1)D属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)C→A的基本反应类型是 。
(3)E→C的化学方程式为 。
13.A、B、C、D、E、F是初中化学常见的6种物质,如图是这些物质间的相互反应及转化关系。其中A、C均为氧化物,B俗称纯碱,F是大理石的主要成分。图中“一”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去)。请根据上述条件进行推断并完成下列问题。
(1)写出C的一种用途 。
(2) B→A的反应属于基本反应类型中的 反应。
(3)写出D的化学式 。
(4)写出E→F的反应方程式 。
14.现欲通过实验确定一固体混合物A的成分,已知其中可能含有Fe2O3、Na2CO3、BaSO4三种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体B是 (写化学式)。
(2)溶液C中,一定存在的阴离子是 (写离子符号)。
(3)现象E为 ,步骤③所发生反应的化学方程式为 。
(4)根据上述现象,固体混合物A中一定含有 种物质。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. CO2 2 MgSO4 滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4
【详解】(1)将气体E通入澄清石灰水中,澄清石灰水变浑浊,说明气体E是二氧化碳,化学式为:CO2;
(2)混合物A中加入氢氧化钠,有气体生成,且该气体能使紫色石蕊溶液变蓝,可推出气体B为氨气,说明混合物中含氯化铵,氯化铵与氢氧化钠反应生成氨气、氯化钠和水,故实验过程①中一定发生反应的化学方程式为:;
(3)向混合物A中加入稀盐酸,有二氧化碳气体生成,说明混合物中含碳酸钙,因为碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,有固体F产生,铜不与稀盐酸反应,故F为铜,向混合物中加入氢氧化钠,有氨气产生,说明含氯化铵,无法确定是否含硫酸镁,故混合沉淀 C 中至少含有碳酸钙、铜两种物质;
(4)由以上分析可知,混合物A 中,还不能确定存在的物质是:MgSO4;
硫酸根离子可与钡离子结合成硫酸钡沉淀,故为确定是否含硫酸镁,可取少量溶液 D 于试管中,滴加 BaCl2(或 Ba(NO3)2 或 Ba(OH)2)溶液,若有白色沉淀产生,则含有MgSO4;若无沉淀生成,则不含 MgSO4。
2. CO CaCO3 Na2CO3+2HCl==2NaCl+H2O+CO2↑ 高炉炼铁
【详解】F、G是组成元素相同的两种气体,所以F、G可能为二氧化碳或一氧化碳,D高温会生成F,所以D可能是碳酸钙,F可能是二氧化碳,G可能是一氧化碳; R是黑色固体,F与R能反应生成G,则R是碳;Q是铁锈的主要成份,则Q是氧化铁;E是生活中常用的调味剂、防腐剂,所以E为氯化钠,A和B反应产生碳酸钙和氯化钠,所以A和B是碳酸钠和氯化钙中的一种,B和C反应产生氯化钠和二氧化碳,所以B是碳酸钠,C是盐酸,A就是氯化钙。(1)由分析可知,G为一氧化碳,故G的化学式为CO;(2) 由分析可知,D是碳酸钙,化学式为CaCO3;反应②是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;(3)反应⑤是一氧化碳与氧化铜的反应,在工业生产中的用途为高炉炼铁。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
3. NaCl 2HCl+Ca(OH)2=CaCl2+2H2O CaCl2+Na2CO3=CaCO3↓+2NaCl
【分析】A~G表示初中化学常见的物质,其中A、B、C中均含有同一种元素,D是温室气体,则以D是二氧化碳;G是重要调味品,则G是氯化钠;二氧化碳和C反应会生成F,则C是氢氧化钠,F是碳酸钠;B和氢氧化钠会生成氯化钠,则B是盐酸;碳酸钠和E反应会生成氯化钠,则E是氯化钙;A和盐酸反应生成氯化钙,则A是氢氧化钙,然后将推出的物质进行验证准确。
【详解】(1)根分析G的化学式为:NaCl;
(2)反应①是盐酸和氢氧化钙反应生成氯化钙和水,2HCl+Ca(OH)2=CaCl2+2H2O;
(3)反应②是E、F反应生成G,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl。
4. 催化作用 H2O 2H2O22H2O+O2↑ CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
【详解】(1)常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂,所以C是水,A分解会生成C和无色气体D,所以A是过氧化氢溶液,D是氧气,B就是二氧化锰,I能使澄清的石灰水变浑浊,所以I是二氧化碳,氧气和H会生成二氧化碳,二氧化碳和H会生成J,所以H是木炭,J是一氧化碳,F和稀硫酸会生成蓝色溶液G,所以G是硫酸铜溶液,氧气和E会生成F,所以F是氧化铜,E是铜,一氧化碳和红色粉末K会生成L,所以K是氧化铁,L就是铁,铁和硫酸铜反应生成铜和硫酸亚铁,经过验证,推导正确,所以反应①中B物质的作用是催化作用,C物质的化学式H2O;
(2)反应①是过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O22H2O+O2↑;
(3)蓝色溶液G与氢氧化钠溶液的反应是硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
故答案为(1)催化作用,H2O;
(2)2H2O22H2O+O2↑;
(3)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。
5.(1)火碱/烧碱/苛性钠
(2)产生白色沉淀
(3)2NaOH + H2SO4 = Na2SO4 + 2H2O
(4)Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑
【分析】A是一种温室气体,为二氧化碳,二氧化碳和氢氧化钠能反应,B为氢氧化钠,F与E反应有红色固体产生,铁和硫酸铜生成硫酸亚铁和铜,一个是硫酸铜,一个是铁,硫酸铜可以和氢氧化钠反应,E为硫酸铜,F为铁,硫酸可以和铁反应,C为硫酸,剩下D为氯化钡,带入转化关系,符合题意。
【详解】(1)由分析可知,B为氢氧化钠,俗称火碱、烧碱、苛性钠。
(2)C硫酸和D氯化钡生成硫酸钡沉淀和盐酸,故填:产生白色沉淀。
(3)B氢氧化钠和C硫酸生成硫酸钠和水,故填:2NaOH + H2SO4 = Na2SO4 + 2H2O。
(4)铁和硫酸铜生成硫酸亚铁和铜,铁和硫酸生成硫酸亚铁和氢气,属于置换反应,故填:Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑。
6. Fe2O3 置换反应 建筑材料或补钙剂 Fe2O3+6HCl=FeCl3+3H2O
【分析】乙为红棕色固体,故乙是氧化铁,常用丁来检验丙跟戊反应生成的气体。则丁可能是氢氧化钙,丙跟戊反应生成的气体可能是二氧化碳,故丙戊即为稀盐酸和碳酸钙两种中的一种,故甲是铁,据此分析解答即可;
【详解】乙为红棕色固体,故乙是氧化铁,常用丁来检验丙跟戊反应生成的气体。则丁可能是氢氧化钙,丙跟戊反应生成的气体可能是二氧化碳,故丙戊即为稀盐酸和碳酸钙两种中的一种,故甲是铁,铁和戊能够反应,戊是稀盐酸,丙是碳酸钙,甲和戊的反应类型是置换反应,其它三个反应均是复分解反应;
(1)由分析知乙是氧化铁,化学式为:Fe2O3;
(2)甲和戊是铁和稀盐酸的反应,其类型是置换反应;
(3)丙是碳酸钙,生活中常用来做建筑材料或补钙剂;
(4)戊与乙反应的化学方程式是:Fe2O3+6HCl=FeCl3+3H2O
7. O2 C+2CuO2Cu+CO2↑ CO2 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH HCl+NaOH=NaCl+H2O
【详解】本题推断题。解答这类框图推断题的关键是找好突破口,缩小范围之后根据已推出的作为源头根据题中信息结合物质的性质导出其他的物质;做推断题要根据信息敢于假设。
(1)根据“若E能使澄清的石灰水变浑浊”,则E为二氧化碳,“A、D、F为单质,且F为紫红色固体”,F为铜,A与D能生成二氧化碳,D能与铜反应,则A可能为碳、D可能为氧气,B可能为氧化铜;氧气能生成C,C能与氧化铜生成二氧化碳,C可能为一氧化碳,碳与氧化铜能生成二氧化碳,碳与氧气能生成一氧化碳。代入检验,符合题意。D为氧气,其化学式为O2;A与B反应为碳与氧化铜的反应生成铜和二氧化碳,其化学方程式为C+2CuO2Cu+CO2↑;
(2)E为一种常见的液体,E可能水,D可用于治疗胃酸过多,D可能是碳酸钠;B常用于造纸、纺织、制肥皂和印染等,B可能是氢氧化钠,根据框图和“A、B、C、D的相对分子质量依次增大”则可推测:A可能为稀盐酸、C可能为二氧化碳、F可能为氢氧化钙。代入框图检验,符合题意。物质C为二氧化碳,其化学式为CO2;反应D→B为碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;反应A与B为氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。
8.(1)CuSO4
(2)复分解反应
(3)
【分析】C是胃酸的主要成分,所以C是盐酸;E广泛用于玻璃、造纸、纺织和洗涤剂的生产,所以E是碳酸钠,D和E(碳酸钠)可以相互转化,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠和水,所以D是氢氧化钠;B 常用来配制农药波尔多液,B是氢氧化钙和硫酸铜中的一种,B能与D(氢氧化钠)反应,氢氧化钠与硫酸铜反应生成氢氧化铜和硫酸钠,不能与氢氧化钙反应,则B是硫酸铜,A、B、C、D属于五种不同类别的物质,B(硫酸铜)属于盐,D(氢氧化钠)属于碱,C是盐酸属于酸,则A是单质或氧化物,A能与B(硫酸铜)反应,则A是活动性强于铜的金属(除K、Ca、Na)。经过验证,推导正确,
【详解】(1)B硫酸铜,化学式为CuSO4;
(2)C-D的反应是盐酸与氢氧化钠反应生成氯化钠和水,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应;
(3)D→E的反应是氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式为。
9.(1)Ba(OH)2
(2)Na2SO4+Ba(OH)2=BaSO4↓+2NaOH/K2SO4+Ba(OH)2=BaSO4↓+2KOH
(3)6
【详解】(1)将白色粉末加足量的水,得到溶液和沉淀,而硫酸钠或硫酸钾均能与氢氧化钡反应生成硫酸钡沉淀,碳酸钠和氢氧化钡反应生成碳酸钡沉淀,则说明白色粉末中一定含有氢氧化钡,化学式为Ba(OH)2。
(2)若得到的沉淀不溶于稀硝酸中,而碳酸钡能溶于硝酸中,硫酸钡不溶于硝酸中,则说明沉淀为硫酸钡,则产生沉淀的化学方程式为Na2SO4+Ba(OH)2=BaSO4↓+2NaOH或K2SO4+Ba(OH)2=BaSO4↓+2KOH。
(3)若得到的沉淀部分溶于稀硝酸中,则说明沉淀为碳酸钡和硫酸钡,则该白色粉末中一定含有碳酸钠和氢氧化钡,至少含有硫酸钠和硫酸钾中的一种,可能含有氯化钠,则可能为氢氧化钡、碳酸钠、硫酸钠或氢氧化钡、碳酸钠、硫酸钠、氯化钠或氢氧化钡、碳酸钠、硫酸钾或氢氧化钡、碳酸钠、硫酸钾、氯化钠或氢氧化钡、碳酸钠、硫酸钠、硫酸钾或氢氧化钡、碳酸钠、硫酸钠、硫酸钾、氯化钠,则组成共6种。
10. 氢气 该反应生成的氢气具有可燃性,遇明火易发生爆炸 过滤 漏斗、烧杯、玻璃棒 C、Cu、Fe Mg
【解析】样品加入过量稀盐酸产生气体A,镁、铁都能和稀盐酸反应生成氢气,故气体A是氢气,生成溶液A是浅绿是,分析是氯化亚铁,所以样品中一定有铁,可能含有镁,得到的固体A与过量AgNO3反应生成蓝色的溶液B,分析蓝色溶液B为Cu(NO3)2,所以样品中一定有铜,固体B和足量的O2反应生成能使澄清石灰水变白的气体,所以气体C是CO2,固体B中有C,所以样品中一定含有炭,固体C是Cu和AgNO3反应置换出的Ag。
【详解】(1)根据分析,气体A是氢气,故填:氢气;
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是反应生成物的氢气具有可燃性,遇到明火易发生爆炸,故填:该反应生成的氢气具有可燃性,遇明火易发生爆炸;
(3)有图可以看出,操作Ⅰ、操作Ⅱ后固液分离,故操作为过滤,在过滤操作中用到的玻璃仪器有漏斗、烧杯、玻璃棒,故填:过滤,漏斗、烧杯、玻璃棒;
(4)根据分析固体A与AgNO3反应是Cu和AgNO3反应,反应的化学方程式为:Cu+2AgNO3=2Ag+Cu(NO3)2 ,故填:Cu+2AgNO3=2Ag+Cu(NO3)2;
(5)根据分析,C是CO2,与澄清石灰水反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,故填:CO2+Ca(OH)2=CaCO3↓+H2O。
(6)根据分析,样品中一定含有C、Cu、Fe,可能含有Mg,故填:C、Cu、Fe,Mg。
【点睛】本题为物质推断题,根据题意涉及可能的四种物质,结合过程图进行分析,本题的突破口在固体与稀盐酸反应产生气体,溶液A为浅蓝色,溶液B为蓝色,推导出固体中有铁和铜;最后的固体B灼烧产生能使澄清石灰水变浑浊的气体,该气体是二氧化碳,推导出一定含有碳单质,因此物质推断题解答时,找准突破口是关键。
11.(1)作食品干燥剂
(2)
(3)
【分析】A~F均为初中化学常见的物质,A、B、C均含同一种金属元素,C是大理石的主要成分,可推出C为碳酸钙,A能转化为C,C能转化为B,B能转化为A,可推出B为氧化钙,A为氢氧化钙,D、E为组成元素完全相同的氧化物,C能与D相互转化,可推出D为二氧化碳,D能与E相互转化,可推出E为一氧化碳,F为黑色单质,F能转化为D、E,可推出F为碳,代入验证,符合题意。
【详解】(1)由分析可知,B为氧化钙,氧化钙能与水反应生成氢氧化钙,可作食品干燥剂;
(2)A转化为C的反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(3)D为二氧化碳,密度最小的气体是氢气,E为一氧化碳,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含C、H、O,生成物中含C、O,故生成物中还应含氢元素,故生成的另一种氧化物是水,该反应的化学方程式为:。
12. 碱 置换反应 H2SO4+CuO=CuSO4+H2O
【分析】A为红色的金属单质,则A为Cu;C物质的水溶液为蓝色,其中金属元素的质量分数为40%,则C为CuSO4;A、B、C均含有同一种元素,且Cu可转化为B、B可转化为CuSO4,则B为CuO;A~E为初中化学常见不同类别的物质,A为单质、B为氧化物、C为盐,故D、E分别为酸、碱中的一种,CuSO4可与D反应,所以D为可溶性碱,例如NaOH等,E属于酸且可转化为硫酸铜,则E为稀硫酸。
【详解】(1)分析可知,D为可溶性碱,属于碱。
(2)A为Cu、C为CuSO4,CuSO4可被活动性比Cu强的金属单质置换出Cu,则CuSO4→Cu为置换反应。
(3)C为CuSO4、E为稀硫酸,稀硫酸与CuO可转化为CuSO4和水,即稀硫酸→CuSO4的化学方程式为H2SO4+CuO=CuSO4+H2O。
13. 灭火(合理即可) 复分解反应 HCl(合理即可)
【分析】A、B、C、D、E、F是初中化学常见的6种物质,B俗称纯碱,故B为碳酸钠,F是大理石的主要成分,故F是碳酸钙,C能和碳酸钠相互转化,且C能转化为碳酸钙,可推出C为二氧化碳,D能转化为二氧化碳,且D能和碳酸钙反应,可推出D为酸,如盐酸,E能与碳酸钠、酸反应,且E可转化为碳酸钙,可推出E为氢氧化钙,碳酸钠能转化为A,A能转化为氢氧化钙,且A为氧化物,可推出A为水。
【详解】(1)C为二氧化碳,二氧化碳可用于光合作用,灭火等;
(2)B为碳酸钠,A为水,碳酸钠可与盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应;
(3)D为酸,如盐酸,化学式为:HCl(合理即可)
(4)E为氢氧化钙,F为碳酸钙,氢氧化钙可与二氧化碳反应生成碳酸钙和水,该反应的化学方程式为:。
【点睛】四大基本反应类型
化合反应:由两种或两种以上的物质生成另一种物质的反应;
分解反应:由一种反应物生成两种或两种以上其他物质的反应;
置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应:两种化合物互相交换成分,生成另外两种化合物的反应。
14. CO2 Cl- 产生红褐色沉淀 3
【详解】(1)可能存在的物质包含碳酸钠,与盐酸反应会产生气体二氧化碳,二氧化碳可使澄清石灰水变浑浊,所以B为二氧化碳;
(2)此时溶液为黄色,说明含有铁离子,是因为盐酸与氧化铁可以反应生成氯化铁,另外盐酸与碳酸钠反应会生成氯化钠,因此一定存在的阴离子为氯离子;
(3)氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,氢氧化铁为红色沉淀,因此可以看到有红褐色沉淀产生,反应的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(4)步骤①确定了碳酸钠存在,步骤②确定氧化铁存在,步骤③确定了硫酸钡存在,所以有3种物质存在。
答案第1页,共2页
答案第1页,共2页
同课章节目录
