【高效课堂】人教A版(2019)高中化学必修2--6.1.6燃料电池(教学课件)(共20张PPT)
文档属性
| 名称 | 【高效课堂】人教A版(2019)高中化学必修2--6.1.6燃料电池(教学课件)(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 57.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 11:04:57 | ||
图片预览








文档简介
(共25张PPT)
第六章
第一节 化学反应与能量变化
第六课时 燃料电池
新人教版 化学 必修第二册
01
目录
原电池原理
02
燃料电池
01
一、原电池原理
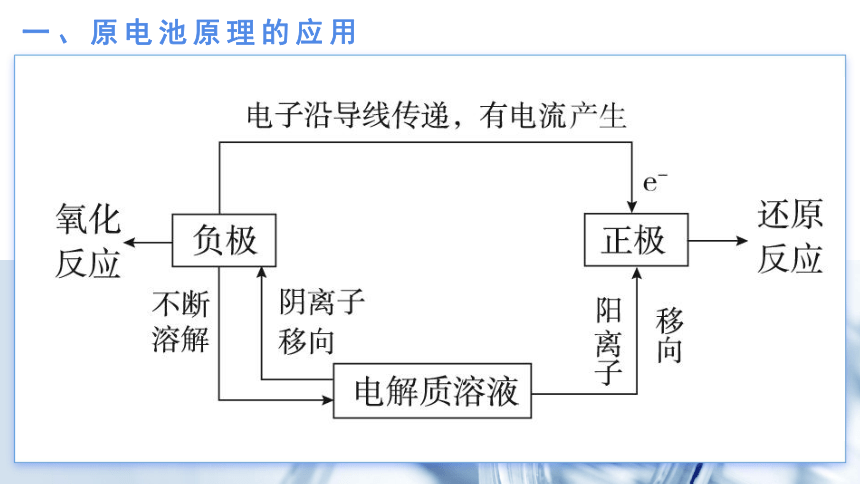
一、原电池原理的应用
一、原电池原理的应用
3.原电池正、负极的判断
(1)根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向来判断
在外电路(导线)中,电流由正极流向负极,电子由负极流向正极。
(3)根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
1.原电池正、负极的判断
(1)根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向来判断
在外电路(导线)中,电流由正极流向负极,电子由负极流向正极。
(3)根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
一、原电池原理
(4)根据现象判断
一般来说,溶解的一极为负极,增重或不变或有气泡放出的一极为正极。
(5)对于燃料电池而言,电极为惰性材料(Pt、C),电极本身不反应,只起传导电子的作用,故可根据向两极通入的气体成分来判断正负极。燃料电池的负极通入的一定是可燃性气体(还原剂),正极通入的一定是助燃性气体(氧化剂一般为O2)。
一、原电池原理
1.加快氧化还原反应的速率
(1)原理:在原电池中,氧化反应和还原反应分别在两极进行,使溶液中的粒子运动时相互间的干扰减小,使反应速率增大。
(2)应用:实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4(或稀盐酸)形成原电池,加快了锌的反应,使产生H2的速率加快。
一、原电池原理的应用
2.比较金属的活动性强弱
(1)原理:原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。
(2)应用:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池
(1)思路:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
一、原电池原理
(2)步骤
①找:找一个能够自发进行的氧化还原反应,只有自发进行的氧化还原反应才能被设计成原电池。
②拆:将氧化还原反应拆分为氧化反应和还原反应两个半反应,分别作为负极和正极的电极反应,还原剂-ne-===氧化产物(负极电极反应);氧化剂+ne-===还原产物(正极电极反应)。
③定:根据氧化还原反应中的还原剂和氧化剂确定原电池的负极和电解质溶液,正极一般选择比负极活泼性差的金属或能导电的非金属。
④画:连接电路形成闭合回路,画出原电池示意图。
一、原电池原理
(3)实例(以Fe+CuSO4===FeSO4+Cu为例)
材料选择 电极反应式 装置
负极:Fe 正极:Cu或C等(活泼性比Fe差的金属或导电的石墨棒均可) 电解质溶液: CuSO4溶液 负极:Fe-2e-===Fe2+ 正极:Cu2++2e-===Cu
01
二、反应热的计算
二、电极反应式的书写
1.书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒,遵循离子方程式的书写规则,两电极反应式相加得电池总化学(或离子)方程式。
2.电极反应式形式
负极反应:还原剂-ne-===氧化产物
正极反应:氧化剂+ne-===还原产物
二、电极反应式的书写
3.电极反应式的书写思路
三、燃料电池
⑴ 氢氧燃料电池
酸性电解质 碱性电解质
负极反应 2H2-4e—= 4H+ 2H2+4OH—-4e—= 4H2O
正极反应 O2 +4H+ +4e—= 2H2O O2+2H2O+4e— = 4OH—
总反应 2H2 + O2 = 2H2O 三、燃料电池
(2)甲烷燃料电池
***正极:2O2+8H++8e—=4H2O
总反应:CH4 + 2O2 =CO2+2H2O
O2
CH4
负极
正极
酸性电解质下反应式:
负极:CH4+2H2O-8e—=CO2+8H+
三、燃料电池
(2)甲烷燃料电池
***正极:2O2+4H2O+8e—=8OH—
总反应:CH4 + 2O2 + 2OH—=CO32- +3H2O
O2
CH4
负极
正极
碱性电解质下反应式:
负极:CH4+10 OH—-8e—=CO32-+7H2O
三、燃料电池
(3)甲醇燃料电池
酸性电解质下反应式:
负 极:2CH3OH - 12e— +2H2O = 12H+ + 2CO2
正 极:3O2 + 12e—+12H+ = 6H2O
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
注意:1.燃料电池不燃烧,不写“点燃”条件。
2.电极不参与反应,一般 正负电极 都为 Pt 。
3.输入燃料的一极为负极,输入O2的一极为正极。
4.电解质酸碱性不同,电极反应不同。
三、燃料电池
课堂检测
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
A
1.100 g碳燃烧所得气体中,CO占体积,CO2占体积,且C(s)+O2(g)===CO(g) ΔH(298 K)=-110.35 kJ·mol-1,CO(g)+O2(g)===CO2(g) ΔH(298 K)=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量约为( )
A.392.92 kJ B.2489.44 kJ
C.784.92 kJ D.3274.3 kJ
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
2.若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-0.5Q2+0.5Q3
D.-(1.5Q1-0.5Q2+0.5Q3)
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
C
3.已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ/mol,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ/mol,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂总结
课堂总结
01
02
盖斯定律
反应热的计算
THANKS
THANKS
感谢观看
第六章
第一节 化学反应与能量变化
第六课时 燃料电池
新人教版 化学 必修第二册
01
目录
原电池原理
02
燃料电池
01
一、原电池原理
一、原电池原理的应用
一、原电池原理的应用
3.原电池正、负极的判断
(1)根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向来判断
在外电路(导线)中,电流由正极流向负极,电子由负极流向正极。
(3)根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
1.原电池正、负极的判断
(1)根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向来判断
在外电路(导线)中,电流由正极流向负极,电子由负极流向正极。
(3)根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
一、原电池原理
(4)根据现象判断
一般来说,溶解的一极为负极,增重或不变或有气泡放出的一极为正极。
(5)对于燃料电池而言,电极为惰性材料(Pt、C),电极本身不反应,只起传导电子的作用,故可根据向两极通入的气体成分来判断正负极。燃料电池的负极通入的一定是可燃性气体(还原剂),正极通入的一定是助燃性气体(氧化剂一般为O2)。
一、原电池原理
1.加快氧化还原反应的速率
(1)原理:在原电池中,氧化反应和还原反应分别在两极进行,使溶液中的粒子运动时相互间的干扰减小,使反应速率增大。
(2)应用:实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4(或稀盐酸)形成原电池,加快了锌的反应,使产生H2的速率加快。
一、原电池原理的应用
2.比较金属的活动性强弱
(1)原理:原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。
(2)应用:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。
3.设计原电池
(1)思路:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
一、原电池原理
(2)步骤
①找:找一个能够自发进行的氧化还原反应,只有自发进行的氧化还原反应才能被设计成原电池。
②拆:将氧化还原反应拆分为氧化反应和还原反应两个半反应,分别作为负极和正极的电极反应,还原剂-ne-===氧化产物(负极电极反应);氧化剂+ne-===还原产物(正极电极反应)。
③定:根据氧化还原反应中的还原剂和氧化剂确定原电池的负极和电解质溶液,正极一般选择比负极活泼性差的金属或能导电的非金属。
④画:连接电路形成闭合回路,画出原电池示意图。
一、原电池原理
(3)实例(以Fe+CuSO4===FeSO4+Cu为例)
材料选择 电极反应式 装置
负极:Fe 正极:Cu或C等(活泼性比Fe差的金属或导电的石墨棒均可) 电解质溶液: CuSO4溶液 负极:Fe-2e-===Fe2+ 正极:Cu2++2e-===Cu
01
二、反应热的计算
二、电极反应式的书写
1.书写电极反应式的原则
电极反应式遵循质量守恒、得失电子守恒及电荷守恒,遵循离子方程式的书写规则,两电极反应式相加得电池总化学(或离子)方程式。
2.电极反应式形式
负极反应:还原剂-ne-===氧化产物
正极反应:氧化剂+ne-===还原产物
二、电极反应式的书写
3.电极反应式的书写思路
三、燃料电池
⑴ 氢氧燃料电池
酸性电解质 碱性电解质
负极反应 2H2-4e—= 4H+ 2H2+4OH—-4e—= 4H2O
正极反应 O2 +4H+ +4e—= 2H2O O2+2H2O+4e— = 4OH—
总反应 2H2 + O2 = 2H2O 三、燃料电池
(2)甲烷燃料电池
***正极:2O2+8H++8e—=4H2O
总反应:CH4 + 2O2 =CO2+2H2O
O2
CH4
负极
正极
酸性电解质下反应式:
负极:CH4+2H2O-8e—=CO2+8H+
三、燃料电池
(2)甲烷燃料电池
***正极:2O2+4H2O+8e—=8OH—
总反应:CH4 + 2O2 + 2OH—=CO32- +3H2O
O2
CH4
负极
正极
碱性电解质下反应式:
负极:CH4+10 OH—-8e—=CO32-+7H2O
三、燃料电池
(3)甲醇燃料电池
酸性电解质下反应式:
负 极:2CH3OH - 12e— +2H2O = 12H+ + 2CO2
正 极:3O2 + 12e—+12H+ = 6H2O
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
注意:1.燃料电池不燃烧,不写“点燃”条件。
2.电极不参与反应,一般 正负电极 都为 Pt 。
3.输入燃料的一极为负极,输入O2的一极为正极。
4.电解质酸碱性不同,电极反应不同。
三、燃料电池
课堂检测
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
A
1.100 g碳燃烧所得气体中,CO占体积,CO2占体积,且C(s)+O2(g)===CO(g) ΔH(298 K)=-110.35 kJ·mol-1,CO(g)+O2(g)===CO2(g) ΔH(298 K)=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量约为( )
A.392.92 kJ B.2489.44 kJ
C.784.92 kJ D.3274.3 kJ
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
2.若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-0.5Q2+0.5Q3
D.-(1.5Q1-0.5Q2+0.5Q3)
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
C
3.已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ/mol,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ/mol,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂总结
课堂总结
01
02
盖斯定律
反应热的计算
THANKS
THANKS
感谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
