【高效课堂】人教A版(2019)高中化学必修2--8.1.2海水资源的开发利用(教学课件)
文档属性
| 名称 | 【高效课堂】人教A版(2019)高中化学必修2--8.1.2海水资源的开发利用(教学课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 93.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 11:22:46 | ||
图片预览





文档简介
(共29张PPT)
第八章
第一节 自然资源的开发利用
第二课时
海水资源的开发和利用
新人教版 化学 必修第二册
目录
01
02
海水化学资源的利用
海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
海水资源的利用
海水生物资源
海水化学资源
海水水资源
01
一、海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
蒸馏法
电渗析法
反渗透法
2.直接利用海水进行冷却循环
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
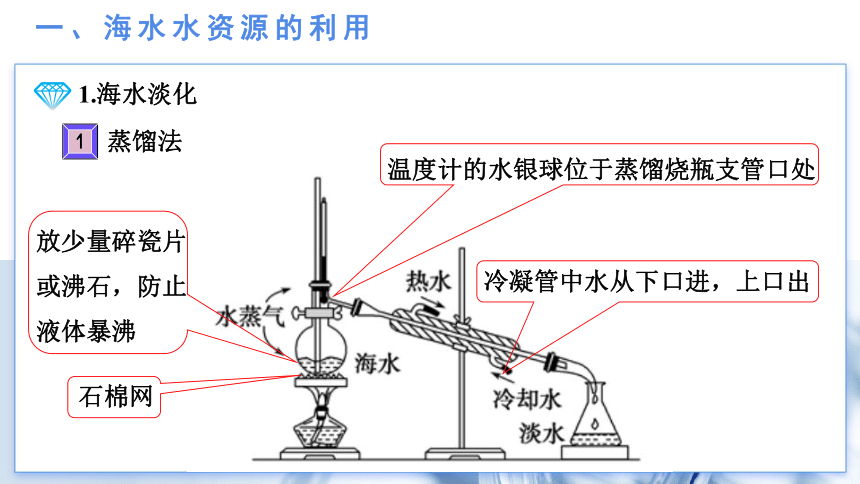
一、海水水资源的利用
1.海水淡化
蒸馏法
石棉网
放少量碎瓷片或沸石,防止液体暴沸
冷凝管中水从下口进,上口出
温度计的水银球位于蒸馏烧瓶支管口处
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
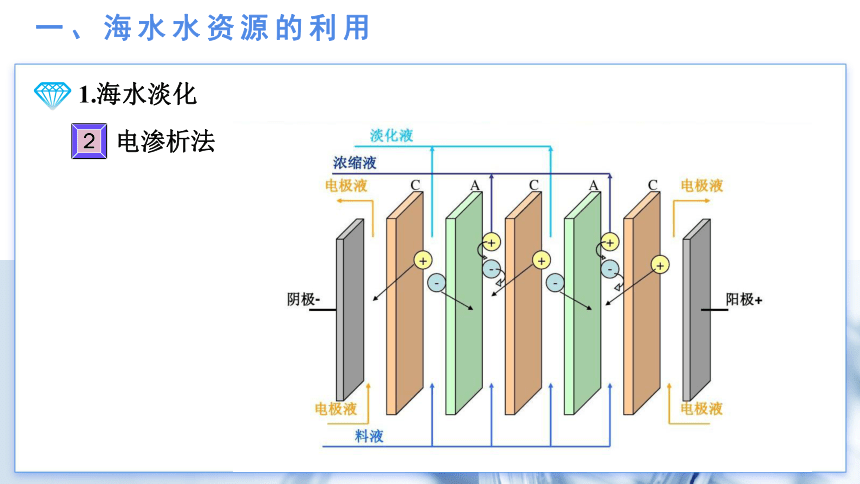
一、海水水资源的利用
1.海水淡化
电渗析法
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
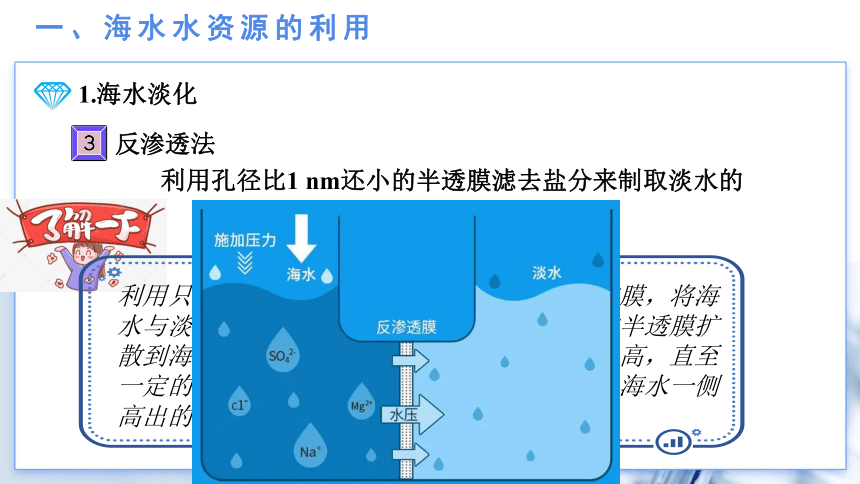
一、海水水资源的利用
1.海水淡化
反渗透法
利用孔径比1 nm还小的半透膜滤去盐分来制取淡水的
利用只允许溶剂透过、不允许溶质透过的半透膜,将海水与淡水分隔开的。在通常情况下,淡水通过半透膜扩散到海水一侧,从而使海水一侧的液面逐渐升高,直至一定的高度才停止,这个过程为渗透。此时,海水一侧高出的水柱静压称为渗透压。
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
反渗透法
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
2.直接利用海水进行冷却循环
01
二、海水化学资源的综合利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
海水中的化学元素
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
1.海水制氯化钠
海水
引入
盐田
风吹日晒
饱和食盐水
粗盐
提纯
NaCl
蒸发结晶
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
1.海水制氯化钠
海水
引入
盐田
风吹日晒
饱和食盐水
粗盐
提纯
NaCl
可溶性杂质:Ca2+、 Mg2+ 、 SO42-
过滤除去泥沙
BaCl2
除杂试剂:
Na2CO3
NaOH
先加BaCl2,后加Na2CO3
先过滤后再加稀盐酸
蒸发结晶
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
NaCl
1.海水制氯化钠
①氯碱工业
通电
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
②制钠和氯气
通电
2NaCl(熔融) 2Na+Cl2↑
③制盐酸
④制漂白剂(84消毒液)
⑤侯氏制碱
Cl2+2NaOH===NaCl+NaClO+H2O
点燃
H2+Cl2 2HCl
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
Δ
2NaHCO3 Na2CO3+CO2↑+H2O
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
2.海水提溴
海水
提取
粗盐
苦卤
硫酸酸化
①氯气氧化
含Br2的海水
热空气吹出
含Br2的空气
吸收液
含Br2的水溶液
Cl2
溴蒸气
蒸馏
冷凝分离
液溴
粗溴水
②SO2 吸收
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
②Br2 + SO2 + 2H2O === 2HBr + H2SO4
①2NaBr + Cl2 === Br2 +2NaCl
③2HBr + Cl2 === Br2 + 2HCl
2.海水提溴
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
3.海水提镁
贝壳
煅烧
①
CaO
水
②
石灰乳
沉淀池
③
海水
引入
过滤
Mg(OH)2
MgCl2·6H2O
HCl气氛中加热脱水
⑤
MgCl2
Mg+Cl2
电解
⑥
盐酸、浓缩
④
盐酸
Cl2循环利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
3.海水提镁
①
高温
CaCO3 CaO+CO2↑
CaO+H2O===Ca(OH)2
②
③ MgCl2+Ca(OH)2===Mg(OH)2+CaCl2
④ Mg(OH)2+2HCl===MgCl2+2H2O
⑤
高温
MgCl2·6H2O MgCl2+6H2O
MgCl2 (熔融) Mg + Cl2 ↑
电解
⑥
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
4.海带提碘
海带
灼烧
海带
灰
溶解、
过滤
含I-的溶液
残渣
含碘单质的溶液
H2O2/Cl2
含碘单质的有机溶液
萃取分液
单质碘
蒸馏
2H++2I-+H2O2=I2+2H2O
Cl2+2I -=2Cl-+I2
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
海水提Mg
海水淡化
海水提取NaCl
Br2的提取
课堂检测
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
1.从苦卤中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.从溴的浓溶液中提取单质溴,可以用乙醇进行萃取
D.步骤Ⅳ包含萃取、分液和蒸馏
C
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
2.下列有关海水提镁的说法中不正确的是( )
A.贝壳在海水提镁的生产流程中,主要经历了CaCO3→CaO →Ca(OH)2的过程
B.利用OH-将海水中的Mg2+转化为Mg(OH)2沉淀,然后电解Mg(OH)2制备纯镁
C.工业生产中是利用电解MgCl2制备镁
D.在海水提镁的工业流程中,氯气可以循环利用,用于制备盐酸,再溶解Mg(OH)2
B
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
3.
A
课堂总结
课堂总结
淡水
钾盐
钾
溴化物
溴
火电厂、核电厂的循环冷却水
镁盐
镁
食盐
氢气
纯碱
钠
烧碱
氯气
海水
THANKS
THANKS
感谢观看
第八章
第一节 自然资源的开发利用
第二课时
海水资源的开发和利用
新人教版 化学 必修第二册
目录
01
02
海水化学资源的利用
海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
海水资源的利用
海水生物资源
海水化学资源
海水水资源
01
一、海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
蒸馏法
电渗析法
反渗透法
2.直接利用海水进行冷却循环
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
蒸馏法
石棉网
放少量碎瓷片或沸石,防止液体暴沸
冷凝管中水从下口进,上口出
温度计的水银球位于蒸馏烧瓶支管口处
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
电渗析法
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
反渗透法
利用孔径比1 nm还小的半透膜滤去盐分来制取淡水的
利用只允许溶剂透过、不允许溶质透过的半透膜,将海水与淡水分隔开的。在通常情况下,淡水通过半透膜扩散到海水一侧,从而使海水一侧的液面逐渐升高,直至一定的高度才停止,这个过程为渗透。此时,海水一侧高出的水柱静压称为渗透压。
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
1.海水淡化
反渗透法
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
一、海水水资源的利用
2.直接利用海水进行冷却循环
01
二、海水化学资源的综合利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
海水中的化学元素
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
1.海水制氯化钠
海水
引入
盐田
风吹日晒
饱和食盐水
粗盐
提纯
NaCl
蒸发结晶
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
1.海水制氯化钠
海水
引入
盐田
风吹日晒
饱和食盐水
粗盐
提纯
NaCl
可溶性杂质:Ca2+、 Mg2+ 、 SO42-
过滤除去泥沙
BaCl2
除杂试剂:
Na2CO3
NaOH
先加BaCl2,后加Na2CO3
先过滤后再加稀盐酸
蒸发结晶
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
NaCl
1.海水制氯化钠
①氯碱工业
通电
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
②制钠和氯气
通电
2NaCl(熔融) 2Na+Cl2↑
③制盐酸
④制漂白剂(84消毒液)
⑤侯氏制碱
Cl2+2NaOH===NaCl+NaClO+H2O
点燃
H2+Cl2 2HCl
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
Δ
2NaHCO3 Na2CO3+CO2↑+H2O
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
2.海水提溴
海水
提取
粗盐
苦卤
硫酸酸化
①氯气氧化
含Br2的海水
热空气吹出
含Br2的空气
吸收液
含Br2的水溶液
Cl2
溴蒸气
蒸馏
冷凝分离
液溴
粗溴水
②SO2 吸收
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
②Br2 + SO2 + 2H2O === 2HBr + H2SO4
①2NaBr + Cl2 === Br2 +2NaCl
③2HBr + Cl2 === Br2 + 2HCl
2.海水提溴
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
3.海水提镁
贝壳
煅烧
①
CaO
水
②
石灰乳
沉淀池
③
海水
引入
过滤
Mg(OH)2
MgCl2·6H2O
HCl气氛中加热脱水
⑤
MgCl2
Mg+Cl2
电解
⑥
盐酸、浓缩
④
盐酸
Cl2循环利用
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
3.海水提镁
①
高温
CaCO3 CaO+CO2↑
CaO+H2O===Ca(OH)2
②
③ MgCl2+Ca(OH)2===Mg(OH)2+CaCl2
④ Mg(OH)2+2HCl===MgCl2+2H2O
⑤
高温
MgCl2·6H2O MgCl2+6H2O
MgCl2 (熔融) Mg + Cl2 ↑
电解
⑥
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
4.海带提碘
海带
灼烧
海带
灰
溶解、
过滤
含I-的溶液
残渣
含碘单质的溶液
H2O2/Cl2
含碘单质的有机溶液
萃取分液
单质碘
蒸馏
2H++2I-+H2O2=I2+2H2O
Cl2+2I -=2Cl-+I2
https://img2./it/u=4137884964,1688312958&fm=253&fmt=auto&app=138&f=JPEG w=500&h=507
二、海水化学资源的利用
海水提Mg
海水淡化
海水提取NaCl
Br2的提取
课堂检测
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
1.从苦卤中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.从溴的浓溶液中提取单质溴,可以用乙醇进行萃取
D.步骤Ⅳ包含萃取、分液和蒸馏
C
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
2.下列有关海水提镁的说法中不正确的是( )
A.贝壳在海水提镁的生产流程中,主要经历了CaCO3→CaO →Ca(OH)2的过程
B.利用OH-将海水中的Mg2+转化为Mg(OH)2沉淀,然后电解Mg(OH)2制备纯镁
C.工业生产中是利用电解MgCl2制备镁
D.在海水提镁的工业流程中,氯气可以循环利用,用于制备盐酸,再溶解Mg(OH)2
B
内容内容内容
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ/mol,PCl3中P—Cl键的键能为1.2c kJ/mol。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为 kJ/mol
D.P—P键的键能为 kJ/mol
课堂检测
3.
A
课堂总结
课堂总结
淡水
钾盐
钾
溴化物
溴
火电厂、核电厂的循环冷却水
镁盐
镁
食盐
氢气
纯碱
钠
烧碱
氯气
海水
THANKS
THANKS
感谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
