2025鲁教版高中化学必修第一册同步练习题--第2课时 气体摩尔体积(含解析)
文档属性
| 名称 | 2025鲁教版高中化学必修第一册同步练习题--第2课时 气体摩尔体积(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 350.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 12:04:12 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第一册
第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
第2课时 气体摩尔体积
基础过关练
题组一 气体体积影响因素与气体摩尔体积
1.(2024福建福州期中)现有下列四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对气体物质体积有显著影响的是( )
A.②③④ B.①②④
C.①③④ D.①②③④
2.(2024四川成都树德中学期中)下列关于气体摩尔体积的说法中,正确的是( )
A.1 mol H2和O2的混合气体在标准状况下的体积约为22.4 L
B.相同温度和压强下,不同气体的体积由气体分子的大小决定
C.若1 mol气体的体积为22.4 L,则它一定处于标准状况下
D.标准状况下,1 mol H2O和1 mol H2所占有的体积相同
题组二 有关气体摩尔体积的计算
3.(2023山东济宁期中)如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A.22.0 L·mol-1 B.22.4 L·mol-1
C.22.8 L·mol-1 D.23.2 L·mol-1
4.(2024河北邯郸大名一中月考)设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L氦气中含有的原子数为0.2NA
B.标准状况下,2.24 L水中含有的氢原子数是0.2NA
C.常温常压下,14 g由N2与CO组成的混合气体中含有的原子数为2NA
D.标准状况下,20 mL CO2与40 mL O2所含的分子个数比为1∶2
5.(2024山东德州阶段练习)一定量的液态化合物XY2在一定量的O2中恰好完全燃烧,化学方程式为XY2(液)+3O2(气) XO2(气)+2YO2(气)。测得生成物的总体积为672 mL(标准状况),密度为2.56 g/L(标准状况)。则:
(1)反应前O2的体积为 mL(标准状况)。
(2)化合物XY2的摩尔质量为 。
(3)若XY2中X、Y两元素的质量比为3∶16,则X、Y分别为 、 (写出元素名称)。
题组三 阿伏加德罗定律及其推论
6.(2024河南郑州期中)如图是两瓶体积相等的气体,在同温同压时两瓶中气体的关系一定正确的是( )
A.气体质量相等 B.气体密度相等
C.所含原子数相等 D.摩尔质量相等
7.(2024河北保定一中月考)在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是( )
A.CO分子数比CO2分子数少
B.甲容器的体积比乙容器的体积小
C.CO的摩尔体积比CO2的摩尔体积小
D.甲中CO的密度比乙中CO2的密度小
能力提升练
题组一 气体摩尔体积的测定及应用
1.(2024山东东营河口一中月考)设NA为阿伏加德罗常数的值。有臭氧(O3)与二氧化碳的混合气体共23.2 g,其标准状况下体积为11.2 L,下列说法错误的是( )
A.混合气体含有的原子数为1.5NA
B.混合气体对氢气的相对密度为23.2
C.混合气体中,臭氧的物质的量分数为40%
D.混合气体中O3在标准状况下的体积为6.72 L
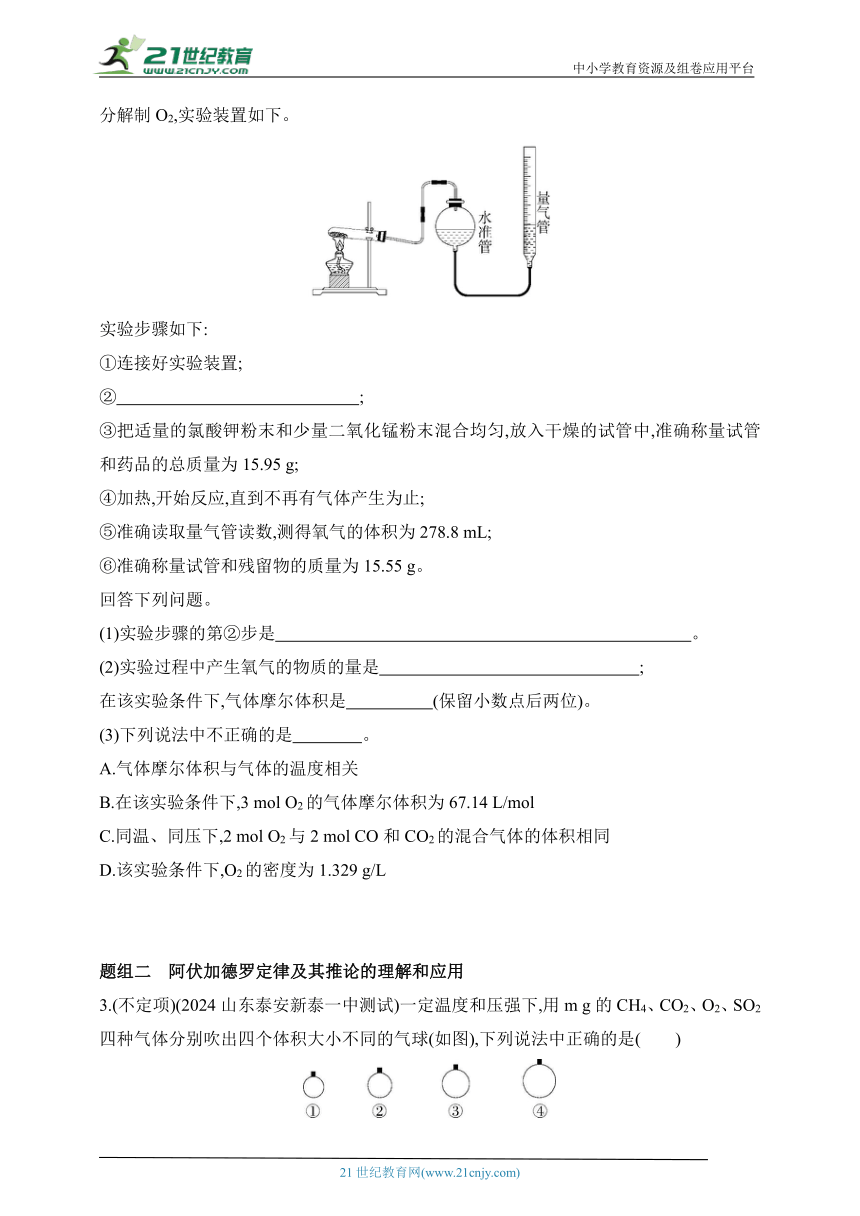
2.(2024河南郑州期中)某同学设计了测定某条件下气体摩尔体积的探究实验,利用氯酸钾分解制O2,实验装置如下。
实验步骤如下:
①连接好实验装置;
② ;
③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g;
④加热,开始反应,直到不再有气体产生为止;
⑤准确读取量气管读数,测得氧气的体积为278.8 mL;
⑥准确称量试管和残留物的质量为15.55 g。
回答下列问题。
(1)实验步骤的第②步是 。
(2)实验过程中产生氧气的物质的量是 ;
在该实验条件下,气体摩尔体积是 (保留小数点后两位)。
(3)下列说法中不正确的是 。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为67.14 L/mol
C.同温、同压下,2 mol O2与2 mol CO和CO2的混合气体的体积相同
D.该实验条件下,O2的密度为1.329 g/L
题组二 阿伏加德罗定律及其推论的理解和应用
3.(不定项)(2024山东泰安新泰一中测试)一定温度和压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球(如图),下列说法中正确的是( )
A.气球①中装的是CH4
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为1∶4
D.气球③和气球④中气体密度之比为2∶1
4.(2023河南洛阳期中)常温时在刚性容器内部有一个可滑动的活塞将容器分成左右两室。左室充入1 mol N2,右室充入H2和O2的混合气体,活塞恰好停留在容器左侧四分之一处(如图),然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞恰好停在容器的中间,忽略水的体积,下列说法错误的是( )
A.反应前,右室充入H2与O2共3 mol
B.反应完毕后,恢复至原来温度,左室的压强变为原来的一半
C.反应完毕后,右室剩余气体中含有1 mol原子
D.反应前,H2与O2的体积比是4∶5或7∶2
答案与分层梯度式解析
第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
第2课时 气体摩尔体积
基础过关练
1.B 决定物质体积大小的因素有微粒数目、微粒的大小、微粒之间的距离。气体微粒本身大小远小于气体微粒间的距离,气体微粒本身大小对体积几乎无影响;温度和压强对气体微粒之间的距离影响较大;故B正确。
2.A 在标准状况下,气体摩尔体积约为22.4 L·mol-1,1 mol任何气体的体积都约为22.4 L,故A正确;相同温度和压强下,气体分子间的平均距离近似相等,不同气体的体积由分子数决定,故B错误;非标准状况下,气体摩尔体积也可能为22.4 L·mol-1,即1 mol气体的体积可能为22.4 L,故C错误;标准状况下,H2O不是气体,不能利用气体摩尔体积计算其体积,故D错误。
3.C 27.2 g H2S气体的物质的量为=0.8 mol,则题给条件下Vm==22.8 L·mol-1,C正确。
方法点津 知道某气体的质量和体积,计算气体摩尔体积时,要牢牢抓住物质的量这个中间物理量,先把质量转化为物质的量,再根据气体摩尔体积的定义进行计算即可。
4.D 标准状况下,2.24 L氦气的物质的量为0.1 mol,含有的原子数为0.1NA,A错误;标准状况下,水不是气态,无法用气体摩尔体积计算2.24 L水中含有的氢原子数,B错误;N2与CO的相对分子质量均为28,14 g由N2与CO组成的混合气体的物质的量为0.5 mol,N2与CO都是双原子分子,所以含有的原子数为NA,C错误;标准状况下,20 mL CO2与40 mL O2的物质的量之比为1∶2,所以分子个数比为1∶2,D正确。
5.答案 (1)672 (2)76 g/mol (3)碳 硫
解析 (1)由题中化学方程式可知V(O2)=V(XO2)+V(YO2)=672 mL。(2)n(O2)==0.03 mol,生成的气体质量为0.672 L×2.56 g/L≈1.72 g,根据质量守恒定律可知m(XY2)=1.72 g-m(O2)=1.72 g-0.03 mol×32 g/mol=0.76 g,根据XY2在一定量的O2中恰好完全燃烧知n(XY2)=n(O2)=0.01 mol,故XY2的摩尔质量M(XY2)==76 g/mol。(3)由XY2中X、Y元素的质量比为3∶16可知,1 mol XY2中含X的质量为76 g×=12 g,含Y的质量为76 g-12 g=64 g,X、Y的物质的量分别为1 mol和2 mol,则X、Y的相对原子质量分别为12和32,故X为碳元素、Y为硫元素。
6.C 同温同压时,体积相等的气体的物质的量相等。左瓶中氮气和氧气的物质的量之比不一定为1∶1,则左瓶气体的平均摩尔质量与右瓶气体的摩尔质量不一定相等,两瓶中气体的质量也不一定相等,故A、D错误;由A项分析可知,两瓶中气体的质量不一定相等,体积相等,所以两瓶中气体的密度不一定相等,故B错误;N2、O2、NO都是双原子分子,所以两瓶中气体含有的原子数相等,故C正确。
7.D 根据n=知,相同质量时,气体的物质的量与其摩尔质量成反比,CO、CO2的摩尔质量分别是28 g·mol-1、44 g·mol-1,所以二者的物质的量之比=44∶28=11∶7,二者的分子数之比等于其物质的量之比,为11∶7,所以CO分子数比CO2分子数多,故A错误;相同条件下,气体体积之比等于其物质的量之比,所以甲容器的体积比乙容器的大,故B错误;温度和压强相等,气体摩尔体积相等,故C错误;在相同条件下,气体密度之比等于摩尔质量之比,所以甲中CO的密度比乙中CO2的密度小,故D正确。
能力提升练
1.C 设臭氧为x mol,二氧化碳为y mol,臭氧与二氧化碳的混合气体共23.2 g,所以48x+44y=23.2,标准状况下体积为11.2 L,物质的量为0.5 mol,可得x+y=0.5,解得x=0.3、y=0.2。臭氧与二氧化碳都是三原子分子,所以混合气体含有的原子数为0.5×3×NA=1.5NA,故A正确;混合气体的平均摩尔质量为=46.4 g·mol-1,相同条件下气体的密度之比等于摩尔质量之比,所以对氢气的相对密度为46.4÷2=23.2,故B正确;臭氧的物质的量分数为×100%=60%,故C错误;混合气体中O3在标准状况下的体积为0.3 mol×22.4 L·mol-1=6.72 L,故D正确。
2.答案 (1)检查装置的气密性 (2)0.012 5 mol
22.30 L/mol (3)BD
解析 (1)制取气体的实验必须检查装置的气密性。
(2)生成的氧气的质量为15.95 g-15.55 g=0.4 g,氧气的物质的量为=0.012 5 mol,Vm=≈22.30 L/mol。
(3)在其他条件不变的情况下,气体温度越高,其体积越大,气体摩尔体积越大,因此气体摩尔体积与气体的温度相关,A正确;该条件下气体摩尔体积为22.30 L/mol,B错误;同温、同压下,物质的量相同的气体体积相等,所以2 mol O2与2 mol CO和CO2的混合气体的体积相同,C正确;该实验条件下,1 mol O2的体积为22.30 L,质量为32 g,则密度为≈1.435 g/L,D错误。
3.CD 相同温度和压强下Vm是定值,根据n=、V=n·Vm可知,相同质量的气体,气体体积与摩尔质量成反比,所以气球①、②、③、④中分别装的是SO2、CO2、O2、CH4,故A错误;相同质量的气体,根据n=、N=n×NA,分子数与摩尔质量成反比,所以气球①中气体分子数比气球③中少,故B错误;相同质量的气体,其物质的量与摩尔质量成反比,所以气球①和气球④中气体物质的量之比为1∶4,故C正确;同温同压下,气体的密度之比等于摩尔质量之比,所以气球③和气球④中气体密度之比为2∶1,故D正确。
4.C 常温下,可滑动的活塞将容器分成左右两室,左右两室压强相等,温度、压强相等时,气体的体积之比等于物质的量之比,则右室充入H2与O2的混合气体为3 mol,A正确。反应完毕后,恢复至原来温度,左室的体积变为原来的二倍,压强变为原来的一半,B正确。反应后恢复至原来的温度,活塞恰好停在中间,说明氮气和右室剩余气体的物质的量相等,右室剩余1 mol气体,含有2 mol原子,C错误。剩余气体的物质的量为1 mol,2H2+O2 2H2O,假设氢气完全反应,则n(H2)= mol,n(O2)=3 mol- mol= mol,氢气和氧气体积之比为 mol∶ mol=4∶5;假设氧气完全反应,则n(O2)= mol,n(H2)=3 mol- mol= mol,所以氢气和氧气的体积之比为 mol∶ mol=7∶2,反应前H2与O2的体积比为4∶5或7∶2,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第一册
第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
第2课时 气体摩尔体积
基础过关练
题组一 气体体积影响因素与气体摩尔体积
1.(2024福建福州期中)现有下列四种因素:①温度和压强、②所含微粒数、③微粒本身大小、④微粒间的距离,其中对气体物质体积有显著影响的是( )
A.②③④ B.①②④
C.①③④ D.①②③④
2.(2024四川成都树德中学期中)下列关于气体摩尔体积的说法中,正确的是( )
A.1 mol H2和O2的混合气体在标准状况下的体积约为22.4 L
B.相同温度和压强下,不同气体的体积由气体分子的大小决定
C.若1 mol气体的体积为22.4 L,则它一定处于标准状况下
D.标准状况下,1 mol H2O和1 mol H2所占有的体积相同
题组二 有关气体摩尔体积的计算
3.(2023山东济宁期中)如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为( )
A.22.0 L·mol-1 B.22.4 L·mol-1
C.22.8 L·mol-1 D.23.2 L·mol-1
4.(2024河北邯郸大名一中月考)设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L氦气中含有的原子数为0.2NA
B.标准状况下,2.24 L水中含有的氢原子数是0.2NA
C.常温常压下,14 g由N2与CO组成的混合气体中含有的原子数为2NA
D.标准状况下,20 mL CO2与40 mL O2所含的分子个数比为1∶2
5.(2024山东德州阶段练习)一定量的液态化合物XY2在一定量的O2中恰好完全燃烧,化学方程式为XY2(液)+3O2(气) XO2(气)+2YO2(气)。测得生成物的总体积为672 mL(标准状况),密度为2.56 g/L(标准状况)。则:
(1)反应前O2的体积为 mL(标准状况)。
(2)化合物XY2的摩尔质量为 。
(3)若XY2中X、Y两元素的质量比为3∶16,则X、Y分别为 、 (写出元素名称)。
题组三 阿伏加德罗定律及其推论
6.(2024河南郑州期中)如图是两瓶体积相等的气体,在同温同压时两瓶中气体的关系一定正确的是( )
A.气体质量相等 B.气体密度相等
C.所含原子数相等 D.摩尔质量相等
7.(2024河北保定一中月考)在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是( )
A.CO分子数比CO2分子数少
B.甲容器的体积比乙容器的体积小
C.CO的摩尔体积比CO2的摩尔体积小
D.甲中CO的密度比乙中CO2的密度小
能力提升练
题组一 气体摩尔体积的测定及应用
1.(2024山东东营河口一中月考)设NA为阿伏加德罗常数的值。有臭氧(O3)与二氧化碳的混合气体共23.2 g,其标准状况下体积为11.2 L,下列说法错误的是( )
A.混合气体含有的原子数为1.5NA
B.混合气体对氢气的相对密度为23.2
C.混合气体中,臭氧的物质的量分数为40%
D.混合气体中O3在标准状况下的体积为6.72 L
2.(2024河南郑州期中)某同学设计了测定某条件下气体摩尔体积的探究实验,利用氯酸钾分解制O2,实验装置如下。
实验步骤如下:
①连接好实验装置;
② ;
③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g;
④加热,开始反应,直到不再有气体产生为止;
⑤准确读取量气管读数,测得氧气的体积为278.8 mL;
⑥准确称量试管和残留物的质量为15.55 g。
回答下列问题。
(1)实验步骤的第②步是 。
(2)实验过程中产生氧气的物质的量是 ;
在该实验条件下,气体摩尔体积是 (保留小数点后两位)。
(3)下列说法中不正确的是 。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为67.14 L/mol
C.同温、同压下,2 mol O2与2 mol CO和CO2的混合气体的体积相同
D.该实验条件下,O2的密度为1.329 g/L
题组二 阿伏加德罗定律及其推论的理解和应用
3.(不定项)(2024山东泰安新泰一中测试)一定温度和压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球(如图),下列说法中正确的是( )
A.气球①中装的是CH4
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为1∶4
D.气球③和气球④中气体密度之比为2∶1
4.(2023河南洛阳期中)常温时在刚性容器内部有一个可滑动的活塞将容器分成左右两室。左室充入1 mol N2,右室充入H2和O2的混合气体,活塞恰好停留在容器左侧四分之一处(如图),然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞恰好停在容器的中间,忽略水的体积,下列说法错误的是( )
A.反应前,右室充入H2与O2共3 mol
B.反应完毕后,恢复至原来温度,左室的压强变为原来的一半
C.反应完毕后,右室剩余气体中含有1 mol原子
D.反应前,H2与O2的体积比是4∶5或7∶2
答案与分层梯度式解析
第1章 认识化学科学
第3节 化学中常用的物理量——物质的量
第2课时 气体摩尔体积
基础过关练
1.B 决定物质体积大小的因素有微粒数目、微粒的大小、微粒之间的距离。气体微粒本身大小远小于气体微粒间的距离,气体微粒本身大小对体积几乎无影响;温度和压强对气体微粒之间的距离影响较大;故B正确。
2.A 在标准状况下,气体摩尔体积约为22.4 L·mol-1,1 mol任何气体的体积都约为22.4 L,故A正确;相同温度和压强下,气体分子间的平均距离近似相等,不同气体的体积由分子数决定,故B错误;非标准状况下,气体摩尔体积也可能为22.4 L·mol-1,即1 mol气体的体积可能为22.4 L,故C错误;标准状况下,H2O不是气体,不能利用气体摩尔体积计算其体积,故D错误。
3.C 27.2 g H2S气体的物质的量为=0.8 mol,则题给条件下Vm==22.8 L·mol-1,C正确。
方法点津 知道某气体的质量和体积,计算气体摩尔体积时,要牢牢抓住物质的量这个中间物理量,先把质量转化为物质的量,再根据气体摩尔体积的定义进行计算即可。
4.D 标准状况下,2.24 L氦气的物质的量为0.1 mol,含有的原子数为0.1NA,A错误;标准状况下,水不是气态,无法用气体摩尔体积计算2.24 L水中含有的氢原子数,B错误;N2与CO的相对分子质量均为28,14 g由N2与CO组成的混合气体的物质的量为0.5 mol,N2与CO都是双原子分子,所以含有的原子数为NA,C错误;标准状况下,20 mL CO2与40 mL O2的物质的量之比为1∶2,所以分子个数比为1∶2,D正确。
5.答案 (1)672 (2)76 g/mol (3)碳 硫
解析 (1)由题中化学方程式可知V(O2)=V(XO2)+V(YO2)=672 mL。(2)n(O2)==0.03 mol,生成的气体质量为0.672 L×2.56 g/L≈1.72 g,根据质量守恒定律可知m(XY2)=1.72 g-m(O2)=1.72 g-0.03 mol×32 g/mol=0.76 g,根据XY2在一定量的O2中恰好完全燃烧知n(XY2)=n(O2)=0.01 mol,故XY2的摩尔质量M(XY2)==76 g/mol。(3)由XY2中X、Y元素的质量比为3∶16可知,1 mol XY2中含X的质量为76 g×=12 g,含Y的质量为76 g-12 g=64 g,X、Y的物质的量分别为1 mol和2 mol,则X、Y的相对原子质量分别为12和32,故X为碳元素、Y为硫元素。
6.C 同温同压时,体积相等的气体的物质的量相等。左瓶中氮气和氧气的物质的量之比不一定为1∶1,则左瓶气体的平均摩尔质量与右瓶气体的摩尔质量不一定相等,两瓶中气体的质量也不一定相等,故A、D错误;由A项分析可知,两瓶中气体的质量不一定相等,体积相等,所以两瓶中气体的密度不一定相等,故B错误;N2、O2、NO都是双原子分子,所以两瓶中气体含有的原子数相等,故C正确。
7.D 根据n=知,相同质量时,气体的物质的量与其摩尔质量成反比,CO、CO2的摩尔质量分别是28 g·mol-1、44 g·mol-1,所以二者的物质的量之比=44∶28=11∶7,二者的分子数之比等于其物质的量之比,为11∶7,所以CO分子数比CO2分子数多,故A错误;相同条件下,气体体积之比等于其物质的量之比,所以甲容器的体积比乙容器的大,故B错误;温度和压强相等,气体摩尔体积相等,故C错误;在相同条件下,气体密度之比等于摩尔质量之比,所以甲中CO的密度比乙中CO2的密度小,故D正确。
能力提升练
1.C 设臭氧为x mol,二氧化碳为y mol,臭氧与二氧化碳的混合气体共23.2 g,所以48x+44y=23.2,标准状况下体积为11.2 L,物质的量为0.5 mol,可得x+y=0.5,解得x=0.3、y=0.2。臭氧与二氧化碳都是三原子分子,所以混合气体含有的原子数为0.5×3×NA=1.5NA,故A正确;混合气体的平均摩尔质量为=46.4 g·mol-1,相同条件下气体的密度之比等于摩尔质量之比,所以对氢气的相对密度为46.4÷2=23.2,故B正确;臭氧的物质的量分数为×100%=60%,故C错误;混合气体中O3在标准状况下的体积为0.3 mol×22.4 L·mol-1=6.72 L,故D正确。
2.答案 (1)检查装置的气密性 (2)0.012 5 mol
22.30 L/mol (3)BD
解析 (1)制取气体的实验必须检查装置的气密性。
(2)生成的氧气的质量为15.95 g-15.55 g=0.4 g,氧气的物质的量为=0.012 5 mol,Vm=≈22.30 L/mol。
(3)在其他条件不变的情况下,气体温度越高,其体积越大,气体摩尔体积越大,因此气体摩尔体积与气体的温度相关,A正确;该条件下气体摩尔体积为22.30 L/mol,B错误;同温、同压下,物质的量相同的气体体积相等,所以2 mol O2与2 mol CO和CO2的混合气体的体积相同,C正确;该实验条件下,1 mol O2的体积为22.30 L,质量为32 g,则密度为≈1.435 g/L,D错误。
3.CD 相同温度和压强下Vm是定值,根据n=、V=n·Vm可知,相同质量的气体,气体体积与摩尔质量成反比,所以气球①、②、③、④中分别装的是SO2、CO2、O2、CH4,故A错误;相同质量的气体,根据n=、N=n×NA,分子数与摩尔质量成反比,所以气球①中气体分子数比气球③中少,故B错误;相同质量的气体,其物质的量与摩尔质量成反比,所以气球①和气球④中气体物质的量之比为1∶4,故C正确;同温同压下,气体的密度之比等于摩尔质量之比,所以气球③和气球④中气体密度之比为2∶1,故D正确。
4.C 常温下,可滑动的活塞将容器分成左右两室,左右两室压强相等,温度、压强相等时,气体的体积之比等于物质的量之比,则右室充入H2与O2的混合气体为3 mol,A正确。反应完毕后,恢复至原来温度,左室的体积变为原来的二倍,压强变为原来的一半,B正确。反应后恢复至原来的温度,活塞恰好停在中间,说明氮气和右室剩余气体的物质的量相等,右室剩余1 mol气体,含有2 mol原子,C错误。剩余气体的物质的量为1 mol,2H2+O2 2H2O,假设氢气完全反应,则n(H2)= mol,n(O2)=3 mol- mol= mol,氢气和氧气体积之比为 mol∶ mol=4∶5;假设氧气完全反应,则n(O2)= mol,n(H2)=3 mol- mol= mol,所以氢气和氧气的体积之比为 mol∶ mol=7∶2,反应前H2与O2的体积比为4∶5或7∶2,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
