2025鲁教版高中化学必修第一册同步练习题--第2课时 研究物质性质的基本程序(含解析)
文档属性
| 名称 | 2025鲁教版高中化学必修第一册同步练习题--第2课时 研究物质性质的基本程序(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 546.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 12:05:20 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第一册
第1章 认识化学科学
第2节 研究物质性质的方法和程序
第2课时 研究物质性质的基本程序
基础过关练
题组一 研究物质性质的基本程序
1.(2024福建厦门一中月考)哈工大研究团队设计了一种使用Fe3O4磁性材料的微型纳米生物机器人。下列关于研究Fe3O4性质的基本程序中排序正确的是( )
a.观察Fe3O4的颜色、状态
b.设计并进行实验,观察实验现象
c.解释现象、得出结论
d.预测Fe3O4的性质
A.abcd B.adbc C.dbac D.dacb
2.(2024北京第二十中学期中)非金属单质溴与氯气的性质很相似。在探究溴单质的性质时,其基本程序应该是( )
A.观察溴的外部特征→预测溴的性质→做实验并观察实验现象→解释和得出结论
B.做实验并观察溴的外部特征→分析、综合、推理得出结论
C.观察并做实验→分析实验现象→综合、推理得出结论
D.预测溴的性质→观察溴的外部特征→做实验并观察实验现象→解释和得出结论
题组二 氯气的性质
3.(2024福建厦门外国语学校月考)下列说法中,不正确的是( )
A.氯气是一种黄绿色有毒气体,密度比空气大
B.氯气常用于制备漂白粉等杀菌消毒剂
C.铁丝在氯气中燃烧,产生棕褐色的烟
D.纯净的氢气在盛有氯气的集气瓶中安静地燃烧,发出苍白色火焰,集气瓶口有白烟
4.(经典题)(2024山东潍坊期中)下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.FeCl3
5.(教材习题改编)某化学试剂厂不慎发生了氯气泄漏事故,泄漏出的氯气迅速向周围的居民区蔓延。下列自救措施合理的是( )
A.顺风向低凹处转移
B.及时戴上用氢氧化钠溶液浸湿过的口罩迅速转移
C.就近向地下商场转移
D.可以用毛巾蘸取肥皂水制作简易的防毒面具
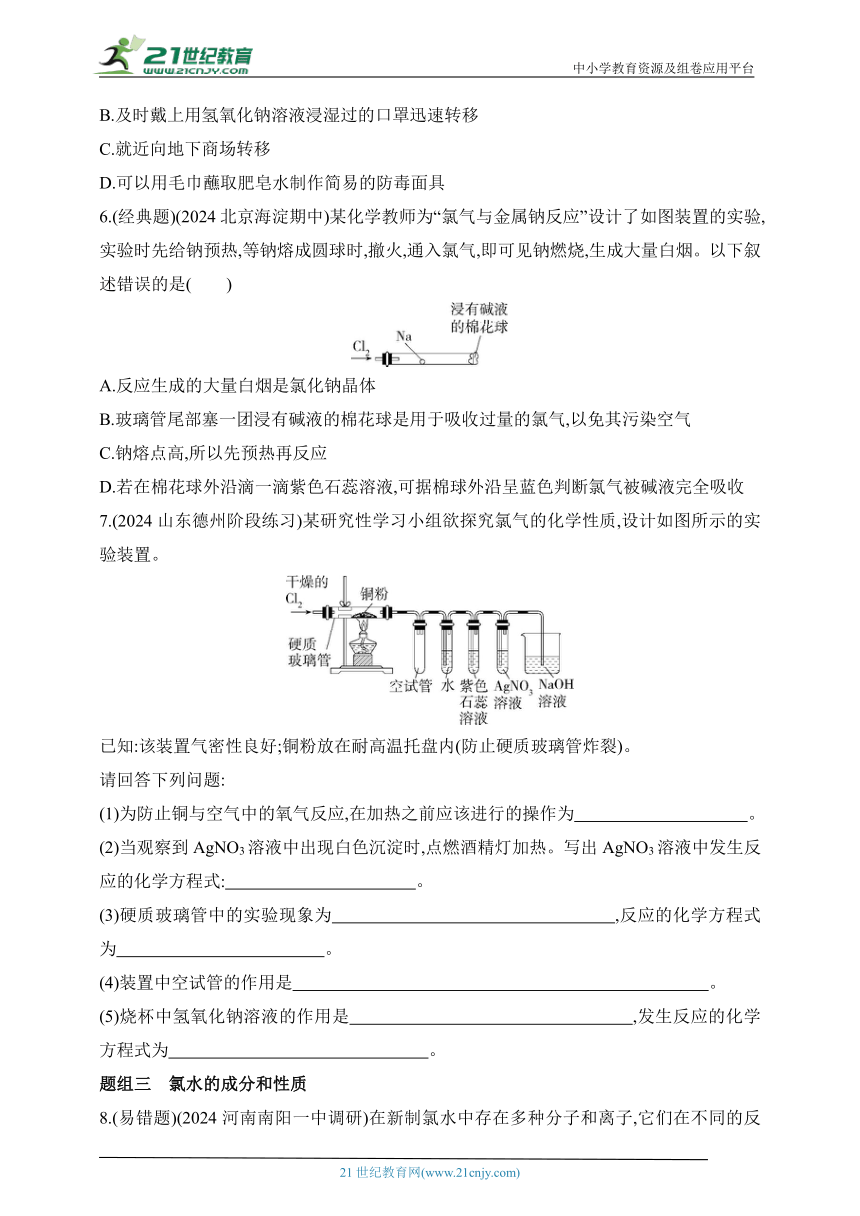
6.(经典题)(2024北京海淀期中)某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验时先给钠预热,等钠熔成圆球时,撤火,通入氯气,即可见钠燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有碱液的棉花球是用于吸收过量的氯气,以免其污染空气
C.钠熔点高,所以先预热再反应
D.若在棉花球外沿滴一滴紫色石蕊溶液,可据棉球外沿呈蓝色判断氯气被碱液完全吸收
7.(2024山东德州阶段练习)某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热。写出AgNO3溶液中发生反应的化学方程式: 。
(3)硬质玻璃管中的实验现象为 ,反应的化学方程式为 。
(4)装置中空试管的作用是 。
(5)烧杯中氢氧化钠溶液的作用是 ,发生反应的化学方程式为 。
题组三 氯水的成分和性质
8.(易错题)(2024河南南阳一中调研)在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.向新制氯水中放入红色布条,一会儿红色布条褪色,说明新制氯水中有Cl2存在
B.新制氯水呈浅黄绿色,且有刺激性气味,说明有HCl分子存在
C.加入AgNO3溶液产生白色沉淀,说明新制氯水中有Cl-存在
D.加入NaOH溶液,新制氯水浅黄绿色消失,说明新制氯水中有HClO分子存在
9.(2024山东烟台莱阳一中月考)某同学在pH试纸上滴几滴新制氯水,现象如图所示,下列说法中正确的是( )
A.该实验说明Cl2分子具有漂白性
B.若用久置的氯水进行实验,现象相同
C.该实验说明H+扩散速度比HClO分子快
D.将新制氯水放置几天,溶液酸性减弱
10.(2024福建南平段考)新制氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图所示四种物质发生的反应回答下列问题(a代表光照新制氯水发生的反应,b、c、d、e代表物质间反应,且新制氯水足量)。
(1)能证明新制氯水具有漂白性的是 (填“b”“c”“d”或“e”)。
(2)c反应的现象是 ,e反应的现象是 ,b反应的化学方程式为 。
(3)新制氯水久置变为 ,用化学方程式表示原因: 。
(4)实验室中饱和氯水常保存于 (填“棕色试剂瓶”或“透明试剂瓶”)中。
题组四 次氯酸盐的性质和用途
11.有关漂白粉和漂白液的说法正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是NaCl
12.(2024山东菏泽一中月考)以NaClO、NaCl为主要成分的消毒液具有杀菌消毒作用,用该消毒液浸泡过的有色布条晾置在空气中一段时间,漂白效果更好。下列说法错误的是( )
A.该消毒液可与AgNO3溶液反应
B.晾置在空气中,有色布条会被空气中的氧气氧化,漂白效果更好
C.该消毒液与空气中的CO2反应生成HClO,漂白效果更好
D.将该消毒液长期露置在空气中,会失去杀菌消毒能力
能力提升练
题组 氯及其化合物性质的综合应用
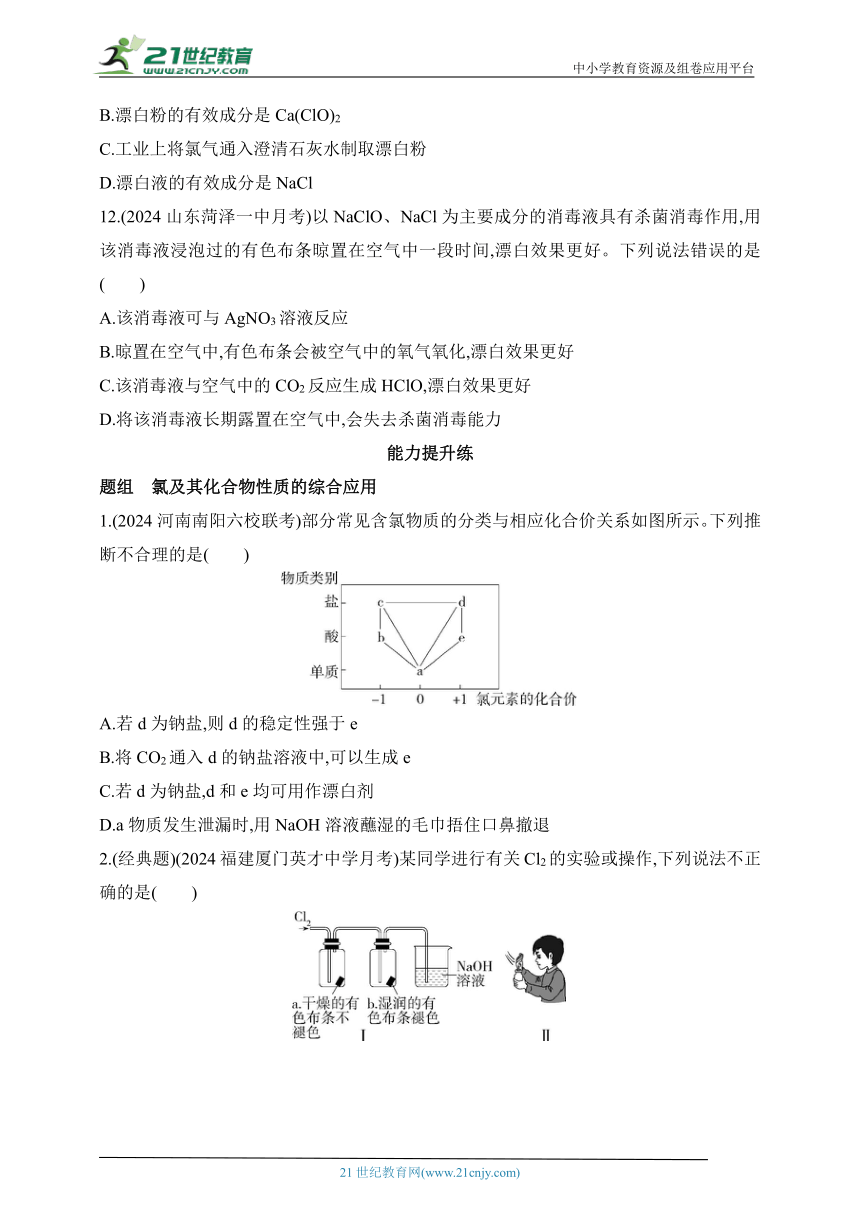
1.(2024河南南阳六校联考)部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.若d为钠盐,则d的稳定性强于e
B.将CO2通入d的钠盐溶液中,可以生成e
C.若d为钠盐,d和e均可用作漂白剂
D.a物质发生泄漏时,用NaOH溶液蘸湿的毛巾捂住口鼻撤退
2.(经典题)(2024福建厦门英才中学月考)某同学进行有关Cl2的实验或操作,下列说法不正确的是( )
A.图Ⅰ中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用
B.图Ⅱ中:闻Cl2的气味时应吸入足量氯气
C.图Ⅲ中:生成棕黄色的烟
D.图Ⅳ中:若气球膨胀,证明Cl2可与NaOH溶液反应
3.(不定项)(2024山东菏泽鄄城一中月考)向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。下列叙述不正确的是( )
A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+
B.过程Ⅱ溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程Ⅲ溶液由无色变成浅黄绿色,证明溶液中有Cl2
D.若向紫色石蕊溶液中持续加入Na2O2粉末,会出现相同的颜色变化
4.(2024河南省实验中学月考)某实验小组以冷的石灰乳和氯气为原料制备漂白粉的过程如下:在三颈烧瓶和烧杯中(实验装置如图)均加入一定量石灰乳,通入氯气和空气,反应20 min。停止通入气体,充分搅拌,取出糊状物,避光,晾干,密封保存。
(1)石灰乳和氯气反应的化学方程式为 。
(2)烧杯中石灰乳的作用是 。
(3)石灰乳吸收氯气放出热量,实验中控温的方法是 。
(4)该实验小组将饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到最后一滴时红色突然褪去。分析实验中红色褪去的原因时,他们产生了分歧。甲认为是氯水中的酸与NaOH溶液发生了中和反应,碱性减弱而使溶液褪色;乙认为是 。丙同学设计了如下实验:取褪色后的溶液于试管中,向其中滴加足量 (填化学式)溶液,溶液不变红,证明乙同学的分析是正确的。
答案与分层梯度式解析
第1章 认识化学科学
第2节 研究物质性质的方法和程序
第2课时 研究物质性质的基本程序
基础过关练
1.B 研究物质性质的基本程序为:观察物质的外部特征→预测物质的性质→实验和观察→解释和结论,所以正确的排序为adbc,故选B。
2.A 非金属单质溴与氯气的性质很相似,可以根据氯气的性质预测溴单质的性质,所以探究溴的性质时其基本程序是先从色、态方面观察溴的外部特征,然后根据氯气的性质预测溴可能具有的性质,再做实验验证预测,观察实验并记录现象,最后分析实验现象并用已知化学知识解释现象,得出结论,故选A。
3.D 氯气是一种黄绿色有毒气体,密度比空气大,故A正确;氯气可以和氢氧化钙等碱反应生成次氯酸盐,常用于制备漂白粉等杀菌消毒剂,故B正确;铁丝在氯气中燃烧,产生棕褐色的烟,产物为氯化铁,故C正确;纯净的氢气在盛有氯气的集气瓶中安静地燃烧,发出苍白色火焰,HCl在集气瓶口遇空气中的水蒸气形成白雾,故D不正确。
4.C 铜与盐酸不反应,故A错误;铁与氯气反应生成氯化铁,与盐酸反应生成氯化亚铁,故B、D错误;镁与氯气、盐酸反应均生成氯化镁,故C正确。
5.D 氯气的密度比空气大,应向地势较高处转移,不能向地下商场转移,故A、C不正确;氢氧化钠溶液有腐蚀性,不能佩戴用氢氧化钠溶液浸湿过的口罩,故B不正确;肥皂水呈碱性,能吸收氯气,故D正确。
6.C 钠熔点低,先预热是为了升高温度使氯气反应较完全,C错误。
7.答案 (1)通入氯气排尽装置中的空气
(2)Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3
(3)剧烈反应,产生棕黄色的烟 Cu+Cl2 CuCl2
(4)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(5)吸收多余的氯气,防止污染空气 Cl2+2NaOH NaCl+NaClO+H2O
解析 (1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为通入氯气排尽装置中的空气。
(2)氯气与水反应生成HCl,HCl能与硝酸银反应生成氯化银,故白色沉淀为氯化银,反应的化学方程式为Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3。
(3)干燥的氯气与铜粉在加热条件下剧烈反应生成氯化铜,化学方程式为Cu+Cl2 CuCl2。
(4)空试管的作用是防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂。
(5)氢氧化钠溶液用于吸收多余的氯气,防止污染空气,发生反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
8.C 新制氯水中HClO具有漂白性,使有色布条褪色的物质是HClO,故A错误;Cl2是黄绿色气体,且有刺激性气味,新制氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在,新制氯水中不存在HCl分子,故B错误;加入AgNO3溶液产生白色沉淀,沉淀为AgCl,说明新制氯水中有Cl-存在,故C正确;向新制氯水中加入NaOH溶液,浅黄绿色消失,发生反应Cl2+2NaOH NaCl+NaClO+H2O,说明有Cl2分子存在,故D错误。
易错分析 解答此类题目时,易混淆新制氯水成分与性质的对应关系。新制氯水的成分比较复杂,含有三分子(HClO、Cl2、H2O)和四离子(Cl-、H+、ClO-、OH-),与不同的物质反应时,表现出不同粒子的性质。
9.C 氯气与水反应生成的次氯酸具有漂白性,氯气本身不具有漂白性,故A错误;久置的氯水为稀盐酸,无漂白性,故B错误;由实验现象可知,滴加氯水后中间区域变为白色,由浅红色区域的位置可说明H+的扩散速度比HClO分子快,故C正确;新制氯水中的次氯酸见光会分解生成HCl和氧气,新制氯水放置几天后,溶液酸性增强,故D错误。
10.答案 (1)d (2)有白色沉淀产生 溶液浅黄绿色变浅 Na2CO3+2HCl 2NaCl+CO2↑+H2O (3)稀盐酸 2HClO 2HCl+O2↑ (4)棕色试剂瓶
解析 (1)新制氯水中含有H+、HClO等,溶液呈酸性,HClO有漂白性,所以新制氯水遇到石蕊溶液,溶液先变红后褪色,故能证明新制氯水具有漂白性的是d。(2)新制氯水中含有Cl-,能与AgNO3发生反应生成AgCl,现象是有白色沉淀产生;新制氯水中含有Cl2,新制氯水呈浅黄绿色,与NaOH溶液混合会发生反应:Cl2+2NaOH NaCl+NaClO+H2O,使溶液浅黄绿色变浅;HCl酸性强于碳酸,将新制氯水(足量)与碳酸钠溶液混合,HCl与Na2CO3反应,化学方程式为2HCl+Na2CO3 2NaCl+H2O+CO2↑。(3)HClO不稳定,见光易分解:2HClO 2HCl+O2↑,所以新制氯水久置变为稀盐酸。(4)HClO不稳定,见光易分解,实验室中饱和氯水常保存于棕色试剂瓶中。
11.B 漂白粉中含有氯化钙、次氯酸钙等,漂白液中含有氯化钠、次氯酸钠等,二者都属于混合物,故A错误;漂白粉的有效成分是Ca(ClO)2,故B正确;氯气与Ca(OH)2反应制次氯酸钙,澄清石灰水中Ca(OH)2的浓度太小,不利于生产,工业上将氯气通入石灰乳制取漂白粉,故C错误;漂白液的有效成分为次氯酸钠,故D错误。
12.B 该消毒液的主要成分为NaClO、NaCl,能与AgNO3反应,故A正确;NaClO能与水、CO2反应生成HClO,HClO具有漂白性,所以用该消毒液浸泡过的有色布条晾置在空气中一段时间,漂白效果更好,故B错误、C正确;将该消毒液长期露置在空气中,生成的HClO会分解,逐渐失去杀菌消毒能力,故D正确。
能力提升练
1.D 根据氯元素的化合价和物质类别可判断a是氯气,b是HCl,c是盐酸盐,d是次氯酸盐,e是次氯酸;A项,次氯酸见光易分解,次氯酸钠的稳定性强于次氯酸,合理;B项,碳酸酸性强于次氯酸,CO2、H2O和NaClO反应可生成次氯酸,合理;C项,次氯酸和次氯酸钠均可用作漂白剂,合理;D项,氢氧化钠溶液腐蚀性强,氯气发生泄漏时,可用肥皂水蘸湿的毛巾捂住口鼻撤退,不合理。
2.B 干燥的有色布条不褪色,湿润的有色布条褪色,说明潮湿的氯气具有漂白性,是因为Cl2与水反应生成的HClO具有漂白作用,A项正确;Cl2有毒,闻气味时用手轻轻在瓶口扇动,使极少量气体飘入鼻孔,B项错误;Cu丝在Cl2中燃烧生成棕黄色的烟,C项正确;若Cl2与NaOH溶液反应,烧瓶内气体压强减小,外压大于内压,故气球会膨胀,D项正确。
3.BD 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液先变红后褪色,过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+,故A正确;过程Ⅱ溶液由红色变成无色,是HClO漂白的结果,溶液中仍然含有盐酸,呈酸性,故B错误;过程Ⅲ形成饱和氯水,显浅黄绿色是因为溶解有Cl2分子,故C正确;Na2O2与H2O反应可看作两个过程:①Na2O2+2H2O 2NaOH+H2O2,②2H2O2 2H2O+O2↑,NaOH使溶液变为蓝色,H2O2具有漂白性,使蓝色褪去,故D错误。
4.答案 (1)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O (2)吸收未反应的氯气,防止污染环境,提高氯气利用率 (3)用冷水浴 (4)氯水中的次氯酸有漂白性,使溶液褪色 NaOH
解析 (1)Ca(OH)2和氯气发生反应的化学方程式为2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O。(2)多余的氯气可用石灰乳吸收,既可以防止污染环境,反应又可得到漂白粉的主要成分,提高氯气的利用率。(3)石灰乳吸收氯气放出热量,为降低温度,实验中可以采用冷水浴控温。(4)若由于次氯酸的漂白性使溶液褪色,则褪色后的溶液中加入氢氧化钠溶液不会恢复红色,故可向褪色后的溶液中加入足量氢氧化钠溶液,若溶液不变红,则证明乙同学分析正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第一册
第1章 认识化学科学
第2节 研究物质性质的方法和程序
第2课时 研究物质性质的基本程序
基础过关练
题组一 研究物质性质的基本程序
1.(2024福建厦门一中月考)哈工大研究团队设计了一种使用Fe3O4磁性材料的微型纳米生物机器人。下列关于研究Fe3O4性质的基本程序中排序正确的是( )
a.观察Fe3O4的颜色、状态
b.设计并进行实验,观察实验现象
c.解释现象、得出结论
d.预测Fe3O4的性质
A.abcd B.adbc C.dbac D.dacb
2.(2024北京第二十中学期中)非金属单质溴与氯气的性质很相似。在探究溴单质的性质时,其基本程序应该是( )
A.观察溴的外部特征→预测溴的性质→做实验并观察实验现象→解释和得出结论
B.做实验并观察溴的外部特征→分析、综合、推理得出结论
C.观察并做实验→分析实验现象→综合、推理得出结论
D.预测溴的性质→观察溴的外部特征→做实验并观察实验现象→解释和得出结论
题组二 氯气的性质
3.(2024福建厦门外国语学校月考)下列说法中,不正确的是( )
A.氯气是一种黄绿色有毒气体,密度比空气大
B.氯气常用于制备漂白粉等杀菌消毒剂
C.铁丝在氯气中燃烧,产生棕褐色的烟
D.纯净的氢气在盛有氯气的集气瓶中安静地燃烧,发出苍白色火焰,集气瓶口有白烟
4.(经典题)(2024山东潍坊期中)下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.FeCl3
5.(教材习题改编)某化学试剂厂不慎发生了氯气泄漏事故,泄漏出的氯气迅速向周围的居民区蔓延。下列自救措施合理的是( )
A.顺风向低凹处转移
B.及时戴上用氢氧化钠溶液浸湿过的口罩迅速转移
C.就近向地下商场转移
D.可以用毛巾蘸取肥皂水制作简易的防毒面具
6.(经典题)(2024北京海淀期中)某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验时先给钠预热,等钠熔成圆球时,撤火,通入氯气,即可见钠燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有碱液的棉花球是用于吸收过量的氯气,以免其污染空气
C.钠熔点高,所以先预热再反应
D.若在棉花球外沿滴一滴紫色石蕊溶液,可据棉球外沿呈蓝色判断氯气被碱液完全吸收
7.(2024山东德州阶段练习)某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热。写出AgNO3溶液中发生反应的化学方程式: 。
(3)硬质玻璃管中的实验现象为 ,反应的化学方程式为 。
(4)装置中空试管的作用是 。
(5)烧杯中氢氧化钠溶液的作用是 ,发生反应的化学方程式为 。
题组三 氯水的成分和性质
8.(易错题)(2024河南南阳一中调研)在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A.向新制氯水中放入红色布条,一会儿红色布条褪色,说明新制氯水中有Cl2存在
B.新制氯水呈浅黄绿色,且有刺激性气味,说明有HCl分子存在
C.加入AgNO3溶液产生白色沉淀,说明新制氯水中有Cl-存在
D.加入NaOH溶液,新制氯水浅黄绿色消失,说明新制氯水中有HClO分子存在
9.(2024山东烟台莱阳一中月考)某同学在pH试纸上滴几滴新制氯水,现象如图所示,下列说法中正确的是( )
A.该实验说明Cl2分子具有漂白性
B.若用久置的氯水进行实验,现象相同
C.该实验说明H+扩散速度比HClO分子快
D.将新制氯水放置几天,溶液酸性减弱
10.(2024福建南平段考)新制氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图所示四种物质发生的反应回答下列问题(a代表光照新制氯水发生的反应,b、c、d、e代表物质间反应,且新制氯水足量)。
(1)能证明新制氯水具有漂白性的是 (填“b”“c”“d”或“e”)。
(2)c反应的现象是 ,e反应的现象是 ,b反应的化学方程式为 。
(3)新制氯水久置变为 ,用化学方程式表示原因: 。
(4)实验室中饱和氯水常保存于 (填“棕色试剂瓶”或“透明试剂瓶”)中。
题组四 次氯酸盐的性质和用途
11.有关漂白粉和漂白液的说法正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是NaCl
12.(2024山东菏泽一中月考)以NaClO、NaCl为主要成分的消毒液具有杀菌消毒作用,用该消毒液浸泡过的有色布条晾置在空气中一段时间,漂白效果更好。下列说法错误的是( )
A.该消毒液可与AgNO3溶液反应
B.晾置在空气中,有色布条会被空气中的氧气氧化,漂白效果更好
C.该消毒液与空气中的CO2反应生成HClO,漂白效果更好
D.将该消毒液长期露置在空气中,会失去杀菌消毒能力
能力提升练
题组 氯及其化合物性质的综合应用
1.(2024河南南阳六校联考)部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.若d为钠盐,则d的稳定性强于e
B.将CO2通入d的钠盐溶液中,可以生成e
C.若d为钠盐,d和e均可用作漂白剂
D.a物质发生泄漏时,用NaOH溶液蘸湿的毛巾捂住口鼻撤退
2.(经典题)(2024福建厦门英才中学月考)某同学进行有关Cl2的实验或操作,下列说法不正确的是( )
A.图Ⅰ中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用
B.图Ⅱ中:闻Cl2的气味时应吸入足量氯气
C.图Ⅲ中:生成棕黄色的烟
D.图Ⅳ中:若气球膨胀,证明Cl2可与NaOH溶液反应
3.(不定项)(2024山东菏泽鄄城一中月考)向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。下列叙述不正确的是( )
A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+
B.过程Ⅱ溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程Ⅲ溶液由无色变成浅黄绿色,证明溶液中有Cl2
D.若向紫色石蕊溶液中持续加入Na2O2粉末,会出现相同的颜色变化
4.(2024河南省实验中学月考)某实验小组以冷的石灰乳和氯气为原料制备漂白粉的过程如下:在三颈烧瓶和烧杯中(实验装置如图)均加入一定量石灰乳,通入氯气和空气,反应20 min。停止通入气体,充分搅拌,取出糊状物,避光,晾干,密封保存。
(1)石灰乳和氯气反应的化学方程式为 。
(2)烧杯中石灰乳的作用是 。
(3)石灰乳吸收氯气放出热量,实验中控温的方法是 。
(4)该实验小组将饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到最后一滴时红色突然褪去。分析实验中红色褪去的原因时,他们产生了分歧。甲认为是氯水中的酸与NaOH溶液发生了中和反应,碱性减弱而使溶液褪色;乙认为是 。丙同学设计了如下实验:取褪色后的溶液于试管中,向其中滴加足量 (填化学式)溶液,溶液不变红,证明乙同学的分析是正确的。
答案与分层梯度式解析
第1章 认识化学科学
第2节 研究物质性质的方法和程序
第2课时 研究物质性质的基本程序
基础过关练
1.B 研究物质性质的基本程序为:观察物质的外部特征→预测物质的性质→实验和观察→解释和结论,所以正确的排序为adbc,故选B。
2.A 非金属单质溴与氯气的性质很相似,可以根据氯气的性质预测溴单质的性质,所以探究溴的性质时其基本程序是先从色、态方面观察溴的外部特征,然后根据氯气的性质预测溴可能具有的性质,再做实验验证预测,观察实验并记录现象,最后分析实验现象并用已知化学知识解释现象,得出结论,故选A。
3.D 氯气是一种黄绿色有毒气体,密度比空气大,故A正确;氯气可以和氢氧化钙等碱反应生成次氯酸盐,常用于制备漂白粉等杀菌消毒剂,故B正确;铁丝在氯气中燃烧,产生棕褐色的烟,产物为氯化铁,故C正确;纯净的氢气在盛有氯气的集气瓶中安静地燃烧,发出苍白色火焰,HCl在集气瓶口遇空气中的水蒸气形成白雾,故D不正确。
4.C 铜与盐酸不反应,故A错误;铁与氯气反应生成氯化铁,与盐酸反应生成氯化亚铁,故B、D错误;镁与氯气、盐酸反应均生成氯化镁,故C正确。
5.D 氯气的密度比空气大,应向地势较高处转移,不能向地下商场转移,故A、C不正确;氢氧化钠溶液有腐蚀性,不能佩戴用氢氧化钠溶液浸湿过的口罩,故B不正确;肥皂水呈碱性,能吸收氯气,故D正确。
6.C 钠熔点低,先预热是为了升高温度使氯气反应较完全,C错误。
7.答案 (1)通入氯气排尽装置中的空气
(2)Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3
(3)剧烈反应,产生棕黄色的烟 Cu+Cl2 CuCl2
(4)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(5)吸收多余的氯气,防止污染空气 Cl2+2NaOH NaCl+NaClO+H2O
解析 (1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为通入氯气排尽装置中的空气。
(2)氯气与水反应生成HCl,HCl能与硝酸银反应生成氯化银,故白色沉淀为氯化银,反应的化学方程式为Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3。
(3)干燥的氯气与铜粉在加热条件下剧烈反应生成氯化铜,化学方程式为Cu+Cl2 CuCl2。
(4)空试管的作用是防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂。
(5)氢氧化钠溶液用于吸收多余的氯气,防止污染空气,发生反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
8.C 新制氯水中HClO具有漂白性,使有色布条褪色的物质是HClO,故A错误;Cl2是黄绿色气体,且有刺激性气味,新制氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在,新制氯水中不存在HCl分子,故B错误;加入AgNO3溶液产生白色沉淀,沉淀为AgCl,说明新制氯水中有Cl-存在,故C正确;向新制氯水中加入NaOH溶液,浅黄绿色消失,发生反应Cl2+2NaOH NaCl+NaClO+H2O,说明有Cl2分子存在,故D错误。
易错分析 解答此类题目时,易混淆新制氯水成分与性质的对应关系。新制氯水的成分比较复杂,含有三分子(HClO、Cl2、H2O)和四离子(Cl-、H+、ClO-、OH-),与不同的物质反应时,表现出不同粒子的性质。
9.C 氯气与水反应生成的次氯酸具有漂白性,氯气本身不具有漂白性,故A错误;久置的氯水为稀盐酸,无漂白性,故B错误;由实验现象可知,滴加氯水后中间区域变为白色,由浅红色区域的位置可说明H+的扩散速度比HClO分子快,故C正确;新制氯水中的次氯酸见光会分解生成HCl和氧气,新制氯水放置几天后,溶液酸性增强,故D错误。
10.答案 (1)d (2)有白色沉淀产生 溶液浅黄绿色变浅 Na2CO3+2HCl 2NaCl+CO2↑+H2O (3)稀盐酸 2HClO 2HCl+O2↑ (4)棕色试剂瓶
解析 (1)新制氯水中含有H+、HClO等,溶液呈酸性,HClO有漂白性,所以新制氯水遇到石蕊溶液,溶液先变红后褪色,故能证明新制氯水具有漂白性的是d。(2)新制氯水中含有Cl-,能与AgNO3发生反应生成AgCl,现象是有白色沉淀产生;新制氯水中含有Cl2,新制氯水呈浅黄绿色,与NaOH溶液混合会发生反应:Cl2+2NaOH NaCl+NaClO+H2O,使溶液浅黄绿色变浅;HCl酸性强于碳酸,将新制氯水(足量)与碳酸钠溶液混合,HCl与Na2CO3反应,化学方程式为2HCl+Na2CO3 2NaCl+H2O+CO2↑。(3)HClO不稳定,见光易分解:2HClO 2HCl+O2↑,所以新制氯水久置变为稀盐酸。(4)HClO不稳定,见光易分解,实验室中饱和氯水常保存于棕色试剂瓶中。
11.B 漂白粉中含有氯化钙、次氯酸钙等,漂白液中含有氯化钠、次氯酸钠等,二者都属于混合物,故A错误;漂白粉的有效成分是Ca(ClO)2,故B正确;氯气与Ca(OH)2反应制次氯酸钙,澄清石灰水中Ca(OH)2的浓度太小,不利于生产,工业上将氯气通入石灰乳制取漂白粉,故C错误;漂白液的有效成分为次氯酸钠,故D错误。
12.B 该消毒液的主要成分为NaClO、NaCl,能与AgNO3反应,故A正确;NaClO能与水、CO2反应生成HClO,HClO具有漂白性,所以用该消毒液浸泡过的有色布条晾置在空气中一段时间,漂白效果更好,故B错误、C正确;将该消毒液长期露置在空气中,生成的HClO会分解,逐渐失去杀菌消毒能力,故D正确。
能力提升练
1.D 根据氯元素的化合价和物质类别可判断a是氯气,b是HCl,c是盐酸盐,d是次氯酸盐,e是次氯酸;A项,次氯酸见光易分解,次氯酸钠的稳定性强于次氯酸,合理;B项,碳酸酸性强于次氯酸,CO2、H2O和NaClO反应可生成次氯酸,合理;C项,次氯酸和次氯酸钠均可用作漂白剂,合理;D项,氢氧化钠溶液腐蚀性强,氯气发生泄漏时,可用肥皂水蘸湿的毛巾捂住口鼻撤退,不合理。
2.B 干燥的有色布条不褪色,湿润的有色布条褪色,说明潮湿的氯气具有漂白性,是因为Cl2与水反应生成的HClO具有漂白作用,A项正确;Cl2有毒,闻气味时用手轻轻在瓶口扇动,使极少量气体飘入鼻孔,B项错误;Cu丝在Cl2中燃烧生成棕黄色的烟,C项正确;若Cl2与NaOH溶液反应,烧瓶内气体压强减小,外压大于内压,故气球会膨胀,D项正确。
3.BD 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液先变红后褪色,过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+,故A正确;过程Ⅱ溶液由红色变成无色,是HClO漂白的结果,溶液中仍然含有盐酸,呈酸性,故B错误;过程Ⅲ形成饱和氯水,显浅黄绿色是因为溶解有Cl2分子,故C正确;Na2O2与H2O反应可看作两个过程:①Na2O2+2H2O 2NaOH+H2O2,②2H2O2 2H2O+O2↑,NaOH使溶液变为蓝色,H2O2具有漂白性,使蓝色褪去,故D错误。
4.答案 (1)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O (2)吸收未反应的氯气,防止污染环境,提高氯气利用率 (3)用冷水浴 (4)氯水中的次氯酸有漂白性,使溶液褪色 NaOH
解析 (1)Ca(OH)2和氯气发生反应的化学方程式为2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O。(2)多余的氯气可用石灰乳吸收,既可以防止污染环境,反应又可得到漂白粉的主要成分,提高氯气的利用率。(3)石灰乳吸收氯气放出热量,为降低温度,实验中可以采用冷水浴控温。(4)若由于次氯酸的漂白性使溶液褪色,则褪色后的溶液中加入氢氧化钠溶液不会恢复红色,故可向褪色后的溶液中加入足量氢氧化钠溶液,若溶液不变红,则证明乙同学分析正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
