1.1.2有机化合物中的共价键课件(共25张ppt)化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.1.2有机化合物中的共价键课件(共25张ppt)化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 42.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-18 15:31:04 | ||
图片预览






文档简介
(共25张PPT)
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第2课时 有机化合物中的共价键
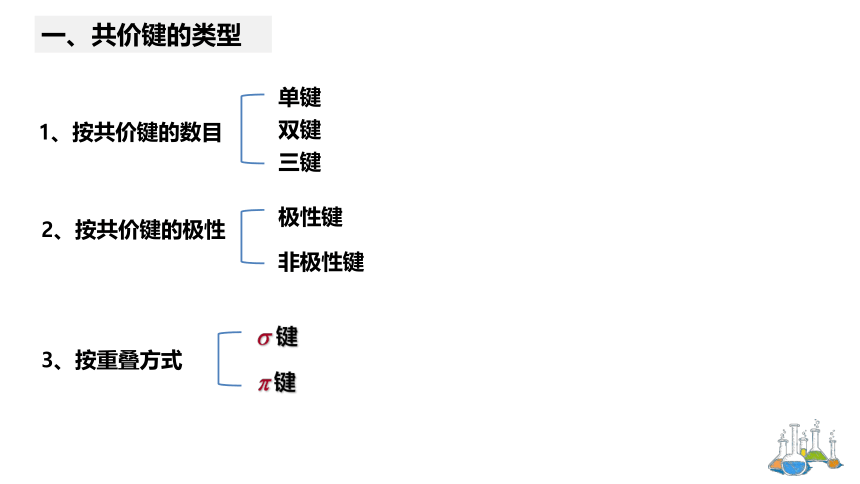
一、共价键的类型
1、按共价键的数目
单键
双键
三键
2、按共价键的极性
极性键
非极性键
3、按重叠方式
键
键
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
键强度及 稳定性 s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
σ 键强度较大,较稳定
二、有机化合物中的共价键
1、σ键和π键
与碳原子相连的原子数 结构 示意图 碳原子的杂化方式 碳原子的 成键方式 碳原子与相邻原子形成的
结构单元空间构型
4 sp3 σ键 四面体
3 sp2 σ键 π键 平面三角形
2 sp σ键 π键 直线形
2、杂化方式
3、共价键的类型对有机化合物性质的影响
4、共价键的类型与有机反应类型间的关系
键型 单键 双键 三键
σ键π键数目 一个σ键 一个σ键 一个π键 一个σ键 二个π键
反应类型 取代反应 π键比σ键更活泼,能发生加成反应
π键的轨道重叠程度比σ键的小,比较容易断裂而发生化学反应。
②CH2= CH2 + Br2 CH2Br-CH2Br
分析下列反应中有机化合物的断键情况,并归纳其反应类型。
断C-H,σ键
①CH4 + Cl2 CH3Cl + HCl
光
断碳碳双键中的π键
取代反应
加成反应
问题解决
5、共价键的极性与有机反应
共价键的类型除了和原子轨道重叠方式不同有关以外,由于成键原子的电负性大小存在差异,共用电子对会发生偏移,而产生键的极性,共价键的极性对有机物的性质又会产生什么影响?
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。
因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
【实验1-1】
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象。
物质 结构式 与钠反应现象 现象分析
水
乙醇
“浮、游、熔、响”
反应剧烈
水中的O—H极性较强
“沉、气、静”
没有钠与水反应剧烈
受乙基的影响,
乙醇中的O—H极性比
水中的O—H弱
实验结论:
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响官能团和物质的性质。共价键极性越强,有机反应越容易发生。
C2H5OH 2.5H2
问题与探讨
1.进一步实验证明1mol乙醇与足量的钠反应生成0.5molH2,那么乙醇与钠反应时断裂的是氧氢键还是碳氢键(即钠置换出的氢是碳上的氢或是羟基氢)?你能不能从理论上加以解释?
断碳氢键
断氧氢键
C2H5OH 0.5H2
是断裂的氧氢键(即置换出羟基氢)。原因:C的电负性(2.5) < O电负性(3.5),氧氢键的极性大于碳氢键,氧氢键更容易断裂。
2H- C-C-O-H
H
H
H
H
→
2H- C-C-O-Na + H2↑
H
H
H
H
+2Na
2H-O-H+ 2Na =NaOH + H2↑
2C2 H5OH +2Na →2C2H5ONa + H2↑
2H- C-C-O-H
H
H
H
H
2.乙醇与钠反应为什么没有水与钠反应剧烈?
3.通过以上分析,你还得出什么结论?
问题与探讨
δ-
δ+
烷基(-R)是推电子基团, 由于乙醇分子中乙基的推电子效应,氧氢键极性降低,使乙醇分子中的氧氢键极性小于水分子中的氧氢键,水分子中的氧氢键更容易断裂,所以钠与水反应更剧烈。
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响着官能团和物质的性质。
另外,由于羟基中的氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,如乙醇与氢溴酸能发生反应,碳氧键发生断裂。
H- C-C-O-H
H
H
H
H
+ H-Br
Δ
H- C-C-Br
H
H
H
H
+ H2O
共价键的断裂需要吸收能量,而且有机物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
CH3CH3OH + HBr CH3CH2Br + H2O
Δ
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
① CH4 + Cl 2 CH3Cl + HCl
② CH2 =CH2 + Br2 → CH2Br - CH2Br
思考与讨论
光
CH4分子中含有C-Hσ键,易发生取代反应。
CH2 =CH2分子中碳碳双键含有π键,易发生加成反应。
6、有机反应的特点:
共价键的断裂需要吸收能量,相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
____________________________________
【例1】张老师发现某有机物分子的结构简式为 ,
该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,
极性更强,更易断裂
O
H
C
O
4、结构式:
CH3 CH = CH2
5、结构简式:
6、键线式:
1、分子式:
C3H6
C C =C H
H
H
H
H
H
C C C H
H
H
H
H
H
::
:
×·
×·
×·
×·
×·
×·
3、电子式:
用元素符号和数字表示分子的原子构成的式子。
用·或×表示原子最外层电子的式子。
用“-” 表示一对共用电子对的式子。
省略部分或全部“-”的结构式。
省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
CH2
2、最简式(实验式):
表示分子式最简整数比的式子。
CH3CH2CH2OH
OH
三、有机物的常见表示方法——“六式”(以丙烯为例)
练习:将下列有机物结构简式改写成键线式。
CH3CH2CH3
CH3CHCH2CH=CH2
CH3
CH3CCH3
CH3
CH3
CH3CHCH2CH3
OH
CH3CH2CH2CHO
OH
CHO
CH3COOCH2CH3
=
O
O
CH2
CH2
CH2
H2C
H2C
CH2
CH
CH
H2C
H2C
CH2
CH
CH
CH
HC
HC
CH
人工合成的第一个有机物——尿素
1824年,维勒从氰经水解制得草酸;1828年他无意中用加热的方法又使氰酸铵转化为尿素。氰和氰酸铵都是无机化合物,而草酸和尿素都是有机化合物。
弗里德里希·维勒
德国化学家
维勒的实验结果给予“生命力”学说第一次冲击。此后,乙酸等有机化合物相继由碳、氢等元素合成,渐渐地“生命力”学说被抛弃了,“有机化学”这一名词却沿用至今。
小结:
有机物中共价键
共价键的类型
π键
σ键
共价键的极性与有机反应
有机物表征方法
不易断裂,发生取代反应
易断裂,发生加成反应
极性越大越易发生反应
“六式”
1、下列说法不正确的是( )
A、碳原子的最外电子层有4个电子
B、1个碳原子可以与其他非金属原子形成4个共价键
C、两个碳原子之间能形成单键、双键或三键
D、所有有机化合物中都含有极性键和非极性键
D
2、下列有机化合物分子的共价键都是σ键的是( )
A、甲烷 B、乙烯 C、乙炔 D、苯
A
3、下列分子的所有原子均在同一平面内的是( )
A、甲烷 B、乙烯 C、乙酸 D、甲苯
B
4、某有机化合物的结构简式为CH2F─CH=CH─CH=CH─CH3,下列关于该有机化合物的叙述正确的是( )
A、所有原子可能位于同一平面
B、6个碳原子可能位于同一平面
C、该有机化合物属于烯烃
D、分子中只含有σ键
B
1.目前已发现的有机物大约有三千万种,下列有关其种类繁多的原因的说法错误的是
A.碳原子间能以单键、双键或三键等多种方式结合
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链
C.每个碳原子都能与氢原子形成四个共价键
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合
【答案】C
【详解】A.碳原子间能以单键、双键或三键等多种方式结合,是碳的化合物种类多的原因之一,故A正确;
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链,是碳的化合物种类多的原因之一,故B正确;
C.每个碳原子都能与氢原子形成四个共价键,不是碳的化合物种类多的原因之一,故C错误;
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合,是碳的化合物种类多的原因之一,故D正确;
2.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是
A.都是极性键
B.都是非极性键
C.既有极性键,又有非极性键
D.都是离子键
【答案】C
【详解】在大多数有机物分子里,碳原子和碳原子之间形成非极性共价键、碳原子和其它原子间形成极性共价键,如C-O、C-N等原子之间存在极性共价键。答案选C。
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第2课时 有机化合物中的共价键
一、共价键的类型
1、按共价键的数目
单键
双键
三键
2、按共价键的极性
极性键
非极性键
3、按重叠方式
键
键
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
键强度及 稳定性 s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
σ 键强度较大,较稳定
二、有机化合物中的共价键
1、σ键和π键
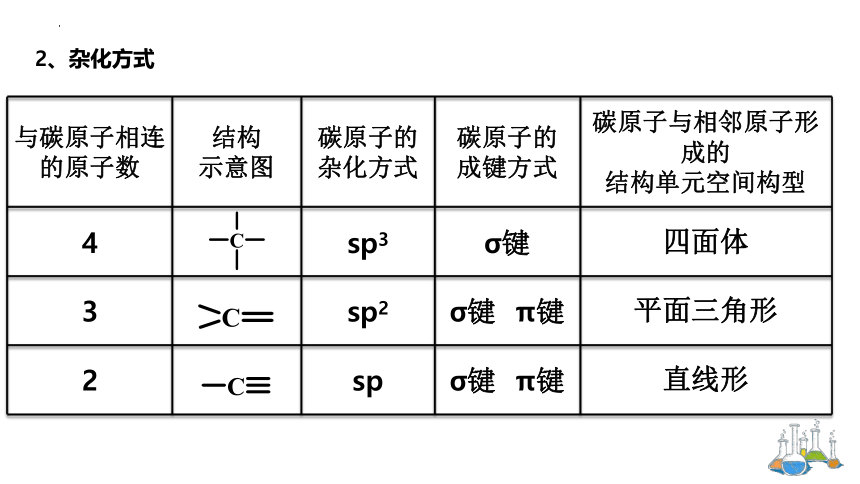
与碳原子相连的原子数 结构 示意图 碳原子的杂化方式 碳原子的 成键方式 碳原子与相邻原子形成的
结构单元空间构型
4 sp3 σ键 四面体
3 sp2 σ键 π键 平面三角形
2 sp σ键 π键 直线形
2、杂化方式
3、共价键的类型对有机化合物性质的影响
4、共价键的类型与有机反应类型间的关系
键型 单键 双键 三键
σ键π键数目 一个σ键 一个σ键 一个π键 一个σ键 二个π键
反应类型 取代反应 π键比σ键更活泼,能发生加成反应
π键的轨道重叠程度比σ键的小,比较容易断裂而发生化学反应。
②CH2= CH2 + Br2 CH2Br-CH2Br
分析下列反应中有机化合物的断键情况,并归纳其反应类型。
断C-H,σ键
①CH4 + Cl2 CH3Cl + HCl
光
断碳碳双键中的π键
取代反应
加成反应
问题解决
5、共价键的极性与有机反应
共价键的类型除了和原子轨道重叠方式不同有关以外,由于成键原子的电负性大小存在差异,共用电子对会发生偏移,而产生键的极性,共价键的极性对有机物的性质又会产生什么影响?
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。
因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
【实验1-1】
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象。
物质 结构式 与钠反应现象 现象分析
水
乙醇
“浮、游、熔、响”
反应剧烈
水中的O—H极性较强
“沉、气、静”
没有钠与水反应剧烈
受乙基的影响,
乙醇中的O—H极性比
水中的O—H弱
实验结论:
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响官能团和物质的性质。共价键极性越强,有机反应越容易发生。
C2H5OH 2.5H2
问题与探讨
1.进一步实验证明1mol乙醇与足量的钠反应生成0.5molH2,那么乙醇与钠反应时断裂的是氧氢键还是碳氢键(即钠置换出的氢是碳上的氢或是羟基氢)?你能不能从理论上加以解释?
断碳氢键
断氧氢键
C2H5OH 0.5H2
是断裂的氧氢键(即置换出羟基氢)。原因:C的电负性(2.5) < O电负性(3.5),氧氢键的极性大于碳氢键,氧氢键更容易断裂。
2H- C-C-O-H
H
H
H
H
→
2H- C-C-O-Na + H2↑
H
H
H
H
+2Na
2H-O-H+ 2Na =NaOH + H2↑
2C2 H5OH +2Na →2C2H5ONa + H2↑
2H- C-C-O-H
H
H
H
H
2.乙醇与钠反应为什么没有水与钠反应剧烈?
3.通过以上分析,你还得出什么结论?
问题与探讨
δ-
δ+
烷基(-R)是推电子基团, 由于乙醇分子中乙基的推电子效应,氧氢键极性降低,使乙醇分子中的氧氢键极性小于水分子中的氧氢键,水分子中的氧氢键更容易断裂,所以钠与水反应更剧烈。
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响着官能团和物质的性质。
另外,由于羟基中的氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,如乙醇与氢溴酸能发生反应,碳氧键发生断裂。
H- C-C-O-H
H
H
H
H
+ H-Br
Δ
H- C-C-Br
H
H
H
H
+ H2O
共价键的断裂需要吸收能量,而且有机物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
CH3CH3OH + HBr CH3CH2Br + H2O
Δ
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
① CH4 + Cl 2 CH3Cl + HCl
② CH2 =CH2 + Br2 → CH2Br - CH2Br
思考与讨论
光
CH4分子中含有C-Hσ键,易发生取代反应。
CH2 =CH2分子中碳碳双键含有π键,易发生加成反应。
6、有机反应的特点:
共价键的断裂需要吸收能量,相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
____________________________________
【例1】张老师发现某有机物分子的结构简式为 ,
该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,
极性更强,更易断裂
O
H
C
O
4、结构式:
CH3 CH = CH2
5、结构简式:
6、键线式:
1、分子式:
C3H6
C C =C H
H
H
H
H
H
C C C H
H
H
H
H
H
::
:
×·
×·
×·
×·
×·
×·
3、电子式:
用元素符号和数字表示分子的原子构成的式子。
用·或×表示原子最外层电子的式子。
用“-” 表示一对共用电子对的式子。
省略部分或全部“-”的结构式。
省略碳和氢,只表示分子中键的连接方式和官能团,每个拐点和终点表示一个碳原子的式子。
CH2
2、最简式(实验式):
表示分子式最简整数比的式子。
CH3CH2CH2OH
OH
三、有机物的常见表示方法——“六式”(以丙烯为例)
练习:将下列有机物结构简式改写成键线式。
CH3CH2CH3
CH3CHCH2CH=CH2
CH3
CH3CCH3
CH3
CH3
CH3CHCH2CH3
OH
CH3CH2CH2CHO
OH
CHO
CH3COOCH2CH3
=
O
O
CH2
CH2
CH2
H2C
H2C
CH2
CH
CH
H2C
H2C
CH2
CH
CH
CH
HC
HC
CH
人工合成的第一个有机物——尿素
1824年,维勒从氰经水解制得草酸;1828年他无意中用加热的方法又使氰酸铵转化为尿素。氰和氰酸铵都是无机化合物,而草酸和尿素都是有机化合物。
弗里德里希·维勒
德国化学家
维勒的实验结果给予“生命力”学说第一次冲击。此后,乙酸等有机化合物相继由碳、氢等元素合成,渐渐地“生命力”学说被抛弃了,“有机化学”这一名词却沿用至今。
小结:
有机物中共价键
共价键的类型
π键
σ键
共价键的极性与有机反应
有机物表征方法
不易断裂,发生取代反应
易断裂,发生加成反应
极性越大越易发生反应
“六式”
1、下列说法不正确的是( )
A、碳原子的最外电子层有4个电子
B、1个碳原子可以与其他非金属原子形成4个共价键
C、两个碳原子之间能形成单键、双键或三键
D、所有有机化合物中都含有极性键和非极性键
D
2、下列有机化合物分子的共价键都是σ键的是( )
A、甲烷 B、乙烯 C、乙炔 D、苯
A
3、下列分子的所有原子均在同一平面内的是( )
A、甲烷 B、乙烯 C、乙酸 D、甲苯
B
4、某有机化合物的结构简式为CH2F─CH=CH─CH=CH─CH3,下列关于该有机化合物的叙述正确的是( )
A、所有原子可能位于同一平面
B、6个碳原子可能位于同一平面
C、该有机化合物属于烯烃
D、分子中只含有σ键
B
1.目前已发现的有机物大约有三千万种,下列有关其种类繁多的原因的说法错误的是
A.碳原子间能以单键、双键或三键等多种方式结合
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链
C.每个碳原子都能与氢原子形成四个共价键
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合
【答案】C
【详解】A.碳原子间能以单键、双键或三键等多种方式结合,是碳的化合物种类多的原因之一,故A正确;
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链,是碳的化合物种类多的原因之一,故B正确;
C.每个碳原子都能与氢原子形成四个共价键,不是碳的化合物种类多的原因之一,故C错误;
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合,是碳的化合物种类多的原因之一,故D正确;
2.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是
A.都是极性键
B.都是非极性键
C.既有极性键,又有非极性键
D.都是离子键
【答案】C
【详解】在大多数有机物分子里,碳原子和碳原子之间形成非极性共价键、碳原子和其它原子间形成极性共价键,如C-O、C-N等原子之间存在极性共价键。答案选C。
