2025人教版高中化学必修第一册同步练习题--第1课时 氯气的性质(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第一册同步练习题--第1课时 氯气的性质(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 460.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 12:26:07 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第一册
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第1课时 氯气的性质
基础过关练
题组一 氯气的性质
1.(2024江西景德镇期中)某污水处理厂发生氯气泄漏事故,导致五百多人中毒。救援人员在现场的下列处理方法和过程较合理的是 ( )
①及时将人群逆风转移到地势较高的地方
②用高压水枪向空中喷洒饱和食盐水
③将泄漏氯气的钢瓶用生石灰掩埋
④及时清理现场,检查水源和食物等是否被污染
A.①③④ B.①②③
C.②④ D.①②③④
2.(易错题)(2024山东枣庄期中)下列实验现象描述中,正确的是 ( )
A.金属钠在氯气中燃烧,产生黄色的烟
B.铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒
C.氢气在氯气中燃烧的火焰为苍白色,瓶口有白色的烟生成
D.铜丝在氯气中燃烧产生棕黄色的烟,产物溶于水为蓝色溶液
3.(经典题)某同学用下列装置进行有关Cl2的实验,下列说法不正确的是 ( )
A.图Ⅰ中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用
B.图Ⅱ中:闻Cl2的气味时应吸入足量氯气
C.图Ⅲ中:生成棕黄色的烟
D.图Ⅳ中:若气球膨胀,证明Cl2可与NaOH溶液反应
4.(2024山东泰安五地联考)某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 ;铜与氯气反应的化学方程式为 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式: 、 。
(3)装置中空试管的作用是 。
(4)实验中,观察到紫色石蕊溶液颜色的变化为 。
(5)烧杯中氢氧化钠溶液的作用是 (用离子方程式表示)。
题组二 氯水的成分及性质分析
5.(经典题)(2024北京人大附中月考)在新制氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列关于新制氯水的说法不正确的是 ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,说明有Cl2分子存在
C.向新制氯水中加入纯碱,有气泡产生,说明新制氯水中含有H+
D.加入AgNO3溶液,出现白色沉淀,说明有Cl-存在
6.(2024山西大学附中期中)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是 ( )
A.该实验说明Cl2具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
7.(2024山东淄博期中)将一定量Cl2通过甲装置后,再通过放有湿润红色布条的乙装置,红色布条不褪色。甲装置中所盛试剂可能是 ( )
①浓硫酸 ②NaOH溶液 ③纯碱溶液
④饱和食盐水 ⑤KI溶液
A.①④⑤ B.①②③
C.②③④ D.②③⑤
题组三 漂白剂的制备及性质探究
8.(2024河北武强中学期中)工业上将氯气通入到石灰乳中制备漂白粉,制备流程如下。下列有关说法正确的是 ( )
A.漂白粉是混合物
B.“反应”中Cl2是氧化剂,石灰乳是还原剂
C.漂白粉配成溶液后必须加入盐酸才能制得具有漂白性的物质
D.工业制备漂白粉的离子方程式为2OH-+Cl2 Cl-+ClO-+H2O
9.(2024广东广州期中)常温下,氯气与烧碱溶液反应可制得“84”消毒液,NaClO是“84”消毒液的有效成分。
(1)化学品储藏室中存放Cl2容器上应贴的标签的名称为 (填字母)。
a.易燃品 b.爆炸品 c.有毒品
(2)氯气与烧碱溶液反应可制得“84”消毒液,该反应的离子方程式为 。
(3)将反应温度控制在70 ℃时,Cl2通入NaOH溶液中可以得到NaClO3、NaCl和水,反应的化学方程式为 。
(4)在一定条件下,把氯气通入NaOH溶液中,生成物中含有Cl-、ClO-、Cl三种含氯元素的离子,其中ClO-、Cl两种离子的数目与反应时间(t)的曲线如图所示。t1时开始有Cl生成的原因是 。在0~t2时间内,Cl2与NaOH反应的离子方程式为 。
能力提升练
题组一 氯及其化合物的转化及性质的综合考查
1.(2024河南新乡九师联盟月考)有关氯及其化合物,下列叙述正确的是 ( )
A.H2在纯净的Cl2中点燃会立即发生爆炸
B.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解
C.若发生Cl2泄漏,可用蘸有NaHCO3溶液的毛巾捂住口鼻向高处转移
D.漂白粉比HClO稳定,可露置在空气中长期保存
2.(易错题)(2024浙江强基联盟联考)已知卤素互化物(例如BrCl)、拟卤素[例如(CN)2]等物质的性质与Cl2单质相似,下列相关反应的化学方程式不正确的是( )
A.3BrCl+2Fe FeCl3+FeBr3
B.BrCl+H2O HBr+HClO
C.(CN)2+H2O HCN+HCNO
D.(CN)2+2KOH KCN+KCNO+H2O
3.(2024河北石家庄月考)常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示,部分产物已省略。
(1)请分别写出B、C、D、E的化学式(如为溶液请填溶质的化学式):B ,C ,D ,E 。
(2)写出A+H2O反应的化学方程式: 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的气体A应用NaOH溶液吸收,其反应的化学方程式为 。
(4)漂白粉的有效成分是 (填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为 ,次氯酸不稳定,次氯酸见光分解的化学方程式为 。
题组二 实验探究氯水及次氯酸盐的性质
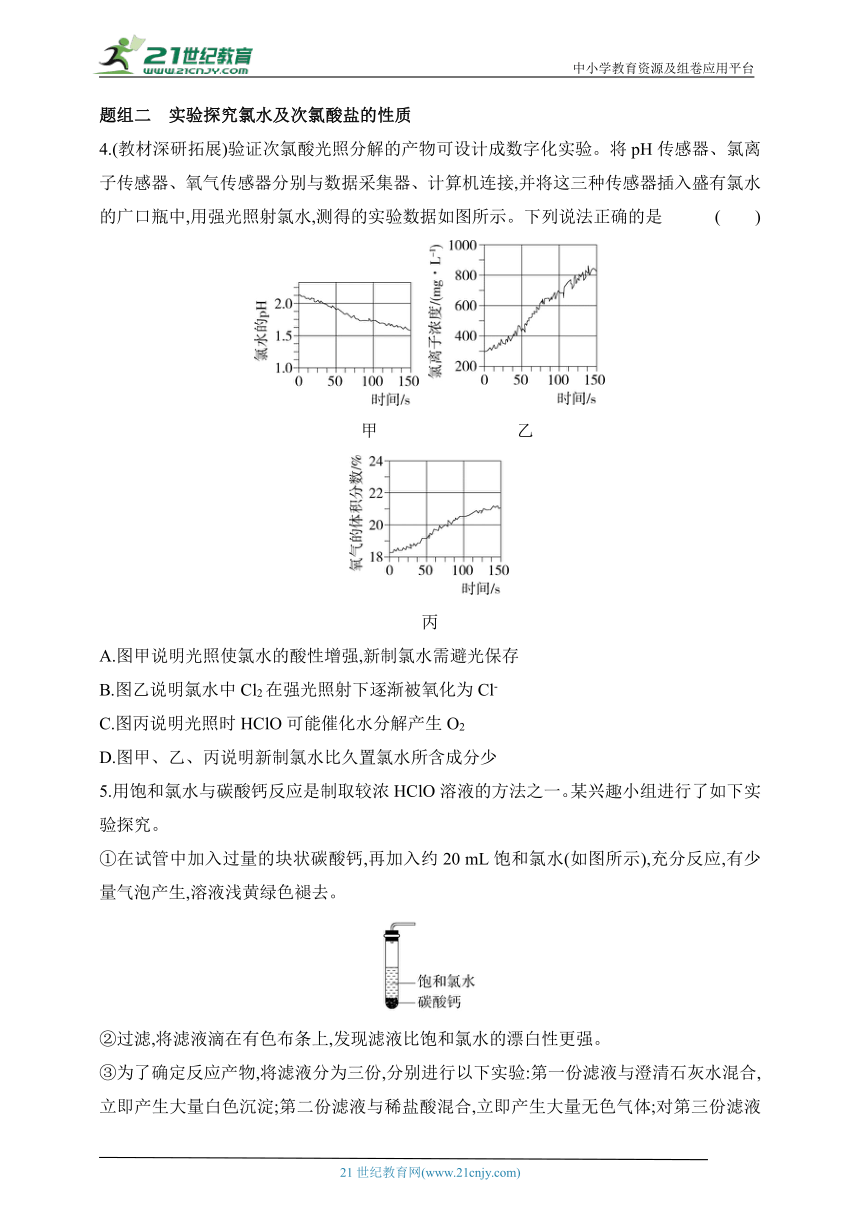
4.(教材深研拓展)验证次氯酸光照分解的产物可设计成数字化实验。将pH传感器、氯离子传感器、氧气传感器分别与数据采集器、计算机连接,并将这三种传感器插入盛有氯水的广口瓶中,用强光照射氯水,测得的实验数据如图所示。下列说法正确的是 ( )
甲 乙
丙
A.图甲说明光照使氯水的酸性增强,新制氯水需避光保存
B.图乙说明氯水中Cl2在强光照射下逐渐被氧化为Cl-
C.图丙说明光照时HClO可能催化水分解产生O2
D.图甲、乙、丙说明新制氯水比久置氯水所含成分少
5.用饱和氯水与碳酸钙反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去。
②过滤,将滤液滴在有色布条上,发现滤液比饱和氯水的漂白性更强。
③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份滤液与澄清石灰水混合,立即产生大量白色沉淀;第二份滤液与稀盐酸混合,立即产生大量无色气体;对第三份滤液进行加热,看到滤液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。依据上述实验可推知,滤液中的溶质除CaCl2、HClO外,还有 ( )
A.Ca(ClO)2 B.CaCO3 C.Ca(HCO3)2 D.CaO
6.(2024广东广州二中期中)84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒。某兴趣小组对84消毒液的组成、性质与使用进行探究。
所用试剂:84消毒液(含NaClO)、医用酒精(CH3CH2OH体积分数为70%~75%)。
Ⅰ.探究84消毒液的成分
(1)实测该84消毒液pH=12.4(溶液呈碱性),能使pH试纸 ,因此其成分中,除了NaCl、NaClO,还含有少量 (填化学式)。
(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是 (用化学方程式表示)。
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是 。某游泳场,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长,该反应的化学方程式为 。
Ⅲ.探究84消毒液能否与医用酒精混用,实验装置如图所示
已知:KI是常见的还原剂;单质碘(I2)遇淀粉变蓝。
实验 液体A 液体B 现象
① 20 mL 84消毒液(pH=12.4) 20 mL 蒸馏水 溶液中无明显现象;溶液pH变为12.0;淀粉-KI试纸在8 min时变蓝,49 min时蓝色完全褪去
② 20 mL 84消毒液(pH=12.4) 20 mL 医用酒精 产生气泡,颜色无明显变化;溶液pH升高到13.1,淀粉-KI试纸在3 min时变蓝,21 min时蓝色完全褪去
(4)判断实验②中生成了Cl2的依据是 。
(5)图中NaOH溶液的作用是 。
结论:医用酒精可与84消毒液发生反应,二者不可混用。
答案与分层梯度式解析
基础过关练
1.A 2.D 3.B 5.A 6.B 7.D 8.A
1.A Cl2密度比空气大,Cl2发生泄漏时会集中在地势较低处,救援人员应及时将人群逆风转移到地势较高的地方,①正确;Cl2在饱和食盐水中的溶解量非常小,故不能用高压水枪向空中喷洒饱和食盐水来吸收氯气,②错误;潮湿的Cl2能与生石灰反应,救援人员可将泄漏Cl2的钢瓶用生石灰掩埋,以减少Cl2扩散到空气中,③正确;Cl2是有毒气体,故Cl2泄漏时,要及时清理现场,检查水源和食物等是否被污染,④正确。
2.D Na在Cl2中燃烧产生白烟,生成NaCl,A错误;铁丝在Cl2中燃烧,产生棕褐色的烟,B错误;H2在Cl2中燃烧,发出苍白色火焰,瓶口上方有白雾,C错误;Cu在Cl2中燃烧,产生棕黄色的烟,生成CuCl2,CuCl2溶于水,得到蓝色溶液,D正确。
易错分析 ①虽然钠的焰色呈黄色,但是Na在Cl2中燃烧产生的是白烟,注意二者的区别。②注意“烟”和“雾”的区别:固体的小颗粒均匀分散在空气中,得到的是烟;而液态物质的小液滴均匀分散在空气中得到的是雾。
3.B 湿润的有色布条褪色,说明潮湿的氯气具有漂白性,是因为Cl2与水反应生成的HClO具有漂白作用,A项正确;Cl2有毒,闻气味时用手轻轻在瓶口扇动,使极少量气体飘入鼻孔,B项错误;Cu丝在Cl2中燃烧生成棕黄色的烟,C项正确;若Cl2与NaOH溶液反应,烧瓶内气体压强迅速减小,外压大于内压,故气球会膨胀,D项正确。
4.答案 (1)先通入氯气排尽装置中的空气 Cu+Cl2 CuCl2
(2)Cl2+H2O HCl+HClO HCl+AgNO3 AgCl↓+HNO3
(3)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(4)先变红后褪色
(5)Cl2+2OH- Cl-+ClO-+H2O
解析 (1)为防止铜与空气中的O2反应,在加热前应先通入Cl2排尽装置中的空气。(2)在AgNO3溶液中,先是Cl2与水反应生成HCl和HClO,HCl再与AgNO3反应生成AgCl白色沉淀,其化学方程式分别为Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3。(3)装置中空试管可防止右侧试管中的水倒吸入硬质玻璃管中,引起硬质玻璃管炸裂。(4)Cl2与石蕊溶液中的水发生反应Cl2+H2O HCl+HClO,溶液呈酸性,紫色石蕊溶液变红,但HClO有漂白性,又能使溶液褪色,故可看到紫色石蕊溶液先变红后褪色。(5)Cl2有毒,可用NaOH溶液吸收多余的Cl2,其离子方程式为Cl2+2OH- Cl-+ClO-+H2O。
5.A 新制氯水中含Cl2、H2O、HClO、Cl-、H+、OH-、ClO-,能使有色布条褪色的是HClO,A错误;Cl2为黄绿色气体,溶于水后溶液呈浅黄绿色,B正确;向新制氯水中加入纯碱产生气泡,说明H+与C反应有CO2生成,C正确;新制氯水中加入AgNO3溶液出现白色沉淀,说明有Cl-存在,D正确。
6.B HClO具有漂白性,Cl2无漂白性,A错误;滴加新制氯水的区域变白色,而周围变成浅红色,可说明H+的扩散速度比HClO分子快,B正确;HClO的漂白持久、稳定,加热实验后的pH试纸,试纸不会恢复原来的颜色,C错误;久置的氯水中主要成分为HCl,无漂白性,D错误。
7.D 浓硫酸具有吸水性,所以通过甲装置后氯气为干燥氯气,而干燥氯气与湿润红色布条中的水反应能生成次氯酸,所以红色布条褪色,①不符合题意;NaOH溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,②符合题意;纯碱溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,③符合题意;饱和食盐水不能吸收氯气,所以通过甲装置后,再通过放有湿润红色布条的乙装置,红色布条褪色,④不符合题意;KI具有还原性,KI溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,⑤符合题意;故选D。
8.A 漂白粉的主要成分是CaCl2和Ca(ClO)2,属于混合物,A正确;“反应”的化学方程式为2Ca(OH)2+2Cl2 CaCl2+Ca(ClO)2+2H2O,Cl2既是氧化剂又是还原剂,B错误;漂白粉配成溶液后,遇到空气中的CO2,可生成次氯酸,C错误;工业制备漂白粉过程加入的是石灰乳,在书写离子方程式时应写化学式,D错误。
知识拓展 Cl2与石灰乳或NaOH溶液的反应中,Cl2既是氧化剂又是还原剂。漂白粉露置在空气中易变质:Ca(ClO)2+CO2+H2O CaCO3+2HClO,2HClO 2HCl+O2↑,故漂白粉需密闭保存。
9.答案 (1)c (2)Cl2+2OH- Cl-+ClO-+H2O
(3)3Cl2+6NaOH NaClO3+5NaCl+3H2O
(4)反应放热,溶液温度升高,在较高温度下有Cl+7Cl-+5H2O
解析 (1)Cl2是有毒的气体,故存放Cl2的容器上应贴有毒品的标签。(2)氯气与烧碱溶液反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O,离子方程式为Cl2+2OH- Cl-+ClO-+H2O。(3)在70 ℃时,Cl2与NaOH反应生成NaClO3、NaCl和H2O,该反应的化学方程式为3Cl2+6NaOH NaClO3+5NaCl+3H2O。(4)Cl2与NaOH在常温下反应有NaClO生成,在70 ℃时有Cl生成,在t1时开始反应生成NaClO3,是因为随着反应进行,溶液温度升高,在较高温度下有Cl生成。在0~t2时间内,Cl2与NaOH反应生成ClO-、Cl的离子数目之比为2∶1,即生成物中ClO-、Cl化学计量数之比为2∶1,结合得失电子守恒、电荷守恒、原子守恒可写出Cl2与NaOH反应的离子方程式为5Cl2+10OH- 2ClO-+Cl+7Cl-+5H2O。
能力提升练
1.C 2.B 4.A 5.C
1.C H2能在Cl2中安静地燃烧,若和Cl2光照会发生爆炸,A错误;洁厕灵中含有盐酸,“84”消毒液中含有NaClO,这两种溶液混合会发生氧化还原反应产生有毒的Cl2,B错误;Cl2有毒且密度比空气大,Cl2能与NaHCO3溶液反应,故若发生Cl2泄漏,可用蘸有NaHCO3溶液的毛巾捂住口鼻并向高处转移,C正确;漂白粉易和空气中的CO2、水蒸气等反应而变质,故漂白粉需密闭保存,以防止在空气中变质失效,D错误。
2.B 在BrCl中Br为+1价,Cl为-1价,由得失电子守恒可知BrCl与Fe的反应为3BrCl+2Fe FeCl3+FeBr3,A正确;BrCl与H2O的反应为BrCl+H2O HBrO+HCl,B错误;(CN)2与Cl2性质相似,则(CN)2与水的反应为(CN)2+H2O HCN+HCNO,C正确;结合Cl2与NaOH的反应,可写出(CN)2与KOH的反应为(CN)2+2KOH KCN+KCNO+H2O,D正确。
易错分析 联想Cl2的相关反应,判断题中化学方程式的正误,尤其要注意卤素互化物中各元素价态不同,与Cl2的性质不完全相同,如BrCl与水的反应不是氧化还原反应。
3.答案 (1)HClO NaCl HCl NaClO
(2)Cl2+H2O HCl+HClO
(3)Cl2+2NaOH NaCl+NaClO+H2O
(4)Ca(ClO)2 Ca(ClO)2+CO2+H2O CaCO3↓+2HClO 2HClO 2HCl+O2↑
解析 (1)常温下,A是可用来对自来水进行消毒的黄绿色气体单质,则A为Cl2,A、B、C、D、E都含X元素,由转化关系可知B为HClO,D为HCl,C为NaCl,E为NaClO。
(2)A为Cl2,Cl2与H2O反应的化学方程式为Cl2+H2O HCl+HClO。
(3)Cl2与NaOH反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
(4)漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,与空气中的CO2反应,有HClO生成,化学方程式为Ca(ClO)2+CO2+H2O CaCO2↓+2HClO;次氯酸见光分解的化学方程式为2HClO 2HCl+O2↑。
4.A 由图甲可知光照后溶液的pH减小,即溶液中H+浓度增大,溶液酸性增强,故新制氯水需避光保存,A正确;由图乙可知在强光照射下,氯水中Cl2逐渐被还原为Cl-,B错误;由图丙可知光照可促使氯水中HClO分解,而不是催化水分解,C错误;新制氯水中含三分子四离子,久置氯水中只含H2O、H+、Cl-、OH-,故新制氯水所含成分比久置氯水多,D错误。
方法点津 结合图甲溶液的pH减小,则溶液中H+浓度增大,图乙溶液中Cl-浓度增大,图丙溶液中O2的体积分数增大,可说明光照时,加快了HClO的分解,即2HClO 2HCl+O2↑,溶液酸性变强,溶液中H+、Cl-浓度均增大,O2的体积分数也增大。
5.C 结合本题信息,可对该实验进行如下梳理:
结合前两份滤液的反应,可知滤液中可能含C;再结合第三份滤液中的反应并联想NaHCO3受热易分解,参考四个选项可知滤液中应该含有Ca(HCO3)2,C项正确。
解题指导 ①C均能与盐酸反应生成CO2气体;均能与澄清石灰水反应生成白色沉淀,其离子方程式分别为C。②结合NaHCO3受热易分解可联想碳酸氢盐受热易分解。
6.答案 (1)先变蓝后褪色 NaOH
(2)2HClO 2HCl+O2↑
(3)ClO-具有氧化性 NaClO+H2O2 H2O+NaCl+O2↑
(4)相同条件下,实验②的淀粉-KI试纸变色比实验①快
(5)吸收Cl2,防止污染空气
解析 (1)84消毒液显碱性且消毒液具有漂白性,故pH试纸先变蓝后褪色,84消毒液是氢氧化钠溶液吸收氯气制成的,溶液显碱性,则其成分中除了NaCl、NaClO,还含有少量氢氧化钠。(2)NaClO与空气中的水蒸气、CO2反应有HClO生成,HClO具有强氧化性,消毒效果增强;HClO不稳定,见光分解导致消毒效果降低,化学方程式为2HClO 2HCl+O2↑。(3)ClO-具有氧化性,84消毒液中含ClO-,故84消毒液具有氧化性;NaClO与H2O2反应产生O2,化学方程式为NaClO+H2O2 H2O+NaCl+O2↑。(4)氯气能和碘离子反应生成碘单质,过量的氯气能进一步氧化碘单质使试纸褪色,故判断实验②中生成了Cl2的依据是相同条件下,实验②的淀粉-KI试纸变色比实验①快。(5)题图中NaOH溶液的作用是吸收Cl2,防止污染空气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第一册
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
第1课时 氯气的性质
基础过关练
题组一 氯气的性质
1.(2024江西景德镇期中)某污水处理厂发生氯气泄漏事故,导致五百多人中毒。救援人员在现场的下列处理方法和过程较合理的是 ( )
①及时将人群逆风转移到地势较高的地方
②用高压水枪向空中喷洒饱和食盐水
③将泄漏氯气的钢瓶用生石灰掩埋
④及时清理现场,检查水源和食物等是否被污染
A.①③④ B.①②③
C.②④ D.①②③④
2.(易错题)(2024山东枣庄期中)下列实验现象描述中,正确的是 ( )
A.金属钠在氯气中燃烧,产生黄色的烟
B.铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒
C.氢气在氯气中燃烧的火焰为苍白色,瓶口有白色的烟生成
D.铜丝在氯气中燃烧产生棕黄色的烟,产物溶于水为蓝色溶液
3.(经典题)某同学用下列装置进行有关Cl2的实验,下列说法不正确的是 ( )
A.图Ⅰ中:实验现象证明干燥的氯气无漂白作用,潮湿的氯气有漂白作用
B.图Ⅱ中:闻Cl2的气味时应吸入足量氯气
C.图Ⅲ中:生成棕黄色的烟
D.图Ⅳ中:若气球膨胀,证明Cl2可与NaOH溶液反应
4.(2024山东泰安五地联考)某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为 ;铜与氯气反应的化学方程式为 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式: 、 。
(3)装置中空试管的作用是 。
(4)实验中,观察到紫色石蕊溶液颜色的变化为 。
(5)烧杯中氢氧化钠溶液的作用是 (用离子方程式表示)。
题组二 氯水的成分及性质分析
5.(经典题)(2024北京人大附中月考)在新制氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列关于新制氯水的说法不正确的是 ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈浅黄绿色,说明有Cl2分子存在
C.向新制氯水中加入纯碱,有气泡产生,说明新制氯水中含有H+
D.加入AgNO3溶液,出现白色沉淀,说明有Cl-存在
6.(2024山西大学附中期中)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是 ( )
A.该实验说明Cl2具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
7.(2024山东淄博期中)将一定量Cl2通过甲装置后,再通过放有湿润红色布条的乙装置,红色布条不褪色。甲装置中所盛试剂可能是 ( )
①浓硫酸 ②NaOH溶液 ③纯碱溶液
④饱和食盐水 ⑤KI溶液
A.①④⑤ B.①②③
C.②③④ D.②③⑤
题组三 漂白剂的制备及性质探究
8.(2024河北武强中学期中)工业上将氯气通入到石灰乳中制备漂白粉,制备流程如下。下列有关说法正确的是 ( )
A.漂白粉是混合物
B.“反应”中Cl2是氧化剂,石灰乳是还原剂
C.漂白粉配成溶液后必须加入盐酸才能制得具有漂白性的物质
D.工业制备漂白粉的离子方程式为2OH-+Cl2 Cl-+ClO-+H2O
9.(2024广东广州期中)常温下,氯气与烧碱溶液反应可制得“84”消毒液,NaClO是“84”消毒液的有效成分。
(1)化学品储藏室中存放Cl2容器上应贴的标签的名称为 (填字母)。
a.易燃品 b.爆炸品 c.有毒品
(2)氯气与烧碱溶液反应可制得“84”消毒液,该反应的离子方程式为 。
(3)将反应温度控制在70 ℃时,Cl2通入NaOH溶液中可以得到NaClO3、NaCl和水,反应的化学方程式为 。
(4)在一定条件下,把氯气通入NaOH溶液中,生成物中含有Cl-、ClO-、Cl三种含氯元素的离子,其中ClO-、Cl两种离子的数目与反应时间(t)的曲线如图所示。t1时开始有Cl生成的原因是 。在0~t2时间内,Cl2与NaOH反应的离子方程式为 。
能力提升练
题组一 氯及其化合物的转化及性质的综合考查
1.(2024河南新乡九师联盟月考)有关氯及其化合物,下列叙述正确的是 ( )
A.H2在纯净的Cl2中点燃会立即发生爆炸
B.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解
C.若发生Cl2泄漏,可用蘸有NaHCO3溶液的毛巾捂住口鼻向高处转移
D.漂白粉比HClO稳定,可露置在空气中长期保存
2.(易错题)(2024浙江强基联盟联考)已知卤素互化物(例如BrCl)、拟卤素[例如(CN)2]等物质的性质与Cl2单质相似,下列相关反应的化学方程式不正确的是( )
A.3BrCl+2Fe FeCl3+FeBr3
B.BrCl+H2O HBr+HClO
C.(CN)2+H2O HCN+HCNO
D.(CN)2+2KOH KCN+KCNO+H2O
3.(2024河北石家庄月考)常温下,A是可用来对自来水进行消毒的黄绿色气体单质,A、B、C、D、E都含X元素,其转化关系如图所示,部分产物已省略。
(1)请分别写出B、C、D、E的化学式(如为溶液请填溶质的化学式):B ,C ,D ,E 。
(2)写出A+H2O反应的化学方程式: 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的气体A应用NaOH溶液吸收,其反应的化学方程式为 。
(4)漂白粉的有效成分是 (填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为 ,次氯酸不稳定,次氯酸见光分解的化学方程式为 。
题组二 实验探究氯水及次氯酸盐的性质
4.(教材深研拓展)验证次氯酸光照分解的产物可设计成数字化实验。将pH传感器、氯离子传感器、氧气传感器分别与数据采集器、计算机连接,并将这三种传感器插入盛有氯水的广口瓶中,用强光照射氯水,测得的实验数据如图所示。下列说法正确的是 ( )
甲 乙
丙
A.图甲说明光照使氯水的酸性增强,新制氯水需避光保存
B.图乙说明氯水中Cl2在强光照射下逐渐被氧化为Cl-
C.图丙说明光照时HClO可能催化水分解产生O2
D.图甲、乙、丙说明新制氯水比久置氯水所含成分少
5.用饱和氯水与碳酸钙反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去。
②过滤,将滤液滴在有色布条上,发现滤液比饱和氯水的漂白性更强。
③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份滤液与澄清石灰水混合,立即产生大量白色沉淀;第二份滤液与稀盐酸混合,立即产生大量无色气体;对第三份滤液进行加热,看到滤液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。依据上述实验可推知,滤液中的溶质除CaCl2、HClO外,还有 ( )
A.Ca(ClO)2 B.CaCO3 C.Ca(HCO3)2 D.CaO
6.(2024广东广州二中期中)84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒。某兴趣小组对84消毒液的组成、性质与使用进行探究。
所用试剂:84消毒液(含NaClO)、医用酒精(CH3CH2OH体积分数为70%~75%)。
Ⅰ.探究84消毒液的成分
(1)实测该84消毒液pH=12.4(溶液呈碱性),能使pH试纸 ,因此其成分中,除了NaCl、NaClO,还含有少量 (填化学式)。
(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是 (用化学方程式表示)。
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是 。某游泳场,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长,该反应的化学方程式为 。
Ⅲ.探究84消毒液能否与医用酒精混用,实验装置如图所示
已知:KI是常见的还原剂;单质碘(I2)遇淀粉变蓝。
实验 液体A 液体B 现象
① 20 mL 84消毒液(pH=12.4) 20 mL 蒸馏水 溶液中无明显现象;溶液pH变为12.0;淀粉-KI试纸在8 min时变蓝,49 min时蓝色完全褪去
② 20 mL 84消毒液(pH=12.4) 20 mL 医用酒精 产生气泡,颜色无明显变化;溶液pH升高到13.1,淀粉-KI试纸在3 min时变蓝,21 min时蓝色完全褪去
(4)判断实验②中生成了Cl2的依据是 。
(5)图中NaOH溶液的作用是 。
结论:医用酒精可与84消毒液发生反应,二者不可混用。
答案与分层梯度式解析
基础过关练
1.A 2.D 3.B 5.A 6.B 7.D 8.A
1.A Cl2密度比空气大,Cl2发生泄漏时会集中在地势较低处,救援人员应及时将人群逆风转移到地势较高的地方,①正确;Cl2在饱和食盐水中的溶解量非常小,故不能用高压水枪向空中喷洒饱和食盐水来吸收氯气,②错误;潮湿的Cl2能与生石灰反应,救援人员可将泄漏Cl2的钢瓶用生石灰掩埋,以减少Cl2扩散到空气中,③正确;Cl2是有毒气体,故Cl2泄漏时,要及时清理现场,检查水源和食物等是否被污染,④正确。
2.D Na在Cl2中燃烧产生白烟,生成NaCl,A错误;铁丝在Cl2中燃烧,产生棕褐色的烟,B错误;H2在Cl2中燃烧,发出苍白色火焰,瓶口上方有白雾,C错误;Cu在Cl2中燃烧,产生棕黄色的烟,生成CuCl2,CuCl2溶于水,得到蓝色溶液,D正确。
易错分析 ①虽然钠的焰色呈黄色,但是Na在Cl2中燃烧产生的是白烟,注意二者的区别。②注意“烟”和“雾”的区别:固体的小颗粒均匀分散在空气中,得到的是烟;而液态物质的小液滴均匀分散在空气中得到的是雾。
3.B 湿润的有色布条褪色,说明潮湿的氯气具有漂白性,是因为Cl2与水反应生成的HClO具有漂白作用,A项正确;Cl2有毒,闻气味时用手轻轻在瓶口扇动,使极少量气体飘入鼻孔,B项错误;Cu丝在Cl2中燃烧生成棕黄色的烟,C项正确;若Cl2与NaOH溶液反应,烧瓶内气体压强迅速减小,外压大于内压,故气球会膨胀,D项正确。
4.答案 (1)先通入氯气排尽装置中的空气 Cu+Cl2 CuCl2
(2)Cl2+H2O HCl+HClO HCl+AgNO3 AgCl↓+HNO3
(3)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(4)先变红后褪色
(5)Cl2+2OH- Cl-+ClO-+H2O
解析 (1)为防止铜与空气中的O2反应,在加热前应先通入Cl2排尽装置中的空气。(2)在AgNO3溶液中,先是Cl2与水反应生成HCl和HClO,HCl再与AgNO3反应生成AgCl白色沉淀,其化学方程式分别为Cl2+H2O HCl+HClO、HCl+AgNO3 AgCl↓+HNO3。(3)装置中空试管可防止右侧试管中的水倒吸入硬质玻璃管中,引起硬质玻璃管炸裂。(4)Cl2与石蕊溶液中的水发生反应Cl2+H2O HCl+HClO,溶液呈酸性,紫色石蕊溶液变红,但HClO有漂白性,又能使溶液褪色,故可看到紫色石蕊溶液先变红后褪色。(5)Cl2有毒,可用NaOH溶液吸收多余的Cl2,其离子方程式为Cl2+2OH- Cl-+ClO-+H2O。
5.A 新制氯水中含Cl2、H2O、HClO、Cl-、H+、OH-、ClO-,能使有色布条褪色的是HClO,A错误;Cl2为黄绿色气体,溶于水后溶液呈浅黄绿色,B正确;向新制氯水中加入纯碱产生气泡,说明H+与C反应有CO2生成,C正确;新制氯水中加入AgNO3溶液出现白色沉淀,说明有Cl-存在,D正确。
6.B HClO具有漂白性,Cl2无漂白性,A错误;滴加新制氯水的区域变白色,而周围变成浅红色,可说明H+的扩散速度比HClO分子快,B正确;HClO的漂白持久、稳定,加热实验后的pH试纸,试纸不会恢复原来的颜色,C错误;久置的氯水中主要成分为HCl,无漂白性,D错误。
7.D 浓硫酸具有吸水性,所以通过甲装置后氯气为干燥氯气,而干燥氯气与湿润红色布条中的水反应能生成次氯酸,所以红色布条褪色,①不符合题意;NaOH溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,②符合题意;纯碱溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,③符合题意;饱和食盐水不能吸收氯气,所以通过甲装置后,再通过放有湿润红色布条的乙装置,红色布条褪色,④不符合题意;KI具有还原性,KI溶液能够吸收氯气,所以通过甲装置后,氯气被吸收,再通过放有湿润红色布条的乙装置,红色布条不褪色,⑤符合题意;故选D。
8.A 漂白粉的主要成分是CaCl2和Ca(ClO)2,属于混合物,A正确;“反应”的化学方程式为2Ca(OH)2+2Cl2 CaCl2+Ca(ClO)2+2H2O,Cl2既是氧化剂又是还原剂,B错误;漂白粉配成溶液后,遇到空气中的CO2,可生成次氯酸,C错误;工业制备漂白粉过程加入的是石灰乳,在书写离子方程式时应写化学式,D错误。
知识拓展 Cl2与石灰乳或NaOH溶液的反应中,Cl2既是氧化剂又是还原剂。漂白粉露置在空气中易变质:Ca(ClO)2+CO2+H2O CaCO3+2HClO,2HClO 2HCl+O2↑,故漂白粉需密闭保存。
9.答案 (1)c (2)Cl2+2OH- Cl-+ClO-+H2O
(3)3Cl2+6NaOH NaClO3+5NaCl+3H2O
(4)反应放热,溶液温度升高,在较高温度下有Cl+7Cl-+5H2O
解析 (1)Cl2是有毒的气体,故存放Cl2的容器上应贴有毒品的标签。(2)氯气与烧碱溶液反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O,离子方程式为Cl2+2OH- Cl-+ClO-+H2O。(3)在70 ℃时,Cl2与NaOH反应生成NaClO3、NaCl和H2O,该反应的化学方程式为3Cl2+6NaOH NaClO3+5NaCl+3H2O。(4)Cl2与NaOH在常温下反应有NaClO生成,在70 ℃时有Cl生成,在t1时开始反应生成NaClO3,是因为随着反应进行,溶液温度升高,在较高温度下有Cl生成。在0~t2时间内,Cl2与NaOH反应生成ClO-、Cl的离子数目之比为2∶1,即生成物中ClO-、Cl化学计量数之比为2∶1,结合得失电子守恒、电荷守恒、原子守恒可写出Cl2与NaOH反应的离子方程式为5Cl2+10OH- 2ClO-+Cl+7Cl-+5H2O。
能力提升练
1.C 2.B 4.A 5.C
1.C H2能在Cl2中安静地燃烧,若和Cl2光照会发生爆炸,A错误;洁厕灵中含有盐酸,“84”消毒液中含有NaClO,这两种溶液混合会发生氧化还原反应产生有毒的Cl2,B错误;Cl2有毒且密度比空气大,Cl2能与NaHCO3溶液反应,故若发生Cl2泄漏,可用蘸有NaHCO3溶液的毛巾捂住口鼻并向高处转移,C正确;漂白粉易和空气中的CO2、水蒸气等反应而变质,故漂白粉需密闭保存,以防止在空气中变质失效,D错误。
2.B 在BrCl中Br为+1价,Cl为-1价,由得失电子守恒可知BrCl与Fe的反应为3BrCl+2Fe FeCl3+FeBr3,A正确;BrCl与H2O的反应为BrCl+H2O HBrO+HCl,B错误;(CN)2与Cl2性质相似,则(CN)2与水的反应为(CN)2+H2O HCN+HCNO,C正确;结合Cl2与NaOH的反应,可写出(CN)2与KOH的反应为(CN)2+2KOH KCN+KCNO+H2O,D正确。
易错分析 联想Cl2的相关反应,判断题中化学方程式的正误,尤其要注意卤素互化物中各元素价态不同,与Cl2的性质不完全相同,如BrCl与水的反应不是氧化还原反应。
3.答案 (1)HClO NaCl HCl NaClO
(2)Cl2+H2O HCl+HClO
(3)Cl2+2NaOH NaCl+NaClO+H2O
(4)Ca(ClO)2 Ca(ClO)2+CO2+H2O CaCO3↓+2HClO 2HClO 2HCl+O2↑
解析 (1)常温下,A是可用来对自来水进行消毒的黄绿色气体单质,则A为Cl2,A、B、C、D、E都含X元素,由转化关系可知B为HClO,D为HCl,C为NaCl,E为NaClO。
(2)A为Cl2,Cl2与H2O反应的化学方程式为Cl2+H2O HCl+HClO。
(3)Cl2与NaOH反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
(4)漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,与空气中的CO2反应,有HClO生成,化学方程式为Ca(ClO)2+CO2+H2O CaCO2↓+2HClO;次氯酸见光分解的化学方程式为2HClO 2HCl+O2↑。
4.A 由图甲可知光照后溶液的pH减小,即溶液中H+浓度增大,溶液酸性增强,故新制氯水需避光保存,A正确;由图乙可知在强光照射下,氯水中Cl2逐渐被还原为Cl-,B错误;由图丙可知光照可促使氯水中HClO分解,而不是催化水分解,C错误;新制氯水中含三分子四离子,久置氯水中只含H2O、H+、Cl-、OH-,故新制氯水所含成分比久置氯水多,D错误。
方法点津 结合图甲溶液的pH减小,则溶液中H+浓度增大,图乙溶液中Cl-浓度增大,图丙溶液中O2的体积分数增大,可说明光照时,加快了HClO的分解,即2HClO 2HCl+O2↑,溶液酸性变强,溶液中H+、Cl-浓度均增大,O2的体积分数也增大。
5.C 结合本题信息,可对该实验进行如下梳理:
结合前两份滤液的反应,可知滤液中可能含C;再结合第三份滤液中的反应并联想NaHCO3受热易分解,参考四个选项可知滤液中应该含有Ca(HCO3)2,C项正确。
解题指导 ①C均能与盐酸反应生成CO2气体;均能与澄清石灰水反应生成白色沉淀,其离子方程式分别为C。②结合NaHCO3受热易分解可联想碳酸氢盐受热易分解。
6.答案 (1)先变蓝后褪色 NaOH
(2)2HClO 2HCl+O2↑
(3)ClO-具有氧化性 NaClO+H2O2 H2O+NaCl+O2↑
(4)相同条件下,实验②的淀粉-KI试纸变色比实验①快
(5)吸收Cl2,防止污染空气
解析 (1)84消毒液显碱性且消毒液具有漂白性,故pH试纸先变蓝后褪色,84消毒液是氢氧化钠溶液吸收氯气制成的,溶液显碱性,则其成分中除了NaCl、NaClO,还含有少量氢氧化钠。(2)NaClO与空气中的水蒸气、CO2反应有HClO生成,HClO具有强氧化性,消毒效果增强;HClO不稳定,见光分解导致消毒效果降低,化学方程式为2HClO 2HCl+O2↑。(3)ClO-具有氧化性,84消毒液中含ClO-,故84消毒液具有氧化性;NaClO与H2O2反应产生O2,化学方程式为NaClO+H2O2 H2O+NaCl+O2↑。(4)氯气能和碘离子反应生成碘单质,过量的氯气能进一步氧化碘单质使试纸褪色,故判断实验②中生成了Cl2的依据是相同条件下,实验②的淀粉-KI试纸变色比实验①快。(5)题图中NaOH溶液的作用是吸收Cl2,防止污染空气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
