2025人教版高中化学必修第一册同步练习题--第2课时 气体摩尔体积(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第一册同步练习题--第2课时 气体摩尔体积(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 336.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 12:31:48 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第一册
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第2课时 气体摩尔体积
基础过关练
题组一 决定气体体积的因素
1.(2023四川泸州期末)当外界温度、压强一定时,决定气体体积的主要因素是 ( )
A.分子半径 B.分子间距离
C.相对分子质量 D.分子数目
2.(经典题)(2024福建福州延安中学期中)如图是1 mol水由4 ℃转化成100 ℃水蒸气时体积的变化。
由图分析下列关于决定物质体积的因素的说法,不正确的是 ( )
A.物质的体积取决于粒子数目、粒子大小和粒子间距离
B.相同条件下,粒子数相同的任何气体都具有相同体积
C.同温同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小、温度越高,气体所占体积越大
题组二 正确理解气体摩尔体积
3.(易错题)(2024辽宁朝阳建平实验中学月考)下列有关气体摩尔体积的描述中正确的是 ( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4 L/mol
C.标准状况下的气体摩尔体积约为22.4 L
D.标准状况下,1 mol任何物质所占的体积都约是22.4 L
4.(2024山东东营河口一中月考)下列说法中正确的是 ( )
A.同温同压下,气体的摩尔体积都约是22.4 L/mol
B.标准状况下,1 L HCl和1 L H2O的物质的量相同
C.标准状况下,1 g N2和1 g CO所占的体积相同
D.常温常压下,22.4 L CO2中含有6.02×1023个CO2分子
5.(2023广西钦州浦北中学期中)一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是 ( )
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4 L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1 mol O2在该条件下的体积为30 L
题组三 与气体摩尔体积相关的计算
6.(经典题)(2023山东新泰一中期中)有一种气体的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是 ( )
A.28.4 B.28.4 g·mol-1
C.71 D.71 g·mol-1
7.在标准状况下,向一质量为100 g的密闭容器中充满CO2后,质量为166 g,相同条件下,向相同的容器中充满一未知气体,称量得其质量为142 g,则该气体可能为 ( )
A.O2 B.CH4 C.CO D.H2
8.(2024河南济源期末)在一定条件下,某化合物X受热分解:2X A↑+2B↑+4C↑,测得反应后生成的混合气体在标准状况下的密度为
1.0 g/L。则在相同条件下,X的相对分子质量是 ( )
A.11.43 B.78.4
C.122.86 D.160.02
9.(2023河北石家庄第二十七中学期末)下列相关的计算正确的是 ( )
A.NO、NO2、O3三种气体均含有1 mol O,则三种气体的体积之比为6∶3∶2
B.标准状况下,n L Cl2中有m个Cl原子,则阿伏加德罗常数的数值NA可表示为
C.标准状况下,11.2 L X气体的质量为16 g,则X气体的摩尔质量是32 g
D.在25 ℃和101 kPa的条件下,28 g CO和22.4 L CO2中含有的碳原子数一定相等
10.(2024安徽安庆七中期中)现有m g X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 mol。
(2)一个X原子的质量为 g。
(3)该气体在标准状况下的体积为 L。
(4)相同状况下,若X2与氮气以体积比为1∶4混合,该混合气体相对氢气密度为14.4,则X2的相对分子质量为 。
(5)若标准状况下X2的密度为1.25 g/L,则X原子最外层有 个电子。
11.CO和CO2的混合气体18 g,与过量的O2充分反应后测得CO2体积为11.2 L(标准状况)。
(1)原混合气体中CO的质量是 g;
(2)原混合气体中CO2在标准状况下的体积是 L;
(3)原混合气体在标准状况下的密度是 g·L-1;
(4)原混合气体的平均摩尔质量是 g·mol-1。
题组四 阿伏加德罗定律及其推论
12.(经典题)如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是 ( )
A.所含原子数相等
B.气体密度相等
C.气体质量相等
D.摩尔质量相等
13.(2024湖北孝感部分学校期中)同温同压下,等质量的O2和O3两种气体相比较,下列叙述错误的是 ( )
A.体积之比为3∶2
B.密度之比为2∶3
C.原子个数之比为1∶1
D.分子个数之比为1∶1
14.(2024广东韶关月考)下列两种气体的分子数一定相等的是 ( )
A.等压等体积的N2和CO2
B.等温等体积的O2和N2
C.质量相等,密度不等的N2和CO
D.等体积等密度的CO2和C2H4
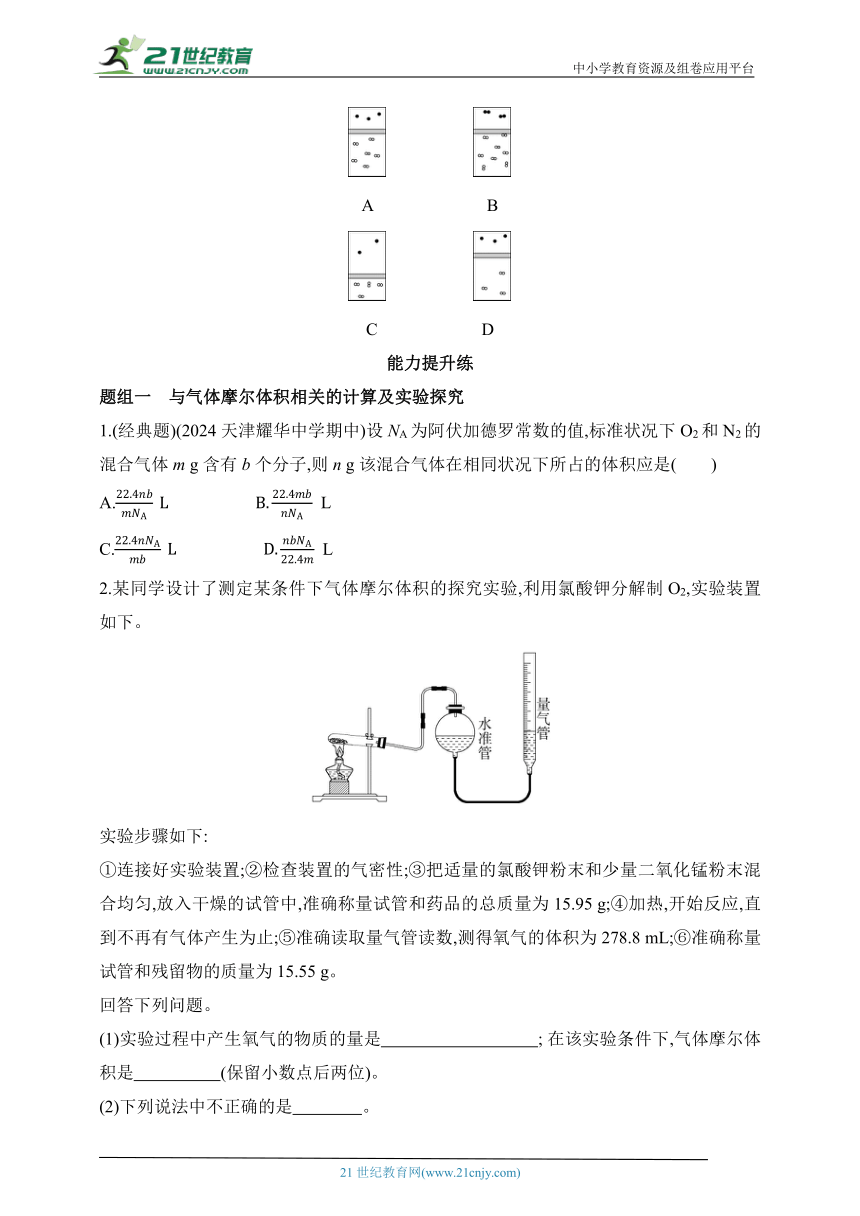
15.(2024广西南宁十四中月考)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的H2与He的是( )
A B
C D
能力提升练
题组一 与气体摩尔体积相关的计算及实验探究
1.(经典题)(2024天津耀华中学期中)设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
A. L
C. L
2.某同学设计了测定某条件下气体摩尔体积的探究实验,利用氯酸钾分解制O2,实验装置如下。
实验步骤如下:
①连接好实验装置;②检查装置的气密性;③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g;④加热,开始反应,直到不再有气体产生为止;⑤准确读取量气管读数,测得氧气的体积为278.8 mL;⑥准确称量试管和残留物的质量为15.55 g。
回答下列问题。
(1)实验过程中产生氧气的物质的量是 ; 在该实验条件下,气体摩尔体积是 (保留小数点后两位)。
(2)下列说法中不正确的是 。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为67.14 L/mol
C.同温、同压下,2 mol O2与2 mol CO和CO2的混合气体的体积相同
D.该实验条件下,O2的密度为1.429 g/L
题组二 阿伏加德罗定律及其推论的应用
3.(经典题)(2024浙江衢温5+1联盟期中)关于阿伏加德罗定律及其推论,下列说法正确的是( )
A.同温同压下,相同体积的任何物质都具有相同数目的分子
B.不同温度下,16.0 g O2和16.0 g O3含有的原子数相等
C.同温同压下,相同质量的二氧化碳与氢气的体积之比为22∶1
D.常温下,相同体积、相同质量的氧气与氢气的压强之比为16∶1
4.(2024河北邯郸八校期中)常温常压下,将等质量的氦气、甲烷、二氧化碳分别充入3个同样规格的气球中,下列各物理量的大小比较不正确的是 ( )
A.气球体积:V(He)>V(CH4)>V(CO2)
B.原子数目:N(He)>N(CH4)>N(CO2)
C.气体密度:ρ(CO2)>ρ(CH4)>ρ(He)
D.分子数目:N(He)>N(CH4)>N(CO2)
5.(2023河南洛阳期中)常温时在刚性容器内部有一个可滑动的活塞将容器分成左右两室。左室充入1 mol N2,右室充入H2和O2的混合气体,活塞恰好停留在容器左侧四分之一处(如图),然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞恰好停在容器的中间,忽略水的体积,下列说法错误的是( )
A.反应前,右室充入H2与O2共3 mol
B.反应完毕后,恢复至原来温度,左室的压强变为原来的一半
C.反应完毕后,右室剩余气体中含有1 mol原子
D.反应前,H2与O2的体积比是4∶5或7∶2
答案与分层梯度式解析
基础过关练
1.D 2.C 3.A 4.C 5.A 6.D 7.C 8.B
9.B 12.A 13.D 14.C 15.A
1.D 当外界温度、压强一定时,气体分子间距离基本固定,则决定气体体积的主要因素是分子数目。
2.C 从微观角度来说,物质体积由粒子数、粒子大小和粒子间距离共同决定,A正确;相同条件下,粒子数相同的气体的物质的量相同,体积也相同,B正确;该结论只适用于气态物质,C错误;等质量的H2,压强越小、温度越高,气体分子间距离越大,则气体体积越大,D正确。
3.A 标准状况下气体摩尔体积约为22.4 L/mol,即标准状况下1 mol任何气体(易错点)的体积都约为22.4 L。
4.C 标准状况下,气体摩尔体积约为22.4 L/mol,A错误;标准状况下,H2O不是气体,1 L HCl和1 L H2O的物质的量不同,B错误;标准状况下,1 g N2和1 g CO的物质的量相同,则两者体积相同,C正确;常温常压下,22.4 L CO2的物质的量不是1 mol,D错误。
名师点津 标准状况下,气体摩尔体积Vm=22.4 L/mol;但Vm=22.4 L/mol时不一定处于标准状况下;标准状况下,Vm=22.4 L/mol不适用于液态或固态物质。
5.A 该温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,即1 mol该气体的体积为30 L,因此温度和压强不是标准状况,A错误;该气体的物质的量为1 mol,若该气体在标准状况下为气体,则其体积约为22.4 L,B正确;1 mol该气体含有1.204×1024个原子,则1个该气体分子中含有原子个数为=2,C正确;1 mol该气体在该条件下为30 L,由此可知该条件下气体摩尔体积为30 L/mol,故若O2在该条件下为气态,则1 mol O2在该条件下的体积为30 L,D正确。
6.D 标准状况下4.48 L气体的物质的量为=0.2 mol,其质量为14.2 g,则该气体的摩尔质量是=71 g·mol-1。
7.C n(CO2)==1.5 mol,相同条件下,体积相等的不同气体,其物质的量相等,所以未知气体的物质的量是1.5 mol,其摩尔质量==28 g/mol,题给几种气体中只有CO的摩尔质量是28 g/mol。
8.B 反应后混合气体的=ρVm=1.0 g/L×22.4 L/mol=22.4 g/mol。根据题中反应的化学方程式可知X与生成物的物质的量之比为2∶7,可求出X的摩尔质量M(X)= g/mol=78.4 g/mol,故X的相对分子质量为78.4。
9.B 含1 mol O的NO、NO2、O3的物质的量分别是1 mol、 mol,三者物质的量之比为6∶3∶2,没有指明温度和压强,无法计算体积之比,A错误;标准状况下,n L Cl2的物质的量为 mol,含Cl原子数为×NA×2=m,NA=,B正确;摩尔质量的单位为g·mol-1,C错误;在25 ℃和101 kPa的条件下,气体摩尔体积大于22.4 L/mol,28 g CO即1 mol CO和22.4 L CO2中含有的碳原子数不相等,D错误。
10.答案 (1) (2) (3) (4)32 (5)5
解析 (1)该气体的物质的量为 mol。(2)由摩尔质量可知1个分子的质量为 g,而该分子是双原子分子,则1个X原子的质量为 g。(3)该气体在标准状况下的体积为 L。(4)根据混合气体相对H2密度为14.4,可知混合气体的平均相对分子质量为14.4×2=28.8,由相同状况下X2与N2的体积比为1∶4,可知其物质的量之比为1∶4,则=28.8 g/mol,解得M(X2)=32,故X2的相对分子质量为32。(5)标准状况下X2的摩尔质量为1.25 g/L×22.4 L/mol=28 g/mol,即X的相对原子质量为14,X为N原子,其最外层电子数为5。
11.答案 (1)7 (2)5.6 (3)1.61 (4)36
解析 CO发生反应:2CO+O2 2CO2,CO的体积与生成CO2的体积相等,与O2充分反应后CO2的总体积为11.2 L,故在标准状况下,18 g CO和CO2的混合气体的总体积为11.2 L,其物质的量为0.5 mol,设CO的物质的量为x mol,CO2的物质的量为y mol,则,解得x=0.25,y=0.25。
(1)原混合气体中CO的质量=28 g·mol-1×0.25 mol=7 g。
(2)原混合气体中,CO2在标准状况下的体积为0.25 mol×22.4 L·mol-1=5.6 L。
(3)原混合气体的密度=≈1.61 g·L-1。
(4)解法一:=ρ(标准状况)·22.4 L·mol-1=1.61 g·L-1×22.4 L·mol-1≈36 g·mol-1;
解法二:=36 g·mol-1;
解法三:=28 g·mol-1×50%+44 g·mol-1×50%=36 g·mol-1。
12.A 两瓶气体所处的温度和压强相同,二者体积也相同,则分子数相同,即两瓶气体的物质的量相同,又因两瓶所盛气体都是双原子分子,原子数相等,A正确;因N2和O2的混合比例不确定,所以混合气体的质量、密度、摩尔质量不确定,B、C、D错误。
技巧点拨 首先根据阿伏加德罗定律推出两瓶中气体分子数相等,然后再分析每个分子中所含原子数目。
13.D 设气体的质量均为m g,则O2和O3的物质的量之比为=3∶2,体积与物质的量成正比,即体积之比为3∶2,A正确;同温同压下,密度与摩尔质量成正比,即密度之比为32∶48=2∶3,B正确;根据物质的量之比为3∶2,则原子个数之比为(3×2)∶(2×3)=1∶1,C正确;分子数和物质的量成正比,即分子数之比为3∶2,D错误。
14.C A项,温度不确定,无法确定气体摩尔体积及物质的量,即分子数无法确定,错误;B项,压强不确定,无法确定气体摩尔体积及物质的量,即分子数无法确定,错误;C项,根据质量、摩尔质量相等,可确定N2和CO的物质的量相等,即分子数相等,正确;D项,二者的质量相等,但摩尔质量不同,两气体的物质的量不同,则分子数不同,错误。
15.A H2是双原子分子,He是单原子分子,B不正确。He的相对分子质量是H2的2倍,所以等质量的H2和He,H2的物质的量是He的2倍,在相同条件下,气体的物质的量与体积成正比,A正确,C、D不正确。
能力提升练
1.A 3.B 4.B 5.C
1.A 解法一:根据气体的质量与分子数成正比,设n g混合气体的分子数为x,即m g∶b=n g∶x,解得x=,混合气体的物质的量为 mol,在标准状况下的体积为 L。
解法二:设混合气体的摩尔质量为M g/mol,根据正比关系,解得M=,则n g混合气体的物质的量为 mol,在标准状况下的体积为 L。
2.答案 (1)0.012 5 mol 22.30 L/mol
(2)BD
解析 (1)生成的氧气的质量为15.95 g-15.55 g=0.4 g,氧气的物质的量为=0.012 5 mol,Vm=≈22.30 L/mol。
(2)在其他条件不变的情况下,气体温度越高,其体积越大,气体摩尔体积越大,因此气体摩尔体积与气体的温度相关,A正确;该条件下气体摩尔体积为22.30 L/mol,B错误;同温、同压下,物质的量相同的气体体积相等,所以2 mol O2与2 mol CO和CO2的混合气体的体积相同,C正确;该实验条件下,1 mol O2的体积为22.30 L,质量为32 g,则密度为≈1.435 g/L,D错误。
3.B A项,阿伏加德罗定律及其推论只适用于气体,错误;B项,两气体均由O原子构成,气体质量相同,O原子的物质的量相同,则氧原子数相同,正确;C项,设气体质量均为1 g,则CO2、H2的物质的量之比为=1∶22,由同温同压下体积之比等于物质的量之比可知,体积之比为1∶22,错误;D项,设气体质量均为1 g,O2与H2的物质的量之比为=1∶16,同温同体积下气体压强之比等于物质的量之比,即压强之比为1∶16,错误。
4.B 设气体的质量均为1 g,则He、CH4、CO2的物质的量之比为=44∶11∶4。同温同压下,气体的体积与物质的量成正比,即V(He)>V(CH4)>V(CO2),A正确;He、CH4、CO2气体的原子数目之比为(44×1)∶(11×5)∶(4×3)=44∶55∶12,则气体的原子数目:N(CH4)>N(He)>N(CO2),B错误;同温同压下,气体的密度与摩尔质量成正比,即He、CH4、CO2的密度之比为4∶16∶44,则气体密度ρ(CO2)>ρ(CH4)>ρ(He),C正确;分子数目与物质的量成正比,即He、CH4、CO2分子数目之比为44∶11∶4,则分子数目:N(He)>N(CH4)>N(CO2),D正确。
5.C 常温下,可滑动的活塞将容器分成左右两室,左右两室压强相等,温度、压强相等时,气体的体积之比等于物质的量之比,则右室充入H2与O2的混合气体为3 mol,A正确。反应完毕后,恢复至原来温度,左室的体积变为原来的二倍,压强变为原来的一半,B正确。反应完结后恢复至原来的温度,活塞恰好停在中间,说明氮气和右室剩余气体的物质的量相等,右室剩余1 mol气体,含有2 mol原子,C错误。剩余气体的物质的量为1 mol,2H2+O2 2H2O,假设氢气完全反应,则n(H2)= mol,n(O2)=3 mol- mol,氢气和氧气体积之比为 mol=4∶5;假设氧气完全反应,则n(O2)= mol,n(H2)=3 mol- mol,所以氢气和氧气的体积之比为 mol=7∶2,反应前H2与O2的体积比为4∶5或7∶2,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第一册
第二章 海水中的重要元素——钠和氯
第三节 物质的量
第2课时 气体摩尔体积
基础过关练
题组一 决定气体体积的因素
1.(2023四川泸州期末)当外界温度、压强一定时,决定气体体积的主要因素是 ( )
A.分子半径 B.分子间距离
C.相对分子质量 D.分子数目
2.(经典题)(2024福建福州延安中学期中)如图是1 mol水由4 ℃转化成100 ℃水蒸气时体积的变化。
由图分析下列关于决定物质体积的因素的说法,不正确的是 ( )
A.物质的体积取决于粒子数目、粒子大小和粒子间距离
B.相同条件下,粒子数相同的任何气体都具有相同体积
C.同温同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小、温度越高,气体所占体积越大
题组二 正确理解气体摩尔体积
3.(易错题)(2024辽宁朝阳建平实验中学月考)下列有关气体摩尔体积的描述中正确的是 ( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4 L/mol
C.标准状况下的气体摩尔体积约为22.4 L
D.标准状况下,1 mol任何物质所占的体积都约是22.4 L
4.(2024山东东营河口一中月考)下列说法中正确的是 ( )
A.同温同压下,气体的摩尔体积都约是22.4 L/mol
B.标准状况下,1 L HCl和1 L H2O的物质的量相同
C.标准状况下,1 g N2和1 g CO所占的体积相同
D.常温常压下,22.4 L CO2中含有6.02×1023个CO2分子
5.(2023广西钦州浦北中学期中)一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是 ( )
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4 L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1 mol O2在该条件下的体积为30 L
题组三 与气体摩尔体积相关的计算
6.(经典题)(2023山东新泰一中期中)有一种气体的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是 ( )
A.28.4 B.28.4 g·mol-1
C.71 D.71 g·mol-1
7.在标准状况下,向一质量为100 g的密闭容器中充满CO2后,质量为166 g,相同条件下,向相同的容器中充满一未知气体,称量得其质量为142 g,则该气体可能为 ( )
A.O2 B.CH4 C.CO D.H2
8.(2024河南济源期末)在一定条件下,某化合物X受热分解:2X A↑+2B↑+4C↑,测得反应后生成的混合气体在标准状况下的密度为
1.0 g/L。则在相同条件下,X的相对分子质量是 ( )
A.11.43 B.78.4
C.122.86 D.160.02
9.(2023河北石家庄第二十七中学期末)下列相关的计算正确的是 ( )
A.NO、NO2、O3三种气体均含有1 mol O,则三种气体的体积之比为6∶3∶2
B.标准状况下,n L Cl2中有m个Cl原子,则阿伏加德罗常数的数值NA可表示为
C.标准状况下,11.2 L X气体的质量为16 g,则X气体的摩尔质量是32 g
D.在25 ℃和101 kPa的条件下,28 g CO和22.4 L CO2中含有的碳原子数一定相等
10.(2024安徽安庆七中期中)现有m g X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 mol。
(2)一个X原子的质量为 g。
(3)该气体在标准状况下的体积为 L。
(4)相同状况下,若X2与氮气以体积比为1∶4混合,该混合气体相对氢气密度为14.4,则X2的相对分子质量为 。
(5)若标准状况下X2的密度为1.25 g/L,则X原子最外层有 个电子。
11.CO和CO2的混合气体18 g,与过量的O2充分反应后测得CO2体积为11.2 L(标准状况)。
(1)原混合气体中CO的质量是 g;
(2)原混合气体中CO2在标准状况下的体积是 L;
(3)原混合气体在标准状况下的密度是 g·L-1;
(4)原混合气体的平均摩尔质量是 g·mol-1。
题组四 阿伏加德罗定律及其推论
12.(经典题)如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是 ( )
A.所含原子数相等
B.气体密度相等
C.气体质量相等
D.摩尔质量相等
13.(2024湖北孝感部分学校期中)同温同压下,等质量的O2和O3两种气体相比较,下列叙述错误的是 ( )
A.体积之比为3∶2
B.密度之比为2∶3
C.原子个数之比为1∶1
D.分子个数之比为1∶1
14.(2024广东韶关月考)下列两种气体的分子数一定相等的是 ( )
A.等压等体积的N2和CO2
B.等温等体积的O2和N2
C.质量相等,密度不等的N2和CO
D.等体积等密度的CO2和C2H4
15.(2024广西南宁十四中月考)下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的H2与He的是( )
A B
C D
能力提升练
题组一 与气体摩尔体积相关的计算及实验探究
1.(经典题)(2024天津耀华中学期中)设NA为阿伏加德罗常数的值,标准状况下O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
A. L
C. L
2.某同学设计了测定某条件下气体摩尔体积的探究实验,利用氯酸钾分解制O2,实验装置如下。
实验步骤如下:
①连接好实验装置;②检查装置的气密性;③把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g;④加热,开始反应,直到不再有气体产生为止;⑤准确读取量气管读数,测得氧气的体积为278.8 mL;⑥准确称量试管和残留物的质量为15.55 g。
回答下列问题。
(1)实验过程中产生氧气的物质的量是 ; 在该实验条件下,气体摩尔体积是 (保留小数点后两位)。
(2)下列说法中不正确的是 。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为67.14 L/mol
C.同温、同压下,2 mol O2与2 mol CO和CO2的混合气体的体积相同
D.该实验条件下,O2的密度为1.429 g/L
题组二 阿伏加德罗定律及其推论的应用
3.(经典题)(2024浙江衢温5+1联盟期中)关于阿伏加德罗定律及其推论,下列说法正确的是( )
A.同温同压下,相同体积的任何物质都具有相同数目的分子
B.不同温度下,16.0 g O2和16.0 g O3含有的原子数相等
C.同温同压下,相同质量的二氧化碳与氢气的体积之比为22∶1
D.常温下,相同体积、相同质量的氧气与氢气的压强之比为16∶1
4.(2024河北邯郸八校期中)常温常压下,将等质量的氦气、甲烷、二氧化碳分别充入3个同样规格的气球中,下列各物理量的大小比较不正确的是 ( )
A.气球体积:V(He)>V(CH4)>V(CO2)
B.原子数目:N(He)>N(CH4)>N(CO2)
C.气体密度:ρ(CO2)>ρ(CH4)>ρ(He)
D.分子数目:N(He)>N(CH4)>N(CO2)
5.(2023河南洛阳期中)常温时在刚性容器内部有一个可滑动的活塞将容器分成左右两室。左室充入1 mol N2,右室充入H2和O2的混合气体,活塞恰好停留在容器左侧四分之一处(如图),然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞恰好停在容器的中间,忽略水的体积,下列说法错误的是( )
A.反应前,右室充入H2与O2共3 mol
B.反应完毕后,恢复至原来温度,左室的压强变为原来的一半
C.反应完毕后,右室剩余气体中含有1 mol原子
D.反应前,H2与O2的体积比是4∶5或7∶2
答案与分层梯度式解析
基础过关练
1.D 2.C 3.A 4.C 5.A 6.D 7.C 8.B
9.B 12.A 13.D 14.C 15.A
1.D 当外界温度、压强一定时,气体分子间距离基本固定,则决定气体体积的主要因素是分子数目。
2.C 从微观角度来说,物质体积由粒子数、粒子大小和粒子间距离共同决定,A正确;相同条件下,粒子数相同的气体的物质的量相同,体积也相同,B正确;该结论只适用于气态物质,C错误;等质量的H2,压强越小、温度越高,气体分子间距离越大,则气体体积越大,D正确。
3.A 标准状况下气体摩尔体积约为22.4 L/mol,即标准状况下1 mol任何气体(易错点)的体积都约为22.4 L。
4.C 标准状况下,气体摩尔体积约为22.4 L/mol,A错误;标准状况下,H2O不是气体,1 L HCl和1 L H2O的物质的量不同,B错误;标准状况下,1 g N2和1 g CO的物质的量相同,则两者体积相同,C正确;常温常压下,22.4 L CO2的物质的量不是1 mol,D错误。
名师点津 标准状况下,气体摩尔体积Vm=22.4 L/mol;但Vm=22.4 L/mol时不一定处于标准状况下;标准状况下,Vm=22.4 L/mol不适用于液态或固态物质。
5.A 该温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,即1 mol该气体的体积为30 L,因此温度和压强不是标准状况,A错误;该气体的物质的量为1 mol,若该气体在标准状况下为气体,则其体积约为22.4 L,B正确;1 mol该气体含有1.204×1024个原子,则1个该气体分子中含有原子个数为=2,C正确;1 mol该气体在该条件下为30 L,由此可知该条件下气体摩尔体积为30 L/mol,故若O2在该条件下为气态,则1 mol O2在该条件下的体积为30 L,D正确。
6.D 标准状况下4.48 L气体的物质的量为=0.2 mol,其质量为14.2 g,则该气体的摩尔质量是=71 g·mol-1。
7.C n(CO2)==1.5 mol,相同条件下,体积相等的不同气体,其物质的量相等,所以未知气体的物质的量是1.5 mol,其摩尔质量==28 g/mol,题给几种气体中只有CO的摩尔质量是28 g/mol。
8.B 反应后混合气体的=ρVm=1.0 g/L×22.4 L/mol=22.4 g/mol。根据题中反应的化学方程式可知X与生成物的物质的量之比为2∶7,可求出X的摩尔质量M(X)= g/mol=78.4 g/mol,故X的相对分子质量为78.4。
9.B 含1 mol O的NO、NO2、O3的物质的量分别是1 mol、 mol,三者物质的量之比为6∶3∶2,没有指明温度和压强,无法计算体积之比,A错误;标准状况下,n L Cl2的物质的量为 mol,含Cl原子数为×NA×2=m,NA=,B正确;摩尔质量的单位为g·mol-1,C错误;在25 ℃和101 kPa的条件下,气体摩尔体积大于22.4 L/mol,28 g CO即1 mol CO和22.4 L CO2中含有的碳原子数不相等,D错误。
10.答案 (1) (2) (3) (4)32 (5)5
解析 (1)该气体的物质的量为 mol。(2)由摩尔质量可知1个分子的质量为 g,而该分子是双原子分子,则1个X原子的质量为 g。(3)该气体在标准状况下的体积为 L。(4)根据混合气体相对H2密度为14.4,可知混合气体的平均相对分子质量为14.4×2=28.8,由相同状况下X2与N2的体积比为1∶4,可知其物质的量之比为1∶4,则=28.8 g/mol,解得M(X2)=32,故X2的相对分子质量为32。(5)标准状况下X2的摩尔质量为1.25 g/L×22.4 L/mol=28 g/mol,即X的相对原子质量为14,X为N原子,其最外层电子数为5。
11.答案 (1)7 (2)5.6 (3)1.61 (4)36
解析 CO发生反应:2CO+O2 2CO2,CO的体积与生成CO2的体积相等,与O2充分反应后CO2的总体积为11.2 L,故在标准状况下,18 g CO和CO2的混合气体的总体积为11.2 L,其物质的量为0.5 mol,设CO的物质的量为x mol,CO2的物质的量为y mol,则,解得x=0.25,y=0.25。
(1)原混合气体中CO的质量=28 g·mol-1×0.25 mol=7 g。
(2)原混合气体中,CO2在标准状况下的体积为0.25 mol×22.4 L·mol-1=5.6 L。
(3)原混合气体的密度=≈1.61 g·L-1。
(4)解法一:=ρ(标准状况)·22.4 L·mol-1=1.61 g·L-1×22.4 L·mol-1≈36 g·mol-1;
解法二:=36 g·mol-1;
解法三:=28 g·mol-1×50%+44 g·mol-1×50%=36 g·mol-1。
12.A 两瓶气体所处的温度和压强相同,二者体积也相同,则分子数相同,即两瓶气体的物质的量相同,又因两瓶所盛气体都是双原子分子,原子数相等,A正确;因N2和O2的混合比例不确定,所以混合气体的质量、密度、摩尔质量不确定,B、C、D错误。
技巧点拨 首先根据阿伏加德罗定律推出两瓶中气体分子数相等,然后再分析每个分子中所含原子数目。
13.D 设气体的质量均为m g,则O2和O3的物质的量之比为=3∶2,体积与物质的量成正比,即体积之比为3∶2,A正确;同温同压下,密度与摩尔质量成正比,即密度之比为32∶48=2∶3,B正确;根据物质的量之比为3∶2,则原子个数之比为(3×2)∶(2×3)=1∶1,C正确;分子数和物质的量成正比,即分子数之比为3∶2,D错误。
14.C A项,温度不确定,无法确定气体摩尔体积及物质的量,即分子数无法确定,错误;B项,压强不确定,无法确定气体摩尔体积及物质的量,即分子数无法确定,错误;C项,根据质量、摩尔质量相等,可确定N2和CO的物质的量相等,即分子数相等,正确;D项,二者的质量相等,但摩尔质量不同,两气体的物质的量不同,则分子数不同,错误。
15.A H2是双原子分子,He是单原子分子,B不正确。He的相对分子质量是H2的2倍,所以等质量的H2和He,H2的物质的量是He的2倍,在相同条件下,气体的物质的量与体积成正比,A正确,C、D不正确。
能力提升练
1.A 3.B 4.B 5.C
1.A 解法一:根据气体的质量与分子数成正比,设n g混合气体的分子数为x,即m g∶b=n g∶x,解得x=,混合气体的物质的量为 mol,在标准状况下的体积为 L。
解法二:设混合气体的摩尔质量为M g/mol,根据正比关系,解得M=,则n g混合气体的物质的量为 mol,在标准状况下的体积为 L。
2.答案 (1)0.012 5 mol 22.30 L/mol
(2)BD
解析 (1)生成的氧气的质量为15.95 g-15.55 g=0.4 g,氧气的物质的量为=0.012 5 mol,Vm=≈22.30 L/mol。
(2)在其他条件不变的情况下,气体温度越高,其体积越大,气体摩尔体积越大,因此气体摩尔体积与气体的温度相关,A正确;该条件下气体摩尔体积为22.30 L/mol,B错误;同温、同压下,物质的量相同的气体体积相等,所以2 mol O2与2 mol CO和CO2的混合气体的体积相同,C正确;该实验条件下,1 mol O2的体积为22.30 L,质量为32 g,则密度为≈1.435 g/L,D错误。
3.B A项,阿伏加德罗定律及其推论只适用于气体,错误;B项,两气体均由O原子构成,气体质量相同,O原子的物质的量相同,则氧原子数相同,正确;C项,设气体质量均为1 g,则CO2、H2的物质的量之比为=1∶22,由同温同压下体积之比等于物质的量之比可知,体积之比为1∶22,错误;D项,设气体质量均为1 g,O2与H2的物质的量之比为=1∶16,同温同体积下气体压强之比等于物质的量之比,即压强之比为1∶16,错误。
4.B 设气体的质量均为1 g,则He、CH4、CO2的物质的量之比为=44∶11∶4。同温同压下,气体的体积与物质的量成正比,即V(He)>V(CH4)>V(CO2),A正确;He、CH4、CO2气体的原子数目之比为(44×1)∶(11×5)∶(4×3)=44∶55∶12,则气体的原子数目:N(CH4)>N(He)>N(CO2),B错误;同温同压下,气体的密度与摩尔质量成正比,即He、CH4、CO2的密度之比为4∶16∶44,则气体密度ρ(CO2)>ρ(CH4)>ρ(He),C正确;分子数目与物质的量成正比,即He、CH4、CO2分子数目之比为44∶11∶4,则分子数目:N(He)>N(CH4)>N(CO2),D正确。
5.C 常温下,可滑动的活塞将容器分成左右两室,左右两室压强相等,温度、压强相等时,气体的体积之比等于物质的量之比,则右室充入H2与O2的混合气体为3 mol,A正确。反应完毕后,恢复至原来温度,左室的体积变为原来的二倍,压强变为原来的一半,B正确。反应完结后恢复至原来的温度,活塞恰好停在中间,说明氮气和右室剩余气体的物质的量相等,右室剩余1 mol气体,含有2 mol原子,C错误。剩余气体的物质的量为1 mol,2H2+O2 2H2O,假设氢气完全反应,则n(H2)= mol,n(O2)=3 mol- mol,氢气和氧气体积之比为 mol=4∶5;假设氧气完全反应,则n(O2)= mol,n(H2)=3 mol- mol,所以氢气和氧气的体积之比为 mol=7∶2,反应前H2与O2的体积比为4∶5或7∶2,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
