2025人教版高中化学必修第一册同步练习题--第四章 物质结构 元素周期律(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第一册同步练习题--第四章 物质结构 元素周期律(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 431.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 12:37:43 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第一册
第四章 物质结构 元素周期律
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列化学用语错误的是 ( )
A.HCl的形成过程:
B.NH3的结构模型:
C.Na2S的电子式:
D.CO2的结构式:O C O
2.活着的生物体内值基本不变,死亡后14C会衰变为其他种类的原子而减少(14C衰变到原来数目一半所需的时间为5 730年),12C基本不变。下列说法不正确的是 ( )
A.14C与12C所属元素位于元素周期表中第二周期第ⅣA族
B.14C与12C含有的中子数分别为14和12
C.1.4 g 14C中所含原子数约为6.02×1022
D.测定死亡生物体残骸中14C的含量可判断生物死亡年代
3.下列关于元素周期表的叙述正确的是 ( )
A.原子的最外层电子数都等于该元素所在的族序数
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.现行元素周期表是按照相对原子质量的大小顺序对元素进行排列的
4.研究化学键有助于人们理解物质的某些性质。下列各组物质中,化学键类型完全相同的是 ( )
A.O2和MgCl2 B.HCl和Na2O2
C.CH4和NaOH D.CO2和H2O
5.下列有关性质的比较,不能用元素周期律解释的是 ( )
A.原子半径:r(C)H2SO4
C.非金属性:N>P D.热稳定性:Na2CO3>NaHCO3
6.下列说法正确的是 ( )
A.氢元素和其他元素可形成共价化合物,也可形成离子化合物
B.离子化合物中只含离子键,共价化合物中只含共价键
C.碘升华、HCl气体溶于水都有共价键被破坏
D.Na+和Cl-之间通过静电引力形成离子键
7.科学家推算,宇宙中可能存在第119号未知元素,位于第ⅠA族,有人称之为“类钫”。根据元素周期表中同主族元素性质的相似性和递变性,下列有关“类钫”的预测中正确的是 ( )
A.其原子半径小于铯的原子半径
B.其形成的单质有较高的熔点
C.“类钫”与钫互为同位素
D.其形成的单质能与水剧烈反应
8.CO2加氢转化为燃料是实现CO2减排的一个重要策略,我国科学家在调控CO2加氢反应的选择性方面取得新进展,其过程的示意图如下。下列说法不正确的是 ( )
A.CO2在5Ru/a-TiO2催化剂表面断开了碳氧双键
B.该反应中,CO2被氧化
C.反应中既有化学键的断裂,也有化学键的形成
D.忽略反应条件,总反应为CO2+4H2 CH4+2H2O
9.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+的电子层结构相同,d和b同族。下列叙述正确的是 ( )
A.a与其他三种元素形成的二元化合物中,其化合价均为+1价
B.b与其他三种元素均可形成至少两种二元化合物
C.d是这些元素中原子半径最大的
D.d与a形成的化合物是离子化合物
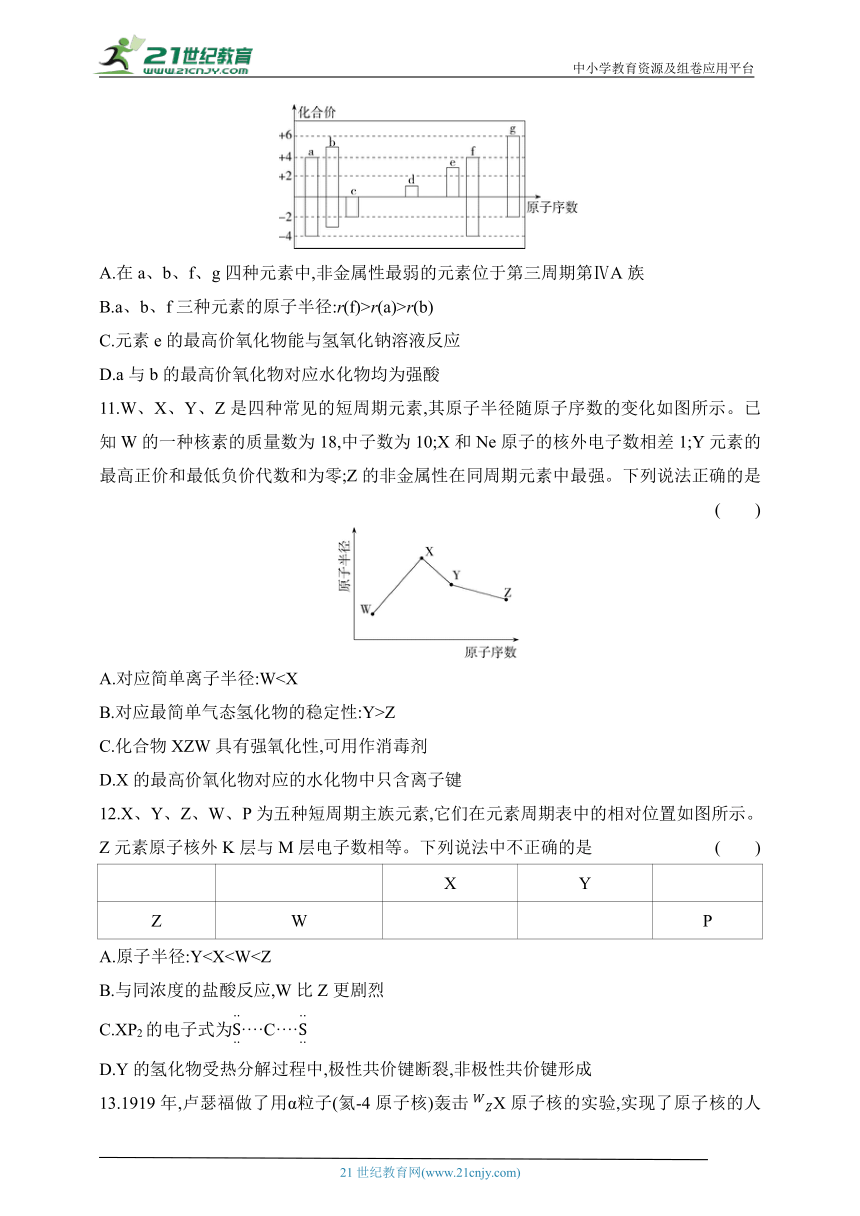
10.随着原子序数的递增,a~g七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。下列说法中不正确的是 ( )
A.在a、b、f、g四种元素中,非金属性最弱的元素位于第三周期第ⅣA族
B.a、b、f三种元素的原子半径:r(f)>r(a)>r(b)
C.元素e的最高价氧化物能与氢氧化钠溶液反应
D.a与b的最高价氧化物对应水化物均为强酸
11.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价代数和为零;Z的非金属性在同周期元素中最强。下列说法正确的是 ( )
A.对应简单离子半径:WB.对应最简单气态氢化物的稳定性:Y>Z
C.化合物XZW具有强氧化性,可用作消毒剂
D.X的最高价氧化物对应的水化物中只含离子键
12.X、Y、Z、W、P为五种短周期主族元素,它们在元素周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中不正确的是 ( )
X Y
Z W P
A.原子半径:YB.与同浓度的盐酸反应,W比Z更剧烈
C.XP2的电子式为····C····
D.Y的氢化物受热分解过程中,极性共价键断裂,非极性共价键形成
13.1919年,卢瑟福做了用α粒子(氦-4原子核)轰击X原子核的实验,实现了原子核的人工转变,发现了质子H。其中Y的某种单质可用于自来水消毒。下列说法正确的是 ( )
A.X与Y均能与H元素组成含18电子的化合物
B.Y存在Y多种同素异形体
CX中子数相同
D.该转化过程属于化学反应
14.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。元素W是整个宇宙中最常见的元素;X元素的原子可以形成两种单质,其中一种单质可用于杀菌消毒,另一种单质是植物光合作用的产物;Y与X在不同周期。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是 ( )
Z2+
A.保存Z的单质时,无须防潮
B.最简单氢化物的稳定性:XC.由W、X、Y三种元素形成的化合物均属于强酸
D.X可以形成两种简单氢化物,其中X原子均满足8电子稳定结构
15.短周期主族元素X、Y、Z、W原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成二元化合物r、t、u,其中u为SO2;v的俗名为烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径:W>Y>Z>X
B.t和r反应时,r只做氧化剂
C.v中只含有离子键
D.由W、Y、Z三种元素组成的化合物有多种
二、非选择题(本题共4小题,共55分)
16.(13分)请回答下列问题:
(1)已知某粒子的结构示意图为。试回答:
①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为 、 、 、 (填符号)。
③当x=10+y时,写出y=1与y=6的元素最高价氧化物对应的水化物之间发生反应的离子方程式: 。
(2)设NA为阿伏加德罗常数的值,X原子的质量数为A,含N个中子,它与1H原子构成HmX分子。a g HmX的物质的量为 ,所含中子的物质的量为 ,所含质子的数目为 。
17.(14分)某化学课外活动小组为了验证主族元素化学性质的递变规律,进行如下实验探究。
Ⅰ.探究1:元素金属性递变规律
(1)验证同主族元素Li、Na、K的金属性递变规律:
序号 实验内容 实验现象
1 将绿豆大小的金属Li投入50 mL水中 Li与水快速反应,且有气泡生成
2 将绿豆大小的金属Na投入50 mL水中 Na与水反应比第1组剧烈,且有气泡生成
3 将绿豆大小的金属K投入50 mL水中
①预测第3组的实验现象是 。
②已知Rb位于第五周期第ⅠA族,则碱性:RbOH (填“<”或“>”)KOH。
(2)某同学取适量可溶性铝盐与氨水(溶质为NH3·H2O)反应制备氢氧化铝,请写出该反应的离子方程式: 。
Ⅱ.探究2:元素非金属性递变规律
(3)某小组同学设计实验比较第ⅦA族元素的非金属性:
实验方案 甲 乙
操作 打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉-KI试纸变蓝 向A中通入少量Cl2充分反应后,A中液体为黄色,将A中液体滴入试管内,取下试管,充分振荡,静置,试管中现象为①
图示
②甲方案中发生多个化学反应,写出产生黄绿色气体的离子方程式: 。
③以上两个实验方案中, (填“甲”或“乙”)方案的实验能证明非金属性:Cl>Br>I。
(4)除了利用卤素单质间的置换反应,以下陈述哪些可作为卤族元素非金属性递变规律的判断依据 (填字母)。
A.Cl2、Br2、I2的熔点逐渐升高
B.HCl、HBr、HI的稳定性逐渐减弱
C.AgCl、AgBr、AgI的固体颜色越来越深
D.Cl-、Br-、I-的还原性逐渐增强
18.(12分)下表为元素周期表中部分短周期主族元素的相关信息。
元素 相关信息
W 在自然界中有三种核素,其中一种核素没有中子
T T为第三周期元素,其最高价氧化物对应的水化物A是一种强碱
X X的原子最外层电子数是其内层电子数的三倍
Y Y是自然界中含量最高的金属元素
Z T、X、Z组成的36电子的化合物B是家用消毒剂的有效成分
M 元素原子最外层比次外层少2个电子
请依据上述信息回答下列问题:
(1)M在元素周期表中的位置是 。
(2)Y的简单离子的结构示意图为 。
(3)X、M分别与W形成的简单化合物中沸点较低的是 (写化学式)。
(4)T和W形成的化合物TW可在野外用作供氢剂,请写出TW跟水反应的化学方程式: 。
(5)将X、Y、W形成的化合物加入到TXW的水溶液中,此过程中涉及的反应的离子方程式为 。
(6)向Z2的水溶液中滴加几滴紫色石蕊溶液,现象为 。
(7)Z的单质(Z2)和Z的氧化物(ZX2)都可以用作饮用水消毒剂,相同物质的量的ZX2消毒效率是Z2的 倍。
19.(16分)如图为元素周期表的一部分,列出了前四周期10种主族元素在周期表中的位置。
请回答下列问题:
(1)元素E的原子结构示意图为 ,I在元素周期表中的位置为 ,C与I形成的化合物的电子式为 。
(2)G与J形成原子数之比为1∶2的化合物P,P是日常生活中常见的物质,P分子的结构式为 ,空间构型为 ;元素K与G同主族且位于G的下一周期,P的沸点比元素K的氢化物的沸点高,原因是 。
(3)已知木炭可在G的单质中完全燃烧生成化合物Q,用电子式表示Q的形成过程: 。
(4)元素K与G同主族且位于G的下一周期,J、F、G、K可以形成原子个数之比为5∶1∶4∶1的化合物M,M的化学式为 ;M中含有的化学键类型为 。
(5)W是第四周期与G同主族的元素。据此推测W不可能具有的性质是 (填字母)。
A.最高化合价为+6
B.简单氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(6)已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b= (用含a的代数式表示)。
答案全解全析
1.A 2.B 3.B 4.D 5.D 6.A 7.D 8.B
9.B 10.D 11.C 12.B 13.A 14.D 15.D
1.A HCl是共价化合物,HCl的形成过程为 。
2.B 碳元素位于元素周期表中第二周期第ⅣA族,A正确;14C质量数为14,质子数为6,中子数为8,12C质量数为12,质子数为6,中子数为6,B错误;1.4 g 14C中所含原子数约为×6.02×1023 mol-1=6.02×1022,C正确;根据14C衰变到原来数目一半所需的时间为5 730年,通过测定死亡生物体残骸中14C的含量,可判断生物死亡年代,D正确。
3.B 主族元素原子的最外层电子数都等于该元素所在的族序数,而副族元素不一定,A错误;目前使用的元素周期表中第六、七周期均含32种元素,B正确;短周期为第一、二、三周期,包含1~18号元素,C错误;现行元素周期表是按原子核电荷数递增的顺序对元素进行排列的,D错误。
4.D O2中只含非极性键,MgCl2中只含离子键,A不符合题意;HCl中只含极性键,Na2O2中既含非极性键又含离子键,B不符合题意;CH4中只含极性键,NaOH中既含极性键又含离子键,C不符合题意;CO2和H2O中都只含极性键,D符合题意。
5.D 同主族元素原子“序大径大”,同周期主族元素原子“序大径小”,即原子半径:r(C)S,可知最高价含氧酸的酸性:HClO4>H2SO4,能用元素周期律解释,B不符合题意;同主族自上而下,元素的非金属性减弱,即非金属性:N>P,能用元素周期律解释,C不符合题意;一般碳酸氢盐受热易分解,碳酸盐受热难分解,即热稳定性:Na2CO3>NaHCO3,但不能用元素周期律解释,D符合题意。
6.A 氢元素和其他元素可形成共价化合物,如HCl,也可形成离子化合物,如NaH,A正确;离子化合物中一定含离子键,可能含共价键,而共价化合物中只含共价键,B错误;碘升华时克服分子间作用力,HCl气体溶于水时共价键被破坏,C错误;阴、阳离子间通过静电作用形成离子键,静电作用既包括静电引力又包括静电斥力,D错误。
7.D “类钫”位于第ⅠA族,同主族元素原子半径从上到下依次增大,所以“类钫”原子半径大于铯的原子半径,A错误;第ⅠA族元素的金属单质,熔点从上到下依次降低,所以“类钫”形成的单质熔点较低,B错误;“类钫”与钫原子序数不同,质子数不同,属于两种不同的元素,C错误;“类钫”金属性很强,其单质与水剧烈反应,D正确。
8.B 由题图可知,CO2和H2反应生成CH4和H2O,CO2在5Ru/a-TiO2催化剂表面断开了碳氧双键,A正确;该反应中,CO2中碳元素的化合价由+4价降低到-4价,碳元素化合价降低,CO2被还原,B错误;化学反应过程中既有化学键的断裂,也有化学键的形成,C正确;由图示可知反应物为CO2和H2,生成物为CH4和H2O,忽略反应条件,总反应为CO2+4H2 CH4+2H2O,D正确。
9.B 由题中所给的信息可知,a为H,b为O,c为Na,d为S。H与Na形成的NaH中H元素的化合价为-1价,A错误;O与H可以形成H2O、H2O2,O与Na可以形成Na2O、Na2O2等,O与S可以形成SO2、SO3等,B正确;题述四种元素原子半径:Na>S>O>H,C错误;H与S形成的化合物H2S为共价化合物,D错误。
10.D 根据表中所给内容可知,a为C,b为N,c为O,d为Na,e为Al,f为Si,g为S。在a、b、f、g四种元素中,非金属性最弱的是Si,其位于第三周期第ⅣA族,A正确;原子半径:r(Si)>r(C)>r(N),B正确;元素e的最高价氧化物为氧化铝,氧化铝为两性氧化物,其能与氢氧化钠溶液反应,C正确;a的最高价氧化物对应的水化物为碳酸,碳酸为弱酸,D错误。
11.C 根据W的一种核素的质量数和中子数可知W为O;四种元素中X的原子半径最大,且与Ne的原子序数相差1,即X为Na;由Y元素的最高正价和最低负价代数和为零可知Y为Si;由Z的非金属性在同周期中最强可知Z为Cl。O2-和Na+电子层结构相同,根据“核大径小”可知离子半径:O2->Na+,A错误;根据非金属性:Si12.B X、Y、Z、W、P为五种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z为Mg,根据相对位置可推出,W为Al,X为C,Y为N,P为S。原子半径:N13.A 由Y的某种单质可用于自来水消毒可推知,Y可能是Cl或OY的质量数为17,故Y不可能是Cl,Y为OY的质子数为8,Z=7,则X为N。H2O2和N2H4均为含18电子的化合物,A正确;16O、17O、18O互为同位素,B错误;根据质量数守恒,W=14O中有9个中子,C错误;题给转化过程中原子核发生了变化,不属于化学变化,D错误。
14.D 根据对元素W的描述可知W为H;X的一种单质能用于杀菌消毒,另一种是植物光合作用的产物,即X为O;结合Y与O不在同周期,且题给物质中Y形成5个共价键,可推知Y为P;Z的原子序数不大于20,且可形成Z2+,可推知Z为Ca。钙为活泼金属,能和水反应,需防潮,A错误;非金属性:P15.D v的俗名为烧碱,v为NaOH,u为SO2,则四种元素为Na、O、H、S;根据短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q可知,X、Y、Z、W分别为H、O、Na、S,m为H2、n为O2、p为Na、q为S,再结合题图转化关系可知r为H2O、t为Na2O2。四种元素中Na的原子半径最大,故A错误;在过氧化钠与水的反应中,过氧化钠既是氧化剂又是还原剂,水既不是氧化剂也不是还原剂,故B错误;v为NaOH,NaOH中含离子键和共价键,故C错误;由W、Y、Z三种元素组成的化合物可以是Na2SO3、Na2SO4等,故D正确。
16.答案 (除标注外,每空2分)
(1)①原子(1分) ②Cl- S2- Ar K+(其他合理答案均可,每空1分) ③OH-+H+ H2O
(2)
解析 (1)①当x-y=10,即x=10+y时,说明质子数等于核外电子数,该粒子表示原子。②当y=8时,为18电子的原子或单核离子,可能为Ar、S2-、Cl-、K+、Ca2+等。③y=1时对应Na,y=6时对应S,二者最高价氧化物对应的水化物分别为NaOH和H2SO4,反应的离子方程式为OH-+H+ H2O。(2)根据题意可知,HmX的摩尔质量为(A+m) g/mol,则a g HmX的物质的量为 mol;HmX分子中,H不含中子,故一个HmX分子含N个中子,则a g HmX分子中含中子的物质的量为 mol;一个HmX分子中含(m+A-N)个质子,则a g HmX分子中所含质子数目为。
17.答案 (每空2分)
(1)①K与水反应比Na与水反应剧烈,且有气泡生成 ②>
(2)3NH3·H2O+Al3+ Al(OH)3↓+3N
(3)①溶液呈紫红色 ②16H++10Cl-+2Mn 2Mn2++5Cl2↑+8H2O ③乙
(4)BD
解析 (1)①根据前两组实验现象,可预测第3组实验现象为K与水反应比Na与水反应剧烈,且有气泡生成。②根据Rb、K两元素在周期表中的位置可知金属性:Rb>K,则最高价氧化物对应水化物RbOH的碱性强于KOH。(2)可溶性铝盐电离出的Al3+能与NH3·H2O反应生成Al(OH)3,其离子方程式为3NH3·H2O+Al3+ Al(OH)3↓+3N。(3)①反应生成碘单质,溶液呈紫红色。②甲方案中KMnO4与浓盐酸反应生成Cl2,其离子方程式为16H++10Cl-+2Mn 2Mn2++5Cl2↑+8H2O。③甲方案中,可能是Cl2与I-反应生成I2,使淀粉-KI试纸变蓝,故该实验不能证明非金属性:Cl>Br>I;乙方案装置A中少量Cl2与NaBr反应生成Br2,打开分液漏斗活塞,Br2与KI反应生成I2,可证明非金属性:Cl>Br>I。(4)卤素单质的熔点属于物理性质,不能用于元素非金属性强弱比较,A错误;根据气态氢化物的稳定性,可比较元素非金属性,B正确;卤化银固体的颜色,属于物理性质,不能用于元素非金属性强弱比较,C错误;Cl-、Br-、I-的还原性逐渐增强,说明相应元素非金属性逐渐减弱,D正确。
18.答案 (除标注外,每空2分)
(1)第三周期第ⅥA族(1分)
(2)(1分)
(3)H2S
(4)NaH+H2O NaOH+H2↑
(5)Al(OH)3+OH- [Al(OH)4]-
(6)溶液先变红后褪色
(7)2.5
解析 根据题表信息,可确定W为H、T为Na、X为O、Y为Al、Z为Cl、M为S。(1)M为S,在元素周期表中位于第三周期第ⅥA族。(2)Y为Al,Al3+核外有10个电子,Al3+结构示意图为。(3)X、M分别与W形成的简单化合物为H2O、H2S,H2O分子间存在氢键,沸点更高,沸点:H2O>H2S。(4)TW为NaH,NaH中H为-1价,具有强还原性,与水发生氧化还原反应生成H2,其化学方程式为H2O+NaH NaOH+H2↑。(5)X、Y、W形成的化合物为Al(OH)3,TXW的水溶液为NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH- [Al(OH)4]-。(6)Cl2溶于水与水反应生成HCl和HClO,滴加几滴紫色石蕊溶液,观察到的现象为溶液先变红后褪色。(7)1 mol Cl2消毒过程中转移电子1 mol×2=2 mol,而1 mol ClO2消毒过程中转移电子1 mol×5=5 mol,故相同物质的量的ClO2的消毒效率为Cl2的2.5倍。
19.答案 (除标注外,每空2分)
(1) (1分) 第四周期第ⅦA族(1分) (1分)
(2) (1分) V形(1分) H2O分子间能形成氢键而H2S分子间不能形成氢键(1分)
(3)
(4)NH4HSO4 离子键、共价键
(5)BD
(6)a+1或a+11
解析 根据元素在周期表中的位置,可确定如下:
符号 A B C D E F G H I J
元素 Na K Mg Al Si N O Cl Br H
(1)Si原子核外有14个电子,其原子结构示意图为;I为Br,在元素周期表中的位置为第四周期第ⅦA族;离子化合物MgBr2的电子式为 。(2)P是H2O,其结构式为,空间构型为V形;元素K与G(O)同主族且位于G的下一周期,则K为S,由于H2O分子间存在氢键,而H2S分子间不存在氢键,故H2O的沸点比H2S的高。(3)C和O2完全反应生成CO2,用电子式表示CO2的形成过程为 。
(4)H、N、O、S按原子个数比5∶1∶4∶1形成的化合物M为NH4HSO4,M中含有离子键和共价键。(5)W在第四周期且与O同族,即W为Se。Se是第ⅥA族元素,其最高化合价为+6价,A正确;非金属性:S>Se,故H2Se的稳定性弱于H2S,B错误;非金属性:Se21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第一册
第四章 物质结构 元素周期律
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列化学用语错误的是 ( )
A.HCl的形成过程:
B.NH3的结构模型:
C.Na2S的电子式:
D.CO2的结构式:O C O
2.活着的生物体内值基本不变,死亡后14C会衰变为其他种类的原子而减少(14C衰变到原来数目一半所需的时间为5 730年),12C基本不变。下列说法不正确的是 ( )
A.14C与12C所属元素位于元素周期表中第二周期第ⅣA族
B.14C与12C含有的中子数分别为14和12
C.1.4 g 14C中所含原子数约为6.02×1022
D.测定死亡生物体残骸中14C的含量可判断生物死亡年代
3.下列关于元素周期表的叙述正确的是 ( )
A.原子的最外层电子数都等于该元素所在的族序数
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.现行元素周期表是按照相对原子质量的大小顺序对元素进行排列的
4.研究化学键有助于人们理解物质的某些性质。下列各组物质中,化学键类型完全相同的是 ( )
A.O2和MgCl2 B.HCl和Na2O2
C.CH4和NaOH D.CO2和H2O
5.下列有关性质的比较,不能用元素周期律解释的是 ( )
A.原子半径:r(C)
C.非金属性:N>P D.热稳定性:Na2CO3>NaHCO3
6.下列说法正确的是 ( )
A.氢元素和其他元素可形成共价化合物,也可形成离子化合物
B.离子化合物中只含离子键,共价化合物中只含共价键
C.碘升华、HCl气体溶于水都有共价键被破坏
D.Na+和Cl-之间通过静电引力形成离子键
7.科学家推算,宇宙中可能存在第119号未知元素,位于第ⅠA族,有人称之为“类钫”。根据元素周期表中同主族元素性质的相似性和递变性,下列有关“类钫”的预测中正确的是 ( )
A.其原子半径小于铯的原子半径
B.其形成的单质有较高的熔点
C.“类钫”与钫互为同位素
D.其形成的单质能与水剧烈反应
8.CO2加氢转化为燃料是实现CO2减排的一个重要策略,我国科学家在调控CO2加氢反应的选择性方面取得新进展,其过程的示意图如下。下列说法不正确的是 ( )
A.CO2在5Ru/a-TiO2催化剂表面断开了碳氧双键
B.该反应中,CO2被氧化
C.反应中既有化学键的断裂,也有化学键的形成
D.忽略反应条件,总反应为CO2+4H2 CH4+2H2O
9.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+的电子层结构相同,d和b同族。下列叙述正确的是 ( )
A.a与其他三种元素形成的二元化合物中,其化合价均为+1价
B.b与其他三种元素均可形成至少两种二元化合物
C.d是这些元素中原子半径最大的
D.d与a形成的化合物是离子化合物
10.随着原子序数的递增,a~g七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。下列说法中不正确的是 ( )
A.在a、b、f、g四种元素中,非金属性最弱的元素位于第三周期第ⅣA族
B.a、b、f三种元素的原子半径:r(f)>r(a)>r(b)
C.元素e的最高价氧化物能与氢氧化钠溶液反应
D.a与b的最高价氧化物对应水化物均为强酸
11.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价代数和为零;Z的非金属性在同周期元素中最强。下列说法正确的是 ( )
A.对应简单离子半径:W
C.化合物XZW具有强氧化性,可用作消毒剂
D.X的最高价氧化物对应的水化物中只含离子键
12.X、Y、Z、W、P为五种短周期主族元素,它们在元素周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中不正确的是 ( )
X Y
Z W P
A.原子半径:Y
C.XP2的电子式为····C····
D.Y的氢化物受热分解过程中,极性共价键断裂,非极性共价键形成
13.1919年,卢瑟福做了用α粒子(氦-4原子核)轰击X原子核的实验,实现了原子核的人工转变,发现了质子H。其中Y的某种单质可用于自来水消毒。下列说法正确的是 ( )
A.X与Y均能与H元素组成含18电子的化合物
B.Y存在Y多种同素异形体
CX中子数相同
D.该转化过程属于化学反应
14.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。元素W是整个宇宙中最常见的元素;X元素的原子可以形成两种单质,其中一种单质可用于杀菌消毒,另一种单质是植物光合作用的产物;Y与X在不同周期。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是 ( )
Z2+
A.保存Z的单质时,无须防潮
B.最简单氢化物的稳定性:X
D.X可以形成两种简单氢化物,其中X原子均满足8电子稳定结构
15.短周期主族元素X、Y、Z、W原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成二元化合物r、t、u,其中u为SO2;v的俗名为烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径:W>Y>Z>X
B.t和r反应时,r只做氧化剂
C.v中只含有离子键
D.由W、Y、Z三种元素组成的化合物有多种
二、非选择题(本题共4小题,共55分)
16.(13分)请回答下列问题:
(1)已知某粒子的结构示意图为。试回答:
①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为 、 、 、 (填符号)。
③当x=10+y时,写出y=1与y=6的元素最高价氧化物对应的水化物之间发生反应的离子方程式: 。
(2)设NA为阿伏加德罗常数的值,X原子的质量数为A,含N个中子,它与1H原子构成HmX分子。a g HmX的物质的量为 ,所含中子的物质的量为 ,所含质子的数目为 。
17.(14分)某化学课外活动小组为了验证主族元素化学性质的递变规律,进行如下实验探究。
Ⅰ.探究1:元素金属性递变规律
(1)验证同主族元素Li、Na、K的金属性递变规律:
序号 实验内容 实验现象
1 将绿豆大小的金属Li投入50 mL水中 Li与水快速反应,且有气泡生成
2 将绿豆大小的金属Na投入50 mL水中 Na与水反应比第1组剧烈,且有气泡生成
3 将绿豆大小的金属K投入50 mL水中
①预测第3组的实验现象是 。
②已知Rb位于第五周期第ⅠA族,则碱性:RbOH (填“<”或“>”)KOH。
(2)某同学取适量可溶性铝盐与氨水(溶质为NH3·H2O)反应制备氢氧化铝,请写出该反应的离子方程式: 。
Ⅱ.探究2:元素非金属性递变规律
(3)某小组同学设计实验比较第ⅦA族元素的非金属性:
实验方案 甲 乙
操作 打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙黄色,湿润的淀粉-KI试纸变蓝 向A中通入少量Cl2充分反应后,A中液体为黄色,将A中液体滴入试管内,取下试管,充分振荡,静置,试管中现象为①
图示
②甲方案中发生多个化学反应,写出产生黄绿色气体的离子方程式: 。
③以上两个实验方案中, (填“甲”或“乙”)方案的实验能证明非金属性:Cl>Br>I。
(4)除了利用卤素单质间的置换反应,以下陈述哪些可作为卤族元素非金属性递变规律的判断依据 (填字母)。
A.Cl2、Br2、I2的熔点逐渐升高
B.HCl、HBr、HI的稳定性逐渐减弱
C.AgCl、AgBr、AgI的固体颜色越来越深
D.Cl-、Br-、I-的还原性逐渐增强
18.(12分)下表为元素周期表中部分短周期主族元素的相关信息。
元素 相关信息
W 在自然界中有三种核素,其中一种核素没有中子
T T为第三周期元素,其最高价氧化物对应的水化物A是一种强碱
X X的原子最外层电子数是其内层电子数的三倍
Y Y是自然界中含量最高的金属元素
Z T、X、Z组成的36电子的化合物B是家用消毒剂的有效成分
M 元素原子最外层比次外层少2个电子
请依据上述信息回答下列问题:
(1)M在元素周期表中的位置是 。
(2)Y的简单离子的结构示意图为 。
(3)X、M分别与W形成的简单化合物中沸点较低的是 (写化学式)。
(4)T和W形成的化合物TW可在野外用作供氢剂,请写出TW跟水反应的化学方程式: 。
(5)将X、Y、W形成的化合物加入到TXW的水溶液中,此过程中涉及的反应的离子方程式为 。
(6)向Z2的水溶液中滴加几滴紫色石蕊溶液,现象为 。
(7)Z的单质(Z2)和Z的氧化物(ZX2)都可以用作饮用水消毒剂,相同物质的量的ZX2消毒效率是Z2的 倍。
19.(16分)如图为元素周期表的一部分,列出了前四周期10种主族元素在周期表中的位置。
请回答下列问题:
(1)元素E的原子结构示意图为 ,I在元素周期表中的位置为 ,C与I形成的化合物的电子式为 。
(2)G与J形成原子数之比为1∶2的化合物P,P是日常生活中常见的物质,P分子的结构式为 ,空间构型为 ;元素K与G同主族且位于G的下一周期,P的沸点比元素K的氢化物的沸点高,原因是 。
(3)已知木炭可在G的单质中完全燃烧生成化合物Q,用电子式表示Q的形成过程: 。
(4)元素K与G同主族且位于G的下一周期,J、F、G、K可以形成原子个数之比为5∶1∶4∶1的化合物M,M的化学式为 ;M中含有的化学键类型为 。
(5)W是第四周期与G同主族的元素。据此推测W不可能具有的性质是 (填字母)。
A.最高化合价为+6
B.简单氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(6)已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b= (用含a的代数式表示)。
答案全解全析
1.A 2.B 3.B 4.D 5.D 6.A 7.D 8.B
9.B 10.D 11.C 12.B 13.A 14.D 15.D
1.A HCl是共价化合物,HCl的形成过程为 。
2.B 碳元素位于元素周期表中第二周期第ⅣA族,A正确;14C质量数为14,质子数为6,中子数为8,12C质量数为12,质子数为6,中子数为6,B错误;1.4 g 14C中所含原子数约为×6.02×1023 mol-1=6.02×1022,C正确;根据14C衰变到原来数目一半所需的时间为5 730年,通过测定死亡生物体残骸中14C的含量,可判断生物死亡年代,D正确。
3.B 主族元素原子的最外层电子数都等于该元素所在的族序数,而副族元素不一定,A错误;目前使用的元素周期表中第六、七周期均含32种元素,B正确;短周期为第一、二、三周期,包含1~18号元素,C错误;现行元素周期表是按原子核电荷数递增的顺序对元素进行排列的,D错误。
4.D O2中只含非极性键,MgCl2中只含离子键,A不符合题意;HCl中只含极性键,Na2O2中既含非极性键又含离子键,B不符合题意;CH4中只含极性键,NaOH中既含极性键又含离子键,C不符合题意;CO2和H2O中都只含极性键,D符合题意。
5.D 同主族元素原子“序大径大”,同周期主族元素原子“序大径小”,即原子半径:r(C)
6.A 氢元素和其他元素可形成共价化合物,如HCl,也可形成离子化合物,如NaH,A正确;离子化合物中一定含离子键,可能含共价键,而共价化合物中只含共价键,B错误;碘升华时克服分子间作用力,HCl气体溶于水时共价键被破坏,C错误;阴、阳离子间通过静电作用形成离子键,静电作用既包括静电引力又包括静电斥力,D错误。
7.D “类钫”位于第ⅠA族,同主族元素原子半径从上到下依次增大,所以“类钫”原子半径大于铯的原子半径,A错误;第ⅠA族元素的金属单质,熔点从上到下依次降低,所以“类钫”形成的单质熔点较低,B错误;“类钫”与钫原子序数不同,质子数不同,属于两种不同的元素,C错误;“类钫”金属性很强,其单质与水剧烈反应,D正确。
8.B 由题图可知,CO2和H2反应生成CH4和H2O,CO2在5Ru/a-TiO2催化剂表面断开了碳氧双键,A正确;该反应中,CO2中碳元素的化合价由+4价降低到-4价,碳元素化合价降低,CO2被还原,B错误;化学反应过程中既有化学键的断裂,也有化学键的形成,C正确;由图示可知反应物为CO2和H2,生成物为CH4和H2O,忽略反应条件,总反应为CO2+4H2 CH4+2H2O,D正确。
9.B 由题中所给的信息可知,a为H,b为O,c为Na,d为S。H与Na形成的NaH中H元素的化合价为-1价,A错误;O与H可以形成H2O、H2O2,O与Na可以形成Na2O、Na2O2等,O与S可以形成SO2、SO3等,B正确;题述四种元素原子半径:Na>S>O>H,C错误;H与S形成的化合物H2S为共价化合物,D错误。
10.D 根据表中所给内容可知,a为C,b为N,c为O,d为Na,e为Al,f为Si,g为S。在a、b、f、g四种元素中,非金属性最弱的是Si,其位于第三周期第ⅣA族,A正确;原子半径:r(Si)>r(C)>r(N),B正确;元素e的最高价氧化物为氧化铝,氧化铝为两性氧化物,其能与氢氧化钠溶液反应,C正确;a的最高价氧化物对应的水化物为碳酸,碳酸为弱酸,D错误。
11.C 根据W的一种核素的质量数和中子数可知W为O;四种元素中X的原子半径最大,且与Ne的原子序数相差1,即X为Na;由Y元素的最高正价和最低负价代数和为零可知Y为Si;由Z的非金属性在同周期中最强可知Z为Cl。O2-和Na+电子层结构相同,根据“核大径小”可知离子半径:O2->Na+,A错误;根据非金属性:Si
14.D 根据对元素W的描述可知W为H;X的一种单质能用于杀菌消毒,另一种是植物光合作用的产物,即X为O;结合Y与O不在同周期,且题给物质中Y形成5个共价键,可推知Y为P;Z的原子序数不大于20,且可形成Z2+,可推知Z为Ca。钙为活泼金属,能和水反应,需防潮,A错误;非金属性:P
16.答案 (除标注外,每空2分)
(1)①原子(1分) ②Cl- S2- Ar K+(其他合理答案均可,每空1分) ③OH-+H+ H2O
(2)
解析 (1)①当x-y=10,即x=10+y时,说明质子数等于核外电子数,该粒子表示原子。②当y=8时,为18电子的原子或单核离子,可能为Ar、S2-、Cl-、K+、Ca2+等。③y=1时对应Na,y=6时对应S,二者最高价氧化物对应的水化物分别为NaOH和H2SO4,反应的离子方程式为OH-+H+ H2O。(2)根据题意可知,HmX的摩尔质量为(A+m) g/mol,则a g HmX的物质的量为 mol;HmX分子中,H不含中子,故一个HmX分子含N个中子,则a g HmX分子中含中子的物质的量为 mol;一个HmX分子中含(m+A-N)个质子,则a g HmX分子中所含质子数目为。
17.答案 (每空2分)
(1)①K与水反应比Na与水反应剧烈,且有气泡生成 ②>
(2)3NH3·H2O+Al3+ Al(OH)3↓+3N
(3)①溶液呈紫红色 ②16H++10Cl-+2Mn 2Mn2++5Cl2↑+8H2O ③乙
(4)BD
解析 (1)①根据前两组实验现象,可预测第3组实验现象为K与水反应比Na与水反应剧烈,且有气泡生成。②根据Rb、K两元素在周期表中的位置可知金属性:Rb>K,则最高价氧化物对应水化物RbOH的碱性强于KOH。(2)可溶性铝盐电离出的Al3+能与NH3·H2O反应生成Al(OH)3,其离子方程式为3NH3·H2O+Al3+ Al(OH)3↓+3N。(3)①反应生成碘单质,溶液呈紫红色。②甲方案中KMnO4与浓盐酸反应生成Cl2,其离子方程式为16H++10Cl-+2Mn 2Mn2++5Cl2↑+8H2O。③甲方案中,可能是Cl2与I-反应生成I2,使淀粉-KI试纸变蓝,故该实验不能证明非金属性:Cl>Br>I;乙方案装置A中少量Cl2与NaBr反应生成Br2,打开分液漏斗活塞,Br2与KI反应生成I2,可证明非金属性:Cl>Br>I。(4)卤素单质的熔点属于物理性质,不能用于元素非金属性强弱比较,A错误;根据气态氢化物的稳定性,可比较元素非金属性,B正确;卤化银固体的颜色,属于物理性质,不能用于元素非金属性强弱比较,C错误;Cl-、Br-、I-的还原性逐渐增强,说明相应元素非金属性逐渐减弱,D正确。
18.答案 (除标注外,每空2分)
(1)第三周期第ⅥA族(1分)
(2)(1分)
(3)H2S
(4)NaH+H2O NaOH+H2↑
(5)Al(OH)3+OH- [Al(OH)4]-
(6)溶液先变红后褪色
(7)2.5
解析 根据题表信息,可确定W为H、T为Na、X为O、Y为Al、Z为Cl、M为S。(1)M为S,在元素周期表中位于第三周期第ⅥA族。(2)Y为Al,Al3+核外有10个电子,Al3+结构示意图为。(3)X、M分别与W形成的简单化合物为H2O、H2S,H2O分子间存在氢键,沸点更高,沸点:H2O>H2S。(4)TW为NaH,NaH中H为-1价,具有强还原性,与水发生氧化还原反应生成H2,其化学方程式为H2O+NaH NaOH+H2↑。(5)X、Y、W形成的化合物为Al(OH)3,TXW的水溶液为NaOH溶液,Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH- [Al(OH)4]-。(6)Cl2溶于水与水反应生成HCl和HClO,滴加几滴紫色石蕊溶液,观察到的现象为溶液先变红后褪色。(7)1 mol Cl2消毒过程中转移电子1 mol×2=2 mol,而1 mol ClO2消毒过程中转移电子1 mol×5=5 mol,故相同物质的量的ClO2的消毒效率为Cl2的2.5倍。
19.答案 (除标注外,每空2分)
(1) (1分) 第四周期第ⅦA族(1分) (1分)
(2) (1分) V形(1分) H2O分子间能形成氢键而H2S分子间不能形成氢键(1分)
(3)
(4)NH4HSO4 离子键、共价键
(5)BD
(6)a+1或a+11
解析 根据元素在周期表中的位置,可确定如下:
符号 A B C D E F G H I J
元素 Na K Mg Al Si N O Cl Br H
(1)Si原子核外有14个电子,其原子结构示意图为;I为Br,在元素周期表中的位置为第四周期第ⅦA族;离子化合物MgBr2的电子式为 。(2)P是H2O,其结构式为,空间构型为V形;元素K与G(O)同主族且位于G的下一周期,则K为S,由于H2O分子间存在氢键,而H2S分子间不存在氢键,故H2O的沸点比H2S的高。(3)C和O2完全反应生成CO2,用电子式表示CO2的形成过程为 。
(4)H、N、O、S按原子个数比5∶1∶4∶1形成的化合物M为NH4HSO4,M中含有离子键和共价键。(5)W在第四周期且与O同族,即W为Se。Se是第ⅥA族元素,其最高化合价为+6价,A正确;非金属性:S>Se,故H2Se的稳定性弱于H2S,B错误;非金属性:Se
21世纪教育网(www.21cnjy.com)
