1.2.1 盖斯定律课件(共20张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2.1 盖斯定律课件(共20张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 470.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-18 22:22:08 | ||
图片预览







文档简介
(共20张PPT)
章
一
第
化学反应的热效应
第1课时
盖斯定律
第二节 反应热的计算
反应热可以通过实验直接测定
还记得用啥吗?
量热计
思考一下
所有反应的反应热都可以通过实验测定反应热吗?
答案自然是否定的。
问题引入
例如,对于化学反应:
C(s)+(g)=CO (g)
C燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热是无法直接测定的。但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?能否利用一些已知反应的反应热来计算其他反应的反应热呢?
答案自然是肯定的。
问题引入
嗨,同学们好,我叫盖斯,我经过大量的实验研究,总结出一条规律,看看能不能帮大家解决问题吧
一、盖斯定律
1、内容:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
讲授新课
2、特点:
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
讲授新课
始态
终态
反应热
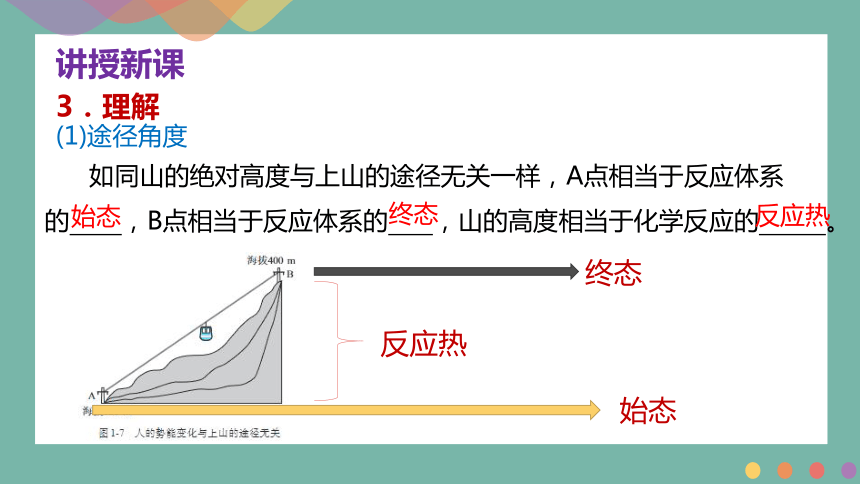
3.理解
(1)途径角度
如同山的绝对高度与上山的途径无关一样,A点相当于反应体系的 ,B点相当于反应体系的 ,山的高度相当于化学反应的 。
终态
始态
反应热
讲授新课
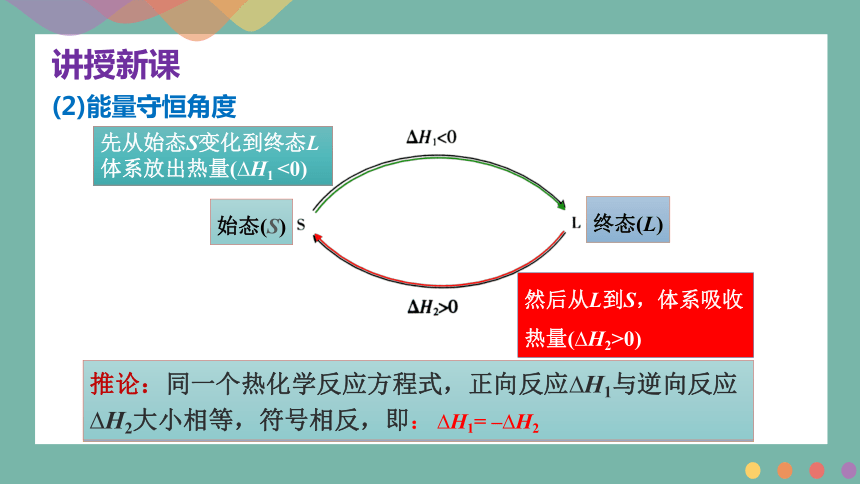
(2)能量守恒角度
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即 H1+ H2=0
先从始态S变化到终态L 体系放出热量( H1 <0)
始态(S)
然后从L到S,体系吸收热量( H2>0)
终态(L)
推论:同一个热化学反应方程式,正向反应 H1与逆向反应 H2大小相等,符号相反,即: H1= – H2
讲授新课
4.图例说明
从反应途径角度:A→D:
ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
讲授新课
5、意义:利用盖斯定律,可以间接地计算很难直接测量的反应热。
C(s)+(g)=CO (g)
交流一下
该反应的反应热可以怎么得到呢?
讲授新课
虽然该反应的反应热无法直接测定,但下列两个反应的反应热却可以直接测定:
C(s)+O2(g)=CO(g) H1=-393.5 kJ/mol
CO(g)+ O2 (g)=CO2(g) H2=-283.0 kJ/mol
上述三个反应具有如下关系:
C(s)+O2(g)
CO2(g)
CO(g)+ O2 (g)
H1
H3
H2
途径一
途径二
讲授新课
根据盖斯定律,则有:
=-393.5kJ/mol-(-283.0kJ/mol)
=-110.5kJ/mol
H1= H2+ H3
H3= H1- H2
C(s)+(g)=CO (g) H3 =-110.5kJ/mol
讲授新课
6.盖斯定律的定量关系
方程式 反应热间的关系
ΔH1=-ΔH2
ΔH1=aΔH2
ΔH=ΔH1+ΔH2
=ΔH3+ΔH4+ΔH5
aA B、A B
讲授新课
Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)==CuCl(s)+Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
典例精析
2CuO(s)+4HCl(g)=2CuCl2(s)+2H2O(g) ΔH=-121×2 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) ΔH=-20×2 kJ·mol-1
2CuCl2(s)=2CuCl(s)+Cl2(g) ΔH=83×2 kJ·mol-1
第一步:找出待求热化学方程式中反应物与生成物在已知热化学方程式中的位置。
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)
第二步:调整已知热化学方程式方向、计量数和ΔH。
第三步:加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
ΔH=(-121×2-20×2+83×2) kJ·mol-1=-116 kJ·mol-1。
典例精析
1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值;
2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
3、将一个热化学方程式颠倒, △H的符号也要随之改变。
总结归纳
“三步”确定热化学方程式或ΔH
思维模型
将调整好的热化学方程式和△H分别进行求△H加和。确定目标反应的焓变△H。
找出
根据待求解的热化学方程式中的反应物和生成物找出可用的已知热化学方程式。
②根据待求解的热化学方程式将调整好的热化学方程式进行缩小或扩大相应的倍数,同时调整△H的值。
①根据待求解的热化学方程式调整可用热化学方程式的方向,同时调整△H的符号。
调整
加和
1. 已知:CH4在一定条件下可发生一系列反应,如图
下列说法不正确的是
A. H1> H5 B. H3= H2- H5
C. H1= H2+ H3+ H4 D. H4>0
随堂小练
通过化学反应完成物质的转化,可用于治理污染、保护环境,实现可持续发展。已知:
①S(g)+2H2O(g) 2H2(g)+SO2(g) H=-90.4kJ/mol
②2CO(g)+SO2(g) S(g)+2CO2(g) H=+8.0kJ/mol
则反应CO(g)+H2O (g)CO2(g)+H2(g) H= kJ/mol
A.-82.4 B.-90.4 C.-41.2 D.+8.0
随堂小练
感谢您的观看
章
一
第
化学反应的热效应
第1课时
盖斯定律
第二节 反应热的计算
反应热可以通过实验直接测定
还记得用啥吗?
量热计
思考一下
所有反应的反应热都可以通过实验测定反应热吗?
答案自然是否定的。
问题引入
例如,对于化学反应:
C(s)+(g)=CO (g)
C燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热是无法直接测定的。但这个反应热是冶金工业中非常有用的数据,应该如何获得呢?能否利用一些已知反应的反应热来计算其他反应的反应热呢?
答案自然是肯定的。
问题引入
嗨,同学们好,我叫盖斯,我经过大量的实验研究,总结出一条规律,看看能不能帮大家解决问题吧
一、盖斯定律
1、内容:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
讲授新课
2、特点:
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
讲授新课
始态
终态
反应热
3.理解
(1)途径角度
如同山的绝对高度与上山的途径无关一样,A点相当于反应体系的 ,B点相当于反应体系的 ,山的高度相当于化学反应的 。
终态
始态
反应热
讲授新课
(2)能量守恒角度
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即 H1+ H2=0
先从始态S变化到终态L 体系放出热量( H1 <0)
始态(S)
然后从L到S,体系吸收热量( H2>0)
终态(L)
推论:同一个热化学反应方程式,正向反应 H1与逆向反应 H2大小相等,符号相反,即: H1= – H2
讲授新课
4.图例说明
从反应途径角度:A→D:
ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
讲授新课
5、意义:利用盖斯定律,可以间接地计算很难直接测量的反应热。
C(s)+(g)=CO (g)
交流一下
该反应的反应热可以怎么得到呢?
讲授新课
虽然该反应的反应热无法直接测定,但下列两个反应的反应热却可以直接测定:
C(s)+O2(g)=CO(g) H1=-393.5 kJ/mol
CO(g)+ O2 (g)=CO2(g) H2=-283.0 kJ/mol
上述三个反应具有如下关系:
C(s)+O2(g)
CO2(g)
CO(g)+ O2 (g)
H1
H3
H2
途径一
途径二
讲授新课
根据盖斯定律,则有:
=-393.5kJ/mol-(-283.0kJ/mol)
=-110.5kJ/mol
H1= H2+ H3
H3= H1- H2
C(s)+(g)=CO (g) H3 =-110.5kJ/mol
讲授新课
6.盖斯定律的定量关系
方程式 反应热间的关系
ΔH1=-ΔH2
ΔH1=aΔH2
ΔH=ΔH1+ΔH2
=ΔH3+ΔH4+ΔH5
aA B、A B
讲授新课
Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)==CuCl(s)+Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+O2(g)=CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
典例精析
2CuO(s)+4HCl(g)=2CuCl2(s)+2H2O(g) ΔH=-121×2 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) ΔH=-20×2 kJ·mol-1
2CuCl2(s)=2CuCl(s)+Cl2(g) ΔH=83×2 kJ·mol-1
第一步:找出待求热化学方程式中反应物与生成物在已知热化学方程式中的位置。
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)
第二步:调整已知热化学方程式方向、计量数和ΔH。
第三步:加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
ΔH=(-121×2-20×2+83×2) kJ·mol-1=-116 kJ·mol-1。
典例精析
1、热化学方程式同乘以一个数时,反应热数值也必须同乘以该数值;
2、热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
3、将一个热化学方程式颠倒, △H的符号也要随之改变。
总结归纳
“三步”确定热化学方程式或ΔH
思维模型
将调整好的热化学方程式和△H分别进行求△H加和。确定目标反应的焓变△H。
找出
根据待求解的热化学方程式中的反应物和生成物找出可用的已知热化学方程式。
②根据待求解的热化学方程式将调整好的热化学方程式进行缩小或扩大相应的倍数,同时调整△H的值。
①根据待求解的热化学方程式调整可用热化学方程式的方向,同时调整△H的符号。
调整
加和
1. 已知:CH4在一定条件下可发生一系列反应,如图
下列说法不正确的是
A. H1> H5 B. H3= H2- H5
C. H1= H2+ H3+ H4 D. H4>0
随堂小练
通过化学反应完成物质的转化,可用于治理污染、保护环境,实现可持续发展。已知:
①S(g)+2H2O(g) 2H2(g)+SO2(g) H=-90.4kJ/mol
②2CO(g)+SO2(g) S(g)+2CO2(g) H=+8.0kJ/mol
则反应CO(g)+H2O (g)CO2(g)+H2(g) H= kJ/mol
A.-82.4 B.-90.4 C.-41.2 D.+8.0
随堂小练
感谢您的观看
