3.1.1 强电解质和弱电解质 弱电解质的电离平衡课件(共35张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.1 强电解质和弱电解质 弱电解质的电离平衡课件(共35张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 586.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-18 22:32:59 | ||
图片预览










文档简介
(共35张PPT)
章
三
第
水溶液中的离子反应与平衡
第一节
电离平衡
第1课时
强电解质和弱电解质
弱电解质的电离平衡
(1)什么叫电解质?
(2)什么叫非电解质?
(3)电解质和非电解质的研究对象是什么?
在水溶液中或熔融状态时能够导电的化合物
包括酸、 碱、 盐、、活泼金属氧化物、少数有机物、水
在水溶液中和熔融状态都不能导电的化合物
包括大多数有机物、NH3、大部分非金属氧化物。
如:NO2、SO3、CO2
化合物,溶于水或融熔状态是导电的条件。
温故知新
A.石墨能导电,所以是电解质。
B.由于BaSO4难溶于水,所以不是电解质。
C.盐酸能导电,所以盐酸是电解质。
D.SO2、NH3、Na2O溶于水可导电,所以均为电解质。
讨论以下几种说法是否正确
随堂小练
1)电解质和非电解质是指化合物,单质和混合物既不是电解质也不是非电解质。
2)电解质应是一定条件下本身电离而导电的化合物。如CO2能导电是因为CO2与H2O反应生成了H2CO3,H2CO3能够电离而非CO2本身电离,所以CO2不是电解质,是非电解质。
3)BaSO4 AgCl难溶于水,但溶解的部分是完全电离的,所以它们是电解质。
4)能导电的物质不一定是电解质,如石墨。电解质本身也不一定能导电,如NaCl固体。
5)电解质包括离子化合物和共价化合物。离子化合物是水溶液中和熔融状态下均能导电,如强碱和盐;共价化合物是只有在水溶液中能导电,如HCl
注意
下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2
D
随堂小练
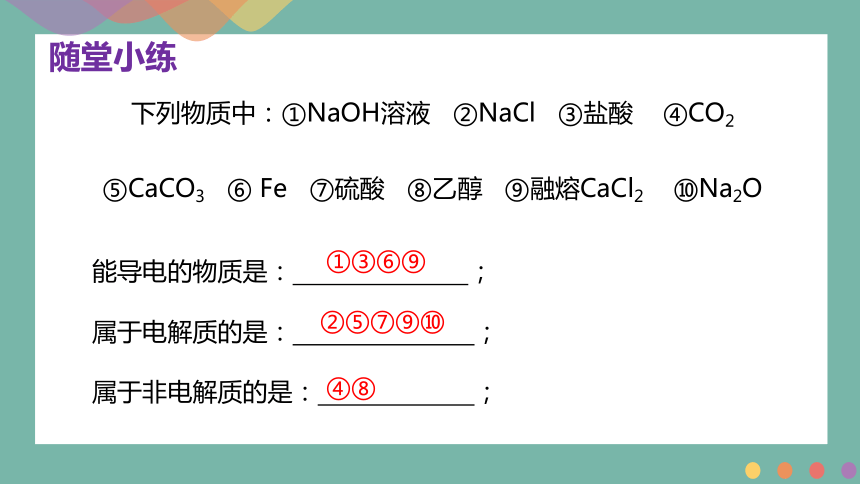
下列物质中:①NaOH溶液 ②NaCl ③盐酸 ④CO2
⑤CaCO3 ⑥ Fe ⑦硫酸 ⑧乙醇 ⑨融熔CaCl2 ⑩Na2O
能导电的物质是: ;
属于电解质的是: ;
属于非电解质的是: ;
①③⑥⑨
②⑤⑦⑨⑩
④⑧
随堂小练
1
酸碱盐都是电解质,在水中都能电离成离子,不同电解质的电离程度是否相同?
盐酸和醋酸是生活中常用的酸,盐酸常用于洁具的清洗和除垢,醋酸的腐蚀性较小,比较安全,为什么不用醋酸代替盐酸?
讲授新课
将体积相同、浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH。
实验3-1
实验3-1 0.1 mol/L HCl 0.1mol/L CH3COOH
与镁条反应的现象
溶液的pH值
导电能力
产生气泡的速度较快
产生气泡的速度较慢
1
2~3
强
弱
讲授新课
3)为什么相同体积、相同浓度的盐酸和醋酸中,H+浓度却不同?
根据实验现象,讨论下列问题
1)镁条和酸的反应的实质是什么?影响反应速率的因素是什么?
2)当酸溶液的物质的量浓度相等时,溶液中的H+浓度是否相等?怎么判断?
Mg+2H+ = Mg2++H2↑
反应速率不同,pH不同,说明盐酸和醋酸中的H+浓度是不同的。
说明HCl和CH3COOH的电离程度不同。
讲授新课
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
说明: HCl分子在水中完全电离
醋酸分子在水中部分电离
讲授新课
(1) 强电解质:在水溶液里全部电离成离子的电解质
(2) 弱电解质:在水溶液里只有一部分分子电离成离子的电解质
一. 强电解质和弱电解质
如:强酸、强碱、绝大多数盐类(包括难溶性盐)
如:弱酸、弱碱、水
讲授新课
常见的强电解质:
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等
③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等
强弱电解质的类别
强电解质、弱电解质与其溶解性无关
讲授新课
常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水是极弱的电解质。
强弱电解质的类别
讲授新课
① CaCO3 ② Ba(OH)2 ③ HF ④ Al(OH)3 ⑤ BaSO4 ⑥ AgCl ⑦ Na2CO3 ⑧ K2SO4 ⑨ H2O
哪些是强电解质,那些是弱电解质
① ② ⑤ ⑥ ⑦ ⑧
弱电解质:
③ ④ ⑨
强电解质:
下列电解质中:
随堂一练
二、电离方程式的书写方法
1.强电解质
完全电离,符号用“=”。如:
2.弱电解质
部分电离,符号选用“ ”,如:
CH3COONH4 = CH3COO - + NH4+
Ba(OH)2 = Ba2+ + 2OH -
(1)一元弱酸弱碱的电离:
NH3·H2O NH4+ + OH -
讲授新课
多元弱酸溶液的的酸性主要由第一步电离决定
电离特点:
部分电离
分步书写
(2)多元弱酸的电离是分步进行的,以第一步电离为主,
一级比一级难电离。
如:
次要
讲授新课
(3)多元弱碱分步电离,但用一步电离表示。
电离特点:
部分电离
一步到位
讲授新课
(4)两性氢氧化物双向电离
(酸式电离)
(碱式电离)
(5)酸式盐的电离
强酸的酸式盐完全电离:
弱酸的酸式盐第一步完全电离:
讲授新课
下列电离方程式书写正确的是( )
A. BaSO4 Ba2+ + SO42-
B. H3PO4 3H+ + PO43-
C. Al(OH)3 H+ + AlO2- + H2O
D. NaHS = Na+ + H+ + S2-
C
随堂小练
写出下列物质的电离方程式
(1) HClO
(2) KHSO3
(3) CaCO3
(4) Cu(OH)2
H++ClO-
= K++HSO3-
= Ca2++CO32-
Cu2++2OH-
随堂小练
总结规律
强等号,弱可逆
多元弱酸分步写
多元弱碱一步完
强电解质 弱电解质
相同点 都是电解质,在水溶液中都能电离,与溶解度无关
不同点 化合物类型 离子化合物,共价化合物 共价化合物
物质类别 强酸、强碱、大多数盐 弱酸、弱碱、水
溶质微粒 离子 分子(多)、离子
电离程度 完全电离(不可逆) 部分电离(可逆)
表示方法 电离方程式用“ = ” 电离方程式用“ ”
实例 强酸、强碱、盐 弱酸、弱碱、水
电离方程式 NaCl=Na++Cl- HF H++F-
三、强电解质与弱电解质的比较
讲授新课
CH3COOH CH3COO - + H+
电离
结合
1)开始时,V电离 和 V结合怎样变化?
2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
讲授新课
c(H+) c(CH3COO-) c(CH3COOH) v(电离) v(结合)
醋酸初溶于水时
接着
最后
0(最小)
0(最小)
最大
增大
最大
0(最小)
增大
减小
减小
增大
不变
不变
不变
不变
不变
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
讲授新课
四、电离平衡
1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态 ― 电离平衡
讲授新课
2.特征
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓度不变
变: 条件改变时,电离平衡发生移动。
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
讲授新课
五、电离平衡的影响因素
(以CH3COOH例)
1)、弱电解质电离过程的特点:
(1)弱电解质的电离属于可逆过程
(2)电离方向是微粒数增多的过程
(3)电离方向是吸热过程
讲授新课
2)、影响电离平衡的因素
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度、电解质(酸碱盐等)
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
冰醋酸稀释
讲授新课
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离 平衡向电离方向(正向)移动。
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制弱电解质的电离,即平衡逆向移动。
讲授新课
②浓度: 降低浓度,电离平衡向电离方向(正向)移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
以醋酸的电离平衡为例:
H>0
外界条件对电离平衡的影响可归纳如下:
改 变 条 件 平衡移 动方向 c(H+) c(Ac-) c(HAc) 电离
程度
加 热
加 盐 酸
加NaOH (s)
加NaAc (s)
加CH3COOH
加 水
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
讲授新课
0.1mol/L的CH3COOH溶液中CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动
B
随堂小练
已知0.1mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO- + H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A 加少量烧碱溶液 B 升高温度
C 加少量冰醋酸 D 加水
BD
随堂小练
弱电解质的电离
相关概念
电离平衡
非电解质
电解质
强电解质
弱电解质
平衡的建立与特征
影响因素
内因:电解质本身
外因:温度、压强
课堂小结
感谢您的观看
章
三
第
水溶液中的离子反应与平衡
第一节
电离平衡
第1课时
强电解质和弱电解质
弱电解质的电离平衡
(1)什么叫电解质?
(2)什么叫非电解质?
(3)电解质和非电解质的研究对象是什么?
在水溶液中或熔融状态时能够导电的化合物
包括酸、 碱、 盐、、活泼金属氧化物、少数有机物、水
在水溶液中和熔融状态都不能导电的化合物
包括大多数有机物、NH3、大部分非金属氧化物。
如:NO2、SO3、CO2
化合物,溶于水或融熔状态是导电的条件。
温故知新
A.石墨能导电,所以是电解质。
B.由于BaSO4难溶于水,所以不是电解质。
C.盐酸能导电,所以盐酸是电解质。
D.SO2、NH3、Na2O溶于水可导电,所以均为电解质。
讨论以下几种说法是否正确
随堂小练
1)电解质和非电解质是指化合物,单质和混合物既不是电解质也不是非电解质。
2)电解质应是一定条件下本身电离而导电的化合物。如CO2能导电是因为CO2与H2O反应生成了H2CO3,H2CO3能够电离而非CO2本身电离,所以CO2不是电解质,是非电解质。
3)BaSO4 AgCl难溶于水,但溶解的部分是完全电离的,所以它们是电解质。
4)能导电的物质不一定是电解质,如石墨。电解质本身也不一定能导电,如NaCl固体。
5)电解质包括离子化合物和共价化合物。离子化合物是水溶液中和熔融状态下均能导电,如强碱和盐;共价化合物是只有在水溶液中能导电,如HCl
注意
下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2
D
随堂小练
下列物质中:①NaOH溶液 ②NaCl ③盐酸 ④CO2
⑤CaCO3 ⑥ Fe ⑦硫酸 ⑧乙醇 ⑨融熔CaCl2 ⑩Na2O
能导电的物质是: ;
属于电解质的是: ;
属于非电解质的是: ;
①③⑥⑨
②⑤⑦⑨⑩
④⑧
随堂小练
1
酸碱盐都是电解质,在水中都能电离成离子,不同电解质的电离程度是否相同?
盐酸和醋酸是生活中常用的酸,盐酸常用于洁具的清洗和除垢,醋酸的腐蚀性较小,比较安全,为什么不用醋酸代替盐酸?
讲授新课
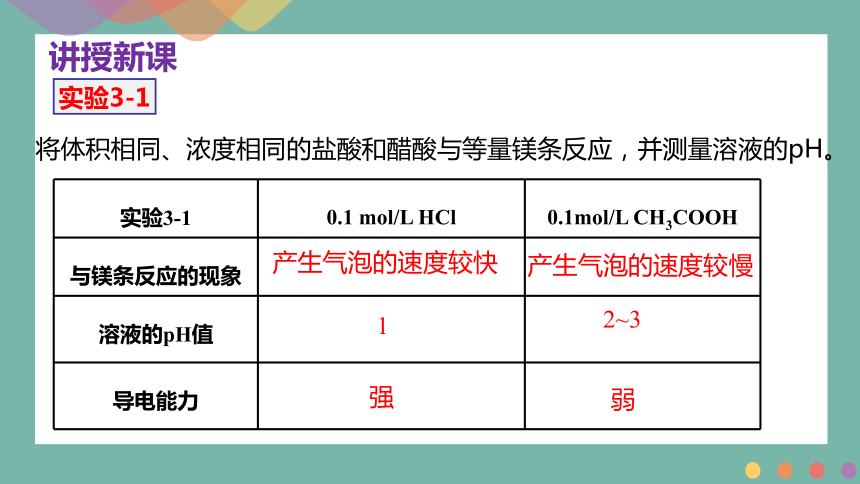
将体积相同、浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH。
实验3-1
实验3-1 0.1 mol/L HCl 0.1mol/L CH3COOH
与镁条反应的现象
溶液的pH值
导电能力
产生气泡的速度较快
产生气泡的速度较慢
1
2~3
强
弱
讲授新课
3)为什么相同体积、相同浓度的盐酸和醋酸中,H+浓度却不同?
根据实验现象,讨论下列问题
1)镁条和酸的反应的实质是什么?影响反应速率的因素是什么?
2)当酸溶液的物质的量浓度相等时,溶液中的H+浓度是否相等?怎么判断?
Mg+2H+ = Mg2++H2↑
反应速率不同,pH不同,说明盐酸和醋酸中的H+浓度是不同的。
说明HCl和CH3COOH的电离程度不同。
讲授新课
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
说明: HCl分子在水中完全电离
醋酸分子在水中部分电离
讲授新课
(1) 强电解质:在水溶液里全部电离成离子的电解质
(2) 弱电解质:在水溶液里只有一部分分子电离成离子的电解质
一. 强电解质和弱电解质
如:强酸、强碱、绝大多数盐类(包括难溶性盐)
如:弱酸、弱碱、水
讲授新课
常见的强电解质:
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等
③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等
强弱电解质的类别
强电解质、弱电解质与其溶解性无关
讲授新课
常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水是极弱的电解质。
强弱电解质的类别
讲授新课
① CaCO3 ② Ba(OH)2 ③ HF ④ Al(OH)3 ⑤ BaSO4 ⑥ AgCl ⑦ Na2CO3 ⑧ K2SO4 ⑨ H2O
哪些是强电解质,那些是弱电解质
① ② ⑤ ⑥ ⑦ ⑧
弱电解质:
③ ④ ⑨
强电解质:
下列电解质中:
随堂一练
二、电离方程式的书写方法
1.强电解质
完全电离,符号用“=”。如:
2.弱电解质
部分电离,符号选用“ ”,如:
CH3COONH4 = CH3COO - + NH4+
Ba(OH)2 = Ba2+ + 2OH -
(1)一元弱酸弱碱的电离:
NH3·H2O NH4+ + OH -
讲授新课
多元弱酸溶液的的酸性主要由第一步电离决定
电离特点:
部分电离
分步书写
(2)多元弱酸的电离是分步进行的,以第一步电离为主,
一级比一级难电离。
如:
次要
讲授新课
(3)多元弱碱分步电离,但用一步电离表示。
电离特点:
部分电离
一步到位
讲授新课
(4)两性氢氧化物双向电离
(酸式电离)
(碱式电离)
(5)酸式盐的电离
强酸的酸式盐完全电离:
弱酸的酸式盐第一步完全电离:
讲授新课
下列电离方程式书写正确的是( )
A. BaSO4 Ba2+ + SO42-
B. H3PO4 3H+ + PO43-
C. Al(OH)3 H+ + AlO2- + H2O
D. NaHS = Na+ + H+ + S2-
C
随堂小练
写出下列物质的电离方程式
(1) HClO
(2) KHSO3
(3) CaCO3
(4) Cu(OH)2
H++ClO-
= K++HSO3-
= Ca2++CO32-
Cu2++2OH-
随堂小练
总结规律
强等号,弱可逆
多元弱酸分步写
多元弱碱一步完
强电解质 弱电解质
相同点 都是电解质,在水溶液中都能电离,与溶解度无关
不同点 化合物类型 离子化合物,共价化合物 共价化合物
物质类别 强酸、强碱、大多数盐 弱酸、弱碱、水
溶质微粒 离子 分子(多)、离子
电离程度 完全电离(不可逆) 部分电离(可逆)
表示方法 电离方程式用“ = ” 电离方程式用“ ”
实例 强酸、强碱、盐 弱酸、弱碱、水
电离方程式 NaCl=Na++Cl- HF H++F-
三、强电解质与弱电解质的比较
讲授新课
CH3COOH CH3COO - + H+
电离
结合
1)开始时,V电离 和 V结合怎样变化?
2)当V电离 = V结合时,可逆过程达到一种什么样的状态?画出V~t图。
思考:在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
讲授新课
c(H+) c(CH3COO-) c(CH3COOH) v(电离) v(结合)
醋酸初溶于水时
接着
最后
0(最小)
0(最小)
最大
增大
最大
0(最小)
增大
减小
减小
增大
不变
不变
不变
不变
不变
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
讲授新课
四、电离平衡
1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态 ― 电离平衡
讲授新课
2.特征
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓度不变
变: 条件改变时,电离平衡发生移动。
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
讲授新课
五、电离平衡的影响因素
(以CH3COOH例)
1)、弱电解质电离过程的特点:
(1)弱电解质的电离属于可逆过程
(2)电离方向是微粒数增多的过程
(3)电离方向是吸热过程
讲授新课
2)、影响电离平衡的因素
(1) 内因:电解质自身性质决定了其电离程度的大小
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
影响电离平衡的条件有温度、浓度、电解质(酸碱盐等)
①温度:弱电解质的电离为吸热,升温促使电离平衡正向移动(越热越电离)
冰醋酸稀释
讲授新课
④离子反应效应:加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离 平衡向电离方向(正向)移动。
③同离子效应:加入与弱电解质具有相同离子的强电解质,将抑制弱电解质的电离,即平衡逆向移动。
讲授新课
②浓度: 降低浓度,电离平衡向电离方向(正向)移动,因为离子相互碰撞结合为分子的几率减小。(越稀越电离)
以醋酸的电离平衡为例:
H>0
外界条件对电离平衡的影响可归纳如下:
改 变 条 件 平衡移 动方向 c(H+) c(Ac-) c(HAc) 电离
程度
加 热
加 盐 酸
加NaOH (s)
加NaAc (s)
加CH3COOH
加 水
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
减小
增大
增大
减小
减小
讲授新课
0.1mol/L的CH3COOH溶液中CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动
B
随堂小练
已知0.1mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO- + H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A 加少量烧碱溶液 B 升高温度
C 加少量冰醋酸 D 加水
BD
随堂小练
弱电解质的电离
相关概念
电离平衡
非电解质
电解质
强电解质
弱电解质
平衡的建立与特征
影响因素
内因:电解质本身
外因:温度、压强
课堂小结
感谢您的观看
