3.4.2 沉淀溶解平衡的应用 课件(共37张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.4.2 沉淀溶解平衡的应用 课件(共37张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 10:02:03 | ||
图片预览











文档简介
(共37张PPT)
章
三
第
水溶液中的离子反应与平衡
第四节
沉淀溶解平衡
第2课时
沉淀溶解平衡的应用
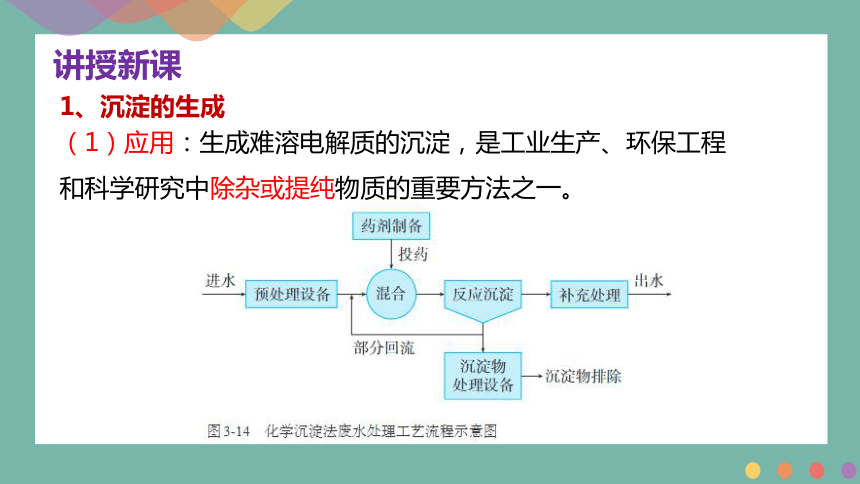
1、沉淀的生成
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
讲授新课
工业废水的处理
工业废水
硫化物等
重金属离子(如Cu2+、Hg2+等)转化成沉淀
讲授新课
原则: 生成沉淀的反应能发生,且进行得越完全越好
方法:
(1) 加沉淀剂
Cu2++S2-=CuS↓
沉淀Cu2+、Hg2+等,可以用Na2S或H2S做沉淀剂
Hg2++S2-=HgS↓
一般认为沉淀离子浓度小于1.0×10-5 mol/L时,则认为已经沉淀完全。
讲授新课
在NaCl溶液中含有少量的Na2S,欲将S2-除去,可加入 ( )
A.CuCl2 B.AgCl
C.NaOH D.Ag2S
B
随堂小练
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
(2) 调节pH形成氢氧化物沉淀
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀。
讲授新课
(3) 同离子效应法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
BaSO4(s) Ba2+(aq)+SO42- (aq)
讲授新课
若使Fe3+当c(Fe3+) ≤ 10-5mol·L-1 时认为已完全沉淀)完全沉淀,pH至少应为多少?
Fe (OH)3(s) Fe3+ + 3OH –
pH = 2.8
Ksp = c(Fe3+ )c3(OH–) = 2.6×10-39
随堂小练
已知Fe3+在pH3到4之间开始沉淀,在pH7到8之间沉淀完全,而Fe2+,Cu2+在8到9之间开始沉淀11到12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
先把Fe2+氧化成Fe3+,然后调pH至7到8使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
氧化剂可用:氯气、双氧水、氧气等(不引入杂质)
调pH可用:氧化铜、碳酸铜等(不引入杂质)
常见氧化剂:硝酸、高锰酸钾、氯气、氧气、双氧水等
调pH:氨水、氢氧化钠、氧化铜、碳酸铜
交流讨论
分步沉淀
溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序沉淀,叫作分步沉淀。
Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全;如AgCl、AgBr、AgI、Ag2S
讲授新课
思考与交流
1、如果要除去某溶液中的SO42-,你选择加入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪些方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成;不可能使要除去的离子通过沉淀完全除去,因为不溶是相对的,沉淀物在溶液中存在溶解平衡。
2. 沉淀的溶解
(1)原理
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。使Qc < Ksp
讲授新课
例:CaCO3(s) CO32-(aq) + Ca2+(aq)
HCO3-
+H+
+H+
H2CO3
H2O + CO2↑
(2)沉淀溶解的方法
①酸溶解法:用强酸溶解的难溶电解质有CaCO3、FeS、Al(OH)3、Ca(OH)2等。如CaCO3难溶于水,却易溶于盐酸。
CaCO3+2H+=Ca2++H2O+CO2↑
讲授新课
3Ag2S+8H+ + 2NO3-=6Ag++3S+2NO↑+4H2O
AgCl + 2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
④盐溶液溶解法:
③氧化还原溶解法:
②配位溶解法:
如Mg(OH)2溶于NH4Cl溶液
如Ag2S溶于稀HNO3
如AgCl溶于氨水
讲授新课
试管编号 ① ② ③
对应试剂 少许Mg(OH)2 少许Mg(OH)2 少许Mg(OH)2
滴加试剂 2ml蒸馏水,滴加酚酞溶液 2ml盐酸 3ml饱和NH4Cl溶液
现象
固体无明显溶解现象,溶液变浅红
迅速溶解
逐渐溶解
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH3·H2O
完成实验,记录现象,写出反应的化学方程式。
说明溶解
实验方案:分别向氢氧化镁沉淀中加入蒸馏水、酸、盐,根据实验现象,得出结论。
讲授新课
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解。
加入NH4Cl时,NH4+与OH-结合,生成弱电解质NH3·H2O(它在水中比Mg(OH)2更难电离出OH-),使c(OH-)减小,平衡右移,从而使Mg(OH)2的沉淀溶解平衡向溶解方向移动。
应用平衡移动原理分析、解释实验中发生的反应,并试从中找出使沉淀溶解的规律。
【解释】
思考与交流
思考:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4 Ba2++SO42- Ksp=1.1×10-10mol2 L-2
BaCO3 Ba2++CO32- Ksp=5.1×10-9mol2 L-2
由于人体内胃酸的酸性较强(pH0.9-1.5),如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使Qc < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体中毒。
讲授新课
BaCO3 Ba2+ + CO32-
+
H+
CO2↑+H2O
所以,不能用BaCO3作为内服造影剂“钡餐”。
而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”。
讲授新课
【实验3-4】:沉淀的转化一(教材P83)
(1)向盛有2mL0.1mol/L NaCl 溶液的试管中滴加2滴0.1mol/LAgNO3溶液,观察并记录现象。
(2)振荡试管,然后向其中滴加4滴0.1mol/LKI溶液,观察并记录现象;
(3)振荡试管,然后再向其中滴加8滴0.1mol/L的Na2S溶液,观察并记录现象。
3.沉淀转化
讲授新课
AgCl
AgI
Ag2S
KI
Na2S
根据下列图示实验,将观察到的现象填在空格内:
白色
沉淀
黄色
沉淀
黑色
沉淀
讲授新课
KI = I- + K+
AgCl(s) Ag+ + Cl-
+
AgI(s)
s(AgCl)=1.5×10-4g
s(AgI)=3.7×10-7g
s(Ag2S)=1.3×10-16g
AgCl(s)+I- AgI(s) + Cl-
沉淀的转化示意图
讲授新课
沉淀的转化示意图
Na2S = S2- + 2Na+
AgI(s) Ag+ + I-
+
Ag2S(s)
s(AgCl)=1.5×10-4g
s(AgI)=3.7×10-7g
s(Ag2S)=1.3×10-16g
2AgI(s)+S2- Ag2S(s) +2I-
讲授新课
[讨论]:从实验中可以得到什么结论?
实验说明:沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
讲授新课
【实验3-5】:探究沉淀的转化二(教材P83)
(1) 向盛有2mL0.1mol/L MgCl2溶液的试管中滴加2-4滴2mol/LNaOH溶液,观察并记录现象。
(2)向上述试管中滴加4滴0.1mol/LFeCl3溶液,静置,观察并记录现象。
讲授新课
实验结论:Fe(OH)3比Mg(OH)2溶解能力小。
向MgCl2溶液中滴加NaOH溶液
生成白色沉淀
向有白色沉淀的溶液中滴加FeCl3溶液
白色沉淀转变为红褐色
静置
红褐色沉淀析出,溶液变无色
讲授新课
(3)沉淀转化的实质:
沉淀转化的实质是沉淀溶解平衡的移动。一般是溶解度小的沉淀转化成溶解度更小的沉淀容易实现。两种沉淀的溶解度差别越大,沉淀转化越容易。
反常:当两种难溶物溶解能力差别不大时, 溶解能力相对较弱的物质在一定条件下能转化为溶解能力相对较强的物质。
讲授新课
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
(4)沉淀转化的应用
①锅炉除水垢
水垢成分CaCO3
Mg(OH)2 CaSO4
用饱和Na2CO3
溶液浸泡数天
疏松的水垢CaCO3 Mg(OH)2
用盐酸或
饱氯化铵液
除去水垢
CaSO4+CO32- CaCO3+SO42-
CaCO3+2H+=Ca2++CO2↑+H2O
Mg(OH)2+2H+=Mg2++2H2O
讲授新课
② 自然界中矿物的转化
③工业废水处理
工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
用FeS除去Hg2+的离子方程式:
FeS(s)+Hg2+(aq)=HgS(s)+ Fe2+
讲授新课
自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象。
各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO4溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使之转变为铜蓝(CuS)。
ZnS+Cu2+=CuS+Zn2+
PbS+Cu2+=CuS+Pb2+
ZnS(s) Zn2+(aq) + S2-(aq)
+
Cu2+(aq)
CuS(s)
平衡向右移动
ZnS与CuS是同类难溶物,CuS的溶解度远小于ZnS的溶解度。
讲授新课
④水垢的形成
硬水煮沸形成的水垢主要成分是CaCO3和Mg(OH)2,说明它形成的原因(用化学方程式表示)。
讲授新课
石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.KCl溶液
C.NaOH溶液 D.CaCl2溶液
A
随堂一练
已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是 ( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
D
随堂一练
练习:龋齿的形成原因及防治方法
(1) 牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
Ca5(PO4)3OH(s) 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59
发酵生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
讲授新课
(2)已知Ca5(PO4)3F的KSP=2.8×10-61,比Ca5(PO4)3OH更难溶,牙膏里的氟离子会与Ca5(PO4)3OH反应。请用离子方程式表示使用含氟牙膏防止龋齿的原因
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
讲授新课
沉淀溶解平衡的应用
沉淀的转化
沉淀的生成
沉淀的溶解
总结归纳
感谢您的观看
章
三
第
水溶液中的离子反应与平衡
第四节
沉淀溶解平衡
第2课时
沉淀溶解平衡的应用
1、沉淀的生成
(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
讲授新课
工业废水的处理
工业废水
硫化物等
重金属离子(如Cu2+、Hg2+等)转化成沉淀
讲授新课
原则: 生成沉淀的反应能发生,且进行得越完全越好
方法:
(1) 加沉淀剂
Cu2++S2-=CuS↓
沉淀Cu2+、Hg2+等,可以用Na2S或H2S做沉淀剂
Hg2++S2-=HgS↓
一般认为沉淀离子浓度小于1.0×10-5 mol/L时,则认为已经沉淀完全。
讲授新课
在NaCl溶液中含有少量的Na2S,欲将S2-除去,可加入 ( )
A.CuCl2 B.AgCl
C.NaOH D.Ag2S
B
随堂小练
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.67
Fe(OH)3 1.48 2.81
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
(2) 调节pH形成氢氧化物沉淀
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀。
讲授新课
(3) 同离子效应法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
BaSO4(s) Ba2+(aq)+SO42- (aq)
讲授新课
若使Fe3+当c(Fe3+) ≤ 10-5mol·L-1 时认为已完全沉淀)完全沉淀,pH至少应为多少?
Fe (OH)3(s) Fe3+ + 3OH –
pH = 2.8
Ksp = c(Fe3+ )c3(OH–) = 2.6×10-39
随堂小练
已知Fe3+在pH3到4之间开始沉淀,在pH7到8之间沉淀完全,而Fe2+,Cu2+在8到9之间开始沉淀11到12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
先把Fe2+氧化成Fe3+,然后调pH至7到8使Fe3+转化为Fe(OH)3 沉淀,过滤除去沉淀。
氧化剂可用:氯气、双氧水、氧气等(不引入杂质)
调pH可用:氧化铜、碳酸铜等(不引入杂质)
常见氧化剂:硝酸、高锰酸钾、氯气、氧气、双氧水等
调pH:氨水、氢氧化钠、氧化铜、碳酸铜
交流讨论
分步沉淀
溶液中含有几种离子,加入某沉淀剂均可生成沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序沉淀,叫作分步沉淀。
Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全;如AgCl、AgBr、AgI、Ag2S
讲授新课
思考与交流
1、如果要除去某溶液中的SO42-,你选择加入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪些方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成;不可能使要除去的离子通过沉淀完全除去,因为不溶是相对的,沉淀物在溶液中存在溶解平衡。
2. 沉淀的溶解
(1)原理
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。使Qc < Ksp
讲授新课
例:CaCO3(s) CO32-(aq) + Ca2+(aq)
HCO3-
+H+
+H+
H2CO3
H2O + CO2↑
(2)沉淀溶解的方法
①酸溶解法:用强酸溶解的难溶电解质有CaCO3、FeS、Al(OH)3、Ca(OH)2等。如CaCO3难溶于水,却易溶于盐酸。
CaCO3+2H+=Ca2++H2O+CO2↑
讲授新课
3Ag2S+8H+ + 2NO3-=6Ag++3S+2NO↑+4H2O
AgCl + 2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
④盐溶液溶解法:
③氧化还原溶解法:
②配位溶解法:
如Mg(OH)2溶于NH4Cl溶液
如Ag2S溶于稀HNO3
如AgCl溶于氨水
讲授新课
试管编号 ① ② ③
对应试剂 少许Mg(OH)2 少许Mg(OH)2 少许Mg(OH)2
滴加试剂 2ml蒸馏水,滴加酚酞溶液 2ml盐酸 3ml饱和NH4Cl溶液
现象
固体无明显溶解现象,溶液变浅红
迅速溶解
逐渐溶解
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH3·H2O
完成实验,记录现象,写出反应的化学方程式。
说明溶解
实验方案:分别向氢氧化镁沉淀中加入蒸馏水、酸、盐,根据实验现象,得出结论。
讲授新课
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解。
加入NH4Cl时,NH4+与OH-结合,生成弱电解质NH3·H2O(它在水中比Mg(OH)2更难电离出OH-),使c(OH-)减小,平衡右移,从而使Mg(OH)2的沉淀溶解平衡向溶解方向移动。
应用平衡移动原理分析、解释实验中发生的反应,并试从中找出使沉淀溶解的规律。
【解释】
思考与交流
思考:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4 Ba2++SO42- Ksp=1.1×10-10mol2 L-2
BaCO3 Ba2++CO32- Ksp=5.1×10-9mol2 L-2
由于人体内胃酸的酸性较强(pH0.9-1.5),如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使Qc < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体中毒。
讲授新课
BaCO3 Ba2+ + CO32-
+
H+
CO2↑+H2O
所以,不能用BaCO3作为内服造影剂“钡餐”。
而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”。
讲授新课
【实验3-4】:沉淀的转化一(教材P83)
(1)向盛有2mL0.1mol/L NaCl 溶液的试管中滴加2滴0.1mol/LAgNO3溶液,观察并记录现象。
(2)振荡试管,然后向其中滴加4滴0.1mol/LKI溶液,观察并记录现象;
(3)振荡试管,然后再向其中滴加8滴0.1mol/L的Na2S溶液,观察并记录现象。
3.沉淀转化
讲授新课
AgCl
AgI
Ag2S
KI
Na2S
根据下列图示实验,将观察到的现象填在空格内:
白色
沉淀
黄色
沉淀
黑色
沉淀
讲授新课
KI = I- + K+
AgCl(s) Ag+ + Cl-
+
AgI(s)
s(AgCl)=1.5×10-4g
s(AgI)=3.7×10-7g
s(Ag2S)=1.3×10-16g
AgCl(s)+I- AgI(s) + Cl-
沉淀的转化示意图
讲授新课
沉淀的转化示意图
Na2S = S2- + 2Na+
AgI(s) Ag+ + I-
+
Ag2S(s)
s(AgCl)=1.5×10-4g
s(AgI)=3.7×10-7g
s(Ag2S)=1.3×10-16g
2AgI(s)+S2- Ag2S(s) +2I-
讲授新课
[讨论]:从实验中可以得到什么结论?
实验说明:沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
讲授新课
【实验3-5】:探究沉淀的转化二(教材P83)
(1) 向盛有2mL0.1mol/L MgCl2溶液的试管中滴加2-4滴2mol/LNaOH溶液,观察并记录现象。
(2)向上述试管中滴加4滴0.1mol/LFeCl3溶液,静置,观察并记录现象。
讲授新课
实验结论:Fe(OH)3比Mg(OH)2溶解能力小。
向MgCl2溶液中滴加NaOH溶液
生成白色沉淀
向有白色沉淀的溶液中滴加FeCl3溶液
白色沉淀转变为红褐色
静置
红褐色沉淀析出,溶液变无色
讲授新课
(3)沉淀转化的实质:
沉淀转化的实质是沉淀溶解平衡的移动。一般是溶解度小的沉淀转化成溶解度更小的沉淀容易实现。两种沉淀的溶解度差别越大,沉淀转化越容易。
反常:当两种难溶物溶解能力差别不大时, 溶解能力相对较弱的物质在一定条件下能转化为溶解能力相对较强的物质。
讲授新课
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
(4)沉淀转化的应用
①锅炉除水垢
水垢成分CaCO3
Mg(OH)2 CaSO4
用饱和Na2CO3
溶液浸泡数天
疏松的水垢CaCO3 Mg(OH)2
用盐酸或
饱氯化铵液
除去水垢
CaSO4+CO32- CaCO3+SO42-
CaCO3+2H+=Ca2++CO2↑+H2O
Mg(OH)2+2H+=Mg2++2H2O
讲授新课
② 自然界中矿物的转化
③工业废水处理
工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
用FeS除去Hg2+的离子方程式:
FeS(s)+Hg2+(aq)=HgS(s)+ Fe2+
讲授新课
自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象。
各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO4溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使之转变为铜蓝(CuS)。
ZnS+Cu2+=CuS+Zn2+
PbS+Cu2+=CuS+Pb2+
ZnS(s) Zn2+(aq) + S2-(aq)
+
Cu2+(aq)
CuS(s)
平衡向右移动
ZnS与CuS是同类难溶物,CuS的溶解度远小于ZnS的溶解度。
讲授新课
④水垢的形成
硬水煮沸形成的水垢主要成分是CaCO3和Mg(OH)2,说明它形成的原因(用化学方程式表示)。
讲授新课
石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.KCl溶液
C.NaOH溶液 D.CaCl2溶液
A
随堂一练
已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是 ( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
D
随堂一练
练习:龋齿的形成原因及防治方法
(1) 牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
Ca5(PO4)3OH(s) 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59
发酵生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
讲授新课
(2)已知Ca5(PO4)3F的KSP=2.8×10-61,比Ca5(PO4)3OH更难溶,牙膏里的氟离子会与Ca5(PO4)3OH反应。请用离子方程式表示使用含氟牙膏防止龋齿的原因
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
讲授新课
沉淀溶解平衡的应用
沉淀的转化
沉淀的生成
沉淀的溶解
总结归纳
感谢您的观看
