4.2.1 电解原理课件 (共33张PPT)人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1 电解原理课件 (共33张PPT)人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-18 22:33:11 | ||
图片预览









文档简介
(共33张PPT)
章
四
第
化学反应与电能
第2节
电解池
第1课时
电解原理
Zn
Cu
CuCl2溶液
(1)两个活性不同的电极
(2)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(3)形成闭合回路
(4)自发进行的氧化还原反应
1、构成原电池的条件是什么
负极:
正极:
电池总反应:
Zn – 2e- = Zn2+
Cu2+ + 2e- = Cu
Zn+Cu2+ = Zn2++Cu
2、原电池的电极反应式
3、原电池中的能量转化方式是什么?
化学能转化成电能
知识回顾
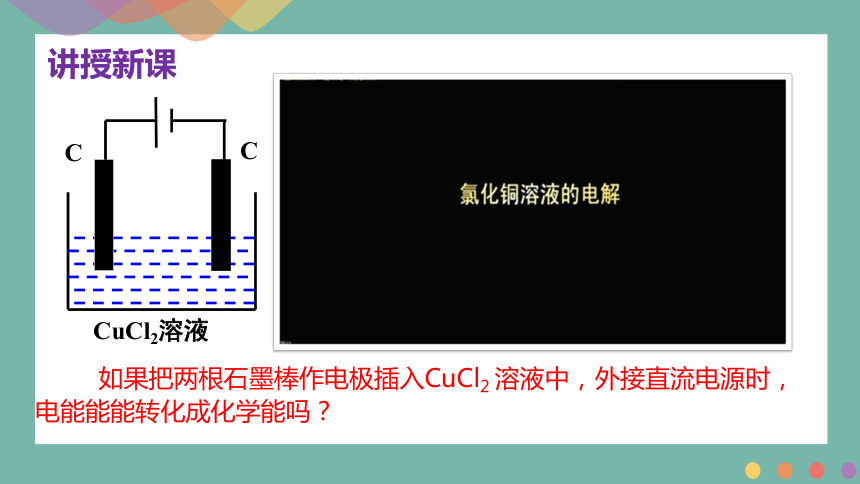
如果把两根石墨棒作电极插入CuCl2 溶液中,外接直流电源时,电能能能转化成化学能吗?
C
C
CuCl2溶液
讲授新课
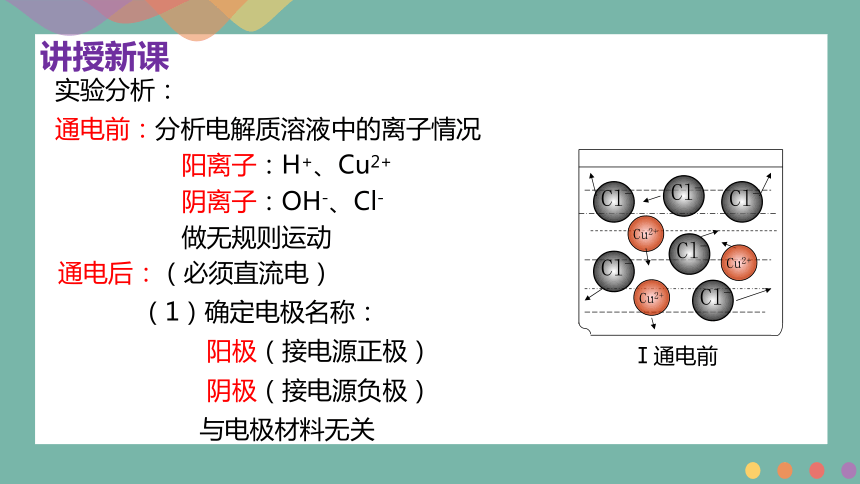
实验分析:
通电前:分析电解质溶液中的离子情况
阳离子:H+、Cu2+
阴离子:OH-、Cl-
做无规则运动
通电后:(必须直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Ⅰ通电前
讲授新课
实践探究
思考1:在通电时这些微粒各向什么区移动?
Cu2+ 、 H+向阴极区移动; Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考2:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
- +
阴极
阳极
Ⅱ通电后
讲授新课
有气泡,湿润KI-淀 粉试纸变蓝,气体有刺激性气味
碳棒上有一层红色的物质析出
阴极:
阳极:
阳离子 阴极
阴离子 阳极
闭合回路特点
e-
溶液中离子定向移动
负极 阴极 阳极 正极
e-
2Cl--2 e- =Cl2↑
Cu2++ 2e-=2Cu
CuCl2 Cu+Cl2 ↑
电解
溶液中氢离子和氢氧根离子定向移动吗?为什么它们没有放电?
+
-
石墨
石墨
CuCl2溶液
Cu2+
Cu2+
Cl-
e-
e-
e-
e-
讲授新课
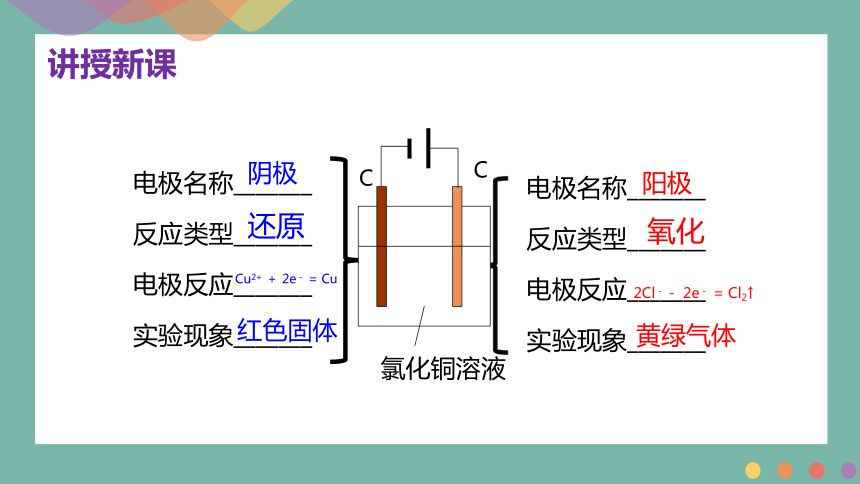
电极名称_______
反应类型_______
电极反应_______
实验现象_______
电极名称_______
反应类型_______
电极反应_______
实验现象_______
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2+ + 2e- = Cu
红色固体
2Cl-- 2e- = Cl2↑
黄绿气体
讲授新课
1、电解
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
2、电解池(电解槽)
把电能转化为化学能的装置
注意:①电流应是直流电
②熔融态的电解质也能被电解
讲授新课
3、电解池构成条件
(1) 外加直流电源
(2) 电极
(3) 电解质溶液或熔融电解质
阳极:接电源正极
阴极:接电源负极
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
电极
材料
名称
(4)形成闭合回路
讲授新课
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
分析下图,属于电解池的是( )
C
Cu
氯化铜溶液
D
C
D
随堂一练
下列说法错误的是( )
A、由电能转化为化学能的装置叫电解池
B、在电解池中跟直流电源的正极相连的电极是电解池的阳极
C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D、电解池中阴极发生还原反应,阳极发生氧化反应
C
随堂一练
阴极放电顺序(阳离子得电子能力)
Al3+~ K+水溶液中不放电,熔融状态放电
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。
4.放电顺序
(即失或得电子的顺序)
讲授新课
S2->SO32->I->Br->Cl->OH- >(含氧酸根)>F-
①用活性电极:金属失电子
②用惰性电极:阴离子放电顺序:
阳极:
看电极材料是否参与反应:
惰性电极(只传递电子本身不失电子): 铂Pt、金Au、石墨C、
活性电极:除铂、金外的金属,如Cu、Ag、Fe等
含氧酸根、 F-在水溶液中不放电
讲授新课
无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2等)溶液的电解
阴极:2H+ + 2e- =H2↑
阳极:2Cl- -2e- =Cl2↑
总反应:2HCl ====Cl2↑+H2↑
通电
1、电解电解质型:
5、电解规律(用惰性电极电解时)
实质:电解质本身被电解
增大
通入HCl
溶液pH变化:
溶液复原方法:
电解盐酸:
讲授新课
实例 电极反应 浓度 pH值 复原
CuSO4
阳极
阴极
氧
气
铜
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
减小
减小
加CuO
CuSO4溶液
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
2、放氧生酸型:
不活泼金属的含氧酸盐 (如CuSO4、AgNO3等)溶液的电解。
讲授新课
阳极
阴极
氯气
氢
气
NaCl溶液
实例 电极反应 浓度 pH 复原
NaCl
阳极: 2Cl- - 2e- = Cl 2↑
阴极: 2H ++ 2e- =H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
减小
增大
加HCl
3、放氢生碱型:
活泼金属的无氧酸盐(如NaCl、K2S等)溶液的电解
讲授新课
阳极
阴极
氧气
氢
气
Na2SO4溶液
实例 电极反应 浓度 pH 复原
Na2SO4
阳极: 4OH- - 4e- =2H2O+O2 ↑
阴极: 4H ++ 4e- = 2H2 ↑
变大
不变
加H2O
2H2O 2H2 ↑ + O2 ↑
电解
4、电解水型:
含氧酸、强碱、活泼金属的含氧酸盐(如H2SO4、NaOH、Na2SO4 等)的电解。
讲授新课
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
讲授新课
图中x﹑y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭的气体放出,符合这一情况的是 ( )
a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
A
a
b
Z溶液
x y
. .
随堂一练
用石墨电极电解硫酸铜溶液,一段时间后断开电路,要使溶液恢复到电解前的浓度应向其中加入( )
A 、CuSO4 B 、 H2O C 、CuO D 、Cu(OH)2
C
用用石墨电极电解1mol/LNaCl溶液,一段时间后,此时NaCl溶液浓度变为0.5mol/L,要使溶液恢复到电解前的浓度应向其中加入( )
A、NaCl(s) B、H2O C、通入HCl气体 D 、盐酸
C
随堂一练
用Pt电极长时间电解下列溶液,整个溶液的pH不发生变化的是( )
A.KNO3
B.Ba(OH)2
C.CaCl2
D.H2SO4
A
随堂一练
下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
A C
随堂一练
如图所示,通电后A极上析出Ag,则有关叙述正确的是( )
A.P是电源的正极
B.F极上发生的反应为:
4OH- - 4e-=2H2O+O2↑
C.电解时,甲、乙、丙三池中,
除E、F两极外,其余电极均参
加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
B
随堂一练
(2)电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒(电子看作负电荷)
(3)标明条件:通电或电解。若电解的H+或OH-来自于H2O,在方程式中要以H2O形式存在,不能书写H+或OH-作为反应物
(4)电解反应是一个氧化还原反应,是被外界强迫发生的反应,所以:弱氧化剂+弱还原剂 = 强氧化剂+强还原剂的反应形式也很常见
(1)首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
6.电极反应式的书写
讲授新课
(包括水的电离,并分 成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法小结
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
讲授新课
1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时。下列判断(设电解按理论进行,溶液不蒸发)正确的是( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个
D.反应中有0.01mol的Ag被氧化
C
随堂一练
用Pt作电极电解某种溶液,通电一段时间后,溶液的pH值变小,并且在阳极得到0.56L气体,阴极得到1.12L气体(两气体均在相同条件下测定).由此可知溶液可能是( )
A﹑稀盐酸 B﹑KNO3溶液
C﹑CuSO4溶液 D﹑稀硫酸
D
随堂一练
用阳极X和阴极Y电解Z的水溶液,然后加入P 能使溶液回复电解前的状态的组是( )
X Y Z P
A. Pt Pt NaOH NaOH
B. Cu Cu CuSO4 CuSO4
C. Cu Pt Cu(NO3)2 CuO
D. Pt Pt H2SO4 H2O
D
随堂一练
根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
随堂一练
在相同条件下,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为( )
A.108g B.54g
C.216g D.64g
C
随堂一练
1、电解
5、电极反应式的书写
2、电解池(电解槽)
3、电解池构成条件
4、电解规律
总结归纳
感谢您的观看
章
四
第
化学反应与电能
第2节
电解池
第1课时
电解原理
Zn
Cu
CuCl2溶液
(1)两个活性不同的电极
(2)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(3)形成闭合回路
(4)自发进行的氧化还原反应
1、构成原电池的条件是什么
负极:
正极:
电池总反应:
Zn – 2e- = Zn2+
Cu2+ + 2e- = Cu
Zn+Cu2+ = Zn2++Cu
2、原电池的电极反应式
3、原电池中的能量转化方式是什么?
化学能转化成电能
知识回顾
如果把两根石墨棒作电极插入CuCl2 溶液中,外接直流电源时,电能能能转化成化学能吗?
C
C
CuCl2溶液
讲授新课
实验分析:
通电前:分析电解质溶液中的离子情况
阳离子:H+、Cu2+
阴离子:OH-、Cl-
做无规则运动
通电后:(必须直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Ⅰ通电前
讲授新课
实践探究
思考1:在通电时这些微粒各向什么区移动?
Cu2+ 、 H+向阴极区移动; Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考2:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
- +
阴极
阳极
Ⅱ通电后
讲授新课
有气泡,湿润KI-淀 粉试纸变蓝,气体有刺激性气味
碳棒上有一层红色的物质析出
阴极:
阳极:
阳离子 阴极
阴离子 阳极
闭合回路特点
e-
溶液中离子定向移动
负极 阴极 阳极 正极
e-
2Cl--2 e- =Cl2↑
Cu2++ 2e-=2Cu
CuCl2 Cu+Cl2 ↑
电解
溶液中氢离子和氢氧根离子定向移动吗?为什么它们没有放电?
+
-
石墨
石墨
CuCl2溶液
Cu2+
Cu2+
Cl-
e-
e-
e-
e-
讲授新课
电极名称_______
反应类型_______
电极反应_______
实验现象_______
电极名称_______
反应类型_______
电极反应_______
实验现象_______
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2+ + 2e- = Cu
红色固体
2Cl-- 2e- = Cl2↑
黄绿气体
讲授新课
1、电解
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
2、电解池(电解槽)
把电能转化为化学能的装置
注意:①电流应是直流电
②熔融态的电解质也能被电解
讲授新课
3、电解池构成条件
(1) 外加直流电源
(2) 电极
(3) 电解质溶液或熔融电解质
阳极:接电源正极
阴极:接电源负极
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
电极
材料
名称
(4)形成闭合回路
讲授新课
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
分析下图,属于电解池的是( )
C
Cu
氯化铜溶液
D
C
D
随堂一练
下列说法错误的是( )
A、由电能转化为化学能的装置叫电解池
B、在电解池中跟直流电源的正极相连的电极是电解池的阳极
C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D、电解池中阴极发生还原反应,阳极发生氧化反应
C
随堂一练
阴极放电顺序(阳离子得电子能力)
Al3+~ K+水溶液中不放电,熔融状态放电
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>
H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。
4.放电顺序
(即失或得电子的顺序)
讲授新课
S2->SO32->I->Br->Cl->OH- >(含氧酸根)>F-
①用活性电极:金属失电子
②用惰性电极:阴离子放电顺序:
阳极:
看电极材料是否参与反应:
惰性电极(只传递电子本身不失电子): 铂Pt、金Au、石墨C、
活性电极:除铂、金外的金属,如Cu、Ag、Fe等
含氧酸根、 F-在水溶液中不放电
讲授新课
无氧酸、不活泼金属的无氧酸盐(如HCl、CuCl2等)溶液的电解
阴极:2H+ + 2e- =H2↑
阳极:2Cl- -2e- =Cl2↑
总反应:2HCl ====Cl2↑+H2↑
通电
1、电解电解质型:
5、电解规律(用惰性电极电解时)
实质:电解质本身被电解
增大
通入HCl
溶液pH变化:
溶液复原方法:
电解盐酸:
讲授新课
实例 电极反应 浓度 pH值 复原
CuSO4
阳极
阴极
氧
气
铜
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
减小
减小
加CuO
CuSO4溶液
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
2、放氧生酸型:
不活泼金属的含氧酸盐 (如CuSO4、AgNO3等)溶液的电解。
讲授新课
阳极
阴极
氯气
氢
气
NaCl溶液
实例 电极反应 浓度 pH 复原
NaCl
阳极: 2Cl- - 2e- = Cl 2↑
阴极: 2H ++ 2e- =H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
减小
增大
加HCl
3、放氢生碱型:
活泼金属的无氧酸盐(如NaCl、K2S等)溶液的电解
讲授新课
阳极
阴极
氧气
氢
气
Na2SO4溶液
实例 电极反应 浓度 pH 复原
Na2SO4
阳极: 4OH- - 4e- =2H2O+O2 ↑
阴极: 4H ++ 4e- = 2H2 ↑
变大
不变
加H2O
2H2O 2H2 ↑ + O2 ↑
电解
4、电解水型:
含氧酸、强碱、活泼金属的含氧酸盐(如H2SO4、NaOH、Na2SO4 等)的电解。
讲授新课
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
讲授新课
图中x﹑y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭的气体放出,符合这一情况的是 ( )
a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
A
a
b
Z溶液
x y
. .
随堂一练
用石墨电极电解硫酸铜溶液,一段时间后断开电路,要使溶液恢复到电解前的浓度应向其中加入( )
A 、CuSO4 B 、 H2O C 、CuO D 、Cu(OH)2
C
用用石墨电极电解1mol/LNaCl溶液,一段时间后,此时NaCl溶液浓度变为0.5mol/L,要使溶液恢复到电解前的浓度应向其中加入( )
A、NaCl(s) B、H2O C、通入HCl气体 D 、盐酸
C
随堂一练
用Pt电极长时间电解下列溶液,整个溶液的pH不发生变化的是( )
A.KNO3
B.Ba(OH)2
C.CaCl2
D.H2SO4
A
随堂一练
下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
A C
随堂一练
如图所示,通电后A极上析出Ag,则有关叙述正确的是( )
A.P是电源的正极
B.F极上发生的反应为:
4OH- - 4e-=2H2O+O2↑
C.电解时,甲、乙、丙三池中,
除E、F两极外,其余电极均参
加了反应
D.通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
B
随堂一练
(2)电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒(电子看作负电荷)
(3)标明条件:通电或电解。若电解的H+或OH-来自于H2O,在方程式中要以H2O形式存在,不能书写H+或OH-作为反应物
(4)电解反应是一个氧化还原反应,是被外界强迫发生的反应,所以:弱氧化剂+弱还原剂 = 强氧化剂+强还原剂的反应形式也很常见
(1)首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
6.电极反应式的书写
讲授新课
(包括水的电离,并分 成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法小结
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
讲授新课
1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时。下列判断(设电解按理论进行,溶液不蒸发)正确的是( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个
D.反应中有0.01mol的Ag被氧化
C
随堂一练
用Pt作电极电解某种溶液,通电一段时间后,溶液的pH值变小,并且在阳极得到0.56L气体,阴极得到1.12L气体(两气体均在相同条件下测定).由此可知溶液可能是( )
A﹑稀盐酸 B﹑KNO3溶液
C﹑CuSO4溶液 D﹑稀硫酸
D
随堂一练
用阳极X和阴极Y电解Z的水溶液,然后加入P 能使溶液回复电解前的状态的组是( )
X Y Z P
A. Pt Pt NaOH NaOH
B. Cu Cu CuSO4 CuSO4
C. Cu Pt Cu(NO3)2 CuO
D. Pt Pt H2SO4 H2O
D
随堂一练
根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
随堂一练
在相同条件下,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为( )
A.108g B.54g
C.216g D.64g
C
随堂一练
1、电解
5、电极反应式的书写
2、电解池(电解槽)
3、电解池构成条件
4、电解规律
总结归纳
感谢您的观看
