4.2.2 电解原理的应用 课件(共31张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.2 电解原理的应用 课件(共31张PPT) 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
章
四
第
化学反应与电能
第2节
电解池
第2课时
电解原理的应用
饱和食盐水
C
C
1、电解饱和食盐水
思考: 若在两极附近均滴加酚酞试液,会有什么现象
制烧碱、氯气和氢气 (氯碱工业)
阴极:
阳极:
总反应:
2H+ + 2e- = H2↑
2Cl- -2e- = Cl2↑
2H2O + 2Cl- = H2↑ + Cl2↑ + 2OH-
电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
电解
阴极试液变红!阳极无明显变化!
讲授新课
上述装置的缺点:
1.H2和Cl2 混合不安全
2.Cl2会和NaOH反应,会使得到的NaOH不纯
讲授新课
-
+
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
氯碱工业:离子交换膜法制烧碱
Na+
讲授新课
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢 阳极:钛
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
(2)离子交换膜的作用:
a、防止H2和Cl2混合而引起爆炸;
b、避免Cl2和NaOH反应影响NaOH的产量。
氯碱工业:离子交换膜法制烧碱
讲授新课
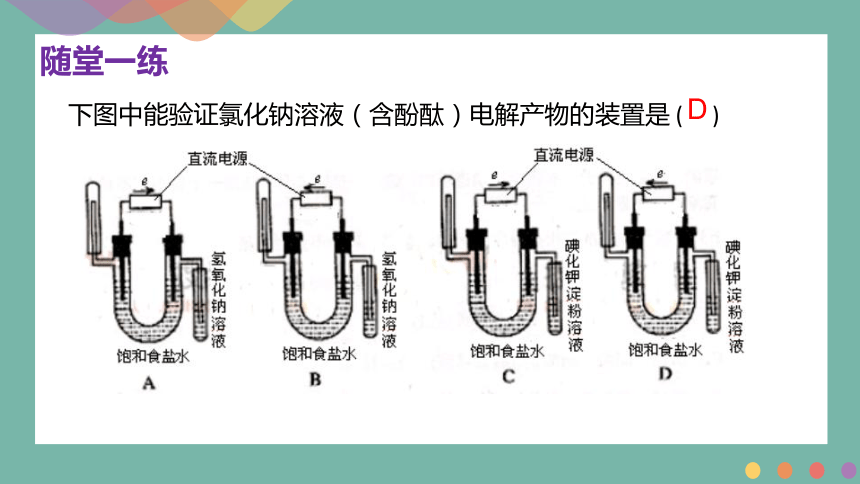
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
D
随堂一练
关于电解NaCl水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
随堂一练
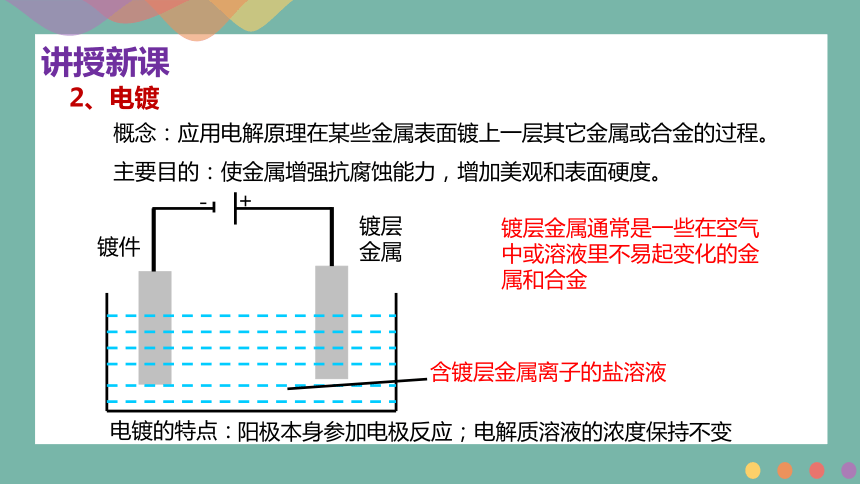
2、电镀
概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
主要目的:使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
电镀的特点:
阳极本身参加电极反应;电解质溶液的浓度保持不变
讲授新课
电镀
讲授新课
镀层金属
待镀
金属
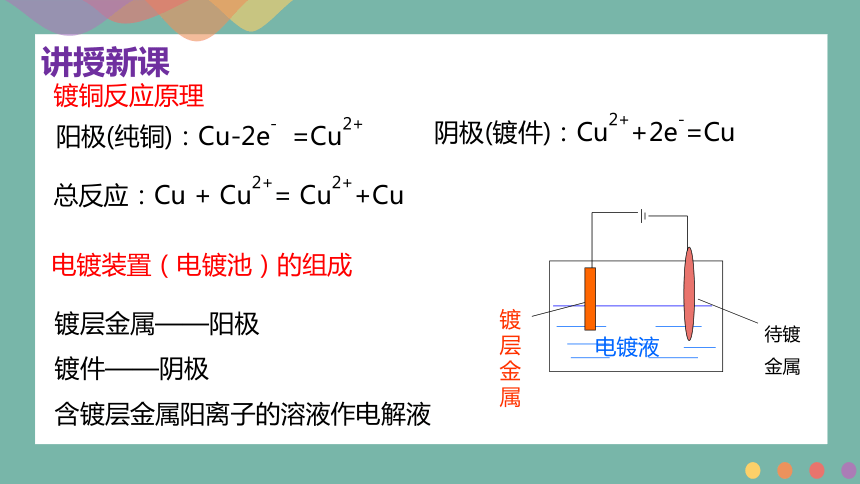
电镀液
阳极(纯铜):Cu-2e- =Cu2+
镀铜反应原理
总反应:Cu + Cu2+= Cu2++Cu
阴极(镀件):Cu2++2e-=Cu
镀层金属——阳极
镀件——阴极
含镀层金属阳离子的溶液作电解液
电镀装置(电镀池)的组成
讲授新课
电镀摆件及电镀金杯
电镀车间
讲授新课
1. a 、b哪一极为正极?
2. 若要给铁叉镀锌,a端电极选用什么材料?选择何种溶液?
思考:
e-
镀件作阴极,所以b为负极,a为正极。
锌是镀层金属,则a端电极应选用纯锌作电极材料;选择可溶性锌盐作电镀液。
讲授新课
若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜上发生的反应是:Ag++e—=Ag
④在银片上发生的反应是:4OH—-4e—=O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④ D、②③④⑥
B
随堂一练
3.电解精炼
讲授新课
(1)粗铜 含杂质(Zn Fe Ni Ag Au 等)
阳极:
Zn - 2e- = Zn2+
Fe - 2e- = Fe2+
Ni - 2e- = Ni2+
Cu - 2e- = Cu2+
Zn Fe Ni
Cu
Ag Au
阳极泥
CuSO4溶液
粗铜
纯铜
阴极: Cu2+ + 2e- → Cu
问:电解完后,CuSO4溶液的浓度有何变化?
(2)粗铜的精炼
以粗铜为阳极,以纯铜为阴极,以CuSO4溶液为电解液进行电解
以阳离子形式留于溶液中
减小
讲授新课
铜的电解精炼示意图
讲授新课
铜精炼阳极炉车间
镍铁精炼炉
讲授新课
下列关于铜电极的叙述不正确的是( )
A. 铜锌原电池中铜是正极
B. 用电解法精炼粗铜时粗铜作阳极
C. 在镀件上电镀铜时,用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
D
随堂一练
用含少量铁的粗铜做阳极,纯铜片做阴极,硫酸铜溶液做电解液,电解一段时间后,阳极质量减少xg,则( )
A、电解液质量增加Xg
B、阴极质量增加Xg
D、阴极质量增加ag,且a < x
C、阴极质量增加ag,且a>x
C
随堂一练
以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
随堂一练
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
随堂一练
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
讲授新课
4.电冶金(使用电解法冶炼像钠、钙、镁、铝等活泼金属的方法)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
讲授新课
(1)原理:
使矿石中的金属离子获得电子,从它们的化合物中还原出来。
Mn+ + ne- = M
如,电解熔融NaCl制金属钠
2NaCl(熔融)=2Na + Cl2
通直流电后—— 阳极:2 Cl--2e- = Cl2↑
阴极: Na+ + e- = Na
讲授新课
讲授新课
请写出电解熔融的Al2O3的电极反应式和总反应式
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) = 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
讲授新课
(双选)下列可被工业上采用的冶金方法是
A.电解氯化钠溶液制钠
B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝
D.高温下用一氧化碳还原氧化铁制铁
BD
随堂一练
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
随堂一练
1.电解饱和食盐水
以制造烧碱、氯气和氢气。(氯碱工业)
2.电镀
3.电解精炼铜
4.电解冶金
总结归纳
感谢您的观看
章
四
第
化学反应与电能
第2节
电解池
第2课时
电解原理的应用
饱和食盐水
C
C
1、电解饱和食盐水
思考: 若在两极附近均滴加酚酞试液,会有什么现象
制烧碱、氯气和氢气 (氯碱工业)
阴极:
阳极:
总反应:
2H+ + 2e- = H2↑
2Cl- -2e- = Cl2↑
2H2O + 2Cl- = H2↑ + Cl2↑ + 2OH-
电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
电解
阴极试液变红!阳极无明显变化!
讲授新课
上述装置的缺点:
1.H2和Cl2 混合不安全
2.Cl2会和NaOH反应,会使得到的NaOH不纯
讲授新课
-
+
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
氯碱工业:离子交换膜法制烧碱
Na+
讲授新课
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢 阳极:钛
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
(2)离子交换膜的作用:
a、防止H2和Cl2混合而引起爆炸;
b、避免Cl2和NaOH反应影响NaOH的产量。
氯碱工业:离子交换膜法制烧碱
讲授新课
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
D
随堂一练
关于电解NaCl水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
随堂一练
2、电镀
概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
主要目的:使金属增强抗腐蚀能力,增加美观和表面硬度。
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金
电镀的特点:
阳极本身参加电极反应;电解质溶液的浓度保持不变
讲授新课
电镀
讲授新课
镀层金属
待镀
金属
电镀液
阳极(纯铜):Cu-2e- =Cu2+
镀铜反应原理
总反应:Cu + Cu2+= Cu2++Cu
阴极(镀件):Cu2++2e-=Cu
镀层金属——阳极
镀件——阴极
含镀层金属阳离子的溶液作电解液
电镀装置(电镀池)的组成
讲授新课
电镀摆件及电镀金杯
电镀车间
讲授新课
1. a 、b哪一极为正极?
2. 若要给铁叉镀锌,a端电极选用什么材料?选择何种溶液?
思考:
e-
镀件作阴极,所以b为负极,a为正极。
锌是镀层金属,则a端电极应选用纯锌作电极材料;选择可溶性锌盐作电镀液。
讲授新课
若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜上发生的反应是:Ag++e—=Ag
④在银片上发生的反应是:4OH—-4e—=O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④ D、②③④⑥
B
随堂一练
3.电解精炼
讲授新课
(1)粗铜 含杂质(Zn Fe Ni Ag Au 等)
阳极:
Zn - 2e- = Zn2+
Fe - 2e- = Fe2+
Ni - 2e- = Ni2+
Cu - 2e- = Cu2+
Zn Fe Ni
Cu
Ag Au
阳极泥
CuSO4溶液
粗铜
纯铜
阴极: Cu2+ + 2e- → Cu
问:电解完后,CuSO4溶液的浓度有何变化?
(2)粗铜的精炼
以粗铜为阳极,以纯铜为阴极,以CuSO4溶液为电解液进行电解
以阳离子形式留于溶液中
减小
讲授新课
铜的电解精炼示意图
讲授新课
铜精炼阳极炉车间
镍铁精炼炉
讲授新课
下列关于铜电极的叙述不正确的是( )
A. 铜锌原电池中铜是正极
B. 用电解法精炼粗铜时粗铜作阳极
C. 在镀件上电镀铜时,用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
D
随堂一练
用含少量铁的粗铜做阳极,纯铜片做阴极,硫酸铜溶液做电解液,电解一段时间后,阳极质量减少xg,则( )
A、电解液质量增加Xg
B、阴极质量增加Xg
D、阴极质量增加ag,且a < x
C、阴极质量增加ag,且a>x
C
随堂一练
以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
随堂一练
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
随堂一练
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
讲授新课
4.电冶金(使用电解法冶炼像钠、钙、镁、铝等活泼金属的方法)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
讲授新课
(1)原理:
使矿石中的金属离子获得电子,从它们的化合物中还原出来。
Mn+ + ne- = M
如,电解熔融NaCl制金属钠
2NaCl(熔融)=2Na + Cl2
通直流电后—— 阳极:2 Cl--2e- = Cl2↑
阴极: Na+ + e- = Na
讲授新课
讲授新课
请写出电解熔融的Al2O3的电极反应式和总反应式
阴极:
阳极:
总反应:
4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) = 4Al + 3O2↑
电解
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
冰晶石
讲授新课
(双选)下列可被工业上采用的冶金方法是
A.电解氯化钠溶液制钠
B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝
D.高温下用一氧化碳还原氧化铁制铁
BD
随堂一练
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
A.右侧发生的电极方程式:O2+4e-+2H2O=4OH-
B.电解槽内发生反应的总化学方程式是:
KI+3H2O=KIO3+3H2↑
C.电解结束后,右侧溶液中不可能含有IO3-
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变
B
随堂一练
1.电解饱和食盐水
以制造烧碱、氯气和氢气。(氯碱工业)
2.电镀
3.电解精炼铜
4.电解冶金
总结归纳
感谢您的观看
