黑龙江省大庆实验中学实验一部2023-2024学年高一下学期6月阶段性质量检测试题 化学 (含答案)
文档属性
| 名称 | 黑龙江省大庆实验中学实验一部2023-2024学年高一下学期6月阶段性质量检测试题 化学 (含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 671.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 00:00:00 | ||
图片预览



文档简介
大庆实验中学实验一部2023级高一下学期
6月份阶段性质量检测
化学学科试题
2024.06.03—2024.06.04
说明:1.请将答案填涂在答题卡的指定区域内。
2.满分100分,考试时间90分钟。
一、选择题(本大题共20小题,1-15小题,每小题2分,16-20小题,每小题3分,共45分)
1.化学与人类生产、生活和社会可持续发展密切相关,下列说法正确的是( )
A.油脂、纤维素、聚乙烯和蛋白质都是高分子化合物
B.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
C.滚丙烯腈纤维可用于制毛线,聚丙烯腈纤维是有机高分子材料
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
2.下列化学用语正确的是( )
A.乙醇的球棍模型: B.一氯甲烷的电子式:
C.乙烯的结构式: D.乙酸的最简式:
3.下列有关官能团和物质类别的关系说法不正确的是( )
A.有机物分子中含有,则该有机物不一定为烯烃类
B.的官能团为(羟基),属于醇类
C.和分子中都含有(醛基),则两者同属于醛类
D.可以看作的一个氢原子被一个溴原子取代后的产物,因此属于烃的衍生物
4.下列有关同分异构体与同系物说法正确的是( )
A.组成元素相同,各元素质量分数也相同的两种化合物一定互为同分异构体
B.相对分子质量相同但结构不同的化合物一定互为同分异构体
C.凡是分子组成相差一个或若干个原子团的物质.一定互为同系物
D.符合通式的两种烃不一定互为同系物
5.分子式为能与Na反应放出气体并且能催化氧化生成醛的有机物有(不含立体结构)( )
A.4种 B.5种 C.6种 D.7种
6.下列热化学方程式书写正确的是( )
A. kJ·mol(反应热)
B. kJ mol(反应热)
C. kJ mol(燃烧热)
D. kJ mol(中和反应反应热)
7.一定温度下,有反应,现将1 mol充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A. B. C. D.
8.下列说法正确的是( )
A.聚异戊二烯和聚乙烯均能使溴水褪色
B.蔗糖水解的最终产物可以发生银镜反应
C.某有机物完全燃烧后生成和,说明该有机物中一定含有C、H、O三种元素
D.1 mol先与发生加成反应,再与发生取代反应,最多消耗 3 mol
9.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是和Zn,电解质溶液为KOH溶液,电池总反应为:。下列说法正确的是( )
A.Zn为正极,为负极
B.正极的电极反应式为:
C.在银锌电池使用过程中,电解质溶液中KOH的物质的量减小
D.当外电路中通过1 mol电子时,负极消耗物质的质量是32.5 g
10.下列有关实验的操作、现象和实验结论正确的是( )
选项 操作 现象 实验结论
A 将乙烯通入溴的四氯化碳溶液 溶液最终变为无色且有分层现象 生成的1,2-二溴乙烷无色且不溶于四氯化碳
B 取2 mL 0.2 mol/L KI溶液于试管中,加入5 mL 0.1 mol/L 溶液,充分反应后滴入5滴15%KSCN溶液溶液 变红色 与KI的反应有一定限度
C 取2mL蛋白质溶液于试管中,加入适量醋酸铅溶液,再加入足量蒸馏水 产生白色沉淀,该沉淀加入蒸馏水后不能再溶解 蛋白质变性
D 向淀粉溶液中加入几滴稀硫酸,煮沸几分钟,向冷却液中加入新制,加热 无砖红色沉淀生 成淀粉没有水解
11创新实验小组设计如图装置进行乙醇催化氧化的实验探究,下列叙述错误的是( )
A.甲烧杯中为热水、乙烧杯中为冷水
B.试管a收集到的液体中至少有两种有机物
C.铜网为该反应的催化剂,能降低反应的活化能和焓变
D.反应开始后熄灭酒精灯,铜网仍能红热,说明乙醇的催化氧化是放热反应
12.A为单烯烃或者单炔烃,A与氢气完全加成后所得产物的结构简式为,当A为单烯烃时有X种结构,当A为单炔烃时有Y种结构,X和Y的值分别为()
A.7和2 B.9和2 C.7和3 D.9和3
13.将2 mol X和2 mol Y充入2 L密闭容器中进行反应:。2 min末该反应达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L,下列叙述错误的是( )
A.a的值为2 B.平衡时X的浓度为0.8 mol L
C.平衡时Y的物质的量为0.8 mol D.0~2 min内Y的反应速率为0.6 mol L min
14.某科研机构将汽车尾气中的NO和CO设计成如图所示的燃料电池,实现了NO和CO的无害转化。下列说法正确的是( )
A.石墨Ⅰ为负极,发生还原反应
B.电池工作时,向石墨Ⅱ电极处移动
C.石墨Ⅱ电极反应式为
D.石墨Ⅰ生成28 g 时,外电路中通过6 mol电子
15.由甲醇制备二甲醚涉及如下反应:
(1) ;
(2) 。
下列说法正确的是( )
A.
B.反应(2)为吸热反应
C. kJmol
D.相同条件下,比稳定
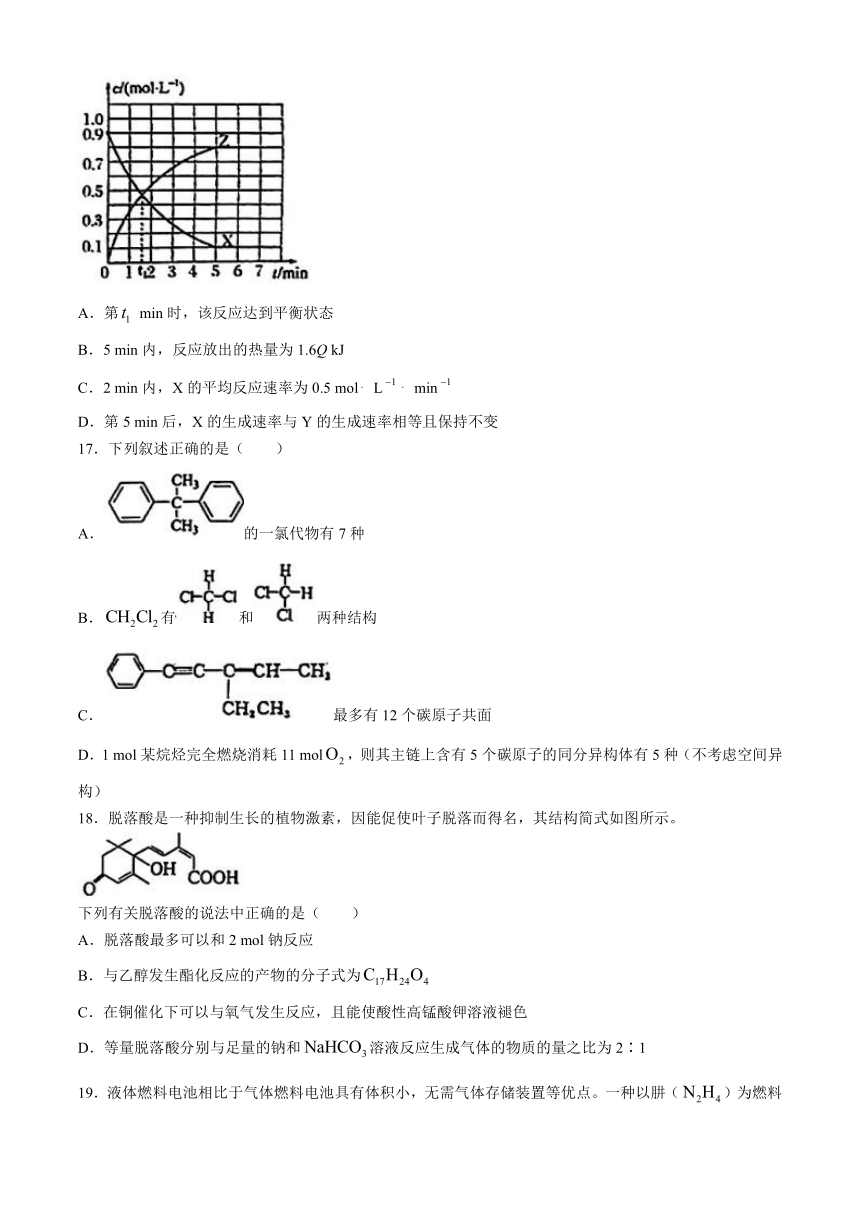
16.某温度时,反应 kJ·mol.在2L恒容密闭容器中进行反应,X和Z的浓度随时间变化如图所示,下列说法正确的是( )
A.第 min时,该反应达到平衡状态
B.5 min内,反应放出的热量为1.6Q kJ
C.2 min内,X的平均反应速率为0.5 mol L min
D.第5 min后,X的生成速率与Y的生成速率相等且保持不变
17.下列叙述正确的是( )
A.的一氯代物有7种
B.有和两种结构
C.最多有12个碳原子共面
D.1 mol某烷烃完全燃烧消耗11 mol,则其主链上含有5个碳原子的同分异构体有5种(不考虑空间异构)
18.脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示。
下列有关脱落酸的说法中正确的是( )
A.脱落酸最多可以和2 mol钠反应
B.与乙醇发生酯化反应的产物的分子式为
C.在铜催化下可以与氧气发生反应,且能使酸性高锰酸钾溶液褪色
D.等量脱落酸分别与足量的钠和溶液反应生成气体的物质的量之比为2∶1
19.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼()为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH为电解质。下列关于该燃料电池的叙述不正确的是( )
A.肼()的电子式为
B.负极发生的电极反应式为
C.电流从右侧电极经过负载流向左侧电极
D.该燃料电池持续放电时,电解质溶液碱性增强
20.向某温度恒定、体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。下列说法不正确的是( )
A.密闭容器的容积为2 L
B.该反应的化学方程式为:
C.物质B的起始浓度是0.02 mol/L
D.若,则s内以C物质浓度变化表示的反应速率
二、填空题(本大题共4小题,共55分)
21.(15分)根据所学知识回答下列问题。
(1)辨析相似概念是化学学科学习的基础,以下物质:
①和;②和;
③和;④红磷和白磷;⑤D和T;⑥氯水与液氯;⑦与;
⑧和,用数字序号回答下列问题:
互为同系物的是______;互为同分异构体的是______;属于同一种物质的是______:互为同瓷异形体的是______;属于同位素的是______。
(2)分子中含有22个共价键的烷烃的分子式为______.
(3)分子式为的同分异构体中,能与反应生成的有______种;写出其中含有两个的同分异构体的结构简式______.
(4)乳酸()最早在酸奶中被发现,是人体代谢的中间产物。
①乳酸中所含官能团的结构简式为______.
②两分子乳酸可以形成六元环化合物X,X的结构简式是______。
22.(14分)I.氢能对环境无污染,请根据下列信息:
化学键
键能/(kJ/mol) 436 498 465
(1)判断氢气燃烧生成1 mol时放出的能量为______kJ。
(2)等质量的液氢与氢气分别与氧气完全燃烧生成液态水时,释放出的能量前者______后者(填“>”“<”或“=”)。
Ⅱ.在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。是工业制硫酸的主要反应之一。
(3)在2L密闭容器内,500℃时测得随时间的变化如下表:
时间(s) 0 1 2 3 4 5
(mol) 0.020 0.010 0.008 0.007 0.007 0.007
①用表示从0~2s内该反应的平均速率______.
②反应达到平衡时,的转化率是______.
③下图中表示的变化的曲线是______(填字母),
(4)以下操作可以提高化学反应速率的是______(填写序号)。
A.选择更高效催化剂 B.增大O2气体的浓度
C.恒容下充入Ne D.适当降低温度
(5)保持密闭容器体积不变,下列能说明该反应已达化学平衡状态的是______(填写序号)。
A.单位时间内消耗2 mol 的同时消耗1 mol
B.容器中气体密度保持不变
C.容器中气体的平均摩尔质量保持不变
D.
23.(14分)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用催化加氢可以制取乙烯: ,该反应体系的能量随反应过程变化关系如图所示,则______kJ mol((用含a、b的式子表示)。
(2)工业上用和反应合成二甲醚。已知:
kJ mol
kJ mol
则 ______kJ,mol,
(3)在完全燃烧生成和液态水的反应中,每有1 mol生成时,放出650 kJ的热量,写出燃烧热的热化学方程式____________。
(4)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气,其工作原理如图所示。
①a极通入的气体是______,b极的电极反应式为______。
②电池工作一段时间后,电解质溶液的碱性______(填“增强”、“减弱”或“不变”)。
③当消耗标准状况下5.6 L甲烷时,若电池的能量转化率为90%,则导线中转移电子的物质的量为______。
24.(12分)丙烯是一种重要的化工原料,以丙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
已知:
请回答下列问题:
(1)A、F中官能团的名称分别为______、______。
(2)反应①②③④中,属于取代反应的是______(填序号)。
(3)聚丙烯具有机械强度高、耐化学腐蚀等特性,可用于制作薄膜、管道等。写出聚丙烯的结构简式:______.
(4)写出1种可鉴别C和E的化学试剂:____________.
(5)写出下列反应的化学方程式:
①C→D:____________.
②B+E→F:____________.
化学答案
一、选择题(1-15小题,每小题2分,16-20小题,每小题3分,共45分)
1 2 3 4 5 6 7 8 9 10
C D C D A B A B D C
11 12 13 14 15 16 17 18 19 20
C A D B A B D B D B
二、填空题(55分)
21.(15分)除标注外每空2分
(1)②(1分);③(1分);①⑧(1分);④(1分);⑤⑦(1分)
(2)
(3)
(4)① ②
22.(14分)每空2分
(1)245(2)<(3)①0.003 mol·L·s②65%③b(4)AB(5)CD
23.(14分)每空2分
(1)kJ/mol(2)-130.8
(3) kJ mol。
(4)① ②减弱③1.8 mol
24.(12分)除标注外每空2分
(1)碳溴键(1分)酯基(1分)
(2)③④
(3)
(4)紫色石蕊溶液(其他合理均可)
(5)①
②
6月份阶段性质量检测
化学学科试题
2024.06.03—2024.06.04
说明:1.请将答案填涂在答题卡的指定区域内。
2.满分100分,考试时间90分钟。
一、选择题(本大题共20小题,1-15小题,每小题2分,16-20小题,每小题3分,共45分)
1.化学与人类生产、生活和社会可持续发展密切相关,下列说法正确的是( )
A.油脂、纤维素、聚乙烯和蛋白质都是高分子化合物
B.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
C.滚丙烯腈纤维可用于制毛线,聚丙烯腈纤维是有机高分子材料
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
2.下列化学用语正确的是( )
A.乙醇的球棍模型: B.一氯甲烷的电子式:
C.乙烯的结构式: D.乙酸的最简式:
3.下列有关官能团和物质类别的关系说法不正确的是( )
A.有机物分子中含有,则该有机物不一定为烯烃类
B.的官能团为(羟基),属于醇类
C.和分子中都含有(醛基),则两者同属于醛类
D.可以看作的一个氢原子被一个溴原子取代后的产物,因此属于烃的衍生物
4.下列有关同分异构体与同系物说法正确的是( )
A.组成元素相同,各元素质量分数也相同的两种化合物一定互为同分异构体
B.相对分子质量相同但结构不同的化合物一定互为同分异构体
C.凡是分子组成相差一个或若干个原子团的物质.一定互为同系物
D.符合通式的两种烃不一定互为同系物
5.分子式为能与Na反应放出气体并且能催化氧化生成醛的有机物有(不含立体结构)( )
A.4种 B.5种 C.6种 D.7种
6.下列热化学方程式书写正确的是( )
A. kJ·mol(反应热)
B. kJ mol(反应热)
C. kJ mol(燃烧热)
D. kJ mol(中和反应反应热)
7.一定温度下,有反应,现将1 mol充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A. B. C. D.
8.下列说法正确的是( )
A.聚异戊二烯和聚乙烯均能使溴水褪色
B.蔗糖水解的最终产物可以发生银镜反应
C.某有机物完全燃烧后生成和,说明该有机物中一定含有C、H、O三种元素
D.1 mol先与发生加成反应,再与发生取代反应,最多消耗 3 mol
9.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是和Zn,电解质溶液为KOH溶液,电池总反应为:。下列说法正确的是( )
A.Zn为正极,为负极
B.正极的电极反应式为:
C.在银锌电池使用过程中,电解质溶液中KOH的物质的量减小
D.当外电路中通过1 mol电子时,负极消耗物质的质量是32.5 g
10.下列有关实验的操作、现象和实验结论正确的是( )
选项 操作 现象 实验结论
A 将乙烯通入溴的四氯化碳溶液 溶液最终变为无色且有分层现象 生成的1,2-二溴乙烷无色且不溶于四氯化碳
B 取2 mL 0.2 mol/L KI溶液于试管中,加入5 mL 0.1 mol/L 溶液,充分反应后滴入5滴15%KSCN溶液溶液 变红色 与KI的反应有一定限度
C 取2mL蛋白质溶液于试管中,加入适量醋酸铅溶液,再加入足量蒸馏水 产生白色沉淀,该沉淀加入蒸馏水后不能再溶解 蛋白质变性
D 向淀粉溶液中加入几滴稀硫酸,煮沸几分钟,向冷却液中加入新制,加热 无砖红色沉淀生 成淀粉没有水解
11创新实验小组设计如图装置进行乙醇催化氧化的实验探究,下列叙述错误的是( )
A.甲烧杯中为热水、乙烧杯中为冷水
B.试管a收集到的液体中至少有两种有机物
C.铜网为该反应的催化剂,能降低反应的活化能和焓变
D.反应开始后熄灭酒精灯,铜网仍能红热,说明乙醇的催化氧化是放热反应
12.A为单烯烃或者单炔烃,A与氢气完全加成后所得产物的结构简式为,当A为单烯烃时有X种结构,当A为单炔烃时有Y种结构,X和Y的值分别为()
A.7和2 B.9和2 C.7和3 D.9和3
13.将2 mol X和2 mol Y充入2 L密闭容器中进行反应:。2 min末该反应达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L,下列叙述错误的是( )
A.a的值为2 B.平衡时X的浓度为0.8 mol L
C.平衡时Y的物质的量为0.8 mol D.0~2 min内Y的反应速率为0.6 mol L min
14.某科研机构将汽车尾气中的NO和CO设计成如图所示的燃料电池,实现了NO和CO的无害转化。下列说法正确的是( )
A.石墨Ⅰ为负极,发生还原反应
B.电池工作时,向石墨Ⅱ电极处移动
C.石墨Ⅱ电极反应式为
D.石墨Ⅰ生成28 g 时,外电路中通过6 mol电子
15.由甲醇制备二甲醚涉及如下反应:
(1) ;
(2) 。
下列说法正确的是( )
A.
B.反应(2)为吸热反应
C. kJmol
D.相同条件下,比稳定
16.某温度时,反应 kJ·mol.在2L恒容密闭容器中进行反应,X和Z的浓度随时间变化如图所示,下列说法正确的是( )
A.第 min时,该反应达到平衡状态
B.5 min内,反应放出的热量为1.6Q kJ
C.2 min内,X的平均反应速率为0.5 mol L min
D.第5 min后,X的生成速率与Y的生成速率相等且保持不变
17.下列叙述正确的是( )
A.的一氯代物有7种
B.有和两种结构
C.最多有12个碳原子共面
D.1 mol某烷烃完全燃烧消耗11 mol,则其主链上含有5个碳原子的同分异构体有5种(不考虑空间异构)
18.脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示。
下列有关脱落酸的说法中正确的是( )
A.脱落酸最多可以和2 mol钠反应
B.与乙醇发生酯化反应的产物的分子式为
C.在铜催化下可以与氧气发生反应,且能使酸性高锰酸钾溶液褪色
D.等量脱落酸分别与足量的钠和溶液反应生成气体的物质的量之比为2∶1
19.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼()为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH为电解质。下列关于该燃料电池的叙述不正确的是( )
A.肼()的电子式为
B.负极发生的电极反应式为
C.电流从右侧电极经过负载流向左侧电极
D.该燃料电池持续放电时,电解质溶液碱性增强
20.向某温度恒定、体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。下列说法不正确的是( )
A.密闭容器的容积为2 L
B.该反应的化学方程式为:
C.物质B的起始浓度是0.02 mol/L
D.若,则s内以C物质浓度变化表示的反应速率
二、填空题(本大题共4小题,共55分)
21.(15分)根据所学知识回答下列问题。
(1)辨析相似概念是化学学科学习的基础,以下物质:
①和;②和;
③和;④红磷和白磷;⑤D和T;⑥氯水与液氯;⑦与;
⑧和,用数字序号回答下列问题:
互为同系物的是______;互为同分异构体的是______;属于同一种物质的是______:互为同瓷异形体的是______;属于同位素的是______。
(2)分子中含有22个共价键的烷烃的分子式为______.
(3)分子式为的同分异构体中,能与反应生成的有______种;写出其中含有两个的同分异构体的结构简式______.
(4)乳酸()最早在酸奶中被发现,是人体代谢的中间产物。
①乳酸中所含官能团的结构简式为______.
②两分子乳酸可以形成六元环化合物X,X的结构简式是______。
22.(14分)I.氢能对环境无污染,请根据下列信息:
化学键
键能/(kJ/mol) 436 498 465
(1)判断氢气燃烧生成1 mol时放出的能量为______kJ。
(2)等质量的液氢与氢气分别与氧气完全燃烧生成液态水时,释放出的能量前者______后者(填“>”“<”或“=”)。
Ⅱ.在生产和生活中,人们关注化学反应进行的快慢和程度,以提高生产效率和调控反应条件。是工业制硫酸的主要反应之一。
(3)在2L密闭容器内,500℃时测得随时间的变化如下表:
时间(s) 0 1 2 3 4 5
(mol) 0.020 0.010 0.008 0.007 0.007 0.007
①用表示从0~2s内该反应的平均速率______.
②反应达到平衡时,的转化率是______.
③下图中表示的变化的曲线是______(填字母),
(4)以下操作可以提高化学反应速率的是______(填写序号)。
A.选择更高效催化剂 B.增大O2气体的浓度
C.恒容下充入Ne D.适当降低温度
(5)保持密闭容器体积不变,下列能说明该反应已达化学平衡状态的是______(填写序号)。
A.单位时间内消耗2 mol 的同时消耗1 mol
B.容器中气体密度保持不变
C.容器中气体的平均摩尔质量保持不变
D.
23.(14分)低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)用催化加氢可以制取乙烯: ,该反应体系的能量随反应过程变化关系如图所示,则______kJ mol((用含a、b的式子表示)。
(2)工业上用和反应合成二甲醚。已知:
kJ mol
kJ mol
则 ______kJ,mol,
(3)在完全燃烧生成和液态水的反应中,每有1 mol生成时,放出650 kJ的热量,写出燃烧热的热化学方程式____________。
(4)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气,其工作原理如图所示。
①a极通入的气体是______,b极的电极反应式为______。
②电池工作一段时间后,电解质溶液的碱性______(填“增强”、“减弱”或“不变”)。
③当消耗标准状况下5.6 L甲烷时,若电池的能量转化率为90%,则导线中转移电子的物质的量为______。
24.(12分)丙烯是一种重要的化工原料,以丙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
已知:
请回答下列问题:
(1)A、F中官能团的名称分别为______、______。
(2)反应①②③④中,属于取代反应的是______(填序号)。
(3)聚丙烯具有机械强度高、耐化学腐蚀等特性,可用于制作薄膜、管道等。写出聚丙烯的结构简式:______.
(4)写出1种可鉴别C和E的化学试剂:____________.
(5)写出下列反应的化学方程式:
①C→D:____________.
②B+E→F:____________.
化学答案
一、选择题(1-15小题,每小题2分,16-20小题,每小题3分,共45分)
1 2 3 4 5 6 7 8 9 10
C D C D A B A B D C
11 12 13 14 15 16 17 18 19 20
C A D B A B D B D B
二、填空题(55分)
21.(15分)除标注外每空2分
(1)②(1分);③(1分);①⑧(1分);④(1分);⑤⑦(1分)
(2)
(3)
(4)① ②
22.(14分)每空2分
(1)245(2)<(3)①0.003 mol·L·s②65%③b(4)AB(5)CD
23.(14分)每空2分
(1)kJ/mol(2)-130.8
(3) kJ mol。
(4)① ②减弱③1.8 mol
24.(12分)除标注外每空2分
(1)碳溴键(1分)酯基(1分)
(2)③④
(3)
(4)紫色石蕊溶液(其他合理均可)
(5)①
②
同课章节目录
