3.2.1 分子晶体与共价晶体(共49张ppt)人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.1 分子晶体与共价晶体(共49张ppt)人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 00:00:00 | ||
图片预览











文档简介
(共49张PPT)
第三章
晶体结构与性质
第二节
分子晶体与共价晶体
第1课时
分子晶体
[明确学习目标]
1.知道分子晶体的概念及典型的分子晶体。
2.认识分子晶体中的微粒及其微粒间的相互作用。
3.借助冰、干冰等模型认识分子晶体的结构特点及物理性质。
[核心素养对接]
1.宏观辨识与微观探析:能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。
2.证据推理与模型认知:能利用分子晶体的通性推断常见的分子晶体,理解分子晶体,理解分子晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。
课前篇
·
自主学习固基础
一、概念及微粒间的作用力
[知识梳理]
1.概念:只含________的晶体称为分子晶体。
2.粒子间的相互作用力:分子晶体内相邻分子间靠_______________相互吸引,分子内原子之间以________结合。
分子
分子间作用力
共价键
二、堆积方式
分子密堆积 分子非密堆积
作用力 只有______________,无______ 有分子间氢键,它具有________性
空间特点 每个分子周围一般有______个紧邻的分子 空间利用率不高,留有相当大的空隙
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
氢键
方向
12
三、常见分子晶体及物质类别
物质种类 示例
所有____________ H2O、NH3、CH4等
部分____________ 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分____________ CO2、P4O10、SO2、SO3等
几乎所有的______ HNO3、H2SO4、H3PO4、H2SiO3等
绝大多数________ 苯、乙醇、乙酸、乙酸乙酯等
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
四、物理性质
一般熔、沸点___________,硬度_________。
较低
较小
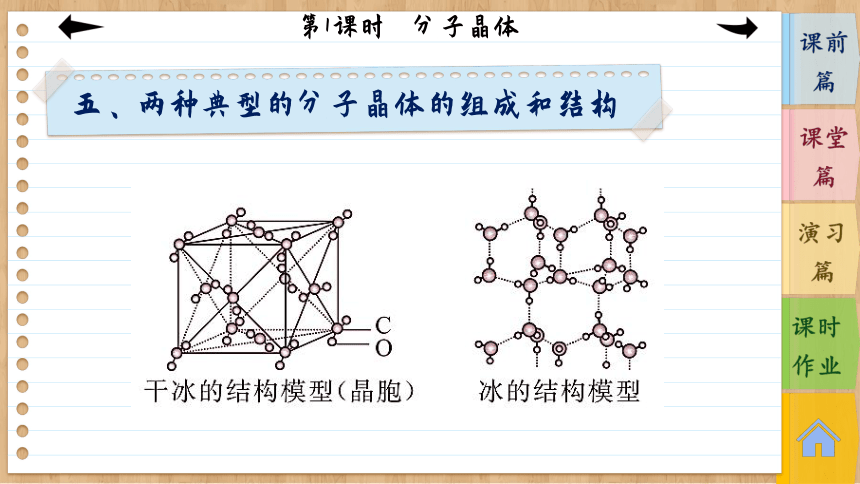
五、两种典型的分子晶体的组成和结构
1.干冰
(1)每个晶胞中有____个CO2分子,____个原子。
(2)每个CO2分子周围等距离紧邻的CO2分子数为_____个。
2.冰
(1)水分子之间的作用力有________________,但主要是______。
(2)由于______的方向性,使四面体中心的每个水分子与四面体顶角方向的____个相邻的水分子相互吸引。
4
12
12
范德华力和氢键
氢键
氢键
4
[自我排查]
一、微判断
(1)冰融化时,分子中H—O键发生断裂( )
(2)冰融化与干冰升华克服的作用力完全相同( )
(3)分子晶体中,分子间作用力越大,对应的物质越稳定( )
二、尝试解答
常温下,液态水中水分子在不停地做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。
提示:(1)共价键、氢键、范德华力
(2)氢键和范德华力
(3)共价键
(4)由于在冰的晶体中,水分子之间形成氢键,水分子之间以缔合分子形式存在,占据的空间增大,密度减小。
课堂篇
·
重点难点要突破
研习1 分子晶体的概念
[探究活动]
[问题探讨]
1.分子晶体中分子内一定含有共价键吗?为什么?
提示:不一定。稀有气体的分子为单原子分子,不含有任何化学键。
2.影响分子晶体的熔、沸点有哪些因素?
3.影响分子晶体的溶解度有哪些因素?
提示:氢键、范德华力、极性。
提示:“相似相溶”原理、氢键、化学反应。
[重点讲解]
1.分子晶体的概念
只含分子的晶体叫做分子晶体。如I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
2.分子晶体中的粒子及粒子间的相互作用
构成分子晶体的微粒是分子,分子晶体中相邻分子之间靠分子间作用力相互吸引,而分子内各原子间通常以共价键结合。稀有气体单质是由单原子分子构成,原子之间不存在共价键,固态时属于分子晶体。
3.典型的分子晶体
(1)所有非金属氢化物:如水、硫化氢、氨、氯化氢、甲烷等。
(2)部分非金属单质:如卤素(X2)、氧气(O2)、硫(S8)、氮气(N2)、白磷(P4)、碳60(C60)等(注意:金刚石、Si等不是分子晶体)。
(3)部分非金属氧化物:如CO2、P4O6、P4O10、SO2等(SiO2不是分子晶体)。
(4)几乎所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)绝大多数有机物:如苯、乙醇、乙酸、葡萄糖等。
4.物理特性
(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时需破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低。部分分子晶体易升华(如干冰、碘、萘等)。
[典例1] 下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中每个分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中只存在范德华力,不存在氢键,1个分子周围有12个紧邻的分子
A
解析:干冰是由分子密堆积形成的晶体,冰中水分子间存在氢键,不属于分子密堆积形成的晶体,故A错误;冰晶体中每个水分子周围只有4个紧邻的水分子形成四面体结构,分子间有空隙,故B正确;冰中水分子间存在氢键,熔点高,干冰比冰的熔点低得多,常压下易升华,故C正确;干冰中只存在范德华力,不存在氢键,是由分子密堆积形成的晶体,1个分子周围有12个紧邻的分子,故D正确。
[举一反三]
下列有关分子晶体的说法中正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积方式
B
解析:稀有气体分子是单原子分子,分子内不存在化学键,A项错误;范德华力存在于所有分子晶体中,而氢键只存在于部分分子晶体内,B项正确,C项错误;分子间只存在范德华力的分子晶体才采取分子密堆积的方式,D项错误。
研习2 常见分子晶体结构分析
[探究活动]
[问题探讨]
据《新科学》杂志报道,科研人员在20 ℃、1个大气压和其他一定的实验条件下,给水施加一个弱电场,水就可以结成冰,称为“热冰”。如图是水和“热冰”微观结构的计算机模拟图。
1.该实验说明水分子具有________性,水分子中氧原子的杂化方式为_________。
极
sp3
2.参照“热冰”的图示,以一个水分子为中心,画出水分子间最基本的连接方式(用结构式表示)。
[重点讲解]
1.分子密堆积
分子密堆积的条件:分子间作用力只有范德华力,无分子间氢键。范德华力没有方向性和饱和性,这类晶体中每个分子周围最多有12个紧邻的分子,如C60、干冰、I2、O2等。干冰晶胞是一种面心立方结构,在立方体的顶角各有一个CO2分子,6个面的中心又各有一个CO2分子。干冰晶
胞如图所示,每个晶胞占有的CO2分子的个数为×8+ ×6=4。每个CO2分子周围等距离且最近的CO2分子有12个。
干冰晶胞
2.非密堆积
若分子间的主要作用力是氢键,由于氢键具有方向性,使得晶体中分子的空间利用率降低,留有相当大的空隙,这种晶体不具有分子密堆积特征,如HF、NH3、冰。
冰的结构
冰中1个水分子周围有4个水分子
以冰的晶体结构为例:在冰的晶体中,水分子之间的主要作用力是氢键。由于氢键具有一定的方向性,每个水分子周围只有4个紧邻的水分子。这样,每个O原子周围都有4个H原子,其中2个H原子与O原子以共价键结合,另外2个H原子与O原子以氢键结合,使水分子间构成四面体骨架结构。
[典例2] 氯化硼的熔点为-107 ℃,沸点为12.5 ℃,在其分子中键与键之间的夹角为120°,它能水解。有关叙述正确的是( )
A.氯化硼晶体是分子晶体
B.氯化硼液态时能导电而固态时不能导电
C.氯化硼分子的中心原子采取sp3杂化
D.氯化硼分子属于极性分子,分子空间结构为三角锥形
A
解析:A对,BCl3的熔点、沸点均较低,说明BCl3晶体是分子晶体。B错,BCl3晶体是分子晶体,在固态和熔融态时均不能发生电离,故均不能导电。C错,BCl3分子中B原子的价电子对数为3+×(3-3×1)=3,B原子采取sp2杂化。D错,BCl3分子为平面三角形,正电中心和负电中心重合,则BCl3为非极性分子。
已知干冰晶胞属于面心立方晶胞(如图),晶胞中最近的两个相邻CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是( )
[举一反三]
干冰晶胞
干冰晶胞
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是 g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的空间结构是直线形,中心C原子的杂化类型是sp3杂化
解析:A错,以顶角CO2分子为研究对象,可得晶胞中一个CO2分子的配位数为12。B对,该晶胞中最近的两个相邻CO2分子间距为a pm,即晶胞面心上的CO2分子和其同一面上顶角的CO2之间的距离为a pm,则晶胞棱长=a pm= a×10-10 cm,晶胞体积=(a×10-10 cm)3,该晶胞中CO2分子个数=8×+6×=4,
晶胞密度== g·cm-3=g·cm-3。 C错,该晶胞中二氧化碳的分子个数=8×+6×=4。D错,CO2分子中C原子采取sp杂化。
演习篇
·
学业测试速达标
1.下列物质固态时,一定是分子晶体的是( )
A.酸性氧化物 B.非金属单质
C.碱性氧化物 D.含氧酸
2.水的沸点为100 ℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7 ℃,引起这种差异的主要原因是( )
A.范德华力 B.共价键
C.氢键 D.相对分子质量
D
C
3.干冰熔点很低是由于( )
A.CO2是非极性分子
B.CC的键能很小
C.CO2化学性质不活泼
D.CO2分子间的作用力较弱
D
4.干冰汽化时,下列所述内容发生变化的是( )
A.分子内共价键 B.分子间作用力
C.分子的性质 D.分子间的氢键
B
解析:干冰是分子晶体,分子间存在分子间作用力,不存在氢键,汽化时破坏分子间作用力,分子内原子间共价键没有被破坏,所以分子的性质不发生改变。
5.下列属于分子晶体的一组物质是( )
A.CaO、NO、CO B.CCl4、H2O、He
C.CO2、SO2、NaCl D.CH4、O2、Na2O
6.下列关于分子晶体熔点高低的叙述中,正确的是
( )
A.氯气>碘单质 B.四氯化硅>四氟化硅
C.NH3正戊烷
B
B
解析:碘常温下为固体,氯气为气体,碘的熔点较高,A错误;四氯化硅、四氟化硅对应的晶体都为分子晶体,四氯化硅的相对分子质量大,熔点较高,B正确;氨分子间存在氢键,熔点较高,C错误;同分异构体中,含有的支链越多,熔点越低,D错误。
7.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判
断这个分子是极性分子还是非极性
分子?_____________。
非极性分子
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?______________________
________________。
分子晶体
解析:(1)XeF4分子中含有Xe—F极性键,由于XeF4分子是平面正方形结构,结构对称,所以XeF4分子为非极性分子。(2)根据晶胞结构可知,XeF2晶体是由分子构成的,所以是分子晶体。
本课结束
This lesson is over
THANKS!
第三章
晶体结构与性质
第二节
分子晶体与共价晶体
第1课时
分子晶体
[明确学习目标]
1.知道分子晶体的概念及典型的分子晶体。
2.认识分子晶体中的微粒及其微粒间的相互作用。
3.借助冰、干冰等模型认识分子晶体的结构特点及物理性质。
[核心素养对接]
1.宏观辨识与微观探析:能辨识常见的分子晶体,并能从微观角度分析分子晶体中各构成微粒之间的作用和对分子晶体物理性质的影响。
2.证据推理与模型认知:能利用分子晶体的通性推断常见的分子晶体,理解分子晶体,理解分子晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。
课前篇
·
自主学习固基础
一、概念及微粒间的作用力
[知识梳理]
1.概念:只含________的晶体称为分子晶体。
2.粒子间的相互作用力:分子晶体内相邻分子间靠_______________相互吸引,分子内原子之间以________结合。
分子
分子间作用力
共价键
二、堆积方式
分子密堆积 分子非密堆积
作用力 只有______________,无______ 有分子间氢键,它具有________性
空间特点 每个分子周围一般有______个紧邻的分子 空间利用率不高,留有相当大的空隙
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
氢键
方向
12
三、常见分子晶体及物质类别
物质种类 示例
所有____________ H2O、NH3、CH4等
部分____________ 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分____________ CO2、P4O10、SO2、SO3等
几乎所有的______ HNO3、H2SO4、H3PO4、H2SiO3等
绝大多数________ 苯、乙醇、乙酸、乙酸乙酯等
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
四、物理性质
一般熔、沸点___________,硬度_________。
较低
较小
五、两种典型的分子晶体的组成和结构
1.干冰
(1)每个晶胞中有____个CO2分子,____个原子。
(2)每个CO2分子周围等距离紧邻的CO2分子数为_____个。
2.冰
(1)水分子之间的作用力有________________,但主要是______。
(2)由于______的方向性,使四面体中心的每个水分子与四面体顶角方向的____个相邻的水分子相互吸引。
4
12
12
范德华力和氢键
氢键
氢键
4
[自我排查]
一、微判断
(1)冰融化时,分子中H—O键发生断裂( )
(2)冰融化与干冰升华克服的作用力完全相同( )
(3)分子晶体中,分子间作用力越大,对应的物质越稳定( )
二、尝试解答
常温下,液态水中水分子在不停地做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。
提示:(1)共价键、氢键、范德华力
(2)氢键和范德华力
(3)共价键
(4)由于在冰的晶体中,水分子之间形成氢键,水分子之间以缔合分子形式存在,占据的空间增大,密度减小。
课堂篇
·
重点难点要突破
研习1 分子晶体的概念
[探究活动]
[问题探讨]
1.分子晶体中分子内一定含有共价键吗?为什么?
提示:不一定。稀有气体的分子为单原子分子,不含有任何化学键。
2.影响分子晶体的熔、沸点有哪些因素?
3.影响分子晶体的溶解度有哪些因素?
提示:氢键、范德华力、极性。
提示:“相似相溶”原理、氢键、化学反应。
[重点讲解]
1.分子晶体的概念
只含分子的晶体叫做分子晶体。如I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
2.分子晶体中的粒子及粒子间的相互作用
构成分子晶体的微粒是分子,分子晶体中相邻分子之间靠分子间作用力相互吸引,而分子内各原子间通常以共价键结合。稀有气体单质是由单原子分子构成,原子之间不存在共价键,固态时属于分子晶体。
3.典型的分子晶体
(1)所有非金属氢化物:如水、硫化氢、氨、氯化氢、甲烷等。
(2)部分非金属单质:如卤素(X2)、氧气(O2)、硫(S8)、氮气(N2)、白磷(P4)、碳60(C60)等(注意:金刚石、Si等不是分子晶体)。
(3)部分非金属氧化物:如CO2、P4O6、P4O10、SO2等(SiO2不是分子晶体)。
(4)几乎所有的酸:如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)绝大多数有机物:如苯、乙醇、乙酸、葡萄糖等。
4.物理特性
(1)分子晶体具有较低的熔、沸点和较小的硬度。分子晶体熔化时需破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低。部分分子晶体易升华(如干冰、碘、萘等)。
[典例1] 下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中每个分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中只存在范德华力,不存在氢键,1个分子周围有12个紧邻的分子
A
解析:干冰是由分子密堆积形成的晶体,冰中水分子间存在氢键,不属于分子密堆积形成的晶体,故A错误;冰晶体中每个水分子周围只有4个紧邻的水分子形成四面体结构,分子间有空隙,故B正确;冰中水分子间存在氢键,熔点高,干冰比冰的熔点低得多,常压下易升华,故C正确;干冰中只存在范德华力,不存在氢键,是由分子密堆积形成的晶体,1个分子周围有12个紧邻的分子,故D正确。
[举一反三]
下列有关分子晶体的说法中正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定为分子密堆积方式
B
解析:稀有气体分子是单原子分子,分子内不存在化学键,A项错误;范德华力存在于所有分子晶体中,而氢键只存在于部分分子晶体内,B项正确,C项错误;分子间只存在范德华力的分子晶体才采取分子密堆积的方式,D项错误。
研习2 常见分子晶体结构分析
[探究活动]
[问题探讨]
据《新科学》杂志报道,科研人员在20 ℃、1个大气压和其他一定的实验条件下,给水施加一个弱电场,水就可以结成冰,称为“热冰”。如图是水和“热冰”微观结构的计算机模拟图。
1.该实验说明水分子具有________性,水分子中氧原子的杂化方式为_________。
极
sp3
2.参照“热冰”的图示,以一个水分子为中心,画出水分子间最基本的连接方式(用结构式表示)。
[重点讲解]
1.分子密堆积
分子密堆积的条件:分子间作用力只有范德华力,无分子间氢键。范德华力没有方向性和饱和性,这类晶体中每个分子周围最多有12个紧邻的分子,如C60、干冰、I2、O2等。干冰晶胞是一种面心立方结构,在立方体的顶角各有一个CO2分子,6个面的中心又各有一个CO2分子。干冰晶
胞如图所示,每个晶胞占有的CO2分子的个数为×8+ ×6=4。每个CO2分子周围等距离且最近的CO2分子有12个。
干冰晶胞
2.非密堆积
若分子间的主要作用力是氢键,由于氢键具有方向性,使得晶体中分子的空间利用率降低,留有相当大的空隙,这种晶体不具有分子密堆积特征,如HF、NH3、冰。
冰的结构
冰中1个水分子周围有4个水分子
以冰的晶体结构为例:在冰的晶体中,水分子之间的主要作用力是氢键。由于氢键具有一定的方向性,每个水分子周围只有4个紧邻的水分子。这样,每个O原子周围都有4个H原子,其中2个H原子与O原子以共价键结合,另外2个H原子与O原子以氢键结合,使水分子间构成四面体骨架结构。
[典例2] 氯化硼的熔点为-107 ℃,沸点为12.5 ℃,在其分子中键与键之间的夹角为120°,它能水解。有关叙述正确的是( )
A.氯化硼晶体是分子晶体
B.氯化硼液态时能导电而固态时不能导电
C.氯化硼分子的中心原子采取sp3杂化
D.氯化硼分子属于极性分子,分子空间结构为三角锥形
A
解析:A对,BCl3的熔点、沸点均较低,说明BCl3晶体是分子晶体。B错,BCl3晶体是分子晶体,在固态和熔融态时均不能发生电离,故均不能导电。C错,BCl3分子中B原子的价电子对数为3+×(3-3×1)=3,B原子采取sp2杂化。D错,BCl3分子为平面三角形,正电中心和负电中心重合,则BCl3为非极性分子。
已知干冰晶胞属于面心立方晶胞(如图),晶胞中最近的两个相邻CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是( )
[举一反三]
干冰晶胞
干冰晶胞
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是 g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的空间结构是直线形,中心C原子的杂化类型是sp3杂化
解析:A错,以顶角CO2分子为研究对象,可得晶胞中一个CO2分子的配位数为12。B对,该晶胞中最近的两个相邻CO2分子间距为a pm,即晶胞面心上的CO2分子和其同一面上顶角的CO2之间的距离为a pm,则晶胞棱长=a pm= a×10-10 cm,晶胞体积=(a×10-10 cm)3,该晶胞中CO2分子个数=8×+6×=4,
晶胞密度== g·cm-3=g·cm-3。 C错,该晶胞中二氧化碳的分子个数=8×+6×=4。D错,CO2分子中C原子采取sp杂化。
演习篇
·
学业测试速达标
1.下列物质固态时,一定是分子晶体的是( )
A.酸性氧化物 B.非金属单质
C.碱性氧化物 D.含氧酸
2.水的沸点为100 ℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7 ℃,引起这种差异的主要原因是( )
A.范德华力 B.共价键
C.氢键 D.相对分子质量
D
C
3.干冰熔点很低是由于( )
A.CO2是非极性分子
B.CC的键能很小
C.CO2化学性质不活泼
D.CO2分子间的作用力较弱
D
4.干冰汽化时,下列所述内容发生变化的是( )
A.分子内共价键 B.分子间作用力
C.分子的性质 D.分子间的氢键
B
解析:干冰是分子晶体,分子间存在分子间作用力,不存在氢键,汽化时破坏分子间作用力,分子内原子间共价键没有被破坏,所以分子的性质不发生改变。
5.下列属于分子晶体的一组物质是( )
A.CaO、NO、CO B.CCl4、H2O、He
C.CO2、SO2、NaCl D.CH4、O2、Na2O
6.下列关于分子晶体熔点高低的叙述中,正确的是
( )
A.氯气>碘单质 B.四氯化硅>四氟化硅
C.NH3
B
B
解析:碘常温下为固体,氯气为气体,碘的熔点较高,A错误;四氯化硅、四氟化硅对应的晶体都为分子晶体,四氯化硅的相对分子质量大,熔点较高,B正确;氨分子间存在氢键,熔点较高,C错误;同分异构体中,含有的支链越多,熔点越低,D错误。
7.自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判
断这个分子是极性分子还是非极性
分子?_____________。
非极性分子
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?______________________
________________。
分子晶体
解析:(1)XeF4分子中含有Xe—F极性键,由于XeF4分子是平面正方形结构,结构对称,所以XeF4分子为非极性分子。(2)根据晶胞结构可知,XeF2晶体是由分子构成的,所以是分子晶体。
本课结束
This lesson is over
THANKS!
