3.2.2共价晶体课件(共46张ppt)人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.2共价晶体课件(共46张ppt)人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 17:58:32 | ||
图片预览










文档简介
(共46张PPT)
第三章
晶体结构与性质
第二节
分子晶体与共价晶体
第2课时
共价晶体
[明确学习目标]
1.知道共价晶体的概念及典型的共价晶体。
2.认识共价晶体中的微粒及其微粒间的相互作用。
3.借助金刚石、二氧化硅等模型认识共价晶体的结构特点及物理性质。
[核心素养对接]
1.宏观辨识与微观探析:能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间的作用和对共价晶体物理性质的影响。
2.证据推理与模型认知:能利用共价晶体的通性推断常见的共价晶体,理解共价晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。
课前篇
·
自主学习固基础
一、共价晶体的结构特点及物理性质
[知识梳理]
1.构成微粒及作用力
原子
共价键
2.空间构型:整块晶体是一个三维的共价键________结构,不存在______的小分子,是一个“巨分子”,又称________晶体。
3.物理性质
(1)共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点____,硬度____。
(2)结构相似的共价晶体,原子半径越小,键长______,键能越大,晶体的熔点越高。
网状
单个
原子
高
大
越短
二、常见的共价晶体
1.物质类别
某些单质
某些非金属化合物
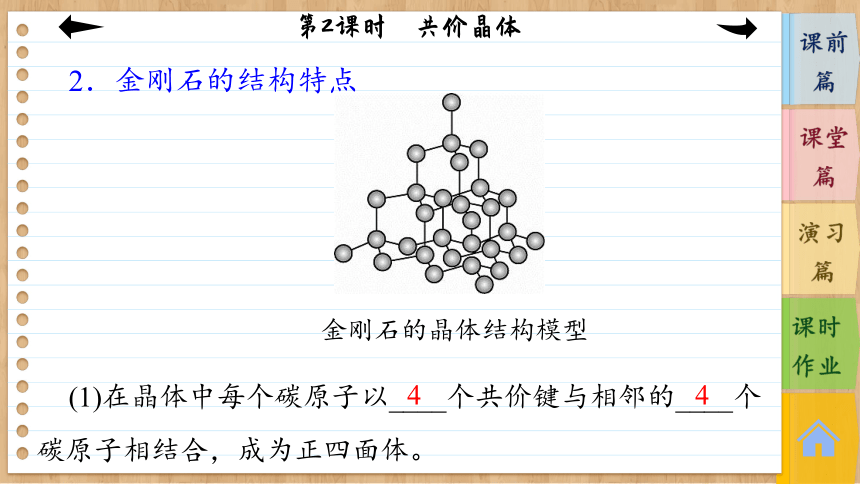
2.金刚石的结构特点
(1)在晶体中每个碳原子以____个共价键与相邻的____个碳原子相结合,成为正四面体。
金刚石的晶体结构模型
4
4
(2)晶体中C—C键夹角为_______________,碳原子采取了________杂化。
(3)最小环上有____个碳原子。
(4)晶体中碳原子个数与C—C键数之比为1∶(4×)=1∶2。
109°28′
sp3
6
[自我排查]
一、微判断
(1)具有共价键的晶体都是共价晶体( )
(2)共价晶体中,共价键越强,熔点越高( )
(3)共价晶体的化学式表示其分子式( )
二、尝试解答
碳化硅(SiC)又名金刚砂,是用石英砂、石油焦(或煤焦)、木屑(生产绿色碳化硅时需要加食盐)等原料通过电阻炉高温冶炼而成。碳化硅在大自然也存在罕见的矿物——莫桑石。碳化硅又称碳硅石,在当代C、N、B等非氧化物高技术耐火原料中,碳化硅为应用最广泛、最经济的一种。
(1)制备金刚砂的化学方程式为_______________________。
SiO2+3CSi === C+2CO↑
高温
(2)金刚砂的熔点比金刚石的熔点______。
(3)金刚砂的结构中,一个硅原子周围结合____个碳原子;金刚砂中含有共价键形成的原子环,其中最小的环上有____个硅原子。
低
4
3
课堂篇
·
重点难点要突破
研习1 共价晶体
[探究活动]
[问题探讨]
1.怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
提示:由于金刚石、晶体硅和锗的结构相似,原子半径:CSi—Si>Ge—Ge,所以三者的熔点和硬度依次下降。
2.“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
提示:此说法不对。“具有共价键”并不是判定共价晶体的唯一条件,有些分子晶体的分子内部也有共价键,如冰和干冰晶体都是分子晶体,但H2O和CO2中存在共价键。对共价晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
[重点讲解]
1.共价晶体
相邻原子间以共价键相互结合形成三维的共价键网状结构的晶体叫做共价晶体。
2.构成微粒及微粒间的作用
3.常见的共价晶体
4.共价晶体的物理性质
(1)熔、沸点很高。共价晶体中各原子间以共价键相结合,要熔化必须破坏其中的共价键,需要较高的温度,所以共价晶体有很高的熔、沸点。
(2)硬度很大。
(3)难溶于一般溶剂。
(4)一般不导电,但晶体硅是半导体。
[典例1] 下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p -p π键
C
解析:键长越短,键能越大,分子越稳定,A项正确;SiC与金刚石结构相似,属于共价晶体,硬度大,熔点高,B项正确;SiH4中H为-1价,SiH4还原性强于CH4,C项错误;π键是p轨道电子以“肩并肩”方式相互重叠形成的,原子半径越大越不易形成,D项正确。
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
[举一反三]
C
解析:属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫黄和碘。属于共价晶体的有SiO2、晶体硼、晶体硅和金刚石。但晶体氖是由稀有气体分子组成的,稀有气体为单原子分子,分子中不存在化学键。
研习2 两种常见的共价晶体
[探究活动]
[问题探讨]
下面是金刚石的多面体外形及结构:
1.金刚石晶体中有没有分子?晶体中碳原子之间的结合力是什么?
提示:金刚石晶体中不存在分子,存在的是碳原子。晶体中碳原子之间以共价键(σ键)结合。
2.金刚石晶体中每个碳原子与几个碳原子相结合?这些碳原子之间形成的空间结构是什么?碳原子的杂化轨道类型是什么?
提示:金刚石晶体中,每个碳原子与相邻的4个碳原子以共价键相结合,它们形成的空间结构是正四面体形,碳原子采取sp3杂化。
3.为什么金刚石的熔点高,硬度大?
提示:金刚石晶体中C—C共价键的键能很大,熔化时需破坏共价键,故金刚石的熔点高,硬度很大。
[重点讲解]
1.金刚石
在金刚石晶体中每个碳原子都采取sp3杂化,每个碳原子都被相邻的4个碳原子包围,以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。这些正四面体向空间发展,构成一个坚实的、彼此连接的空间网状结构的晶体(如图甲)。
2.二氧化硅
(1)二氧化硅晶体相当于在晶体硅结构中的每个Si—Si中“插入”一个氧原子,便可得到以硅氧四面体为骨架的二氧化硅的空间网状结构。每个Si原子周围结合4个O原子形成4个共价键,同时每个O原子跟2个Si原子相结合形成2个共价键。所以SiO2晶体是由Si原子和O原子按1∶2的比例所组成的立体网状的晶体,SiO2不能叫做分子式。1 mol SiO2中含4 mol Si—O。最小的环是由6个Si原子和6个O原子组成的
12元环,每个环拥有的硅原子数为6×=,拥有的氧原子数为6× =1。如图:
[典例2] 下列各组物质的晶体类型相同的是( )
A.SiO2和SO3
B.I2和NaCl
C.Cu和Ag
D.SiC和MgO
C
解析:SiO2为共价晶体,SO3为分子晶体,晶体类型不同,故A错误;I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;Cu和Ag都为金属晶体,晶体类型相同,故C正确;SiC为共价晶体,MgO为离子晶体,晶体类型不同,故D错误。。
根据下列性质判断,属于共价晶体的是( )
A.熔点为2 700 ℃,导电性好,延展性好
B.无色晶体,熔点为3 550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
[举一反三]
B
解析:“导电性好,延展性好”不符合共价晶体的特征,A错误;“不导电,质硬,难溶于水和有机溶剂”符合共价晶体的特征,B正确;“能溶于水……熔化时能导电”不符合共价晶体的特征,C错误;“熔点为-56.6 ℃,微溶于水,硬度小”不符合共价晶体的特征,D错误。
演习篇
·
学业测试速达标
1.下列事实能说明刚玉(Al2O3)是一种共价晶体的是( )
①Al2O3是两性氧化物 ②硬度很大 ③它的熔点为2 045 ℃ ④几乎不溶于水 ⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
B
解析:①指的是Al2O3的分类,⑤指的是刚玉的种类,这两项都无法说明Al2O3是一种共价晶体。
2.下列晶体熔化时,必须破坏非极性共价键的是( )
A.冰 B.晶体硅 C.溴 D.二氧化硅
B
解析:冰、溴为分子晶体,熔化时破坏的是分子间作用力,A、C项错误;晶体硅、二氧化硅为共价晶体,二氧化硅熔化时,破坏的是Si—O极性键,晶体硅熔化时,破坏的是Si—Si非极性键,B项正确,D项错误。
3.碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
A
解析:C与Si同为第ⅣA族元素,它们的相似性表现在金刚石是共价晶体,晶体硅、碳化硅也是共价晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱,熔点取决于它们的键能,故熔点从高到低的顺序是金刚石、碳化硅、晶体硅。
4.金刚石晶体是立体的网状结构,其
晶体模型如图所示。认真观察晶体模型并
回答下列问题:
(1)金刚石晶体中最小的环上有________个碳原子。
(2)每个C—C键为________个最小环共用,每个碳原子的任意两个C—C键的夹角都是____________。
(3)C原子个数与C—C键数之比为________。
6
6
109°28′
1∶2
解析:金刚石晶体是一种空间网状结构,每个C与另4个C以共价键结合,前者位于正四面体中心,后四者位于正四面体顶点。晶体中所有C—C键的键长相等、键角均为109°28′。晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子个数与C—C键数之比为1∶2。
本课结束
This lesson is over
THANKS!
第三章
晶体结构与性质
第二节
分子晶体与共价晶体
第2课时
共价晶体
[明确学习目标]
1.知道共价晶体的概念及典型的共价晶体。
2.认识共价晶体中的微粒及其微粒间的相互作用。
3.借助金刚石、二氧化硅等模型认识共价晶体的结构特点及物理性质。
[核心素养对接]
1.宏观辨识与微观探析:能辨识常见的共价晶体,并能从微观角度分析共价晶体中各构成微粒之间的作用和对共价晶体物理性质的影响。
2.证据推理与模型认知:能利用共价晶体的通性推断常见的共价晶体,理解共价晶体中微粒的堆积模型,并能利用均摊法对晶胞进行分析。
课前篇
·
自主学习固基础
一、共价晶体的结构特点及物理性质
[知识梳理]
1.构成微粒及作用力
原子
共价键
2.空间构型:整块晶体是一个三维的共价键________结构,不存在______的小分子,是一个“巨分子”,又称________晶体。
3.物理性质
(1)共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点____,硬度____。
(2)结构相似的共价晶体,原子半径越小,键长______,键能越大,晶体的熔点越高。
网状
单个
原子
高
大
越短
二、常见的共价晶体
1.物质类别
某些单质
某些非金属化合物
2.金刚石的结构特点
(1)在晶体中每个碳原子以____个共价键与相邻的____个碳原子相结合,成为正四面体。
金刚石的晶体结构模型
4
4
(2)晶体中C—C键夹角为_______________,碳原子采取了________杂化。
(3)最小环上有____个碳原子。
(4)晶体中碳原子个数与C—C键数之比为1∶(4×)=1∶2。
109°28′
sp3
6
[自我排查]
一、微判断
(1)具有共价键的晶体都是共价晶体( )
(2)共价晶体中,共价键越强,熔点越高( )
(3)共价晶体的化学式表示其分子式( )
二、尝试解答
碳化硅(SiC)又名金刚砂,是用石英砂、石油焦(或煤焦)、木屑(生产绿色碳化硅时需要加食盐)等原料通过电阻炉高温冶炼而成。碳化硅在大自然也存在罕见的矿物——莫桑石。碳化硅又称碳硅石,在当代C、N、B等非氧化物高技术耐火原料中,碳化硅为应用最广泛、最经济的一种。
(1)制备金刚砂的化学方程式为_______________________。
SiO2+3CSi === C+2CO↑
高温
(2)金刚砂的熔点比金刚石的熔点______。
(3)金刚砂的结构中,一个硅原子周围结合____个碳原子;金刚砂中含有共价键形成的原子环,其中最小的环上有____个硅原子。
低
4
3
课堂篇
·
重点难点要突破
研习1 共价晶体
[探究活动]
[问题探讨]
1.怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
提示:由于金刚石、晶体硅和锗的结构相似,原子半径:C
2.“具有共价键的晶体叫做共价晶体”,这种说法对吗?为什么?
提示:此说法不对。“具有共价键”并不是判定共价晶体的唯一条件,有些分子晶体的分子内部也有共价键,如冰和干冰晶体都是分子晶体,但H2O和CO2中存在共价键。对共价晶体的认识除了要求“具有共价键”外,还要求形成晶体的粒子是原子。
[重点讲解]
1.共价晶体
相邻原子间以共价键相互结合形成三维的共价键网状结构的晶体叫做共价晶体。
2.构成微粒及微粒间的作用
3.常见的共价晶体
4.共价晶体的物理性质
(1)熔、沸点很高。共价晶体中各原子间以共价键相结合,要熔化必须破坏其中的共价键,需要较高的温度,所以共价晶体有很高的熔、沸点。
(2)硬度很大。
(3)难溶于一般溶剂。
(4)一般不导电,但晶体硅是半导体。
[典例1] 下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p -p π键
C
解析:键长越短,键能越大,分子越稳定,A项正确;SiC与金刚石结构相似,属于共价晶体,硬度大,熔点高,B项正确;SiH4中H为-1价,SiH4还原性强于CH4,C项错误;π键是p轨道电子以“肩并肩”方式相互重叠形成的,原子半径越大越不易形成,D项正确。
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
[举一反三]
C
解析:属于分子晶体的有SO3、HCl、CO2、SO2、晶体氖、晶体氮、硫黄和碘。属于共价晶体的有SiO2、晶体硼、晶体硅和金刚石。但晶体氖是由稀有气体分子组成的,稀有气体为单原子分子,分子中不存在化学键。
研习2 两种常见的共价晶体
[探究活动]
[问题探讨]
下面是金刚石的多面体外形及结构:
1.金刚石晶体中有没有分子?晶体中碳原子之间的结合力是什么?
提示:金刚石晶体中不存在分子,存在的是碳原子。晶体中碳原子之间以共价键(σ键)结合。
2.金刚石晶体中每个碳原子与几个碳原子相结合?这些碳原子之间形成的空间结构是什么?碳原子的杂化轨道类型是什么?
提示:金刚石晶体中,每个碳原子与相邻的4个碳原子以共价键相结合,它们形成的空间结构是正四面体形,碳原子采取sp3杂化。
3.为什么金刚石的熔点高,硬度大?
提示:金刚石晶体中C—C共价键的键能很大,熔化时需破坏共价键,故金刚石的熔点高,硬度很大。
[重点讲解]
1.金刚石
在金刚石晶体中每个碳原子都采取sp3杂化,每个碳原子都被相邻的4个碳原子包围,以共价键跟4个碳原子结合,形成正四面体,被包围的碳原子处于正四面体的中心。这些正四面体向空间发展,构成一个坚实的、彼此连接的空间网状结构的晶体(如图甲)。
2.二氧化硅
(1)二氧化硅晶体相当于在晶体硅结构中的每个Si—Si中“插入”一个氧原子,便可得到以硅氧四面体为骨架的二氧化硅的空间网状结构。每个Si原子周围结合4个O原子形成4个共价键,同时每个O原子跟2个Si原子相结合形成2个共价键。所以SiO2晶体是由Si原子和O原子按1∶2的比例所组成的立体网状的晶体,SiO2不能叫做分子式。1 mol SiO2中含4 mol Si—O。最小的环是由6个Si原子和6个O原子组成的
12元环,每个环拥有的硅原子数为6×=,拥有的氧原子数为6× =1。如图:
[典例2] 下列各组物质的晶体类型相同的是( )
A.SiO2和SO3
B.I2和NaCl
C.Cu和Ag
D.SiC和MgO
C
解析:SiO2为共价晶体,SO3为分子晶体,晶体类型不同,故A错误;I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;Cu和Ag都为金属晶体,晶体类型相同,故C正确;SiC为共价晶体,MgO为离子晶体,晶体类型不同,故D错误。。
根据下列性质判断,属于共价晶体的是( )
A.熔点为2 700 ℃,导电性好,延展性好
B.无色晶体,熔点为3 550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点为-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
[举一反三]
B
解析:“导电性好,延展性好”不符合共价晶体的特征,A错误;“不导电,质硬,难溶于水和有机溶剂”符合共价晶体的特征,B正确;“能溶于水……熔化时能导电”不符合共价晶体的特征,C错误;“熔点为-56.6 ℃,微溶于水,硬度小”不符合共价晶体的特征,D错误。
演习篇
·
学业测试速达标
1.下列事实能说明刚玉(Al2O3)是一种共价晶体的是( )
①Al2O3是两性氧化物 ②硬度很大 ③它的熔点为2 045 ℃ ④几乎不溶于水 ⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
B
解析:①指的是Al2O3的分类,⑤指的是刚玉的种类,这两项都无法说明Al2O3是一种共价晶体。
2.下列晶体熔化时,必须破坏非极性共价键的是( )
A.冰 B.晶体硅 C.溴 D.二氧化硅
B
解析:冰、溴为分子晶体,熔化时破坏的是分子间作用力,A、C项错误;晶体硅、二氧化硅为共价晶体,二氧化硅熔化时,破坏的是Si—O极性键,晶体硅熔化时,破坏的是Si—Si非极性键,B项正确,D项错误。
3.碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③
A
解析:C与Si同为第ⅣA族元素,它们的相似性表现在金刚石是共价晶体,晶体硅、碳化硅也是共价晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱,熔点取决于它们的键能,故熔点从高到低的顺序是金刚石、碳化硅、晶体硅。
4.金刚石晶体是立体的网状结构,其
晶体模型如图所示。认真观察晶体模型并
回答下列问题:
(1)金刚石晶体中最小的环上有________个碳原子。
(2)每个C—C键为________个最小环共用,每个碳原子的任意两个C—C键的夹角都是____________。
(3)C原子个数与C—C键数之比为________。
6
6
109°28′
1∶2
解析:金刚石晶体是一种空间网状结构,每个C与另4个C以共价键结合,前者位于正四面体中心,后四者位于正四面体顶点。晶体中所有C—C键的键长相等、键角均为109°28′。晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子个数与C—C键数之比为1∶2。
本课结束
This lesson is over
THANKS!
