第二章 分子结构与性质 章节复习课件(共19张ppt)人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 章节复习课件(共19张ppt)人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 18:03:29 | ||
图片预览





文档简介
(共19张PPT)
第二章
分子结构与性质
本章复习提纲二
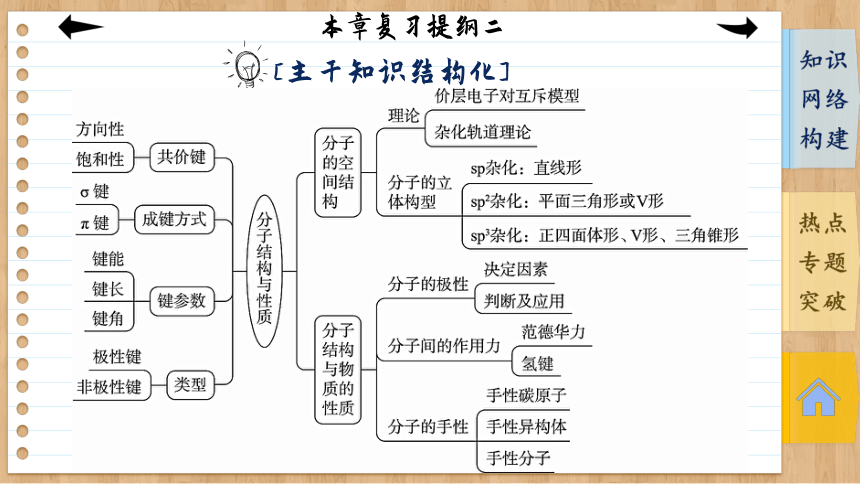
[主干知识结构化]
[知识网络构建]
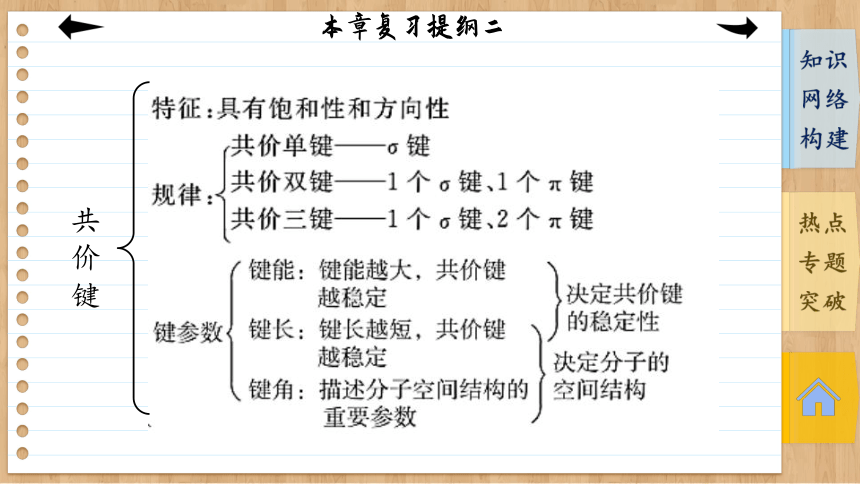
专题一 共价键
共价键
共价键
专题二 分子的空间结构及判断方法
1.用价层电子对互斥模型判断
价层电子对互斥模型说明价层电子对的排斥作用对分子空间结构的影响,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对。
(1)当中心原子上无孤电子对时,分子的空间结构与VSEPR模型一致。
(2)当中心原子上有孤电子对时,分子的空间结构与VSEPR模型不一致。
(3)若中心原子有孤电子对,根据孤电子对与成键电子对相互排斥作用的大小规律:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对。随着孤电子对数目的增多,键角减小。如CH4、NH3和H2O分子中的键角依次减小。
2.用杂化轨道理论判断
杂化 类型 杂化轨 道数目 杂化轨道 间夹角 分子空 间结构 实例
sp 2 180° 直线形 BeCl2、CH≡≡CH
sp2 3 120° 平面三角形 BF3、BCl3
sp3 4 109°28′ 正四面体形 CH4、CCl4
3. 用键角判断
分子的空间结构和键角的关系如表所示:
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
A2 直线形 (对称) — 非极 性键 非极性 H2、O2、N2等
AB 直线形 (非对称) — 极性键 极性 HX(X为卤素原
子)、CO、NO等
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
AB2 直线形 (对称) 180° 极性键 非极性 CO2、CS2等
A2B V形 (不对称) — 极性键 极性 H2O、H2S等
AB3 平面三角形(对称) 120° 极性键 非极性 BF3、SO3等
续表
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
AB3 三角锥形 (不对称) — 极性键 极性 NH3、PCl3等
AB4 正四面体形(对称) 109°28′ 极性键 非极性 CH4、CCl4等
续表
4.根据等电子原理判断
通常情况下,等电子体的空间结构相同,如SO2与O3均为V形,CH4与NH均为正四面体形。
专题三 化学键、分子间作用力的比较
1.化学键的比较
类型 比较 离子键 共价键
非极性键 极性键
本质 阴、阳离子通过静电作用形成 原子间通过共用电子对所形成的相互作用
成键条件(元素种类) 成键原子的得、失电子能力差别很大(金属元素与非金属元素之间) 成键原子得、失电子能力相同(同种非金属元素之间) 成键原子得、失电子能力差别较小(不同种非金属元素之间)
类型 比较 离子键 共价键
非极性键 极性键
特征 无方向性和饱和性 有方向性、饱和性
存在 离子化合物 单质(如H2),共价化合物(如H2O2),某些离子化合物(如Na2O2) 共价化合物(如HCl),某些离子化合物(如NaOH)
续表
类型 比较 离子键 共价键
非极性键 极性键
影响强弱因素 一般阴、阳离子电荷越多,半径越小,离子键越强 成键原子电负性差值越大,键的极性越强;键能越大,键长越短,共价键越牢固
续表
2.范德华力、氢键和共价键的比较
范德华力 氢键 共价键
作用粒子 分子或原子(稀有气体分子) 氢原子,氟、氮、氧原子(分子内、分子间) 原子
强度比较 共价键>氢键>范德华力
范德华力 氢键 共价键
影响其强度的因素 ①随着分子极性的增大而增大; ②组成和结构相似的物质,相对分子质量越大,范德华力越大 对于AH…B—,A、B的电负性越大,半径越小,氢键越强 成键原子半径越小,键长越短,键能越大,共价键越稳定
续表
范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔、沸点和溶解度等物理性质;②组成和结构相似的物质,随着相对分子质量的增大,物质的熔、沸点升高,如熔、沸点:F2<Cl2<Br2<I2 、CF4<CCl4<CBr4 ①分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大,如沸点:H2O>H2S、HF>HCl、NH3>PH3;②分子内氢键使物质的熔、沸点降低 影响分子的稳定性,共价键键能越大,分子稳定性越强
续表
本课结束
This lesson is over
THANKS!
第二章
分子结构与性质
本章复习提纲二
[主干知识结构化]
[知识网络构建]
专题一 共价键
共价键
共价键
专题二 分子的空间结构及判断方法
1.用价层电子对互斥模型判断
价层电子对互斥模型说明价层电子对的排斥作用对分子空间结构的影响,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对。
(1)当中心原子上无孤电子对时,分子的空间结构与VSEPR模型一致。
(2)当中心原子上有孤电子对时,分子的空间结构与VSEPR模型不一致。
(3)若中心原子有孤电子对,根据孤电子对与成键电子对相互排斥作用的大小规律:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对。随着孤电子对数目的增多,键角减小。如CH4、NH3和H2O分子中的键角依次减小。
2.用杂化轨道理论判断
杂化 类型 杂化轨 道数目 杂化轨道 间夹角 分子空 间结构 实例
sp 2 180° 直线形 BeCl2、CH≡≡CH
sp2 3 120° 平面三角形 BF3、BCl3
sp3 4 109°28′ 正四面体形 CH4、CCl4
3. 用键角判断
分子的空间结构和键角的关系如表所示:
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
A2 直线形 (对称) — 非极 性键 非极性 H2、O2、N2等
AB 直线形 (非对称) — 极性键 极性 HX(X为卤素原
子)、CO、NO等
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
AB2 直线形 (对称) 180° 极性键 非极性 CO2、CS2等
A2B V形 (不对称) — 极性键 极性 H2O、H2S等
AB3 平面三角形(对称) 120° 极性键 非极性 BF3、SO3等
续表
分子 类型 分子的空 间结构 键角 键的 极性 分子 极性 实例
AB3 三角锥形 (不对称) — 极性键 极性 NH3、PCl3等
AB4 正四面体形(对称) 109°28′ 极性键 非极性 CH4、CCl4等
续表
4.根据等电子原理判断
通常情况下,等电子体的空间结构相同,如SO2与O3均为V形,CH4与NH均为正四面体形。
专题三 化学键、分子间作用力的比较
1.化学键的比较
类型 比较 离子键 共价键
非极性键 极性键
本质 阴、阳离子通过静电作用形成 原子间通过共用电子对所形成的相互作用
成键条件(元素种类) 成键原子的得、失电子能力差别很大(金属元素与非金属元素之间) 成键原子得、失电子能力相同(同种非金属元素之间) 成键原子得、失电子能力差别较小(不同种非金属元素之间)
类型 比较 离子键 共价键
非极性键 极性键
特征 无方向性和饱和性 有方向性、饱和性
存在 离子化合物 单质(如H2),共价化合物(如H2O2),某些离子化合物(如Na2O2) 共价化合物(如HCl),某些离子化合物(如NaOH)
续表
类型 比较 离子键 共价键
非极性键 极性键
影响强弱因素 一般阴、阳离子电荷越多,半径越小,离子键越强 成键原子电负性差值越大,键的极性越强;键能越大,键长越短,共价键越牢固
续表
2.范德华力、氢键和共价键的比较
范德华力 氢键 共价键
作用粒子 分子或原子(稀有气体分子) 氢原子,氟、氮、氧原子(分子内、分子间) 原子
强度比较 共价键>氢键>范德华力
范德华力 氢键 共价键
影响其强度的因素 ①随着分子极性的增大而增大; ②组成和结构相似的物质,相对分子质量越大,范德华力越大 对于AH…B—,A、B的电负性越大,半径越小,氢键越强 成键原子半径越小,键长越短,键能越大,共价键越稳定
续表
范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔、沸点和溶解度等物理性质;②组成和结构相似的物质,随着相对分子质量的增大,物质的熔、沸点升高,如熔、沸点:F2<Cl2<Br2<I2 、CF4<CCl4<CBr4 ①分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大,如沸点:H2O>H2S、HF>HCl、NH3>PH3;②分子内氢键使物质的熔、沸点降低 影响分子的稳定性,共价键键能越大,分子稳定性越强
续表
本课结束
This lesson is over
THANKS!
