第三章 晶体结构与性质章节复习课件(共24张ppt)人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质章节复习课件(共24张ppt)人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 18:04:18 | ||
图片预览


文档简介
(共24张PPT)
第三章
晶体结构与性质
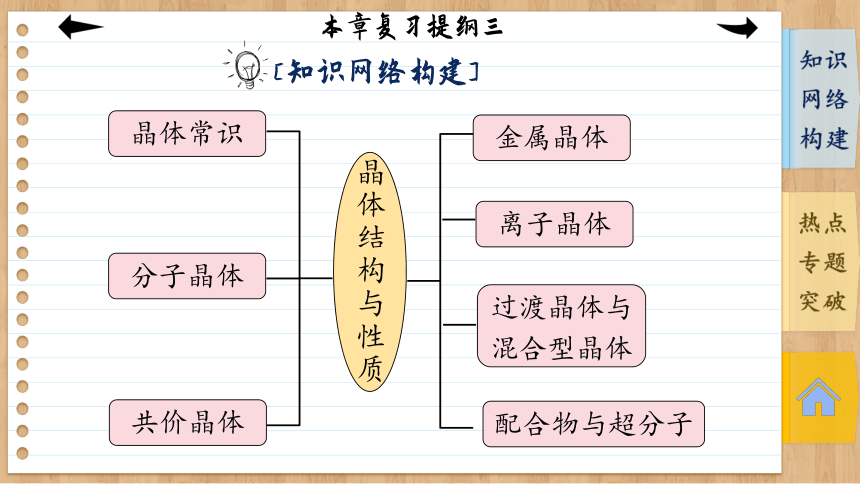
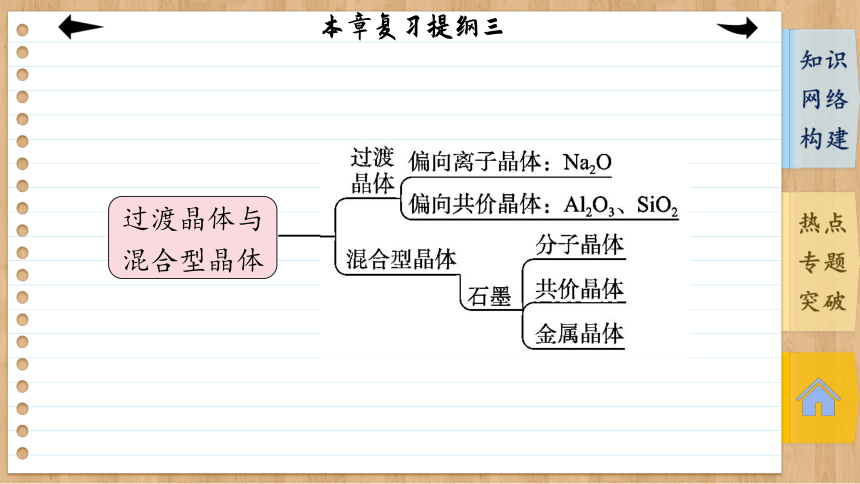
本章复习提纲三
[知识网络构建]
晶体结构与性质
金属晶体
离子晶体
过渡晶体与混合型晶体
配合物与超分子
晶体常识
分子晶体
共价晶体
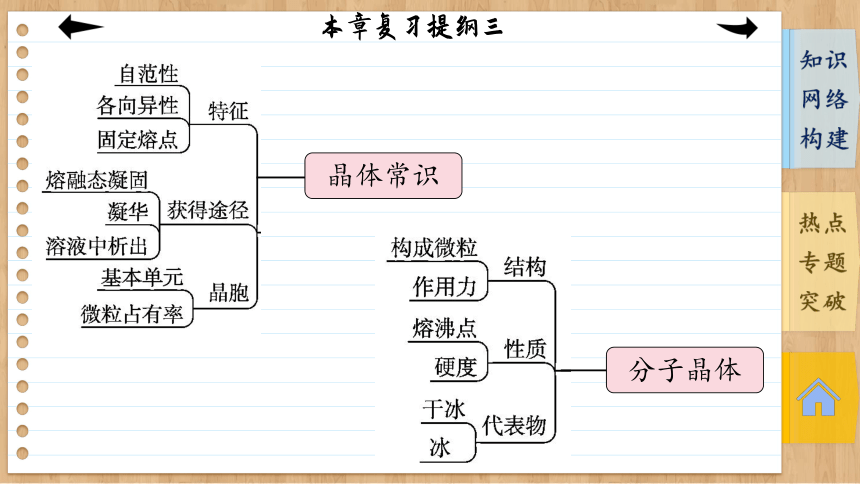
晶体常识
分子晶体
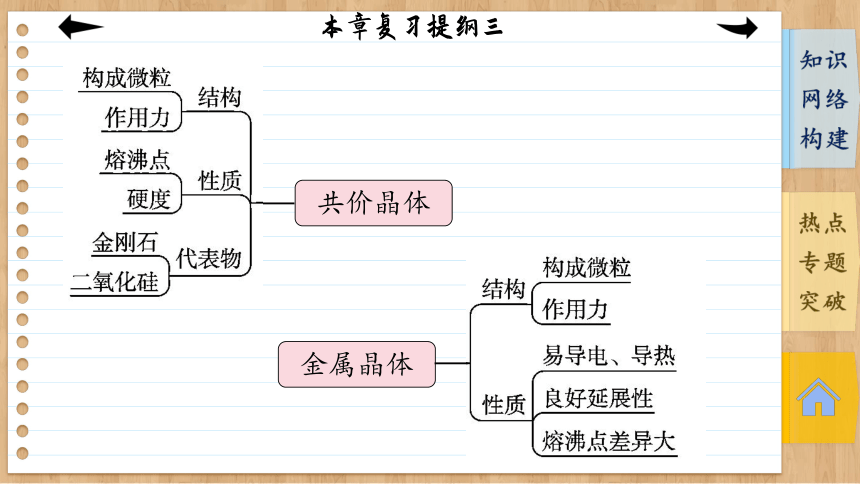
共价晶体
金属晶体
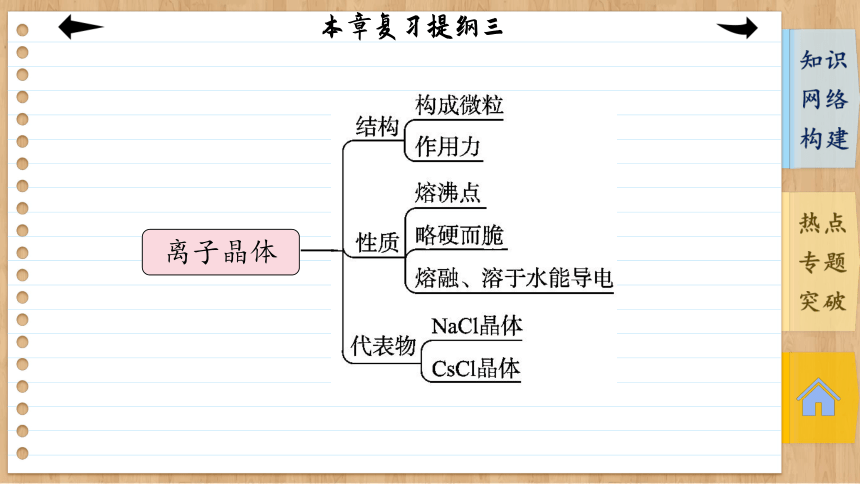
离子晶体
过渡晶体与混合型晶体
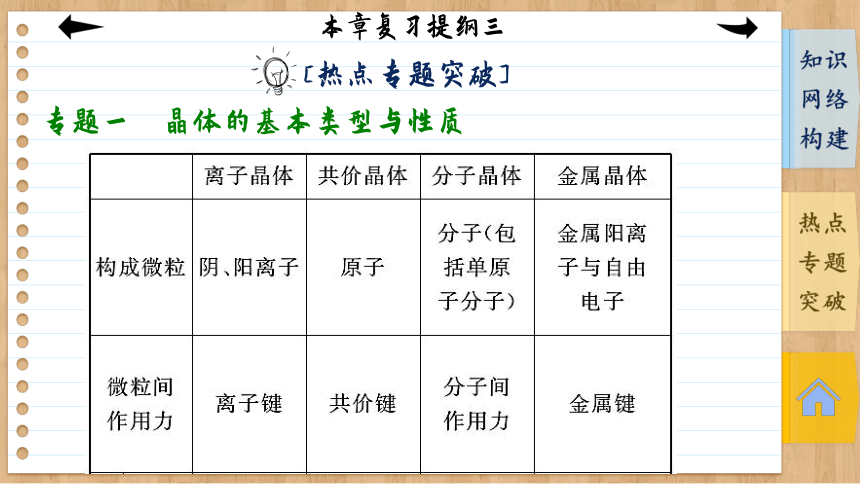
[热点专题突破]
专题一 晶体的基本类型与性质
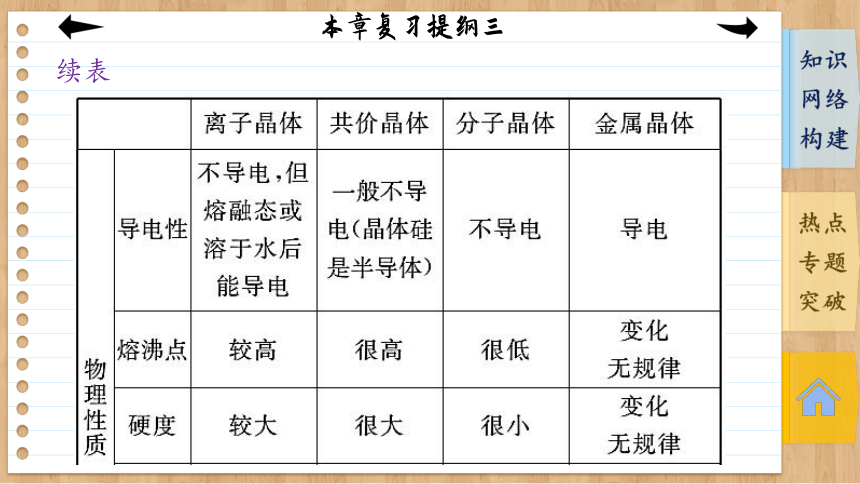
续表
续表
离子晶体 共价晶体 分子晶体 金属晶体
熔化时键 的变化 断开离子键,共价键不一定断裂 破坏 共价键 不破坏化学键, 破坏分子间作用力 破坏
金属键
物质种类 大多数盐、 强碱、活泼金属氧化物和金属过氧化物等 部分非金属单质、部分非金属化合物、极少数金属氧化物(如α Al2O3) 部分非金属质、所有非金属氢化物、几乎所有的酸、部分非金属氧化物、绝大多数有机物 金属单质及合金(Ge等除外)
续表
离子晶体 共价晶体 分子晶体 金属晶体
典型实例 NaCl、 NaOH等 金刚石、晶体Si、晶体B、SiO2、SiC等 干冰、白磷、冰、 硫黄、HCl、CH4等 Na、Mg、
Al、Fe、
Cu、Zn等
续表
专题二 物质熔、沸点高低的比较规律
1.根据物质的聚集状态
常温常压下,固体的熔、沸点高于液体,液体的熔、沸点高于气体。
2.根据晶体的类型
比较晶体熔、沸点时首先应该明确晶体的类型,因为不同晶体微粒间的作用力不同,影响晶体熔、沸点的因素也不同。一般来说,熔、沸点:共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点比较特殊,有的很高,如钨、铂等;有的很低,如汞、铯等。
3.同种类型晶体熔、沸点的比较规律
(1)共价晶体
比较共价晶体熔、沸点高低的关键是比较共价键的强弱。对于结构相似的共价晶体来说,成键原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高。如熔、沸点:金刚石>碳化硅>晶体硅。
(2) 离子晶体
离子晶体熔、沸点的高低取决于离子键的强弱。离子键的本质是阴、阳离子间的静电作用,对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距越小,则离子键越牢固,晶体的熔、沸点一般越高。如熔、沸点:MgO>NaCl>CsCl。
(3) 分子晶体
①组成和结构相似的分子晶体,相对分子质量越大,其熔、沸点越高。如熔、沸点:HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量相近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2。
③在同分异构体中,一般支链越多,熔、沸点越低。如熔、沸点:正戊烷>异戊烷>新戊烷。
④具有氢键的分子晶体,与同类化合物相比,其熔、沸点反常。如熔、沸点:H2O>H2Te>H2Se>H2S。
(4) 金属晶体
金属晶体熔、沸点的高低取决于金属键的强弱。金属键是金属阳离子与自由电子之间的强烈的相互作用,也属于静电作用。金属晶体结构相似,金属原子的价层电子数越多,原子半径越小,金属阳离子与自由电子之间的静电作用越强,金属键越强,熔、沸点越高。如熔、沸点:Na专题三 常见晶体的结构类型和分析
续表
续表
续表
续表
本课结束
This lesson is over
THANKS!
第三章
晶体结构与性质
本章复习提纲三
[知识网络构建]
晶体结构与性质
金属晶体
离子晶体
过渡晶体与混合型晶体
配合物与超分子
晶体常识
分子晶体
共价晶体
晶体常识
分子晶体
共价晶体
金属晶体
离子晶体
过渡晶体与混合型晶体
[热点专题突破]
专题一 晶体的基本类型与性质
续表
续表
离子晶体 共价晶体 分子晶体 金属晶体
熔化时键 的变化 断开离子键,共价键不一定断裂 破坏 共价键 不破坏化学键, 破坏分子间作用力 破坏
金属键
物质种类 大多数盐、 强碱、活泼金属氧化物和金属过氧化物等 部分非金属单质、部分非金属化合物、极少数金属氧化物(如α Al2O3) 部分非金属质、所有非金属氢化物、几乎所有的酸、部分非金属氧化物、绝大多数有机物 金属单质及合金(Ge等除外)
续表
离子晶体 共价晶体 分子晶体 金属晶体
典型实例 NaCl、 NaOH等 金刚石、晶体Si、晶体B、SiO2、SiC等 干冰、白磷、冰、 硫黄、HCl、CH4等 Na、Mg、
Al、Fe、
Cu、Zn等
续表
专题二 物质熔、沸点高低的比较规律
1.根据物质的聚集状态
常温常压下,固体的熔、沸点高于液体,液体的熔、沸点高于气体。
2.根据晶体的类型
比较晶体熔、沸点时首先应该明确晶体的类型,因为不同晶体微粒间的作用力不同,影响晶体熔、沸点的因素也不同。一般来说,熔、沸点:共价晶体>离子晶体>分子晶体。金属晶体的熔、沸点比较特殊,有的很高,如钨、铂等;有的很低,如汞、铯等。
3.同种类型晶体熔、沸点的比较规律
(1)共价晶体
比较共价晶体熔、沸点高低的关键是比较共价键的强弱。对于结构相似的共价晶体来说,成键原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高。如熔、沸点:金刚石>碳化硅>晶体硅。
(2) 离子晶体
离子晶体熔、沸点的高低取决于离子键的强弱。离子键的本质是阴、阳离子间的静电作用,对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距越小,则离子键越牢固,晶体的熔、沸点一般越高。如熔、沸点:MgO>NaCl>CsCl。
(3) 分子晶体
①组成和结构相似的分子晶体,相对分子质量越大,其熔、沸点越高。如熔、沸点:HI>HBr>HCl。
②组成和结构不相似的分子晶体(相对分子质量相近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2。
③在同分异构体中,一般支链越多,熔、沸点越低。如熔、沸点:正戊烷>异戊烷>新戊烷。
④具有氢键的分子晶体,与同类化合物相比,其熔、沸点反常。如熔、沸点:H2O>H2Te>H2Se>H2S。
(4) 金属晶体
金属晶体熔、沸点的高低取决于金属键的强弱。金属键是金属阳离子与自由电子之间的强烈的相互作用,也属于静电作用。金属晶体结构相似,金属原子的价层电子数越多,原子半径越小,金属阳离子与自由电子之间的静电作用越强,金属键越强,熔、沸点越高。如熔、沸点:Na
续表
续表
续表
续表
本课结束
This lesson is over
THANKS!
