2.1.1化学反应速率及测定课件(共46张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.1化学反应速率及测定课件(共46张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-19 21:30:24 | ||
图片预览









文档简介
(共46张PPT)
在化学反应中,如炸药的爆炸的计时最好能够精确到10-2~10- 3 s。
而研究某些岩石变化可能要用106~108 年为计时。
这是为什么?
化学反应速率及测定
学习目标0102概念单位计算化学反应速率直接观察法比色法速率的测定有的反应进行地轰轰烈烈瞬间完成
钾与水反应
房屋定向爆破
有些反应却是在潜移默化中完成的
煤的形成
经过几亿年的时间
01
PART ONE
如何表示化学反应的快慢
化学反应速率及计算
交流讨论
如何判断谁跑的快?
化学反应中,怎样定量判断反应的快、慢?
υ=
ΔS
Δt
单位时间或单位体积中,反应物或生成物物质的量变化来表示
如反应体系的体积是恒定的,则
用反应物或生成物物质的量浓度变化来表示
化学反应速率
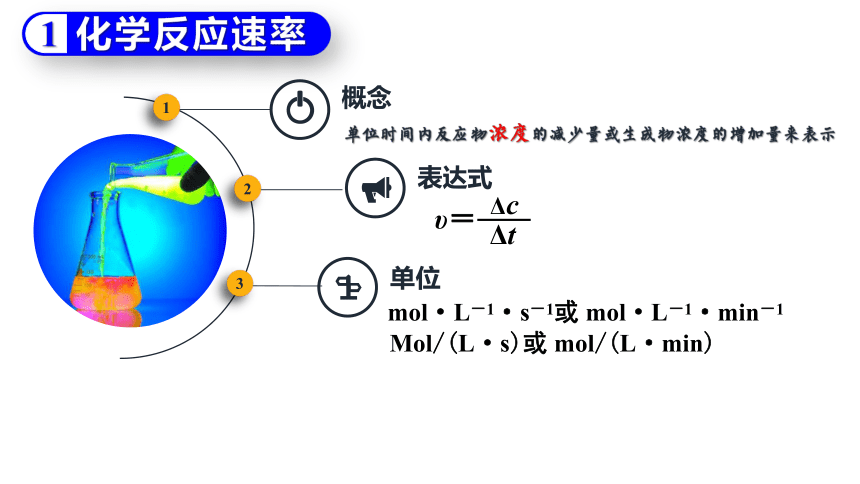
1
概念
1
2
表达式
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
υ=
Δc
Δt
3
单位
mol·L-1·s-1或 mol·L-1·min-1
Mol/(L·s)或 mol/(L·min)
一般来说,化学反应不是等速进行的,因此某一时间内的反应速率实际上是这一段时间内的平均速率。
化学反应速率无论是用反应物还是生成物表示,其化学反应速率都为正值。
固体或纯液体的浓度视为常数,Δc = 0,因此不用固体或纯液体表示化学反应速率。
C(s) + H2O(g) = CO + H2
请分别用一种物质的浓度随时间变化来表示下列反应速率:
υ(C)=
Δc(C)
Δt
你学会了吗?
υ(H2O)=
Δc(H2O)
Δt
υ(H2)=
Δc(H2)
Δt
υ(CO)=
Δc(CO)
Δt
① 在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质。
② 纯液体和纯固体的浓度视为常数,Δc=0,因此不用固体或纯液体浓度来表示化学反应速率。
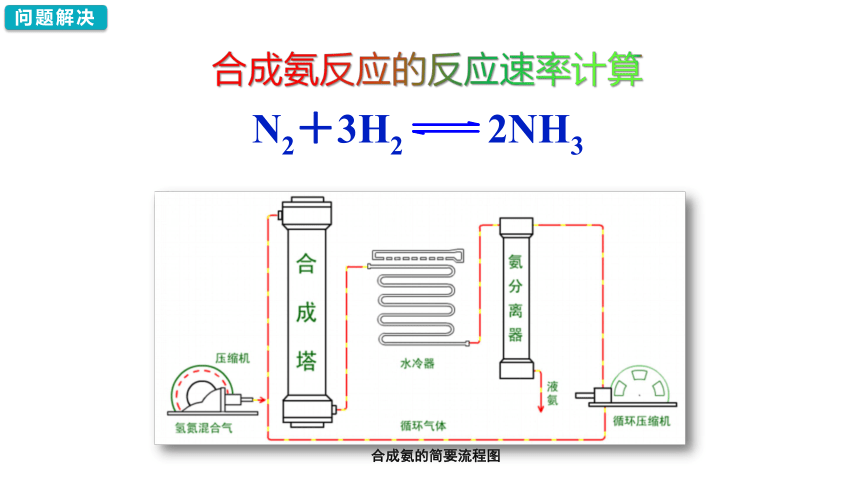
合成氨反应的反应速率计算
合成氨的简要流程图
问题解决
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应: ,2秒末时,测得生成0.6 mol NH3,求氨的反应速率。
合成氨反应的反应速率计算
看谁做得既准又快
Δc(NH3)=
0.6 mol
2 s
=0.3 mol·L-1
υ(NH3)=
Δc(NH3)
Δt
=
0.3 mol·L-1
2 s
=
0.15 mol·L-1·s-1
若用H2的浓度变化来表示,则反应速率是多少?
若用N2的浓度变化来表示,则反应速率是多少?
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应:
,2秒末时,测得生成0.6 mol NH3。
合成氨反应的反应速率计算
看谁做得既准又快
若用H2的浓度变化来表示,则反应速率是多少?
若用N2的浓度变化来表示,则反应速率是多少?
起始量/mol·L-1
转化量/mol·L-1
2 s量/mol·L-1
0.5
1.5
0.15
0.45
0.3
0.3
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应:
,2秒末时,测得生成0.6 mol NH3。
合成氨反应的反应速率计算
看谁做得既准又快
起始量/mol·L-1
转化量/mol·L-1
2 s量/mol·L-1
0.5
1.5
0.15
0.45
0.3
0.3
υ(N2)=
Δc(N2)
Δt
=
0.15 mol·L-1
2 s
=
0.075 mol·L-1·s-1
υ(H2)=
Δc(H2)
Δt
=
0.45 mol·L-1
2 s
=
0.225 mol·L-1·s-1
不同物质表示的反应速率可能不相同
要指明是哪种物质的反应速率
物质 N2 H2 NH3
反应速率/0.15 mol·L-1·s-1 0.075 0.225 0.15
温馨提醒
化学反应速率
1
概念
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
1
2
3
4
表达式
单位
计算
三段式
mol·L-1·s-1或 mol·L-1·min-1
v=
Δt
Δc
“三段式”计算模板
规律方法点拨
第一步:写出有关反应的化学方程式
第二步:设未知数,列出各物质的起始量、转化量、某时刻量
a b 0 0
起始量/mol·L-1
转化量/mol·L-1
mx nx px qx
某时刻量/mol·L-1
a-mx b-nx px qx
第三步:根据已知条件列方程式计算,得出各物质的转化浓度(Δc)
第四步:根据 计算反应速率
υ=
Δc
Δt
不同物质表示的反应速率可能不相同
物质 N2 H2 NH3
反应速率/0.15 mol·L-1·s-1 0.075 0.225 0.15
温馨提醒
对于同一化学反应,不同物质表示化学反应速率,其数值有何关系?
化学反应速率之比=化学计量数之比
化学反应速率
1
概念
1
2
表达式
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
3
单位
mol·L-1·s-1或 mol·L-1·min-1
4
计算
三段式
技巧
各物质的反应速率之比等于各物质的化学计量数之比
v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
H2与N2在一密闭容器中生成NH3,在不同的条件下测得反应速率如下:
①v(N2)=3 mol·L-1·s-1
②v(H2)=6 mol·L-1·min-1
哪种条件下反应速率最慢?
③v(NH3)=2 mol·L-1·s-1
考考你自己
v(H2)=0.1 mol·L-1·s-1
以v(N2)为基准
①v(N2)=3 mol·L-1·s-1
②v(H2)=6 mol·L-1·min-1
v(N2)=1/3 v(H2)=1/3 × 0.1 mol·L-1·s-1
③v(NH3)=2 mol·L-1·s-1
v(N2)=1/2 v(H2)=1/2 × 2 mol·L-1·s-1
不能单纯看数值大小
反应速率的大小比较
归纳与整理
规律方法点拨
归一法
不同物质表示的反应速率,换算成同一物质来表示反应速率;再比较数值的大小。
若单位不统一,则要换算成相同的单位
比值法
比较化学反应速率与化学计量数的比值,如
>
v(A)
m
v(B)
n
则说明用A表示的化学反应速率大于用B表示的化学反应速率。
可逆反应A(g)+2B(g)=3C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是
A.v(A)=0.15 mol·L-1·min -1
B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.4 mol·L-1·min-1
D.v(D)=0.01 mol·L-1·s-1
看谁做得既准又快
在同一反应中,反应速率的大小不能单纯地看数值大小,应化作相同的物质并统一单位进行比较。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示
① 反应开始到10 s,用Z表示的反应速率为____________________
② 反应化学方程式_______________
0.079 mol·L-1·s-1
挑战自我
02
PART TWO
如何通过实验测定反应速率?
思考﹒ 讨论
根据哪些实验现象可判断锌和不同浓度的稀硫酸反应的快慢?
定性描述
① 观察产生气泡的快慢
② 观察试管中剩余锌粒的大小
③ 用手触摸试管,感受试管壁温度高低
测定溶液浑浊程度、颜色变化
思考﹒ 讨论
如何测定锌和某浓度的稀硫酸的反应速率?
2.1 测定原理
反应速率的测定
2
υ=
Δc
Δt
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
选择可观测、易操作的变量
定量描述——化学反应速率
思考﹒ 讨论
测量化学反应速率的方法
其他物理量
2.2 测定项目
反应速率的测定
2
气体
气体的体积
体系的压强
颜色的深浅
测量气体体积的装置
资料在线
测定放出一定体积的气体的时间以测定反应速率
测定一定时间内气体体积/压强的变化以测定反应速率
2.2 测定项目
反应速率的测定
2
气体
气体的体积
体系的压强
颜色的深浅
离子浓度
导电能力
浑浊度
酸碱度
资料在线
测量离子浓度的仪器
电导率
pH
颜色
浑浊度
pH计
浊度计
离子浓度检测仪
便携式电导率仪
2.3 测定方法
反应速率的测定
2
比色法
溶液中,有颜色变化时,利用颜色深浅和显色物质浓度间的正比关系,测量反应速率
01
03
量气法
02
电导法
激光技术法
牛刀小试
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2 ↑
催化剂
选择可观测、易操作的变量
浓度变化容易测量吗?
我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测量哪些物理量呢?
气体体积
牛刀小试
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
Δn(O2)=
= 1.0×10-3 mol
Vm
Δ V(O2)
0.0224 L
22.4 L/mol
=
2H2O2 2H2O + O2 ↑
催化剂
1.0×10-3 mol
2.0×10-3
n /(mol)
=
Δn(H2O2)
V ·Δt
Δc(H2O2)
Δt
υ(H2O2)=
0.01L×6 min
2.0×10-3 mol
=
≈ 3.3×10-2 mol/(L·min)
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
测定项目
Zn+H2SO4 = ZnSO4+H2 ↑
设计方案
c(H+)
c(Zn2 +)
V(H2)
m(Zn)
确定变量
硫酸的浓度
控制变量
锌粒的质量
锌粒的表面积
溶液的体积
温度
压强
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
测定数据
固定体积,测时间
固定时间,测体积
测10 mL H2所用时间
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
加入试剂 反应时间/s 化学反应速/( mL·s-1) 结论
1 mol/L H2SO4
4 mol/L H2SO4 19
10.1
10
19
10
10.1
其他条件相同,4 mol/L H2SO4 硫酸溶液比 1 mol/L H2SO4 硫酸溶液化学反应速率大
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
化学反应速率
1
2
表达式
v=
Δc
Δt
注意
指明具体的物质(固体、纯液体不可以),带单位
是平均速度(不是瞬时速率),为正值
也可从其他角度或现象描述反应速率
3
规律
反应速率之比等于其化学计量数之比
归一法比较化学反应速率
规律方法
变换单拉
1
2
3
转换物质
比较大小
将各反应速率的单位统一
将各反应速率转换为同一物质(化学计量数最小)的反应速率
据各物质速率的数值排序
三步骤
变量控制法测定化学反应速率
规律方法
1
2
3
测定项目
测定方法
控制单一变量
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
看谁做得既准又快
看谁做得既准又快
控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是
A.浓度 B .温度 C .催化剂 D .固体质量
在化学反应中,如炸药的爆炸的计时最好能够精确到10-2~10- 3 s。
而研究某些岩石变化可能要用106~108 年为计时。
这是为什么?
化学反应速率及测定
学习目标0102概念单位计算化学反应速率直接观察法比色法速率的测定有的反应进行地轰轰烈烈瞬间完成
钾与水反应
房屋定向爆破
有些反应却是在潜移默化中完成的
煤的形成
经过几亿年的时间
01
PART ONE
如何表示化学反应的快慢
化学反应速率及计算
交流讨论
如何判断谁跑的快?
化学反应中,怎样定量判断反应的快、慢?
υ=
ΔS
Δt
单位时间或单位体积中,反应物或生成物物质的量变化来表示
如反应体系的体积是恒定的,则
用反应物或生成物物质的量浓度变化来表示
化学反应速率
1
概念
1
2
表达式
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
υ=
Δc
Δt
3
单位
mol·L-1·s-1或 mol·L-1·min-1
Mol/(L·s)或 mol/(L·min)
一般来说,化学反应不是等速进行的,因此某一时间内的反应速率实际上是这一段时间内的平均速率。
化学反应速率无论是用反应物还是生成物表示,其化学反应速率都为正值。
固体或纯液体的浓度视为常数,Δc = 0,因此不用固体或纯液体表示化学反应速率。
C(s) + H2O(g) = CO + H2
请分别用一种物质的浓度随时间变化来表示下列反应速率:
υ(C)=
Δc(C)
Δt
你学会了吗?
υ(H2O)=
Δc(H2O)
Δt
υ(H2)=
Δc(H2)
Δt
υ(CO)=
Δc(CO)
Δt
① 在反应中,用浓度变化表示化学反应速率只适用于气体和溶液中的溶质。
② 纯液体和纯固体的浓度视为常数,Δc=0,因此不用固体或纯液体浓度来表示化学反应速率。
合成氨反应的反应速率计算
合成氨的简要流程图
问题解决
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应: ,2秒末时,测得生成0.6 mol NH3,求氨的反应速率。
合成氨反应的反应速率计算
看谁做得既准又快
Δc(NH3)=
0.6 mol
2 s
=0.3 mol·L-1
υ(NH3)=
Δc(NH3)
Δt
=
0.3 mol·L-1
2 s
=
0.15 mol·L-1·s-1
若用H2的浓度变化来表示,则反应速率是多少?
若用N2的浓度变化来表示,则反应速率是多少?
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应:
,2秒末时,测得生成0.6 mol NH3。
合成氨反应的反应速率计算
看谁做得既准又快
若用H2的浓度变化来表示,则反应速率是多少?
若用N2的浓度变化来表示,则反应速率是多少?
起始量/mol·L-1
转化量/mol·L-1
2 s量/mol·L-1
0.5
1.5
0.15
0.45
0.3
0.3
在2 L的密闭容器中,通入1.0 mol N2和3.0 mol H2发生反应:
,2秒末时,测得生成0.6 mol NH3。
合成氨反应的反应速率计算
看谁做得既准又快
起始量/mol·L-1
转化量/mol·L-1
2 s量/mol·L-1
0.5
1.5
0.15
0.45
0.3
0.3
υ(N2)=
Δc(N2)
Δt
=
0.15 mol·L-1
2 s
=
0.075 mol·L-1·s-1
υ(H2)=
Δc(H2)
Δt
=
0.45 mol·L-1
2 s
=
0.225 mol·L-1·s-1
不同物质表示的反应速率可能不相同
要指明是哪种物质的反应速率
物质 N2 H2 NH3
反应速率/0.15 mol·L-1·s-1 0.075 0.225 0.15
温馨提醒
化学反应速率
1
概念
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
1
2
3
4
表达式
单位
计算
三段式
mol·L-1·s-1或 mol·L-1·min-1
v=
Δt
Δc
“三段式”计算模板
规律方法点拨
第一步:写出有关反应的化学方程式
第二步:设未知数,列出各物质的起始量、转化量、某时刻量
a b 0 0
起始量/mol·L-1
转化量/mol·L-1
mx nx px qx
某时刻量/mol·L-1
a-mx b-nx px qx
第三步:根据已知条件列方程式计算,得出各物质的转化浓度(Δc)
第四步:根据 计算反应速率
υ=
Δc
Δt
不同物质表示的反应速率可能不相同
物质 N2 H2 NH3
反应速率/0.15 mol·L-1·s-1 0.075 0.225 0.15
温馨提醒
对于同一化学反应,不同物质表示化学反应速率,其数值有何关系?
化学反应速率之比=化学计量数之比
化学反应速率
1
概念
1
2
表达式
单位时间内反应物浓度的减少量或生成物浓度的增加量来表示
3
单位
mol·L-1·s-1或 mol·L-1·min-1
4
计算
三段式
技巧
各物质的反应速率之比等于各物质的化学计量数之比
v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
H2与N2在一密闭容器中生成NH3,在不同的条件下测得反应速率如下:
①v(N2)=3 mol·L-1·s-1
②v(H2)=6 mol·L-1·min-1
哪种条件下反应速率最慢?
③v(NH3)=2 mol·L-1·s-1
考考你自己
v(H2)=0.1 mol·L-1·s-1
以v(N2)为基准
①v(N2)=3 mol·L-1·s-1
②v(H2)=6 mol·L-1·min-1
v(N2)=1/3 v(H2)=1/3 × 0.1 mol·L-1·s-1
③v(NH3)=2 mol·L-1·s-1
v(N2)=1/2 v(H2)=1/2 × 2 mol·L-1·s-1
不能单纯看数值大小
反应速率的大小比较
归纳与整理
规律方法点拨
归一法
不同物质表示的反应速率,换算成同一物质来表示反应速率;再比较数值的大小。
若单位不统一,则要换算成相同的单位
比值法
比较化学反应速率与化学计量数的比值,如
>
v(A)
m
v(B)
n
则说明用A表示的化学反应速率大于用B表示的化学反应速率。
可逆反应A(g)+2B(g)=3C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是
A.v(A)=0.15 mol·L-1·min -1
B.v(B)=0.6 mol·L-1·min-1
C.v(C)=0.4 mol·L-1·min-1
D.v(D)=0.01 mol·L-1·s-1
看谁做得既准又快
在同一反应中,反应速率的大小不能单纯地看数值大小,应化作相同的物质并统一单位进行比较。
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示
① 反应开始到10 s,用Z表示的反应速率为____________________
② 反应化学方程式_______________
0.079 mol·L-1·s-1
挑战自我
02
PART TWO
如何通过实验测定反应速率?
思考﹒ 讨论
根据哪些实验现象可判断锌和不同浓度的稀硫酸反应的快慢?
定性描述
① 观察产生气泡的快慢
② 观察试管中剩余锌粒的大小
③ 用手触摸试管,感受试管壁温度高低
测定溶液浑浊程度、颜色变化
思考﹒ 讨论
如何测定锌和某浓度的稀硫酸的反应速率?
2.1 测定原理
反应速率的测定
2
υ=
Δc
Δt
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
选择可观测、易操作的变量
定量描述——化学反应速率
思考﹒ 讨论
测量化学反应速率的方法
其他物理量
2.2 测定项目
反应速率的测定
2
气体
气体的体积
体系的压强
颜色的深浅
测量气体体积的装置
资料在线
测定放出一定体积的气体的时间以测定反应速率
测定一定时间内气体体积/压强的变化以测定反应速率
2.2 测定项目
反应速率的测定
2
气体
气体的体积
体系的压强
颜色的深浅
离子浓度
导电能力
浑浊度
酸碱度
资料在线
测量离子浓度的仪器
电导率
pH
颜色
浑浊度
pH计
浊度计
离子浓度检测仪
便携式电导率仪
2.3 测定方法
反应速率的测定
2
比色法
溶液中,有颜色变化时,利用颜色深浅和显色物质浓度间的正比关系,测量反应速率
01
03
量气法
02
电导法
激光技术法
牛刀小试
在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2 ↑
催化剂
选择可观测、易操作的变量
浓度变化容易测量吗?
我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测量哪些物理量呢?
气体体积
牛刀小试
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
Δn(O2)=
= 1.0×10-3 mol
Vm
Δ V(O2)
0.0224 L
22.4 L/mol
=
2H2O2 2H2O + O2 ↑
催化剂
1.0×10-3 mol
2.0×10-3
n /(mol)
=
Δn(H2O2)
V ·Δt
Δc(H2O2)
Δt
υ(H2O2)=
0.01L×6 min
2.0×10-3 mol
=
≈ 3.3×10-2 mol/(L·min)
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
测定项目
Zn+H2SO4 = ZnSO4+H2 ↑
设计方案
c(H+)
c(Zn2 +)
V(H2)
m(Zn)
确定变量
硫酸的浓度
控制变量
锌粒的质量
锌粒的表面积
溶液的体积
温度
压强
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
测定数据
固定体积,测时间
固定时间,测体积
测10 mL H2所用时间
观察与思考
锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液
化学反应速率的大小测定
加入试剂 反应时间/s 化学反应速/( mL·s-1) 结论
1 mol/L H2SO4
4 mol/L H2SO4 19
10.1
10
19
10
10.1
其他条件相同,4 mol/L H2SO4 硫酸溶液比 1 mol/L H2SO4 硫酸溶液化学反应速率大
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
化学反应速率
1
2
表达式
v=
Δc
Δt
注意
指明具体的物质(固体、纯液体不可以),带单位
是平均速度(不是瞬时速率),为正值
也可从其他角度或现象描述反应速率
3
规律
反应速率之比等于其化学计量数之比
归一法比较化学反应速率
规律方法
变换单拉
1
2
3
转换物质
比较大小
将各反应速率的单位统一
将各反应速率转换为同一物质(化学计量数最小)的反应速率
据各物质速率的数值排序
三步骤
变量控制法测定化学反应速率
规律方法
1
2
3
测定项目
测定方法
控制单一变量
(1)任何化学反应都可以通过反应现象判断化学反应的快慢
(2)测定化学反应速率,可以用比色的方法测定溶液颜色的深浅进行比较
×
(3)可用装置 测定过氧化氢分解的化学反应速率
√
×
(4)锌与H2SO4反应,H2SO4的浓度越大,产生H2的速率越快
×
看谁做得既准又快
看谁做得既准又快
控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是
A.浓度 B .温度 C .催化剂 D .固体质量
