2025苏教版高中化学必修第一册同步练习题--第2课时 氯气的性质及应用(含解析)
文档属性
| 名称 | 2025苏教版高中化学必修第一册同步练习题--第2课时 氯气的性质及应用(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 884.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025苏教版高中化学必修第一册
第2课时 氯气的性质及应用
基础过关练
题组一 氯气的物理性质与用途
1.(2023重庆沙坪坝阶段练习)生活中难免会遇到一些突发事件,我们要善于利用学过的知识采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救得当的是( )
A.用蘸有肥皂水的毛巾捂住口鼻撤离
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.在附近放一盆水
2.下列有关氯气用途的说法不正确的是( )
A.氯气可用于生产盐酸
B.氯气是生产高纯度的氯化钠、氯化亚铁等的主要原料
C.氯气可用于生产漂白剂和消毒剂
D.氯气可用于药物、染料等的生产
题组二 氯气与单质的反应
3.(2023云南玉溪期中)下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.FeCl3
4.氢气在氯气中燃烧的示意图如下所示。下列有关该实验的说法错误的是( )
A.集气瓶中氯气呈黄绿色
B.氢气在氯气中燃烧,火焰呈淡蓝色
C.燃烧过程中集气瓶口会产生大量白雾
D.该实验能充分说明燃烧,不一定有氧气参加
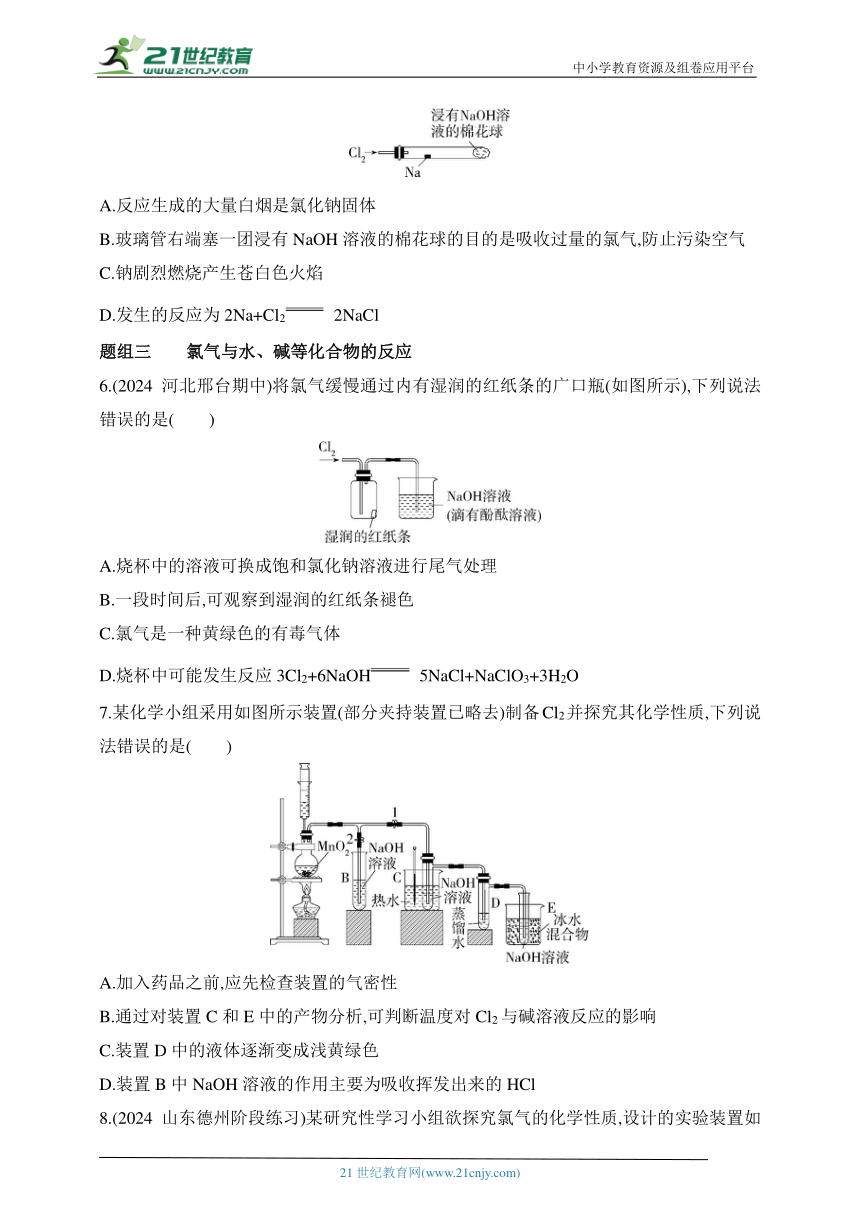
5.(2024北京海淀期中)某化学教师为进行氯气与金属钠反应的实验,设计了如图所示装置。将一根硬质玻璃管与氯气发生器相连,向该玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管右端塞一团浸有NaOH溶液的棉花球。先用酒精灯给钠预热,钠熔成小球时,撤去酒精灯,立即通入氯气,钠剧烈燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠固体
B.玻璃管右端塞一团浸有NaOH溶液的棉花球的目的是吸收过量的氯气,防止污染空气
C.钠剧烈燃烧产生苍白色火焰
D.发生的反应为2Na+Cl2 2NaCl
题组三 氯气与水、碱等化合物的反应
6.(2024河北邢台期中)将氯气缓慢通过内有湿润的红纸条的广口瓶(如图所示),下列说法错误的是( )
A.烧杯中的溶液可换成饱和氯化钠溶液进行尾气处理
B.一段时间后,可观察到湿润的红纸条褪色
C.氯气是一种黄绿色的有毒气体
D.烧杯中可能发生反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O
7.某化学小组采用如图所示装置(部分夹持装置已略去)制备Cl2并探究其化学性质,下列说法错误的是( )
A.加入药品之前,应先检查装置的气密性
B.通过对装置C和E中的产物分析,可判断温度对Cl2与碱溶液反应的影响
C.装置D中的液体逐渐变成浅黄绿色
D.装置B中NaOH溶液的作用主要为吸收挥发出来的HCl
8.(2024山东德州阶段练习)某研究性学习小组欲探究氯气的化学性质,设计的实验装置如图所示。
已知:该装置气密性良好,铁粉放在耐高温的硬质玻璃管中。
请回答下列问题:
(1)为防止铁粉被空气中的氧气氧化,在加热之前应该进行的操作为 。
(2)实验装置中空试管的作用是 。
(3)烧杯中氢氧化钠溶液的作用是 。
(4)盛水的试管中,溶液的颜色为 ,说明氯气 (填“能”或“不能”)溶于水。
题组四 新制氯水及次氯酸的性质
9.(2024江苏连云港期中)下列关于新制氯水的说法错误的是( )
A.向新制氯水中滴入碳酸钠溶液,有气体生成,该气体为CO2
B.将新制氯水滴入紫色石蕊试液,石蕊试液先变红后褪色,说明Cl2有漂白性
C.将新制氯水滴入AgNO3溶液,有白色沉淀生成,其化学方程式为AgNO3+HCl AgCl↓+HNO3
D.新制氯水中含有Cl2、HClO分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应
10.(2024山东菏泽阶段练习)向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。
下列叙述正确的是( )
A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+
B.过程Ⅱ溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程Ⅲ溶液由无色变成浅黄绿色,证明溶液中有HClO
D.过程Ⅱ溶液由红色变成无色,起作用的微粒是Cl2
11.(2024广东江门期中)新制氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应回答问题(重合部分代表物质间会发生反应,a代表光照新制氯水,b、c、d、e分别代表向新制氯水中加入少量Na2CO3、AgNO3溶液、石蕊试液、NaOH溶液的操作)。
(1)能证明新制氯水具有漂白性的是 (填“a”“b”“c”“d”或“e”)。
(2)c过程中的现象是 。
(3)e过程中主要反应的化学方程式为 。
能力提升练
题组 氯气及含氯化合物性质的综合应用
1.(2023广东汕头实验中学期中)氯气及其化合物在生产和生活中有重要应用,下列关于氯及其化合物的说法正确的是( )
A.氢气在氯气中燃烧产生苍白色火焰
B.NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,原因是生成了氯气,具有漂白性
C.氯气能与铁反应,所以液氯不能存放在钢瓶中
D.氯气能使湿润的石蕊试纸先变蓝后褪色
2.用排饱和食盐水法收集到一集气瓶Cl2,用该瓶气体不能完成的实验是( )
A.探究Cl2是否有漂白性的实验
B.探究Cl2能被NaOH溶液吸收的实验
C.探究H2在Cl2中燃烧的实验
D.探究铜丝在Cl2中燃烧的实验
3.(2024江西南昌期中)若将浓盐酸滴入烧瓶中进行如图(a、c、d均为浸有相应试液的棉花团)所示的探究实验,下列分析正确的是( )
A.装置A中的KMnO4可用MnO2代替
B.b处红色鲜花瓣褪色,说明Cl2具有漂白性
C.d处涉及反应的化学方程式为:2KI+Cl2 I2+2KCl,现象为d处棉花团变蓝
D.含有0.001 mol Cl2的尾气进入C装置,最多消耗0.001 mol NaOH
4.(2023山东聊城第一中学月考)某实验小组利用长柄V形管设计如图所示的Na与氯气反应的实验(“△”代表酒精灯加热),方法是先加热长柄中的钠块至熔化,撤掉酒精灯,再通入Cl2。下列判断错误的是 ( )
A.长柄中有白烟生成,逐渐凝聚在玻璃管内壁
B.X溶液可为浓NaOH溶液
C.V形管的“消膜泡”可防止X溶液被吹出
D.钠在氯气中燃烧的火焰为苍白色
5.(2023江苏常州高级中学第一次调研)用久置于空气中的生石灰[主要成分为CaO,还含有Ca(OH)2和CaCO3]制取KClO3的流程如下图所示。“转化”时发生反应的化学方程式为Ca(ClO3)2+2KCl 2KClO3↓+CaCl2。下列说法不正确的是( )
A.“打浆”有利于后续“氯化”反应的加速进行
B.“过滤”后的滤渣中含有CaCO3
C.“氯化”过程中Cl2与氢氧化钙反应生成Ca(ClO3)2
D.由“转化”反应可知,相同条件下KClO3的溶解度大于Ca(ClO3)2
6.用新制氯水做实验,验证次氯酸光照分解的产物,可设计成数字化实验,其数据经计算机处理得如下图像。已知:溶液中离子浓度越大,离子所带电荷数越多,溶液导电能力越强。下列说法不正确的是( )
A.0~150 s,氯水pH降低的主要原因是HClO电离产生了H+
B.0~150 s,溶液的导电能力逐渐增强
C.0~150 s,氯水中c(Cl-)逐渐增大
D.可以通过测定氧气的体积分数变化来验证次氯酸分解有O2生成
7.(2024江西鹰潭期中)某研究性学习小组同学为探究氯气的性质,设计如图装置进行实验探究。
下列说法不正确的是( )
A.利用装置a、b可探究氯气是否有漂白性
B.通入氯气后可观察到装置c中溶液变红
C.装置d中产生白色沉淀说明氯气与水反应生成了HCl
D.装置e中反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O
8.(2023河北衡水中学月考)如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让氯气经过甲瓶后,再通入乙瓶,红色布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀,再通入氯气,红色布条褪色。甲瓶中所盛的试剂可能是( )
①浓硫酸 ②NaOH溶液 ③饱和NaCl溶液 ④KI溶液
A.①② B.②③ C.①②③ D.①②④
9.(2024江苏如皋月考)二氧化氯(ClO2)常温下为黄绿色气体,易溶于水且不与水反应,浓的ClO2受热时易爆炸。ClO2与Cl2一样具有强氧化性,可用于消毒,湿润的ClO2具有漂白性。实验室可用干燥的Cl2与NaClO2固体反应制取ClO2,实验装置如下图所示:
(1)装置A中所发生反应的化学方程式为 。
(2)装置C中应盛装的试剂是 。
(3)装置D中反应的化学方程式为 。
(4)为防止ClO2受热爆炸,实验中采取的措施有 、 。
(5)实验室可通过反应2NaClO3+4HCl(浓) 2NaCl+2ClO2↑+Cl2↑+2H2O制取ClO2,所制ClO2中含有Cl2。从所提供的试剂中,选择合适的试剂,设计由该混合气体验证ClO2具有漂白性的实验方案: 。
(可供选择的试剂:NaOH溶液、NaClO2固体、湿润的有色布条)
答案与分层梯度式解析
第2课时 氯气的性质及应用
基础过关练
1.A 肥皂水显弱碱性,可以吸收氯气且不伤皮肤,A正确;氯气的密度大于空气,故应向地势高的地方撤离,B错误;氯气泄漏时应逆风撤离,C错误;氯气在水中的溶解度不大,且与水反应不充分,D错误。
2.B Cl2与H2在点燃或光照下反应生成HCl,HCl溶于水得盐酸,A正确;氯化钠的生产一般不以氯气为原料,高纯度的氯化钠一般是对海水中获取的粗盐进行提纯而得到,B错误;氯气与碱溶液反应,可得到含有次氯酸盐的漂白剂,氯气也可以用于生产ClO2等消毒剂,C正确;氯气是药物制备、冶金工业及染料生产中的重要原料,D正确。
3.C Cu与盐酸不反应,A错误;Fe与氯气在点燃条件下反应生成FeCl3,B错误;Mg与氯气在点燃条件下反应生成MgCl2,Mg与盐酸反应生成MgCl2和H2,C正确;Fe与盐酸反应生成FeCl2,D错误。
4.B 氯气是一种黄绿色有毒气体,A正确;氢气在氯气中燃烧发出苍白色火焰,B错误;氢气在氯气中燃烧生成HCl气体,HCl在集气瓶口与空气中的水蒸气形成盐酸小液滴,产生大量白雾,C正确;该实验没有氧气参与,说明燃烧不一定有氧气参加,D正确。
5.C 该实验中,Na和Cl2反应发出黄色火焰,有白烟(NaCl)生成,化学方程式为2Na+Cl2 2NaCl,A、D正确,C错误;Cl2有毒,为防止其污染空气,用NaOH溶液吸收多余的Cl2,B正确。
6.A 氯气难溶于饱和食盐水,烧杯中的溶液不能换成饱和氯化钠溶液,A错误;氯气与H2O反应能生成HClO,HClO具有强氧化性,能使湿润的红纸条褪色,B正确;氯气呈黄绿色,是一种有毒气体,C正确;烧杯中起初发生反应Cl2+2NaOH NaCl+NaClO+H2O,放出的热量使溶液温度升高(破题关键),可能发生反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,D正确。
7.D
实验时应该先检查装置的气密性,然后再装药品,A正确;装置C和E温度不同,故可以通过对装置C和E中的产物分析来判断温度对Cl2与碱溶液反应的影响(破题关键)B正确;装置D中通入氯气,形成氯水,新制氯水呈浅黄绿色,C正确;装置B中NaOH溶液用于处理反应后多余的氯气,D错误。
8.答案 (1)通入氯气排尽装置中的空气
(2)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(3)吸收尾气中的氯气,防止污染空气
(4)浅黄绿色 能
解析 (1)为防止铁粉被空气中的氧气氧化,在加热之前应该通入氯气排尽装置中的空气。
(2)装置中空试管的作用是防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂。
(3)氯气有毒,烧杯中氢氧化钠溶液的作用是吸收尾气中的氯气,防止污染空气。
(4)盛水的试管中,溶液最后的颜色为浅黄绿色,说明氯气能溶于水。
9.B 新制氯水中存在反应Cl2+H2O H++Cl-+HClO,新制氯水中含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(极少量)。HCl与少量Na2CO3反应可生成气体CO2,A项正确;H+可使紫色石蕊试液变红,HClO具有漂白性,可使红色褪去,Cl2没有漂白性,B项错误;Cl-与Ag+反应生成AgCl白色沉淀,C项正确;氯水中既含反应物Cl2,又含生成物HClO、H+、Cl-等,说明Cl2与H2O的反应为可逆反应,即Cl2与H2O不能完全反应,D项正确。
10.A 过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+,A正确;过程Ⅱ溶液由红色变成无色,是因为HClO具有漂白性,此时溶液仍然呈酸性,B错误,D错误;过程Ⅲ溶液由无色变成浅黄绿色,是因为溶液中存在Cl2,C错误。
11.答案 (1)d
(2)有白色沉淀生成
(3)Cl2+2NaOH NaCl+NaClO+H2O
解析 (1)新制氯水中的HClO有强氧化性,HClO可将有色物质氧化成无色物质,本题中新制氯水能使石蕊试液先变红后褪色,故d能证明新制氯水具有漂白性。
(2)新制氯水中有Cl-,加入AgNO3溶液有白色沉淀AgCl生成。
(3)新制氯水中含有大量Cl2,Cl2与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
能力提升练
1.A 氢气在氯气中燃烧产生苍白色火焰,A正确;Cl2本身不具有漂白性,B错误;Cl2与铁在点燃或加热条件下反应,常温下不发生反应,可用钢瓶储存液氯(易错点)C错误;Cl2溶于水形成的氯水中含有H+、HClO,可使石蕊试纸先变红后褪色,D错误。
2.A 该氯气中含有水蒸气,要探究Cl2是否有漂白性,应用干燥的氯气,所以用该瓶气体不能完成A项实验。
3.C KMnO4与浓盐酸反应时不需加热,而MnO2与浓盐酸必须在加热条件下反应,所以装置A中的KMnO4不能用MnO2代替,A不正确;Cl2本身不具有漂白性,应为Cl2与水反应的产物具有漂白性,故b处红色鲜花瓣褪色不能说明Cl2具有漂白性,B不正确;d处Cl2先将I-氧化为I2,化学方程式为2KI+Cl2 2KCl+I2,I2再使淀粉溶液变蓝,C正确;Cl2与NaOH发生反应Cl2+2NaOH NaCl+NaClO+H2O,且尾气中还含有HCl杂质,则含有0.001 mol Cl2的尾气进入C装置,消耗NaOH的物质的量多于0.002 mol,D不正确。
4.D 钠在氯气中燃烧生成NaCl固体,有白烟出现,A项正确;Cl2的持续通入可能导致污染,故可用浓NaOH溶液吸收,B项正确;“消膜泡”起到防止液体被吹出的作用,C项正确;Na在氯气中燃烧产生黄色火焰,D项错误。
5.D 加水后CaO与H2O反应生成Ca(OH)2,“打浆”是将固体反应物粉碎,得到CaCO3和Ca(OH)2的悬浊液,增大氯化时反应物的接触面积,提高反应速率,A正确;Cl2在75 ℃时与Ca(OH)2反应生成CaCl2、Ca(ClO3)2和H2O,过滤后,滤渣中含有CaCO3,滤液中加入KCl,KCl与Ca(ClO3)2发生复分解反应生成KClO3沉淀和CaCl2(破题关键)则相同条件下KClO3的溶解度小于Ca(ClO3)2,B、C正确,D错误。
6.A 氯水中存在反应Cl2+H2O H++Cl-+HClO,HClO在光照条件下分解生成HCl和O2,0~150 s氯水pH降低的主要原因是HCl的量增多,电离产生的H+增多,A错误;随着反应的进行,溶液中c(Cl-)逐渐增大,溶液的导电能力逐渐增强,B正确,C正确;题图中0~150 s氧气的体积分数不断增大,说明HClO分解有O2生成,D正确。
7.B 通入干燥的Cl2,装置a中干燥的红色布条不褪色,装置b中湿润的红色布条褪色,说明Cl2本身没有漂白性,A正确;通入Cl2,Cl2与水反应生成HCl和HClO,HCl可使紫色石蕊溶液变红,HClO具有漂白性,可使变红了的石蕊溶液褪色,所以观察到装置c中的现象是紫色石蕊溶液先变红后褪色,B错误;装置d中产生白色沉淀,说明Cl2与水反应生成了HCl,HCl与AgNO3反应生成了AgCl白色沉淀,C正确;Cl2与NaOH反应生成NaCl、NaClO和H2O,D正确。
8.D 若关闭Ⅰ阀,打开Ⅱ阀,让氯气经过甲瓶后,再通入乙瓶,红色布条不褪色,可知甲中试剂干燥氯气或与氯气反应,①可干燥氯气,②④可吸收氯气,均符合题意,③饱和NaCl溶液抑制氯气的溶解,氯气经过饱和NaCl溶液仍能使红色布条褪色。
9.答案 (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)浓硫酸
(3)Cl2+2NaClO2 ClO2+2NaCl
(4)冰水浴 通入干燥空气稀释ClO2
(5)将混合气体先与足量NaClO2固体充分反应,将Cl2反应完,剩余气体再与湿润的有色布条中的有色物质反应,最后将尾气通入NaOH溶液中,若布条褪色,则证明ClO2具有漂白性
解析 实验目的为用干燥的Cl2与NaClO2固体反应制取ClO2,实验装置分为A、B、C、D、E、F六个部分,A装置为氯气发生装置,B装置中的试剂为饱和氯化钠溶液,用于除去氯气中混有的氯化氢气体,C装置中的试剂为浓硫酸,用于除去氯气中混有的水蒸气,D装置发生反应Cl2+2NaClO2 ClO2+2NaCl,生成ClO2,E装置用于收集ClO2,装置F中的试剂为氢氧化钠溶液,用于吸收尾气。
(1)浓盐酸与二氧化锰反应制氯气的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(2)C装置用于除去氯气中混有的水蒸气,则C装置中的试剂为浓硫酸。
(3)装置D中发生干燥的Cl2与NaClO2固体制取ClO2的反应,反应的化学方程式为Cl2+2NaClO2 ClO2+2NaCl。
(4)由题给信息可知,浓的ClO2受热时易爆炸,则为防止ClO2受热爆炸,实验中采取的措施有冰水浴和通入干燥空气稀释ClO2。
(5)验证混合气体中ClO2的漂白性需要先把氯气除去,故先使气体与足量NaClO2固体充分反应,将Cl2反应完,剩余气体再与湿润的有色布条中的有色物质反应,最后利用NaOH溶液吸收尾气,若布条褪色,则证明ClO2具有漂白性。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版高中化学必修第一册
第2课时 氯气的性质及应用
基础过关练
题组一 氯气的物理性质与用途
1.(2023重庆沙坪坝阶段练习)生活中难免会遇到一些突发事件,我们要善于利用学过的知识采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救得当的是( )
A.用蘸有肥皂水的毛巾捂住口鼻撤离
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.在附近放一盆水
2.下列有关氯气用途的说法不正确的是( )
A.氯气可用于生产盐酸
B.氯气是生产高纯度的氯化钠、氯化亚铁等的主要原料
C.氯气可用于生产漂白剂和消毒剂
D.氯气可用于药物、染料等的生产
题组二 氯气与单质的反应
3.(2023云南玉溪期中)下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.FeCl3
4.氢气在氯气中燃烧的示意图如下所示。下列有关该实验的说法错误的是( )
A.集气瓶中氯气呈黄绿色
B.氢气在氯气中燃烧,火焰呈淡蓝色
C.燃烧过程中集气瓶口会产生大量白雾
D.该实验能充分说明燃烧,不一定有氧气参加
5.(2024北京海淀期中)某化学教师为进行氯气与金属钠反应的实验,设计了如图所示装置。将一根硬质玻璃管与氯气发生器相连,向该玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管右端塞一团浸有NaOH溶液的棉花球。先用酒精灯给钠预热,钠熔成小球时,撤去酒精灯,立即通入氯气,钠剧烈燃烧,生成大量白烟。以下叙述错误的是( )
A.反应生成的大量白烟是氯化钠固体
B.玻璃管右端塞一团浸有NaOH溶液的棉花球的目的是吸收过量的氯气,防止污染空气
C.钠剧烈燃烧产生苍白色火焰
D.发生的反应为2Na+Cl2 2NaCl
题组三 氯气与水、碱等化合物的反应
6.(2024河北邢台期中)将氯气缓慢通过内有湿润的红纸条的广口瓶(如图所示),下列说法错误的是( )
A.烧杯中的溶液可换成饱和氯化钠溶液进行尾气处理
B.一段时间后,可观察到湿润的红纸条褪色
C.氯气是一种黄绿色的有毒气体
D.烧杯中可能发生反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O
7.某化学小组采用如图所示装置(部分夹持装置已略去)制备Cl2并探究其化学性质,下列说法错误的是( )
A.加入药品之前,应先检查装置的气密性
B.通过对装置C和E中的产物分析,可判断温度对Cl2与碱溶液反应的影响
C.装置D中的液体逐渐变成浅黄绿色
D.装置B中NaOH溶液的作用主要为吸收挥发出来的HCl
8.(2024山东德州阶段练习)某研究性学习小组欲探究氯气的化学性质,设计的实验装置如图所示。
已知:该装置气密性良好,铁粉放在耐高温的硬质玻璃管中。
请回答下列问题:
(1)为防止铁粉被空气中的氧气氧化,在加热之前应该进行的操作为 。
(2)实验装置中空试管的作用是 。
(3)烧杯中氢氧化钠溶液的作用是 。
(4)盛水的试管中,溶液的颜色为 ,说明氯气 (填“能”或“不能”)溶于水。
题组四 新制氯水及次氯酸的性质
9.(2024江苏连云港期中)下列关于新制氯水的说法错误的是( )
A.向新制氯水中滴入碳酸钠溶液,有气体生成,该气体为CO2
B.将新制氯水滴入紫色石蕊试液,石蕊试液先变红后褪色,说明Cl2有漂白性
C.将新制氯水滴入AgNO3溶液,有白色沉淀生成,其化学方程式为AgNO3+HCl AgCl↓+HNO3
D.新制氯水中含有Cl2、HClO分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应
10.(2024山东菏泽阶段练习)向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现红色、无色、浅黄绿色等变化。
下列叙述正确的是( )
A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+
B.过程Ⅱ溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程Ⅲ溶液由无色变成浅黄绿色,证明溶液中有HClO
D.过程Ⅱ溶液由红色变成无色,起作用的微粒是Cl2
11.(2024广东江门期中)新制氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应回答问题(重合部分代表物质间会发生反应,a代表光照新制氯水,b、c、d、e分别代表向新制氯水中加入少量Na2CO3、AgNO3溶液、石蕊试液、NaOH溶液的操作)。
(1)能证明新制氯水具有漂白性的是 (填“a”“b”“c”“d”或“e”)。
(2)c过程中的现象是 。
(3)e过程中主要反应的化学方程式为 。
能力提升练
题组 氯气及含氯化合物性质的综合应用
1.(2023广东汕头实验中学期中)氯气及其化合物在生产和生活中有重要应用,下列关于氯及其化合物的说法正确的是( )
A.氢气在氯气中燃烧产生苍白色火焰
B.NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,原因是生成了氯气,具有漂白性
C.氯气能与铁反应,所以液氯不能存放在钢瓶中
D.氯气能使湿润的石蕊试纸先变蓝后褪色
2.用排饱和食盐水法收集到一集气瓶Cl2,用该瓶气体不能完成的实验是( )
A.探究Cl2是否有漂白性的实验
B.探究Cl2能被NaOH溶液吸收的实验
C.探究H2在Cl2中燃烧的实验
D.探究铜丝在Cl2中燃烧的实验
3.(2024江西南昌期中)若将浓盐酸滴入烧瓶中进行如图(a、c、d均为浸有相应试液的棉花团)所示的探究实验,下列分析正确的是( )
A.装置A中的KMnO4可用MnO2代替
B.b处红色鲜花瓣褪色,说明Cl2具有漂白性
C.d处涉及反应的化学方程式为:2KI+Cl2 I2+2KCl,现象为d处棉花团变蓝
D.含有0.001 mol Cl2的尾气进入C装置,最多消耗0.001 mol NaOH
4.(2023山东聊城第一中学月考)某实验小组利用长柄V形管设计如图所示的Na与氯气反应的实验(“△”代表酒精灯加热),方法是先加热长柄中的钠块至熔化,撤掉酒精灯,再通入Cl2。下列判断错误的是 ( )
A.长柄中有白烟生成,逐渐凝聚在玻璃管内壁
B.X溶液可为浓NaOH溶液
C.V形管的“消膜泡”可防止X溶液被吹出
D.钠在氯气中燃烧的火焰为苍白色
5.(2023江苏常州高级中学第一次调研)用久置于空气中的生石灰[主要成分为CaO,还含有Ca(OH)2和CaCO3]制取KClO3的流程如下图所示。“转化”时发生反应的化学方程式为Ca(ClO3)2+2KCl 2KClO3↓+CaCl2。下列说法不正确的是( )
A.“打浆”有利于后续“氯化”反应的加速进行
B.“过滤”后的滤渣中含有CaCO3
C.“氯化”过程中Cl2与氢氧化钙反应生成Ca(ClO3)2
D.由“转化”反应可知,相同条件下KClO3的溶解度大于Ca(ClO3)2
6.用新制氯水做实验,验证次氯酸光照分解的产物,可设计成数字化实验,其数据经计算机处理得如下图像。已知:溶液中离子浓度越大,离子所带电荷数越多,溶液导电能力越强。下列说法不正确的是( )
A.0~150 s,氯水pH降低的主要原因是HClO电离产生了H+
B.0~150 s,溶液的导电能力逐渐增强
C.0~150 s,氯水中c(Cl-)逐渐增大
D.可以通过测定氧气的体积分数变化来验证次氯酸分解有O2生成
7.(2024江西鹰潭期中)某研究性学习小组同学为探究氯气的性质,设计如图装置进行实验探究。
下列说法不正确的是( )
A.利用装置a、b可探究氯气是否有漂白性
B.通入氯气后可观察到装置c中溶液变红
C.装置d中产生白色沉淀说明氯气与水反应生成了HCl
D.装置e中反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O
8.(2023河北衡水中学月考)如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让氯气经过甲瓶后,再通入乙瓶,红色布条不褪色;若关闭Ⅱ阀,打开Ⅰ阀,再通入氯气,红色布条褪色。甲瓶中所盛的试剂可能是( )
①浓硫酸 ②NaOH溶液 ③饱和NaCl溶液 ④KI溶液
A.①② B.②③ C.①②③ D.①②④
9.(2024江苏如皋月考)二氧化氯(ClO2)常温下为黄绿色气体,易溶于水且不与水反应,浓的ClO2受热时易爆炸。ClO2与Cl2一样具有强氧化性,可用于消毒,湿润的ClO2具有漂白性。实验室可用干燥的Cl2与NaClO2固体反应制取ClO2,实验装置如下图所示:
(1)装置A中所发生反应的化学方程式为 。
(2)装置C中应盛装的试剂是 。
(3)装置D中反应的化学方程式为 。
(4)为防止ClO2受热爆炸,实验中采取的措施有 、 。
(5)实验室可通过反应2NaClO3+4HCl(浓) 2NaCl+2ClO2↑+Cl2↑+2H2O制取ClO2,所制ClO2中含有Cl2。从所提供的试剂中,选择合适的试剂,设计由该混合气体验证ClO2具有漂白性的实验方案: 。
(可供选择的试剂:NaOH溶液、NaClO2固体、湿润的有色布条)
答案与分层梯度式解析
第2课时 氯气的性质及应用
基础过关练
1.A 肥皂水显弱碱性,可以吸收氯气且不伤皮肤,A正确;氯气的密度大于空气,故应向地势高的地方撤离,B错误;氯气泄漏时应逆风撤离,C错误;氯气在水中的溶解度不大,且与水反应不充分,D错误。
2.B Cl2与H2在点燃或光照下反应生成HCl,HCl溶于水得盐酸,A正确;氯化钠的生产一般不以氯气为原料,高纯度的氯化钠一般是对海水中获取的粗盐进行提纯而得到,B错误;氯气与碱溶液反应,可得到含有次氯酸盐的漂白剂,氯气也可以用于生产ClO2等消毒剂,C正确;氯气是药物制备、冶金工业及染料生产中的重要原料,D正确。
3.C Cu与盐酸不反应,A错误;Fe与氯气在点燃条件下反应生成FeCl3,B错误;Mg与氯气在点燃条件下反应生成MgCl2,Mg与盐酸反应生成MgCl2和H2,C正确;Fe与盐酸反应生成FeCl2,D错误。
4.B 氯气是一种黄绿色有毒气体,A正确;氢气在氯气中燃烧发出苍白色火焰,B错误;氢气在氯气中燃烧生成HCl气体,HCl在集气瓶口与空气中的水蒸气形成盐酸小液滴,产生大量白雾,C正确;该实验没有氧气参与,说明燃烧不一定有氧气参加,D正确。
5.C 该实验中,Na和Cl2反应发出黄色火焰,有白烟(NaCl)生成,化学方程式为2Na+Cl2 2NaCl,A、D正确,C错误;Cl2有毒,为防止其污染空气,用NaOH溶液吸收多余的Cl2,B正确。
6.A 氯气难溶于饱和食盐水,烧杯中的溶液不能换成饱和氯化钠溶液,A错误;氯气与H2O反应能生成HClO,HClO具有强氧化性,能使湿润的红纸条褪色,B正确;氯气呈黄绿色,是一种有毒气体,C正确;烧杯中起初发生反应Cl2+2NaOH NaCl+NaClO+H2O,放出的热量使溶液温度升高(破题关键),可能发生反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,D正确。
7.D
实验时应该先检查装置的气密性,然后再装药品,A正确;装置C和E温度不同,故可以通过对装置C和E中的产物分析来判断温度对Cl2与碱溶液反应的影响(破题关键)B正确;装置D中通入氯气,形成氯水,新制氯水呈浅黄绿色,C正确;装置B中NaOH溶液用于处理反应后多余的氯气,D错误。
8.答案 (1)通入氯气排尽装置中的空气
(2)防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂
(3)吸收尾气中的氯气,防止污染空气
(4)浅黄绿色 能
解析 (1)为防止铁粉被空气中的氧气氧化,在加热之前应该通入氯气排尽装置中的空气。
(2)装置中空试管的作用是防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂。
(3)氯气有毒,烧杯中氢氧化钠溶液的作用是吸收尾气中的氯气,防止污染空气。
(4)盛水的试管中,溶液最后的颜色为浅黄绿色,说明氯气能溶于水。
9.B 新制氯水中存在反应Cl2+H2O H++Cl-+HClO,新制氯水中含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-(极少量)。HCl与少量Na2CO3反应可生成气体CO2,A项正确;H+可使紫色石蕊试液变红,HClO具有漂白性,可使红色褪去,Cl2没有漂白性,B项错误;Cl-与Ag+反应生成AgCl白色沉淀,C项正确;氯水中既含反应物Cl2,又含生成物HClO、H+、Cl-等,说明Cl2与H2O的反应为可逆反应,即Cl2与H2O不能完全反应,D项正确。
10.A 过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+,A正确;过程Ⅱ溶液由红色变成无色,是因为HClO具有漂白性,此时溶液仍然呈酸性,B错误,D错误;过程Ⅲ溶液由无色变成浅黄绿色,是因为溶液中存在Cl2,C错误。
11.答案 (1)d
(2)有白色沉淀生成
(3)Cl2+2NaOH NaCl+NaClO+H2O
解析 (1)新制氯水中的HClO有强氧化性,HClO可将有色物质氧化成无色物质,本题中新制氯水能使石蕊试液先变红后褪色,故d能证明新制氯水具有漂白性。
(2)新制氯水中有Cl-,加入AgNO3溶液有白色沉淀AgCl生成。
(3)新制氯水中含有大量Cl2,Cl2与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为Cl2+2NaOH NaCl+NaClO+H2O。
能力提升练
1.A 氢气在氯气中燃烧产生苍白色火焰,A正确;Cl2本身不具有漂白性,B错误;Cl2与铁在点燃或加热条件下反应,常温下不发生反应,可用钢瓶储存液氯(易错点)C错误;Cl2溶于水形成的氯水中含有H+、HClO,可使石蕊试纸先变红后褪色,D错误。
2.A 该氯气中含有水蒸气,要探究Cl2是否有漂白性,应用干燥的氯气,所以用该瓶气体不能完成A项实验。
3.C KMnO4与浓盐酸反应时不需加热,而MnO2与浓盐酸必须在加热条件下反应,所以装置A中的KMnO4不能用MnO2代替,A不正确;Cl2本身不具有漂白性,应为Cl2与水反应的产物具有漂白性,故b处红色鲜花瓣褪色不能说明Cl2具有漂白性,B不正确;d处Cl2先将I-氧化为I2,化学方程式为2KI+Cl2 2KCl+I2,I2再使淀粉溶液变蓝,C正确;Cl2与NaOH发生反应Cl2+2NaOH NaCl+NaClO+H2O,且尾气中还含有HCl杂质,则含有0.001 mol Cl2的尾气进入C装置,消耗NaOH的物质的量多于0.002 mol,D不正确。
4.D 钠在氯气中燃烧生成NaCl固体,有白烟出现,A项正确;Cl2的持续通入可能导致污染,故可用浓NaOH溶液吸收,B项正确;“消膜泡”起到防止液体被吹出的作用,C项正确;Na在氯气中燃烧产生黄色火焰,D项错误。
5.D 加水后CaO与H2O反应生成Ca(OH)2,“打浆”是将固体反应物粉碎,得到CaCO3和Ca(OH)2的悬浊液,增大氯化时反应物的接触面积,提高反应速率,A正确;Cl2在75 ℃时与Ca(OH)2反应生成CaCl2、Ca(ClO3)2和H2O,过滤后,滤渣中含有CaCO3,滤液中加入KCl,KCl与Ca(ClO3)2发生复分解反应生成KClO3沉淀和CaCl2(破题关键)则相同条件下KClO3的溶解度小于Ca(ClO3)2,B、C正确,D错误。
6.A 氯水中存在反应Cl2+H2O H++Cl-+HClO,HClO在光照条件下分解生成HCl和O2,0~150 s氯水pH降低的主要原因是HCl的量增多,电离产生的H+增多,A错误;随着反应的进行,溶液中c(Cl-)逐渐增大,溶液的导电能力逐渐增强,B正确,C正确;题图中0~150 s氧气的体积分数不断增大,说明HClO分解有O2生成,D正确。
7.B 通入干燥的Cl2,装置a中干燥的红色布条不褪色,装置b中湿润的红色布条褪色,说明Cl2本身没有漂白性,A正确;通入Cl2,Cl2与水反应生成HCl和HClO,HCl可使紫色石蕊溶液变红,HClO具有漂白性,可使变红了的石蕊溶液褪色,所以观察到装置c中的现象是紫色石蕊溶液先变红后褪色,B错误;装置d中产生白色沉淀,说明Cl2与水反应生成了HCl,HCl与AgNO3反应生成了AgCl白色沉淀,C正确;Cl2与NaOH反应生成NaCl、NaClO和H2O,D正确。
8.D 若关闭Ⅰ阀,打开Ⅱ阀,让氯气经过甲瓶后,再通入乙瓶,红色布条不褪色,可知甲中试剂干燥氯气或与氯气反应,①可干燥氯气,②④可吸收氯气,均符合题意,③饱和NaCl溶液抑制氯气的溶解,氯气经过饱和NaCl溶液仍能使红色布条褪色。
9.答案 (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)浓硫酸
(3)Cl2+2NaClO2 ClO2+2NaCl
(4)冰水浴 通入干燥空气稀释ClO2
(5)将混合气体先与足量NaClO2固体充分反应,将Cl2反应完,剩余气体再与湿润的有色布条中的有色物质反应,最后将尾气通入NaOH溶液中,若布条褪色,则证明ClO2具有漂白性
解析 实验目的为用干燥的Cl2与NaClO2固体反应制取ClO2,实验装置分为A、B、C、D、E、F六个部分,A装置为氯气发生装置,B装置中的试剂为饱和氯化钠溶液,用于除去氯气中混有的氯化氢气体,C装置中的试剂为浓硫酸,用于除去氯气中混有的水蒸气,D装置发生反应Cl2+2NaClO2 ClO2+2NaCl,生成ClO2,E装置用于收集ClO2,装置F中的试剂为氢氧化钠溶液,用于吸收尾气。
(1)浓盐酸与二氧化锰反应制氯气的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(2)C装置用于除去氯气中混有的水蒸气,则C装置中的试剂为浓硫酸。
(3)装置D中发生干燥的Cl2与NaClO2固体制取ClO2的反应,反应的化学方程式为Cl2+2NaClO2 ClO2+2NaCl。
(4)由题给信息可知,浓的ClO2受热时易爆炸,则为防止ClO2受热爆炸,实验中采取的措施有冰水浴和通入干燥空气稀释ClO2。
(5)验证混合气体中ClO2的漂白性需要先把氯气除去,故先使气体与足量NaClO2固体充分反应,将Cl2反应完,剩余气体再与湿润的有色布条中的有色物质反应,最后利用NaOH溶液吸收尾气,若布条褪色,则证明ClO2具有漂白性。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
