2025苏教版高中化学必修第一册同步练习题--第2课时 物质的检验 物质性质和变化的探究
文档属性
| 名称 | 2025苏教版高中化学必修第一册同步练习题--第2课时 物质的检验 物质性质和变化的探究 |  | |
| 格式 | docx | ||
| 文件大小 | 557.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 16:35:06 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025苏教版高中化学必修第一册
第2课时 物质的检验 物质性质和变化的探究
基础过关练
题组一 检验物质的化学方法
1.(经典题)可以确定溶液中存在C的实验事实是 ( )
A.加入硝酸银溶液,有白色沉淀产生
B.加入盐酸,有无色无味气体产生
C.加入氯化钙溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
2.(经典题)(2023上海静安期末)检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,将红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞溶液
D.加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口检验
3.鉴别NaCl的最佳方法是( )
A.焰色呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀生成
B.焰色呈紫色,加盐酸酸化的AgNO3溶液有白色沉淀生成
C.焰色呈黄色,加盐酸酸化的AgNO3溶液有白色沉淀生成
D.焰色呈紫色,加硝酸酸化的AgNO3溶液有白色沉淀生成
4.(2024湖北武汉期中)检验某未知溶液中的离子,下列有关实验操作、实验现象和结论均正确的是( )
选项 实验操作 实验现象 结论
A 用铂丝蘸取少量该溶液,放在煤气灯火焰上灼烧 焰色为黄色 原溶液中存在Na+
B 取少量该溶液于试管中,滴加硝酸银溶液 产生白色沉淀 原溶液中存在Cl-
C 取少量该溶液于试管中,滴加足量稀盐酸,将产生的无色无味气体通入澄清石灰水中 澄清石灰水变浑浊 原溶液中存在C
D 取少量该溶液于试管中,滴加氯化钡溶液 产生白色沉淀 原溶液中存在S
5.(经典题)(2024江西宜春阶段练习)某溶液无色、澄清,对该溶液初步分析后发现其中可能含有S、Na+、C、H+、N、Cl-中的若干种,然后又做了如下实验。
①用pH试纸测定溶液的pH,结果pH试纸显红色。
②取2 mL溶液,加入BaCl2溶液和稀盐酸,生成了白色沉淀。
③将②中所得的混合物充分静置后,取上层澄清的液体,加入AgNO3溶液和稀硫酸,生成了白色沉淀。
(1)由上述实验可知,溶液中一定存在的离子是 (填离子符号,下同),一定不存在的离子是 。
(2)在上述实验操作中,有错误的步骤是(填序号) 。正确的操作是
。
(3)按(2)中改正实验操作后,仍生成白色沉淀,则还不能确定该溶液中是否存在的离子是 。
题组二 检验物质的物理方法
6.(2024安徽淮南阶段练习)看到绽放的美丽焰火,很容易联想到化学中的焰色反应,下列关于焰色反应的说法中不正确的是 ( )
A.焰色反应是金属元素在火焰上灼烧时使火焰呈现特殊的颜色
B.应该用稀盐酸清洗做过焰色反应实验的铂丝
C.在酒精灯火焰上灼烧蘸有K2CO3溶液的细铁丝时,透过蓝色钴玻璃能观察到紫色火焰
D.焰色反应的本质是元素在发生化学变化时引起能量差异导致的
7.(2024河北石家庄月考)用光洁的铂丝蘸取某无色溶液在火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )
A.只含Na+
B.可能含有Na+,可能还含有K+
C.既含有Na+,又含有K+
D.一定含Na+,可能含有K+
8.(经典题)现有A、B、C、D四种化合物,透过蓝色钴玻璃观察其焰色时发现火焰均为紫色;A、B、C分别和盐酸反应后,均可得到D;将固体C加热可制得A;若在A的溶液中通入一种无色无味气体,又可制得C;B与C的溶液混合可制得A。回答下列问题:
(1)A是 (填化学式,下同),B是 ,C是 ,D是 。
(2)写出B+C→A的化学方程式: 。
题组三 物质性质和变化的探究
9.某同学想用实验证明硫酸铜溶液显蓝色与S无关,进行下列实验无意义的是( )
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
10.(经典题)为了探究温度对化学反应快慢的影响,下列实验方案可行的是( )
11.为了探究影响化学反应速率的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论不正确的是( )
A.在相同条件下,等质量的大理石块和大理石粉分别与相同浓度、相同体积的盐酸反应时,大理石粉的反应快
B.将相同大小、相同形状的镁条和铝条分别与相同浓度的盐酸反应时,二者的化学反应速率相等
C.将相同浓度、相同体积的浓硝酸分别放在暗处和光照处,会发现光照可以加快浓硝酸的分解
D.室温下,向两支试管中分别加入相同浓度、相同体积的双氧水,再向其中一支试管中加入少量二氧化锰粉末,二者产生氧气的快慢不同
能力提升练
题组一 物质的检验与鉴别
1.(2023湖北宜昌夷陵中学期中,)在Na2SO4溶液中可能含有NaCl杂质,要检验NaCl是否存在,下列实验方法正确的是( )
A.取样,加入AgNO3溶液,有白色沉淀生成,则有Cl-
B.取样,加足量BaCl2溶液,过滤后再加AgNO3溶液,有白色沉淀生成,则有Cl-
C.取样,加入足量Ba(NO3)2溶液,过滤后再加AgNO3溶液,有白色沉淀生成,则有Cl-
D.取样,加入Ba(NO3)2和AgNO3的混合溶液,有白色沉淀生成,则有Cl-
2.(经典题)(2024江苏泰州)有4瓶常用溶液:①BaCl2溶液,②NaCl溶液,③Na2SO4溶液,④CuSO4溶液。不用其他试剂,即可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是( )
A.①④③② B.①④②③
C.①③④② D.④①②③
3.(2024四川成都第七中学期中)某溶液的溶质仅由Na+、Cu2+、Ba2+、Fe3+、C、S、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
根据以上实验判断,下列推断错误的是( )
A.气体1通入澄清石灰水中,溶液变浑浊
B.白色沉淀2中加稀硝酸,沉淀不溶解
C.原溶液中一定存在Na+和Cl-
D.滤液2中加入碳酸钠溶液一定会产生白色沉淀
4.下列物质鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl溶液
B.用氢氧化钠鉴别MgCl2溶液、NaCl溶液
C.利用丁达尔效应鉴别FeCl2溶液和HCl溶液
D.用澄清石灰水鉴别CO、CO2气体
题组二 物质性质和变化的探究
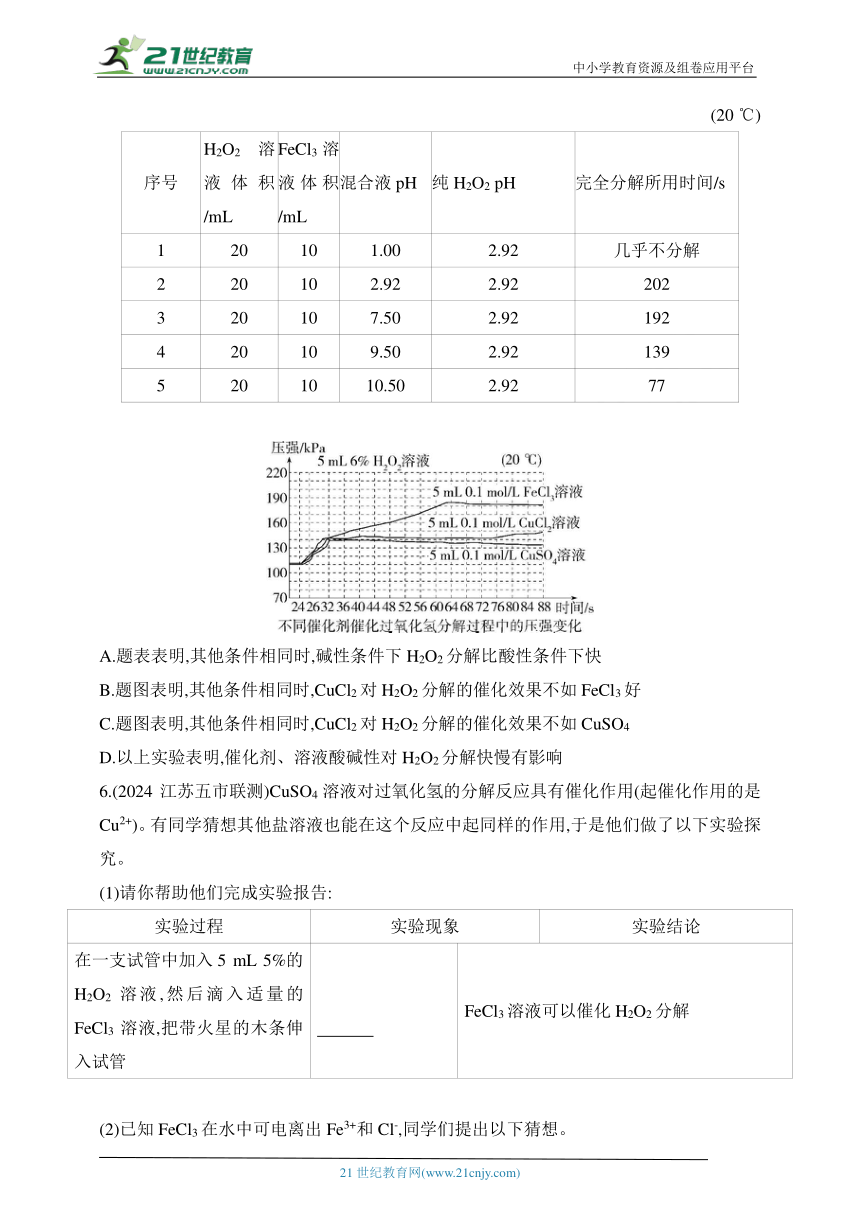
5.已知H2O2分解快慢受多种因素影响,某小组对此进行探究。下列说法不正确的是( )
(20 ℃)
序号 H2O2溶液体积/mL FeCl3溶液体积/mL 混合液pH 纯H2O2 pH 完全分解所用时间/s
1 20 10 1.00 2.92 几乎不分解
2 20 10 2.92 2.92 202
3 20 10 7.50 2.92 192
4 20 10 9.50 2.92 139
5 20 10 10.50 2.92 77
A.题表表明,其他条件相同时,碱性条件下H2O2分解比酸性条件下快
B.题图表明,其他条件相同时,CuCl2对H2O2分解的催化效果不如FeCl3好
C.题图表明,其他条件相同时,CuCl2对H2O2分解的催化效果不如CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解快慢有影响
6.(2024江苏五市联测)CuSO4溶液对过氧化氢的分解反应具有催化作用(起催化作用的是Cu2+)。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下实验探究。
(1)请你帮助他们完成实验报告:
实验过程 实验现象 实验结论
在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 FeCl3溶液可以催化H2O2分解
(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是 同学的猜想,理由是 。
(3)同学们对余下的两个猜想用实验进行了探究。请你仔细分析后完成下表:
实验过程 实验现象 实验结论
向盛有5 mL 5%的H2O2溶液的试管中加入少量的盐酸,并把带火星的木条伸入试管 无明显 现象 ①
向盛有5 mL 5%的H2O2溶液的试管中加入少量的② ,并把带火星的木条伸入试管 ③ ④
7.某化学小组同学在进行“活泼金属与酸的反应”实验时,对铝和铝的化合物的性质进行了探究。
【查阅资料】铝是一种活泼金属,在空气中表现出良好的抗腐蚀性,是由于铝与氧气作用形成一层致密的氧化膜。
【性质探究】
(1)金属的活动性
甲同学将用砂纸打磨过的铝片放入氯化镁溶液中,观察到 ,说明铝在金属活动性顺序中排在镁的 。
(2)金属与酸的反应
图1
图2
①铝片与稀硫酸反应产生氢气的速率与时间的关系如图1所示,单质铝与稀硫酸反应的化学方程式为 。图中从a到c产生H2的速率增大的原因可能是
。
②将铝片与pH相同的足量稀硫酸、稀盐酸反应,结果生成氢气的速率前者比后者慢很多。
甲同学认为可能是两片铝片的大小、质地等不同造成的,于是将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,结果仍是生成氢气的速率前者比后者慢得多。此实验方法是 。乙同学提出,可能是与稀硫酸反应的铝片表面有氧化膜的原因,大家一致反对,因为 。
丙同学对比盐酸和硫酸的化学式之后,认为可能是盐酸中的氯离子对反应产生促进作用,你认为还存在的另一种可能是 。
【验证猜想】为了验证“盐酸中的氯离子对反应产生促进作用”的猜想,大家一起设计了如图2所示的实验。如果该实验能证明猜想正确,则加入的两种溶液的溶质化学式分别为A ,B 。
答案与分层梯度式解析
第2课时 物质的检验 物质性质和变化的探究
基础过关练
1.C C的检验要考虑到干扰离子:S、HC等,如HC也会产生B、D项中的现象。
2.D 利用铵盐与强碱溶液共热反应生成氨气及氨气的性质进行检验,把NaOH溶液加入试管中,加热后产生的气体若能使湿润的红色石蕊试纸变蓝,就可以确定该物质中含铵盐,故D项正确。
3.A Na+焰色呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀生成,证明含Cl-。
4.A 钠的焰色为黄色,A项正确;检验Cl-的方法为:取少量待测液于试管中,加入AgNO3溶液,产生白色沉淀,加入稀硝酸,沉淀不溶解,则含有Cl-,B项错误;若原溶液中不含C,而含HC,加入足量稀盐酸,产生的无色无味气体也可以使澄清石灰水变浑浊,C项错误;检验S:取少量待测液于试管中,先加入过量稀盐酸,无现象,后滴加BaCl2溶液,若产生白色沉淀,则原溶液中含有S,D项错误。
5.答案 (1)H+、S
(2)③ 另取2 mL原溶液,加入AgNO3溶液和稀硝酸
(3)Na+、N
解析 (1)pH试纸显红色,说明溶液中大量存在H+,故不能有C。用BaCl2溶液和稀盐酸检验时生成了白色沉淀,说明溶液中有S。
(2)第②步操作中引入了Cl-,所以第③步操作是错误的(易错点),应另取原溶液进行Cl-的检验。
6.D 由焰色反应的概念可知,焰色反应是金属元素在灼烧时使火焰呈现特殊的颜色,A正确;做焰色反应实验结束后,铂丝要用稀盐酸洗涤,以除去杂质,B正确;在酒精灯火焰上灼烧蘸有K2CO3溶液的细铁丝时,透过蓝色钴玻璃能观察到紫色火焰,C正确;焰色反应属于物理变化,D错误。
7.D 直接观察时看到火焰呈黄色,说明溶液中含有Na+,没有透过蓝色钴玻璃观察,无法确定溶液中是否含有K+。
8.答案 (1)K2CO3 KOH KHCO3 KCl
(2)KHCO3+KOHK2CO3+H2O
解析 根据焰色可知四种化合物中均含有钾元素;A、B、C分别和盐酸反应都生成了D,D为KCl。由A、B、C之间的转化关系可推知A为K2CO3,B为KOH,C为KHCO3。
9.D A项,做对照实验;B项,生成硫酸钡沉淀,溶液蓝色没有消失,可以说明硫酸铜溶液显蓝色与S无关;C项,形成氢氧化铜沉淀,溶液蓝色消失,可以说明硫酸铜溶液显蓝色与S无关。
10.D 探究温度对化学反应快慢的影响,需在催化剂相同,H2O2溶液浓度相同,温度不同的条件下做对照实验,通过产生气泡的快慢来探究温度对化学反应快慢的影响。
11.B 将相同大小、相同形状的镁条和铝条分别与相同浓度的盐酸反应,镁、铝性质不同,镁与盐酸反应速率更快。
能力提升练
1.C 加入AgNO3溶液,生成的白色沉淀可能是AgCl,也可能是Ag2SO4,无法确定是否含有Cl-,A错误;加足量BaCl2溶液,引入了Cl-,干扰检验,B错误;先加足量Ba(NO3)2溶液,可除去S,从而排除S的干扰,过滤后再加AgNO3溶液,产生了白色沉淀,可表明溶液中含有Cl-,C正确;加入Ba(NO3)2和AgNO3的混合溶液,生成白色沉淀,无法确定是否含有Cl-,D错误。
方法点津 一般情况下,检验Cl-需要用HNO3溶液和AgNO3溶液。本题中S的存在会干扰Cl-的检验,所以先用足量Ba(NO3)2除去S,此时已经没有其他干扰离子,可以省略HNO3溶液,过滤后直接加入AgNO3溶液检验Cl-。
2.D 解答此类问题的一般方法:先根据待鉴别的溶液颜色确定出一种溶液,由已确定的溶液再去进一步鉴别其他溶液(解题技法)。由于CuSO4溶液呈蓝色,故可最先确定CuSO4溶液;取少量其他三种溶液于三支试管中,加入CuSO4溶液,只有BaCl2溶液中产生白色沉淀,故第二个鉴别出的是BaCl2溶液;然后取少量剩余两种溶液分别加入BaCl2溶液,可鉴别出Na2SO4溶液和NaCl溶液,故其检出顺序为④①③②或④①②③。
3.C 该溶液的溶质仅由Na+、Cu2+、Ba2+、Fe3+、C、S、Cl-中的若干种离子组成,加过量盐酸有气体放出,放出的气体一定是二氧化碳,则原溶液中一定含有C,Cu2+、Ba2+、Fe3+都不能与C大量共存,则原溶液中一定不含Cu2+、Ba2+、Fe3+;根据溶液呈电中性,可知原溶液中一定含有Na+;向无色溶液1中加过量氢氧化钡溶液得白色沉淀2,该沉淀一定是硫酸钡,则原溶液中一定含有S;向滤液2中加过量硝酸和硝酸银溶液生成白色沉淀3,该沉淀一定是氯化银,由于操作过程中加入了盐酸,所以不能确定原溶液中是否含有Cl-(易错点)。气体1是二氧化碳,将其通入澄清石灰水中,溶液变浑浊,A正确;白色沉淀2是硫酸钡,加稀硝酸,BaSO4不溶解,B正确;根据以上分析,知原溶液中一定存在Na+,不能确定是否含有Cl-,C错误;由于加入了过量氢氧化钡,则滤液2中一定含有Ba2+,故向滤液2中加入碳酸钠溶液一定会产生白色沉淀,D正确。
4.C K的焰色为紫色,Na的焰色为黄色,可以鉴别,A项正确;NaOH与MgCl2溶液反应产生沉淀,而NaOH与NaCl溶液不反应,可以鉴别,B项正确;只有胶体才具有丁达尔效应,C项错误;少量CO2通入澄清石灰水中,石灰水变浑浊,而向澄清石灰水中通入CO无现象,可以鉴别,D项正确。
5.C 对比实验3和实验1可知,碱性条件下,H2O2完全分解所用时间短,即其他条件相同时,H2O2在碱性条件下分解比在酸性条件下快,A项正确;对比题图中FeCl3、CuCl2催化曲线可知,其他条件相同时,相同时间内,FeCl3催化过程H2O2分解生成的气体的压强大,即FeCl3催化更有利于H2O2分解,B项正确;对比题图中CuSO4、CuCl2催化曲线,可知CuCl2对H2O2分解的催化效果比CuSO4好,C项错误;根据题表中溶液的酸碱性对H2O2分解的影响可知,其他条件相同时,H2O2在酸性条件下分解比碱性条件下慢,根据题图中FeCl3、CuSO4、CuCl2的催化曲线可知,催化效果:FeCl3>CuCl2>CuSO4,所以催化剂、溶液酸碱性对H2O2分解快慢有影响,D项正确。
6.答案 (1)试管中有大量气泡产生,带火星的木条复燃
(2)甲 过氧化氢溶液中有水,可见水不是催化剂
(3)①起催化作用的不是Cl- ②Fe2(SO4)3溶液(合理即可) ③试管中有大量气泡产生,带火星的木条复燃 ④起催化作用的是Fe3+
解析 (1)FeCl3溶液对H2O2的分解有催化作用,所以现象是试管中有大量气泡产生,带火星的木条复燃。
(2)过氧化氢溶液中有水,但一般情况过氧化氢分解速率很小,可见水不是催化剂,所以三个猜想中,最不可能的是甲。
(3)设计实验时需要控制变量,即分别加入Fe3+、Cl-,第一步实验加盐酸(有Cl-、无Fe3+),无明显现象,说明Cl-不起催化作用;第二步实验应加入一种含Fe3+但不含Cl-的物质,如Fe2(SO4)3等,H2O2的分解被促进,所以试管中有大量气泡产生,带火星的木条复燃,说明起催化作用的是Fe3+。
7.答案 (1)无明显现象 后面
(2)①2Al+3H2SO4Al2(SO4)3+3H2↑ 反应放热,随着反应的进行,温度升高,加快了反应速率 ②控制变量法 与盐酸反应的铝片表面也有氧化膜 S对反应有抑制作用 NaCl Na2SO4(合理即可)
解析 (1)甲同学将用砂纸打磨过的铝片放入MgCl2溶液中,观察不到明显的现象,说明铝在金属活动性顺序中排在镁的后面。
(2)①铝片与稀硫酸反应产生氢气和Al2(SO4)3,反应的化学方程式为2Al+3H2SO4Al2(SO4)3+3H2↑,图中从a到c产生H2的速率增大,是因为反应放热,随着反应的进行,温度升高,加快了反应速率。②将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,观察现象,此实验方法是控制变量法;由于使用的铝片是一样的,即与盐酸反应的铝片表面也有氧化膜,故该猜想错误;可能是Cl-对反应有促进作用,使用的还有硫酸,还可能是S对反应有抑制作用;为了验证盐酸中的氯离子对反应产生促进作用的猜想,加入的两种溶液的溶质可以是NaCl(A)和Na2SO4(B)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版高中化学必修第一册
第2课时 物质的检验 物质性质和变化的探究
基础过关练
题组一 检验物质的化学方法
1.(经典题)可以确定溶液中存在C的实验事实是 ( )
A.加入硝酸银溶液,有白色沉淀产生
B.加入盐酸,有无色无味气体产生
C.加入氯化钙溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
2.(经典题)(2023上海静安期末)检验铵盐的方法是将待检物取出少量放入试管中,然后( )
A.加热,将红色石蕊试纸放在试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞溶液
D.加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口检验
3.鉴别NaCl的最佳方法是( )
A.焰色呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀生成
B.焰色呈紫色,加盐酸酸化的AgNO3溶液有白色沉淀生成
C.焰色呈黄色,加盐酸酸化的AgNO3溶液有白色沉淀生成
D.焰色呈紫色,加硝酸酸化的AgNO3溶液有白色沉淀生成
4.(2024湖北武汉期中)检验某未知溶液中的离子,下列有关实验操作、实验现象和结论均正确的是( )
选项 实验操作 实验现象 结论
A 用铂丝蘸取少量该溶液,放在煤气灯火焰上灼烧 焰色为黄色 原溶液中存在Na+
B 取少量该溶液于试管中,滴加硝酸银溶液 产生白色沉淀 原溶液中存在Cl-
C 取少量该溶液于试管中,滴加足量稀盐酸,将产生的无色无味气体通入澄清石灰水中 澄清石灰水变浑浊 原溶液中存在C
D 取少量该溶液于试管中,滴加氯化钡溶液 产生白色沉淀 原溶液中存在S
5.(经典题)(2024江西宜春阶段练习)某溶液无色、澄清,对该溶液初步分析后发现其中可能含有S、Na+、C、H+、N、Cl-中的若干种,然后又做了如下实验。
①用pH试纸测定溶液的pH,结果pH试纸显红色。
②取2 mL溶液,加入BaCl2溶液和稀盐酸,生成了白色沉淀。
③将②中所得的混合物充分静置后,取上层澄清的液体,加入AgNO3溶液和稀硫酸,生成了白色沉淀。
(1)由上述实验可知,溶液中一定存在的离子是 (填离子符号,下同),一定不存在的离子是 。
(2)在上述实验操作中,有错误的步骤是(填序号) 。正确的操作是
。
(3)按(2)中改正实验操作后,仍生成白色沉淀,则还不能确定该溶液中是否存在的离子是 。
题组二 检验物质的物理方法
6.(2024安徽淮南阶段练习)看到绽放的美丽焰火,很容易联想到化学中的焰色反应,下列关于焰色反应的说法中不正确的是 ( )
A.焰色反应是金属元素在火焰上灼烧时使火焰呈现特殊的颜色
B.应该用稀盐酸清洗做过焰色反应实验的铂丝
C.在酒精灯火焰上灼烧蘸有K2CO3溶液的细铁丝时,透过蓝色钴玻璃能观察到紫色火焰
D.焰色反应的本质是元素在发生化学变化时引起能量差异导致的
7.(2024河北石家庄月考)用光洁的铂丝蘸取某无色溶液在火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( )
A.只含Na+
B.可能含有Na+,可能还含有K+
C.既含有Na+,又含有K+
D.一定含Na+,可能含有K+
8.(经典题)现有A、B、C、D四种化合物,透过蓝色钴玻璃观察其焰色时发现火焰均为紫色;A、B、C分别和盐酸反应后,均可得到D;将固体C加热可制得A;若在A的溶液中通入一种无色无味气体,又可制得C;B与C的溶液混合可制得A。回答下列问题:
(1)A是 (填化学式,下同),B是 ,C是 ,D是 。
(2)写出B+C→A的化学方程式: 。
题组三 物质性质和变化的探究
9.某同学想用实验证明硫酸铜溶液显蓝色与S无关,进行下列实验无意义的是( )
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
10.(经典题)为了探究温度对化学反应快慢的影响,下列实验方案可行的是( )
11.为了探究影响化学反应速率的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论不正确的是( )
A.在相同条件下,等质量的大理石块和大理石粉分别与相同浓度、相同体积的盐酸反应时,大理石粉的反应快
B.将相同大小、相同形状的镁条和铝条分别与相同浓度的盐酸反应时,二者的化学反应速率相等
C.将相同浓度、相同体积的浓硝酸分别放在暗处和光照处,会发现光照可以加快浓硝酸的分解
D.室温下,向两支试管中分别加入相同浓度、相同体积的双氧水,再向其中一支试管中加入少量二氧化锰粉末,二者产生氧气的快慢不同
能力提升练
题组一 物质的检验与鉴别
1.(2023湖北宜昌夷陵中学期中,)在Na2SO4溶液中可能含有NaCl杂质,要检验NaCl是否存在,下列实验方法正确的是( )
A.取样,加入AgNO3溶液,有白色沉淀生成,则有Cl-
B.取样,加足量BaCl2溶液,过滤后再加AgNO3溶液,有白色沉淀生成,则有Cl-
C.取样,加入足量Ba(NO3)2溶液,过滤后再加AgNO3溶液,有白色沉淀生成,则有Cl-
D.取样,加入Ba(NO3)2和AgNO3的混合溶液,有白色沉淀生成,则有Cl-
2.(经典题)(2024江苏泰州)有4瓶常用溶液:①BaCl2溶液,②NaCl溶液,③Na2SO4溶液,④CuSO4溶液。不用其他试剂,即可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是( )
A.①④③② B.①④②③
C.①③④② D.④①②③
3.(2024四川成都第七中学期中)某溶液的溶质仅由Na+、Cu2+、Ba2+、Fe3+、C、S、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
根据以上实验判断,下列推断错误的是( )
A.气体1通入澄清石灰水中,溶液变浑浊
B.白色沉淀2中加稀硝酸,沉淀不溶解
C.原溶液中一定存在Na+和Cl-
D.滤液2中加入碳酸钠溶液一定会产生白色沉淀
4.下列物质鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl溶液
B.用氢氧化钠鉴别MgCl2溶液、NaCl溶液
C.利用丁达尔效应鉴别FeCl2溶液和HCl溶液
D.用澄清石灰水鉴别CO、CO2气体
题组二 物质性质和变化的探究
5.已知H2O2分解快慢受多种因素影响,某小组对此进行探究。下列说法不正确的是( )
(20 ℃)
序号 H2O2溶液体积/mL FeCl3溶液体积/mL 混合液pH 纯H2O2 pH 完全分解所用时间/s
1 20 10 1.00 2.92 几乎不分解
2 20 10 2.92 2.92 202
3 20 10 7.50 2.92 192
4 20 10 9.50 2.92 139
5 20 10 10.50 2.92 77
A.题表表明,其他条件相同时,碱性条件下H2O2分解比酸性条件下快
B.题图表明,其他条件相同时,CuCl2对H2O2分解的催化效果不如FeCl3好
C.题图表明,其他条件相同时,CuCl2对H2O2分解的催化效果不如CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解快慢有影响
6.(2024江苏五市联测)CuSO4溶液对过氧化氢的分解反应具有催化作用(起催化作用的是Cu2+)。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下实验探究。
(1)请你帮助他们完成实验报告:
实验过程 实验现象 实验结论
在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管 FeCl3溶液可以催化H2O2分解
(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是 同学的猜想,理由是 。
(3)同学们对余下的两个猜想用实验进行了探究。请你仔细分析后完成下表:
实验过程 实验现象 实验结论
向盛有5 mL 5%的H2O2溶液的试管中加入少量的盐酸,并把带火星的木条伸入试管 无明显 现象 ①
向盛有5 mL 5%的H2O2溶液的试管中加入少量的② ,并把带火星的木条伸入试管 ③ ④
7.某化学小组同学在进行“活泼金属与酸的反应”实验时,对铝和铝的化合物的性质进行了探究。
【查阅资料】铝是一种活泼金属,在空气中表现出良好的抗腐蚀性,是由于铝与氧气作用形成一层致密的氧化膜。
【性质探究】
(1)金属的活动性
甲同学将用砂纸打磨过的铝片放入氯化镁溶液中,观察到 ,说明铝在金属活动性顺序中排在镁的 。
(2)金属与酸的反应
图1
图2
①铝片与稀硫酸反应产生氢气的速率与时间的关系如图1所示,单质铝与稀硫酸反应的化学方程式为 。图中从a到c产生H2的速率增大的原因可能是
。
②将铝片与pH相同的足量稀硫酸、稀盐酸反应,结果生成氢气的速率前者比后者慢很多。
甲同学认为可能是两片铝片的大小、质地等不同造成的,于是将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,结果仍是生成氢气的速率前者比后者慢得多。此实验方法是 。乙同学提出,可能是与稀硫酸反应的铝片表面有氧化膜的原因,大家一致反对,因为 。
丙同学对比盐酸和硫酸的化学式之后,认为可能是盐酸中的氯离子对反应产生促进作用,你认为还存在的另一种可能是 。
【验证猜想】为了验证“盐酸中的氯离子对反应产生促进作用”的猜想,大家一起设计了如图2所示的实验。如果该实验能证明猜想正确,则加入的两种溶液的溶质化学式分别为A ,B 。
答案与分层梯度式解析
第2课时 物质的检验 物质性质和变化的探究
基础过关练
1.C C的检验要考虑到干扰离子:S、HC等,如HC也会产生B、D项中的现象。
2.D 利用铵盐与强碱溶液共热反应生成氨气及氨气的性质进行检验,把NaOH溶液加入试管中,加热后产生的气体若能使湿润的红色石蕊试纸变蓝,就可以确定该物质中含铵盐,故D项正确。
3.A Na+焰色呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀生成,证明含Cl-。
4.A 钠的焰色为黄色,A项正确;检验Cl-的方法为:取少量待测液于试管中,加入AgNO3溶液,产生白色沉淀,加入稀硝酸,沉淀不溶解,则含有Cl-,B项错误;若原溶液中不含C,而含HC,加入足量稀盐酸,产生的无色无味气体也可以使澄清石灰水变浑浊,C项错误;检验S:取少量待测液于试管中,先加入过量稀盐酸,无现象,后滴加BaCl2溶液,若产生白色沉淀,则原溶液中含有S,D项错误。
5.答案 (1)H+、S
(2)③ 另取2 mL原溶液,加入AgNO3溶液和稀硝酸
(3)Na+、N
解析 (1)pH试纸显红色,说明溶液中大量存在H+,故不能有C。用BaCl2溶液和稀盐酸检验时生成了白色沉淀,说明溶液中有S。
(2)第②步操作中引入了Cl-,所以第③步操作是错误的(易错点),应另取原溶液进行Cl-的检验。
6.D 由焰色反应的概念可知,焰色反应是金属元素在灼烧时使火焰呈现特殊的颜色,A正确;做焰色反应实验结束后,铂丝要用稀盐酸洗涤,以除去杂质,B正确;在酒精灯火焰上灼烧蘸有K2CO3溶液的细铁丝时,透过蓝色钴玻璃能观察到紫色火焰,C正确;焰色反应属于物理变化,D错误。
7.D 直接观察时看到火焰呈黄色,说明溶液中含有Na+,没有透过蓝色钴玻璃观察,无法确定溶液中是否含有K+。
8.答案 (1)K2CO3 KOH KHCO3 KCl
(2)KHCO3+KOHK2CO3+H2O
解析 根据焰色可知四种化合物中均含有钾元素;A、B、C分别和盐酸反应都生成了D,D为KCl。由A、B、C之间的转化关系可推知A为K2CO3,B为KOH,C为KHCO3。
9.D A项,做对照实验;B项,生成硫酸钡沉淀,溶液蓝色没有消失,可以说明硫酸铜溶液显蓝色与S无关;C项,形成氢氧化铜沉淀,溶液蓝色消失,可以说明硫酸铜溶液显蓝色与S无关。
10.D 探究温度对化学反应快慢的影响,需在催化剂相同,H2O2溶液浓度相同,温度不同的条件下做对照实验,通过产生气泡的快慢来探究温度对化学反应快慢的影响。
11.B 将相同大小、相同形状的镁条和铝条分别与相同浓度的盐酸反应,镁、铝性质不同,镁与盐酸反应速率更快。
能力提升练
1.C 加入AgNO3溶液,生成的白色沉淀可能是AgCl,也可能是Ag2SO4,无法确定是否含有Cl-,A错误;加足量BaCl2溶液,引入了Cl-,干扰检验,B错误;先加足量Ba(NO3)2溶液,可除去S,从而排除S的干扰,过滤后再加AgNO3溶液,产生了白色沉淀,可表明溶液中含有Cl-,C正确;加入Ba(NO3)2和AgNO3的混合溶液,生成白色沉淀,无法确定是否含有Cl-,D错误。
方法点津 一般情况下,检验Cl-需要用HNO3溶液和AgNO3溶液。本题中S的存在会干扰Cl-的检验,所以先用足量Ba(NO3)2除去S,此时已经没有其他干扰离子,可以省略HNO3溶液,过滤后直接加入AgNO3溶液检验Cl-。
2.D 解答此类问题的一般方法:先根据待鉴别的溶液颜色确定出一种溶液,由已确定的溶液再去进一步鉴别其他溶液(解题技法)。由于CuSO4溶液呈蓝色,故可最先确定CuSO4溶液;取少量其他三种溶液于三支试管中,加入CuSO4溶液,只有BaCl2溶液中产生白色沉淀,故第二个鉴别出的是BaCl2溶液;然后取少量剩余两种溶液分别加入BaCl2溶液,可鉴别出Na2SO4溶液和NaCl溶液,故其检出顺序为④①③②或④①②③。
3.C 该溶液的溶质仅由Na+、Cu2+、Ba2+、Fe3+、C、S、Cl-中的若干种离子组成,加过量盐酸有气体放出,放出的气体一定是二氧化碳,则原溶液中一定含有C,Cu2+、Ba2+、Fe3+都不能与C大量共存,则原溶液中一定不含Cu2+、Ba2+、Fe3+;根据溶液呈电中性,可知原溶液中一定含有Na+;向无色溶液1中加过量氢氧化钡溶液得白色沉淀2,该沉淀一定是硫酸钡,则原溶液中一定含有S;向滤液2中加过量硝酸和硝酸银溶液生成白色沉淀3,该沉淀一定是氯化银,由于操作过程中加入了盐酸,所以不能确定原溶液中是否含有Cl-(易错点)。气体1是二氧化碳,将其通入澄清石灰水中,溶液变浑浊,A正确;白色沉淀2是硫酸钡,加稀硝酸,BaSO4不溶解,B正确;根据以上分析,知原溶液中一定存在Na+,不能确定是否含有Cl-,C错误;由于加入了过量氢氧化钡,则滤液2中一定含有Ba2+,故向滤液2中加入碳酸钠溶液一定会产生白色沉淀,D正确。
4.C K的焰色为紫色,Na的焰色为黄色,可以鉴别,A项正确;NaOH与MgCl2溶液反应产生沉淀,而NaOH与NaCl溶液不反应,可以鉴别,B项正确;只有胶体才具有丁达尔效应,C项错误;少量CO2通入澄清石灰水中,石灰水变浑浊,而向澄清石灰水中通入CO无现象,可以鉴别,D项正确。
5.C 对比实验3和实验1可知,碱性条件下,H2O2完全分解所用时间短,即其他条件相同时,H2O2在碱性条件下分解比在酸性条件下快,A项正确;对比题图中FeCl3、CuCl2催化曲线可知,其他条件相同时,相同时间内,FeCl3催化过程H2O2分解生成的气体的压强大,即FeCl3催化更有利于H2O2分解,B项正确;对比题图中CuSO4、CuCl2催化曲线,可知CuCl2对H2O2分解的催化效果比CuSO4好,C项错误;根据题表中溶液的酸碱性对H2O2分解的影响可知,其他条件相同时,H2O2在酸性条件下分解比碱性条件下慢,根据题图中FeCl3、CuSO4、CuCl2的催化曲线可知,催化效果:FeCl3>CuCl2>CuSO4,所以催化剂、溶液酸碱性对H2O2分解快慢有影响,D项正确。
6.答案 (1)试管中有大量气泡产生,带火星的木条复燃
(2)甲 过氧化氢溶液中有水,可见水不是催化剂
(3)①起催化作用的不是Cl- ②Fe2(SO4)3溶液(合理即可) ③试管中有大量气泡产生,带火星的木条复燃 ④起催化作用的是Fe3+
解析 (1)FeCl3溶液对H2O2的分解有催化作用,所以现象是试管中有大量气泡产生,带火星的木条复燃。
(2)过氧化氢溶液中有水,但一般情况过氧化氢分解速率很小,可见水不是催化剂,所以三个猜想中,最不可能的是甲。
(3)设计实验时需要控制变量,即分别加入Fe3+、Cl-,第一步实验加盐酸(有Cl-、无Fe3+),无明显现象,说明Cl-不起催化作用;第二步实验应加入一种含Fe3+但不含Cl-的物质,如Fe2(SO4)3等,H2O2的分解被促进,所以试管中有大量气泡产生,带火星的木条复燃,说明起催化作用的是Fe3+。
7.答案 (1)无明显现象 后面
(2)①2Al+3H2SO4Al2(SO4)3+3H2↑ 反应放热,随着反应的进行,温度升高,加快了反应速率 ②控制变量法 与盐酸反应的铝片表面也有氧化膜 S对反应有抑制作用 NaCl Na2SO4(合理即可)
解析 (1)甲同学将用砂纸打磨过的铝片放入MgCl2溶液中,观察不到明显的现象,说明铝在金属活动性顺序中排在镁的后面。
(2)①铝片与稀硫酸反应产生氢气和Al2(SO4)3,反应的化学方程式为2Al+3H2SO4Al2(SO4)3+3H2↑,图中从a到c产生H2的速率增大,是因为反应放热,随着反应的进行,温度升高,加快了反应速率。②将某铝片从中间切成两等份,再分别放入pH相同的稀硫酸和稀盐酸中,观察现象,此实验方法是控制变量法;由于使用的铝片是一样的,即与盐酸反应的铝片表面也有氧化膜,故该猜想错误;可能是Cl-对反应有促进作用,使用的还有硫酸,还可能是S对反应有抑制作用;为了验证盐酸中的氯离子对反应产生促进作用的猜想,加入的两种溶液的溶质可以是NaCl(A)和Na2SO4(B)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
