2025苏教版高中化学必修第一册同步练习题--实验整合练 与硫的化合物相关的实验(含解析)
文档属性
| 名称 | 2025苏教版高中化学必修第一册同步练习题--实验整合练 与硫的化合物相关的实验(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 509.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025苏教版高中化学必修第一册
实验整合练 与硫的化合物相关的实验
1.(2023江苏南通金沙中学质量监测)室温下,为探究Na2SO3、NaHSO3溶液的性质,进行如下实验。
实验1:测得0.1 mol·L-1NaHSO3溶液的pH约为5。
实验2:向0.1 mol·L-1Na2SO3溶液中滴加H2O2溶液,再滴加BaCl2溶液,产生白色沉淀。
实验3:向0.1 mol·L-1NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀
实验4:向0.1 mol·L-1Na2SO3溶液中滴加少量酸性KMnO4溶液,溶液的紫红色褪去。
下列说法正确的是( )
A.实验1中NaHSO3溶液呈酸性的主要原因是HS在水中发生电离,产生了H+
B.实验2说明S被H2O2氧化生成了S
C.实验3中发生反应的离子方程式为Ba2++S BaSO3↓
D.实验4说明Na2SO3具有漂白性
2.(2024江苏连云港期中)某同学通过查阅资料得到以下信息:
材料一 BaSO4、BaSO3都难溶于水,BaSO4难溶于强酸,但BaSO3可溶于强酸。
材料二 氯化铁与二氧化硫能发生反应:2FeCl3+SO2+2H2O FeCl2+FeSO4+4HCl。
在含有FeCl3和BaCl2的酸性溶液中通入一定量的SO2,有白色沉淀生成,由此可得出的结论中正确的是( )
A.白色沉淀是BaSO3
B.Fe3+被SO2还原为Fe2+
C.把SO2换成CO2也有同样现象
D.无法确定白色沉淀的成分
3.已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)写出反应的化学方程式: 。
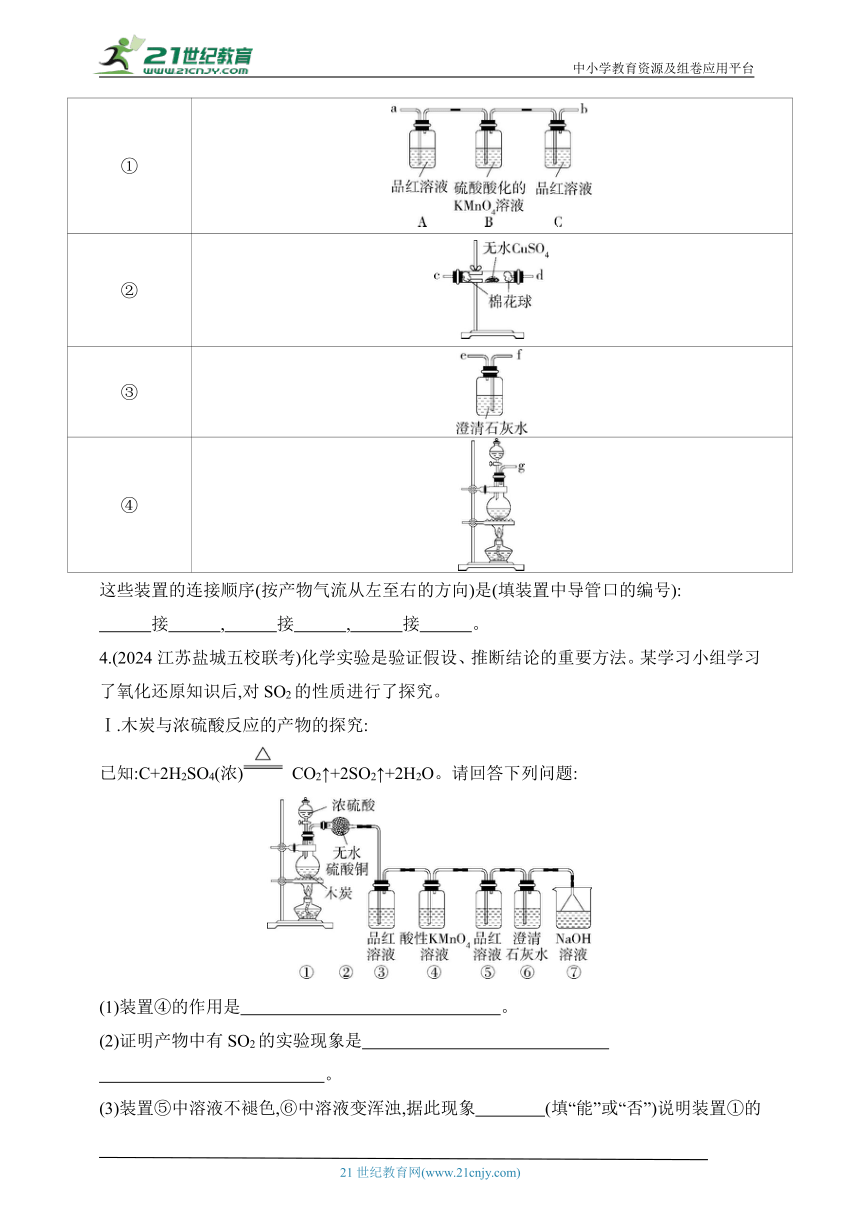
(2)试用图表中所列装置设计一个实验,来验证上述反应所产生的各种产物。
编号 装置
①
②
③
④
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
接 , 接 , 接 。
4.(2024江苏盐城五校联考)化学实验是验证假设、推断结论的重要方法。某学习小组学习了氧化还原知识后,对SO2的性质进行了探究。
Ⅰ.木炭与浓硫酸反应的产物的探究:
已知:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。请回答下列问题:
(1)装置④的作用是 。
(2)证明产物中有SO2的实验现象是
。
(3)装置⑤中溶液不褪色,⑥中溶液变浑浊,据此现象 (填“能”或“否”)说明装置①的反应产物中有CO2,理由是
。
Ⅱ.有同学认为CO2、SO2均是酸性氧化物,性质相似,由CO2与Ca(ClO)2溶液反应生成CaCO3,推测SO2与Ca(ClO)2溶液反应会生成CaSO3,通过如图所示装置探究假设是否正确。
开始装置A中出现浑浊,溶液逐渐变为黄绿色,随着SO2不断通入,产生大量白色沉淀,溶液黄绿色又褪去。
(4)取白色沉淀,加入稀盐酸,没有明显变化,推测沉淀是 。
(5)通入SO2一段时间后,黄绿色消失,发生反应的离子方程式是 。若要验证该反应能发生,实验方案是
。
5.(2024江苏苏州月考)中药常采用硫黄熏蒸法以达到防霉、防虫等目的。我国规定党参等中药SO2残留量不得超过400 mg·kg-1。某小组欲检测某药厂所售党参是否合格,查阅资料后得知:①SO2残留量是指残留硫的总量,以SO2计;②中药中残留的SO2已大部分转化为S。
(1)将200 g所售党参研碎,用500 mL 0.01 mol·L-1NaOH溶液充分浸泡,得无色浸泡液,将浸泡液分成两等份,分别编号为X、Y。
①配制500 mL 0.01 mol·L-1 NaOH溶液需要的仪器有电子天平、药匙、烧杯、量筒、玻璃棒、试剂瓶、 ;
②用NaOH溶液浸泡的目的是 (用化学方程式表示)。
(2)甲同学取X溶液采用如下方案测定党参中SO2残留量:
判断BaCl2溶液已过量的操作为 ;判断沉淀是否洗净所选用的试剂为 ;党参中SO2残留量的表达式为 mg·kg-1(用含m的式子表示)。
(3)乙同学取Y溶液采用如下方案进行测定(整个过程无气体放出),判断该党参 (填“符合”或“不符合”)国家标准。
答案与分层梯度式解析
实验整合练 与硫的化合物相关的实验
1.A HS在水中发生电离产生了H+,使NaHSO3溶液在常温下pH<7,A正确;Na2SO3可与BaCl2反应生成BaSO3白色沉淀,实验2中的白色沉淀可能是BaSO3,故不能得出S被H2O2氧化生成了S的结论,B错误;实验3中发生反应的离子方程式为:Ba2++2OH-+2HS BaSO3↓+S+2H2O,C错误;向Na2SO3溶液中滴加少量酸性KMnO4溶液,溶液的紫红色褪去,说明Na2SO3具有还原性,D错误。
2.B 由题给材料二的化学方程式可知,向FeCl3和BaCl2的酸性溶液中通入一定量的SO2会生成HCl,盐酸为强酸,而BaSO3可溶于强酸,所以白色沉淀为BaSO4,A错误,D错误;在2FeCl3+SO2+2H2O FeCl2+FeSO4+4HCl中,FeCl3为氧化剂,Fe3+被SO2还原为Fe2+,B正确;将SO2换成CO2不会生成白色沉淀,C错误。
3.答案 (1)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
(2)g c(或d) d(或c) a b f
解析 (1)木炭与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水,化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
(2)依据实验设计的要求,实验顺序为浓硫酸和木炭反应,检验水蒸气的存在,检验SO2的存在,检验CO2的存在。由此确定仪器接口的连接顺序为g接c(或d),d(或c)接a,b接f。
4.答案 (1)除去SO2,以免干扰CO2的检验
(2)装置③中的品红溶液褪色
(3)能 装置⑤中品红溶液不褪色,说明SO2已除净,则使装置⑥中澄清石灰水变浑浊的是CO2
(4)CaSO4
(5)Cl2+SO2+2H2O 4H++S+2Cl- 向氯水中通入适量SO2,再滴加BaCl2溶液,有白色沉淀生成,过滤,洗涤沉淀,再向沉淀中滴加足量的稀盐酸,沉淀不溶解
解析 (1)SO2能使澄清石灰水变浑浊,会干扰二氧化碳的检验,酸性高锰酸钾具有强氧化性,可以与SO2反应,即装置④的作用是除去SO2,以免干扰CO2的检验。
(2)二氧化硫具有漂白性,可以使品红溶液褪色,所以装置③中的品红溶液褪色,可以证明产物中含有SO2。
(5)发生反应的离子方程式为:Cl2+SO2+2H2O 4H++S+2Cl-。
5.答案 (1)①胶头滴管、500 mL容量瓶 ②SO2+2NaOH Na2SO3+H2O
(2)静置片刻,取少量上层清液于试管中滴加Na2SO4溶液,有白色沉淀生成,证明BaCl2已过量 稀HNO3、AgNO3溶液
(3)不符合
解析 (1)①配制500 mL 0.01 mol·L-1NaOH溶液,除题述仪器外,还需要胶头滴管、500 mL容量瓶;②用NaOH溶液浸泡是为了吸收SO2,反应的化学方程式为SO2+2NaOH Na2SO3+H2O。
(2)证明BaCl2溶液已过量则需要证明溶液中存在Ba2+,实验操作为静置片刻,取少量上层清液于试管中滴加Na2SO4溶液,有白色沉淀生成,证明BaCl2已过量;判断沉淀是否洗净即检验最后一次洗涤液中是否存在Cl-,所选用的试剂为稀HNO3和AgNO3溶液;BaSO4的质量为m g,所以n(S mol,由原子守恒可得关系式SO2~S,所以n(SO2)= mol,质量为 g,所以党参中SO2残留量的表达式为 mg·kg-1。
(3)SO2残留量=0.005 L×0.100 0 mol·L-1××64 g·mol-1×1 000 mg·g-1÷0.1 kg=800 mg·kg-1,大于400 mg·kg-1,不符合国家标准。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025苏教版高中化学必修第一册
实验整合练 与硫的化合物相关的实验
1.(2023江苏南通金沙中学质量监测)室温下,为探究Na2SO3、NaHSO3溶液的性质,进行如下实验。
实验1:测得0.1 mol·L-1NaHSO3溶液的pH约为5。
实验2:向0.1 mol·L-1Na2SO3溶液中滴加H2O2溶液,再滴加BaCl2溶液,产生白色沉淀。
实验3:向0.1 mol·L-1NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀
实验4:向0.1 mol·L-1Na2SO3溶液中滴加少量酸性KMnO4溶液,溶液的紫红色褪去。
下列说法正确的是( )
A.实验1中NaHSO3溶液呈酸性的主要原因是HS在水中发生电离,产生了H+
B.实验2说明S被H2O2氧化生成了S
C.实验3中发生反应的离子方程式为Ba2++S BaSO3↓
D.实验4说明Na2SO3具有漂白性
2.(2024江苏连云港期中)某同学通过查阅资料得到以下信息:
材料一 BaSO4、BaSO3都难溶于水,BaSO4难溶于强酸,但BaSO3可溶于强酸。
材料二 氯化铁与二氧化硫能发生反应:2FeCl3+SO2+2H2O FeCl2+FeSO4+4HCl。
在含有FeCl3和BaCl2的酸性溶液中通入一定量的SO2,有白色沉淀生成,由此可得出的结论中正确的是( )
A.白色沉淀是BaSO3
B.Fe3+被SO2还原为Fe2+
C.把SO2换成CO2也有同样现象
D.无法确定白色沉淀的成分
3.已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)写出反应的化学方程式: 。
(2)试用图表中所列装置设计一个实验,来验证上述反应所产生的各种产物。
编号 装置
①
②
③
④
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
接 , 接 , 接 。
4.(2024江苏盐城五校联考)化学实验是验证假设、推断结论的重要方法。某学习小组学习了氧化还原知识后,对SO2的性质进行了探究。
Ⅰ.木炭与浓硫酸反应的产物的探究:
已知:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。请回答下列问题:
(1)装置④的作用是 。
(2)证明产物中有SO2的实验现象是
。
(3)装置⑤中溶液不褪色,⑥中溶液变浑浊,据此现象 (填“能”或“否”)说明装置①的反应产物中有CO2,理由是
。
Ⅱ.有同学认为CO2、SO2均是酸性氧化物,性质相似,由CO2与Ca(ClO)2溶液反应生成CaCO3,推测SO2与Ca(ClO)2溶液反应会生成CaSO3,通过如图所示装置探究假设是否正确。
开始装置A中出现浑浊,溶液逐渐变为黄绿色,随着SO2不断通入,产生大量白色沉淀,溶液黄绿色又褪去。
(4)取白色沉淀,加入稀盐酸,没有明显变化,推测沉淀是 。
(5)通入SO2一段时间后,黄绿色消失,发生反应的离子方程式是 。若要验证该反应能发生,实验方案是
。
5.(2024江苏苏州月考)中药常采用硫黄熏蒸法以达到防霉、防虫等目的。我国规定党参等中药SO2残留量不得超过400 mg·kg-1。某小组欲检测某药厂所售党参是否合格,查阅资料后得知:①SO2残留量是指残留硫的总量,以SO2计;②中药中残留的SO2已大部分转化为S。
(1)将200 g所售党参研碎,用500 mL 0.01 mol·L-1NaOH溶液充分浸泡,得无色浸泡液,将浸泡液分成两等份,分别编号为X、Y。
①配制500 mL 0.01 mol·L-1 NaOH溶液需要的仪器有电子天平、药匙、烧杯、量筒、玻璃棒、试剂瓶、 ;
②用NaOH溶液浸泡的目的是 (用化学方程式表示)。
(2)甲同学取X溶液采用如下方案测定党参中SO2残留量:
判断BaCl2溶液已过量的操作为 ;判断沉淀是否洗净所选用的试剂为 ;党参中SO2残留量的表达式为 mg·kg-1(用含m的式子表示)。
(3)乙同学取Y溶液采用如下方案进行测定(整个过程无气体放出),判断该党参 (填“符合”或“不符合”)国家标准。
答案与分层梯度式解析
实验整合练 与硫的化合物相关的实验
1.A HS在水中发生电离产生了H+,使NaHSO3溶液在常温下pH<7,A正确;Na2SO3可与BaCl2反应生成BaSO3白色沉淀,实验2中的白色沉淀可能是BaSO3,故不能得出S被H2O2氧化生成了S的结论,B错误;实验3中发生反应的离子方程式为:Ba2++2OH-+2HS BaSO3↓+S+2H2O,C错误;向Na2SO3溶液中滴加少量酸性KMnO4溶液,溶液的紫红色褪去,说明Na2SO3具有还原性,D错误。
2.B 由题给材料二的化学方程式可知,向FeCl3和BaCl2的酸性溶液中通入一定量的SO2会生成HCl,盐酸为强酸,而BaSO3可溶于强酸,所以白色沉淀为BaSO4,A错误,D错误;在2FeCl3+SO2+2H2O FeCl2+FeSO4+4HCl中,FeCl3为氧化剂,Fe3+被SO2还原为Fe2+,B正确;将SO2换成CO2不会生成白色沉淀,C错误。
3.答案 (1)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O
(2)g c(或d) d(或c) a b f
解析 (1)木炭与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水,化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
(2)依据实验设计的要求,实验顺序为浓硫酸和木炭反应,检验水蒸气的存在,检验SO2的存在,检验CO2的存在。由此确定仪器接口的连接顺序为g接c(或d),d(或c)接a,b接f。
4.答案 (1)除去SO2,以免干扰CO2的检验
(2)装置③中的品红溶液褪色
(3)能 装置⑤中品红溶液不褪色,说明SO2已除净,则使装置⑥中澄清石灰水变浑浊的是CO2
(4)CaSO4
(5)Cl2+SO2+2H2O 4H++S+2Cl- 向氯水中通入适量SO2,再滴加BaCl2溶液,有白色沉淀生成,过滤,洗涤沉淀,再向沉淀中滴加足量的稀盐酸,沉淀不溶解
解析 (1)SO2能使澄清石灰水变浑浊,会干扰二氧化碳的检验,酸性高锰酸钾具有强氧化性,可以与SO2反应,即装置④的作用是除去SO2,以免干扰CO2的检验。
(2)二氧化硫具有漂白性,可以使品红溶液褪色,所以装置③中的品红溶液褪色,可以证明产物中含有SO2。
(5)发生反应的离子方程式为:Cl2+SO2+2H2O 4H++S+2Cl-。
5.答案 (1)①胶头滴管、500 mL容量瓶 ②SO2+2NaOH Na2SO3+H2O
(2)静置片刻,取少量上层清液于试管中滴加Na2SO4溶液,有白色沉淀生成,证明BaCl2已过量 稀HNO3、AgNO3溶液
(3)不符合
解析 (1)①配制500 mL 0.01 mol·L-1NaOH溶液,除题述仪器外,还需要胶头滴管、500 mL容量瓶;②用NaOH溶液浸泡是为了吸收SO2,反应的化学方程式为SO2+2NaOH Na2SO3+H2O。
(2)证明BaCl2溶液已过量则需要证明溶液中存在Ba2+,实验操作为静置片刻,取少量上层清液于试管中滴加Na2SO4溶液,有白色沉淀生成,证明BaCl2已过量;判断沉淀是否洗净即检验最后一次洗涤液中是否存在Cl-,所选用的试剂为稀HNO3和AgNO3溶液;BaSO4的质量为m g,所以n(S mol,由原子守恒可得关系式SO2~S,所以n(SO2)= mol,质量为 g,所以党参中SO2残留量的表达式为 mg·kg-1。
(3)SO2残留量=0.005 L×0.100 0 mol·L-1××64 g·mol-1×1 000 mg·g-1÷0.1 kg=800 mg·kg-1,大于400 mg·kg-1,不符合国家标准。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
