5.5 实验活动5 不同价态含硫物质的转化 课件 (共43张PPT) 人教版(2019) 必修 第二册
文档属性
| 名称 | 5.5 实验活动5 不同价态含硫物质的转化 课件 (共43张PPT) 人教版(2019) 必修 第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 73.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 00:00:00 | ||
图片预览









文档简介
(共43张PPT)
第五章
化工生产中的重要非金属元素
实验活动5
不同价态含硫物质的转化
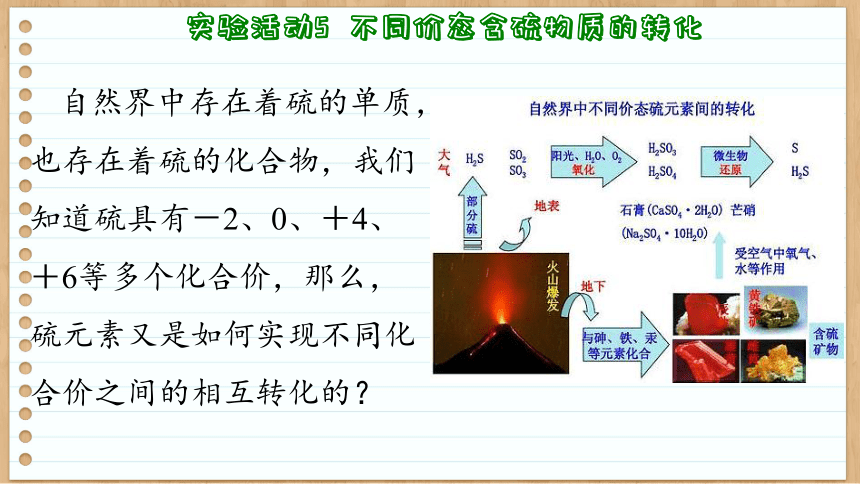
自然界中存在着硫的单质,也存在着硫的化合物,我们知道硫具有-2、0、+4、+6等多个化合价,那么,硫元素又是如何实现不同化合价之间的相互转化的?
~~~~~~~~~~~~~ 实验活动5 ~~~~~~~~~~~~~
不同价态含硫物质的转化
[实验目的]
1. 通过实验加深对硫及其化合物性质的认识。
2. 应用氧化还原反应原理实现不同价态含硫物质的转化。
[实验用品]
试管、天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、陶土网、玻璃棒、药匙、棉花、镊子、火柴。
浓硫酸、铜片、硫粉、铁粉、Na2S 溶液、酸性KMnO4溶液、NaOH溶液、H2SO4溶液、品红溶液。
注意
实验中可能产生少量有毒、有刺激性气味的气体。因此要注意通风,控制试剂的用量,严格按照要求进行操作,避免污染空气,保证实验安全。
[实验步骤]
1. 在两支试管中分别加入 1mL Na2S溶液,向其中一支边振荡边滴加 H2SO4 溶液,另一支边振荡边滴加酸性KMnO4溶液,用浸 NaOH 溶液的棉团分别塞住两个试管口,观察并记录实验现象。
实验现象:
加入H2SO3溶液的试管中,出现淡黄色浑浊。
加入酸性KMnO4溶液的试管中,紫红色逐渐消失,并出现淡黄色浑浊
反应的化学方程式:
2 Na2S+3H2SO3 ══ 3S ↓+3H2O+2Na2SO3
反应的离子方程式:
5S2-+2MnO4-+16H+ ═══ 2Mn2++8H2O+5S↓
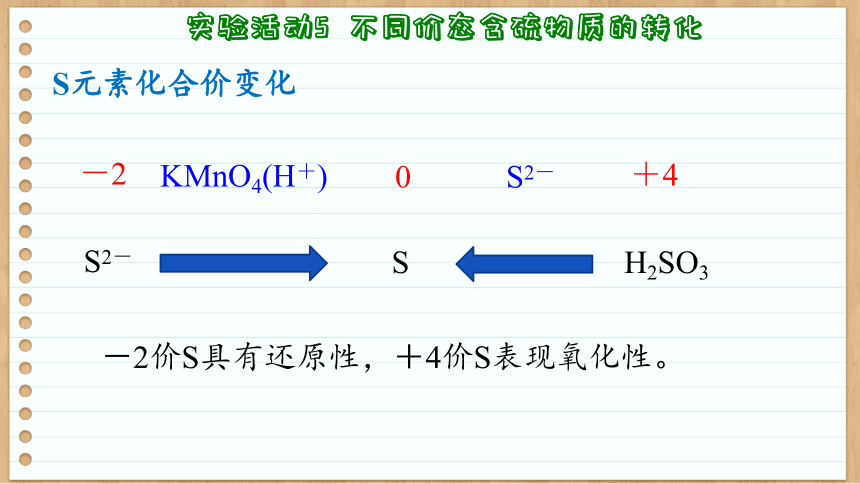
S
H2SO3
+4
S2-
KMnO4(H+)
S2-
-2
0
S元素化合价变化
-2价S具有还原性,+4价S表现氧化性。
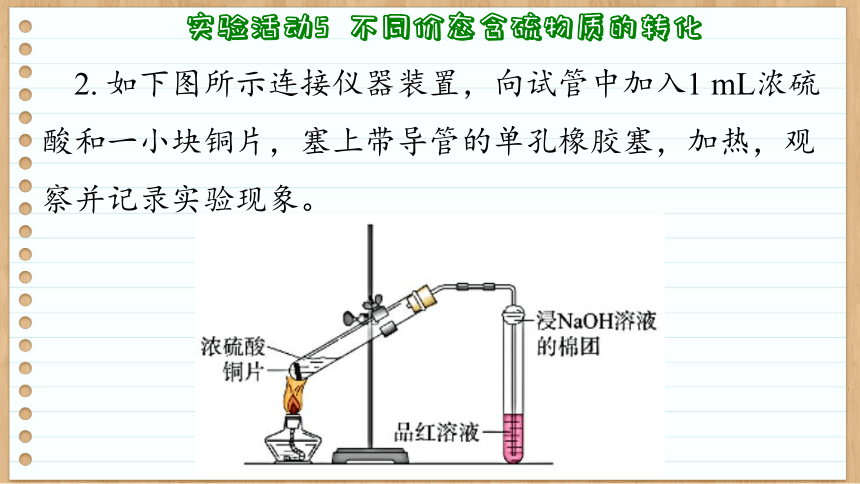
2. 如下图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,塞上带导管的单孔橡胶塞,加热,观察并记录实验现象。
实验现象:
浓硫酸和铜片反应产生气泡,品红溶液颜色逐渐变浅直至褪色。
硫酸铜溶液加入浓硫酸
原理: Cu +2H2SO4(浓) ═══ CuSO4+SO2↑+2H2O
△
S S
表现S的氧化性
+4 +6
S元素化合价变化
实验:铜与浓硫酸反应 (需要加热)
3. 将 0.5g 硫粉和 1.0g 铁粉均匀混合,放在陶网上堆成条状。用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒,观察并记录实验现象。
本实验的反应类似于如图装置
硫粉与铁粉加热反应,得到硫化亚铁
Fe + S ═══ FeS
点燃
实验现象:刚开始无现象,玻璃棒呈红热状态后,反应迅速,并有黑色固体生成。
S S
表现S的氧化性
0 -2
S 元素化合价变化
S 与一些变价金属 (如Fe,Cu) 反应时一般得到的是低价态的硫化物。
[问题和讨论]
1. 在上述实验中,含硫物质中硫元素的价态发生了怎样的变化?
实验1中:在Na2S和H2SO3反应中,Na2S中S的化合价由-2变为0价,H2SO3化合价由+4变为0价;
在Na2S和酸性KMnO4的反应中,S的化合价由-2变为0价。
实验2中:浓硫酸中S的化合价由+6变为+4.
实验3中:S的化合价由0价变为-2价。
2. 铁粉和硫粉在空气中混合燃烧,可能发生哪些化学反应?
可能发生铁和氧气、铁和硫、硫和氧气的反应。
3. 在实验过程中你遇到了哪些问题?你是如何解决的?
在实验1中可能遇到实验现象不明显,在操作中要注意充分摇动;
实验2中反应过于剧烈,要注意控制加热温度;
实验3中不能引燃,要把玻璃棒加热到红热状态。
硫元素转化规律
1. 硫元素的化合价及其化合物
S S S S
-2 0 +4 +6
FeS
H2S
HgS
SO3
H2SO4
Na2SO4
BaSO4
S
SO2
H2SO3
Na2SO3
NaHSO3
2. 硫元素的氧化性和还原性
硫元素最高价(+6)只有氧化性,最低价(-2)只具有还原性;中间价(0、+4)既具有氧化性,又具有还原性。
使硫元素由高价态向低价态转化需要加入还原剂,而硫元素低价态向高价态转化需要加入氧化剂。
3. 不同价态硫元素间的相互转化
溴水、HNO3、Fe3+ 、H2O2
MnO4(H+)、
Cu、C、
HI、H2S
H2S
Cl2、O2、 KMnO4(H+)
H2S
S
SO2
-2
0
+4
+6
H2SO4
O2
H2
4. 硫及其化合物之间相互转化
① 2H2S+SO2 ══ 3S ↓+H2O
② S+O2 ═══ SO2
点燃
③ 2SO2+O2 2SO3
催化剂
加热
④ SO3+H2O ═══ H2SO4
⑤ 2NaOH+SO2 ═══ Na2SO3+H2O
⑥ H2O+SO2 H2SO3
⑦ 2Na2SO3+O2 ═══ 2Na2SO4
⑧ 2NaOH+H2SO4 ═══ Na2SO4+2H2O
⑨ BaCl2+H2SO4 ═══ BaSO4↓+2HCl
相同价态含硫化合物间——酸碱反应规律转化
不同价态含硫化合物间——氧化还原反应规律
随堂练习
1. 下列转化需要加入氧化剂才能实现的是 ( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
A
解 析
【解析】
A.该反应中S元素化合价由-2价变为+4价,则H2S是还原剂,需要氧化剂才能实现,如氧气,故A正确;
B.该反应中S元素化合价由+6价变为+4价,则H2SO4是氧化剂,需要还原剂才能实现,如Cu,故B错误;
C.该反应中各元素化合价不变,不发生氧化还原反应就能实现,故C错误;
D.该反应中各元素化合价不变,不发生氧化还原反应就能实现,故D错误。
2. 下列化学品久置于空气中因发生氧化还原反应而变质的是( )
A、NaOH B、浓H2SO4
C、Na2SO3 D、Na2SO4
C
解 析
【解析】
A.NaOH与空气中的二氧化碳、水反应而变质,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.H2SO4 在空气中不发生反应,故B不选;
C.Na2SO3 在空气中被氧气氧化为硫酸钠,有元素的化合价变化,发生氧化还原反应,故C选;
D. Na2SO4 在空气中不发生反应,故D不选;
3、下列离子方程式书写正确的是( )
A、硫化亚铁与盐酸反应 S2-+2H+ ══ H2S↑
B、SO2通入溴水中
SO2+Br2+2H2O ══ SO42-+2Br-+4H+
C、硫酸与氢氧化钡溶液
H++SO42-+Ba2++OH- ══ BaSO4↓+H2O
D、亚硫酸与氢氧化钠溶液混合 H++OH- ══ H2O
B
4、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是
( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C
【分析】除杂时不能引入新的杂质.其他能够引入杂质的氧化剂都不行,只能是过氧化氢(H2O2)了.
解 析
5、将SO2通入BaCl2溶液,未见沉淀,通入另一气体 X仍无沉淀,则X可能是 ( )
A.H2S B.NH3 C.Cl2 D.CO2
D
解 析
【解析】
A.SO2通入BaCl2溶液,未见沉淀,通入H2S与二氧化硫反应生成S沉淀,故A不选;
B.通入NH3溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B不选;
C.Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C不选;
D.SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,故D选;
6.下列现象或事实可用同一原理解释的是( )
A.氯水和SO2使品红溶液退色
B.浓硫酸和浓硝酸长期暴露在空气中浓度降低
C.浓硫酸和浓硝酸都可以用铁质容器储运
D.SO2可使品红和酸性高锰酸钾溶液退色
C
7. 某化学课外兴趣小组为探究铜与浓硫酸的反应,用如图所示的装置进行实验:
请回答下列问题:实验中他们取 6.4 g 铜片和12 mL 18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 写出铜与浓硫酸反应的化学方程式:___________________________________________,实验中若有m g铜参加了反应,则有_________mol 硫酸被_________ (填“氧化”或“还原”),电子转移数目为_________mol。
Cu+2H2SO4(浓) ═══ CuSO4+SO2↑+2H2O
△
还原
② 下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是______ (填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液
C.银粉 D.碳酸钠溶液
D
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是____________________________________ ________________________________________________________________________________________________________________________________________________。
随着反应的进行,浓硫酸逐渐变为稀硫酸,稀硫酸不与铜反应
本课结束
This lesson is over
THANKS!
第五章
化工生产中的重要非金属元素
实验活动5
不同价态含硫物质的转化
自然界中存在着硫的单质,也存在着硫的化合物,我们知道硫具有-2、0、+4、+6等多个化合价,那么,硫元素又是如何实现不同化合价之间的相互转化的?
~~~~~~~~~~~~~ 实验活动5 ~~~~~~~~~~~~~
不同价态含硫物质的转化
[实验目的]
1. 通过实验加深对硫及其化合物性质的认识。
2. 应用氧化还原反应原理实现不同价态含硫物质的转化。
[实验用品]
试管、天平、量筒、酒精灯、铁架台、试管架、橡胶塞、乳胶管、胶头滴管、玻璃导管、陶土网、玻璃棒、药匙、棉花、镊子、火柴。
浓硫酸、铜片、硫粉、铁粉、Na2S 溶液、酸性KMnO4溶液、NaOH溶液、H2SO4溶液、品红溶液。
注意
实验中可能产生少量有毒、有刺激性气味的气体。因此要注意通风,控制试剂的用量,严格按照要求进行操作,避免污染空气,保证实验安全。
[实验步骤]
1. 在两支试管中分别加入 1mL Na2S溶液,向其中一支边振荡边滴加 H2SO4 溶液,另一支边振荡边滴加酸性KMnO4溶液,用浸 NaOH 溶液的棉团分别塞住两个试管口,观察并记录实验现象。
实验现象:
加入H2SO3溶液的试管中,出现淡黄色浑浊。
加入酸性KMnO4溶液的试管中,紫红色逐渐消失,并出现淡黄色浑浊
反应的化学方程式:
2 Na2S+3H2SO3 ══ 3S ↓+3H2O+2Na2SO3
反应的离子方程式:
5S2-+2MnO4-+16H+ ═══ 2Mn2++8H2O+5S↓
S
H2SO3
+4
S2-
KMnO4(H+)
S2-
-2
0
S元素化合价变化
-2价S具有还原性,+4价S表现氧化性。
2. 如下图所示连接仪器装置,向试管中加入1 mL浓硫酸和一小块铜片,塞上带导管的单孔橡胶塞,加热,观察并记录实验现象。
实验现象:
浓硫酸和铜片反应产生气泡,品红溶液颜色逐渐变浅直至褪色。
硫酸铜溶液加入浓硫酸
原理: Cu +2H2SO4(浓) ═══ CuSO4+SO2↑+2H2O
△
S S
表现S的氧化性
+4 +6
S元素化合价变化
实验:铜与浓硫酸反应 (需要加热)
3. 将 0.5g 硫粉和 1.0g 铁粉均匀混合,放在陶网上堆成条状。用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒,观察并记录实验现象。
本实验的反应类似于如图装置
硫粉与铁粉加热反应,得到硫化亚铁
Fe + S ═══ FeS
点燃
实验现象:刚开始无现象,玻璃棒呈红热状态后,反应迅速,并有黑色固体生成。
S S
表现S的氧化性
0 -2
S 元素化合价变化
S 与一些变价金属 (如Fe,Cu) 反应时一般得到的是低价态的硫化物。
[问题和讨论]
1. 在上述实验中,含硫物质中硫元素的价态发生了怎样的变化?
实验1中:在Na2S和H2SO3反应中,Na2S中S的化合价由-2变为0价,H2SO3化合价由+4变为0价;
在Na2S和酸性KMnO4的反应中,S的化合价由-2变为0价。
实验2中:浓硫酸中S的化合价由+6变为+4.
实验3中:S的化合价由0价变为-2价。
2. 铁粉和硫粉在空气中混合燃烧,可能发生哪些化学反应?
可能发生铁和氧气、铁和硫、硫和氧气的反应。
3. 在实验过程中你遇到了哪些问题?你是如何解决的?
在实验1中可能遇到实验现象不明显,在操作中要注意充分摇动;
实验2中反应过于剧烈,要注意控制加热温度;
实验3中不能引燃,要把玻璃棒加热到红热状态。
硫元素转化规律
1. 硫元素的化合价及其化合物
S S S S
-2 0 +4 +6
FeS
H2S
HgS
SO3
H2SO4
Na2SO4
BaSO4
S
SO2
H2SO3
Na2SO3
NaHSO3
2. 硫元素的氧化性和还原性
硫元素最高价(+6)只有氧化性,最低价(-2)只具有还原性;中间价(0、+4)既具有氧化性,又具有还原性。
使硫元素由高价态向低价态转化需要加入还原剂,而硫元素低价态向高价态转化需要加入氧化剂。
3. 不同价态硫元素间的相互转化
溴水、HNO3、Fe3+ 、H2O2
MnO4(H+)、
Cu、C、
HI、H2S
H2S
Cl2、O2、 KMnO4(H+)
H2S
S
SO2
-2
0
+4
+6
H2SO4
O2
H2
4. 硫及其化合物之间相互转化
① 2H2S+SO2 ══ 3S ↓+H2O
② S+O2 ═══ SO2
点燃
③ 2SO2+O2 2SO3
催化剂
加热
④ SO3+H2O ═══ H2SO4
⑤ 2NaOH+SO2 ═══ Na2SO3+H2O
⑥ H2O+SO2 H2SO3
⑦ 2Na2SO3+O2 ═══ 2Na2SO4
⑧ 2NaOH+H2SO4 ═══ Na2SO4+2H2O
⑨ BaCl2+H2SO4 ═══ BaSO4↓+2HCl
相同价态含硫化合物间——酸碱反应规律转化
不同价态含硫化合物间——氧化还原反应规律
随堂练习
1. 下列转化需要加入氧化剂才能实现的是 ( )
A.H2S SO2 B. H2SO4 SO2
C.SO42- BaSO4 D. SO32- SO2
A
解 析
【解析】
A.该反应中S元素化合价由-2价变为+4价,则H2S是还原剂,需要氧化剂才能实现,如氧气,故A正确;
B.该反应中S元素化合价由+6价变为+4价,则H2SO4是氧化剂,需要还原剂才能实现,如Cu,故B错误;
C.该反应中各元素化合价不变,不发生氧化还原反应就能实现,故C错误;
D.该反应中各元素化合价不变,不发生氧化还原反应就能实现,故D错误。
2. 下列化学品久置于空气中因发生氧化还原反应而变质的是( )
A、NaOH B、浓H2SO4
C、Na2SO3 D、Na2SO4
C
解 析
【解析】
A.NaOH与空气中的二氧化碳、水反应而变质,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.H2SO4 在空气中不发生反应,故B不选;
C.Na2SO3 在空气中被氧气氧化为硫酸钠,有元素的化合价变化,发生氧化还原反应,故C选;
D. Na2SO4 在空气中不发生反应,故D不选;
3、下列离子方程式书写正确的是( )
A、硫化亚铁与盐酸反应 S2-+2H+ ══ H2S↑
B、SO2通入溴水中
SO2+Br2+2H2O ══ SO42-+2Br-+4H+
C、硫酸与氢氧化钡溶液
H++SO42-+Ba2++OH- ══ BaSO4↓+H2O
D、亚硫酸与氢氧化钠溶液混合 H++OH- ══ H2O
B
4、已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是
( )
A. KMnO4 B. Ca(ClO)2 C. H2O2 D. Cl2
C
【分析】除杂时不能引入新的杂质.其他能够引入杂质的氧化剂都不行,只能是过氧化氢(H2O2)了.
解 析
5、将SO2通入BaCl2溶液,未见沉淀,通入另一气体 X仍无沉淀,则X可能是 ( )
A.H2S B.NH3 C.Cl2 D.CO2
D
解 析
【解析】
A.SO2通入BaCl2溶液,未见沉淀,通入H2S与二氧化硫反应生成S沉淀,故A不选;
B.通入NH3溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B不选;
C.Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C不选;
D.SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,故D选;
6.下列现象或事实可用同一原理解释的是( )
A.氯水和SO2使品红溶液退色
B.浓硫酸和浓硝酸长期暴露在空气中浓度降低
C.浓硫酸和浓硝酸都可以用铁质容器储运
D.SO2可使品红和酸性高锰酸钾溶液退色
C
7. 某化学课外兴趣小组为探究铜与浓硫酸的反应,用如图所示的装置进行实验:
请回答下列问题:实验中他们取 6.4 g 铜片和12 mL 18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 写出铜与浓硫酸反应的化学方程式:___________________________________________,实验中若有m g铜参加了反应,则有_________mol 硫酸被_________ (填“氧化”或“还原”),电子转移数目为_________mol。
Cu+2H2SO4(浓) ═══ CuSO4+SO2↑+2H2O
△
还原
② 下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是______ (填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液
C.银粉 D.碳酸钠溶液
D
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是____________________________________ ________________________________________________________________________________________________________________________________________________。
随着反应的进行,浓硫酸逐渐变为稀硫酸,稀硫酸不与铜反应
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
