6.1 化学反应与能量变化课件(共122张ppt)人教版(2019)必修第二册
文档属性
| 名称 | 6.1 化学反应与能量变化课件(共122张ppt)人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 95.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 19:23:29 | ||
图片预览











文档简介
(共122张PPT)
第六章
化学反应与能量
第一节
化学反应与能量变化
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
火的发现和使用使人类告别了茹毛饮血的时代,从野蛮走向文明。我们利用的正是燃烧过程中释放的能量,化学反应不仅仅是物质的变化,还伴随有能量的变化。
化学能可以转化为光能、热能、电能等,
当能量以热的形式表现时,化学反应就分
为吸热反应和放热反应。那么化学中都有
哪些放热和吸热反应。
一
化学反应与热能
化石燃料燃烧会释放大量的热。 除了燃烧,其他化学反应也伴随着放热或吸热现象。
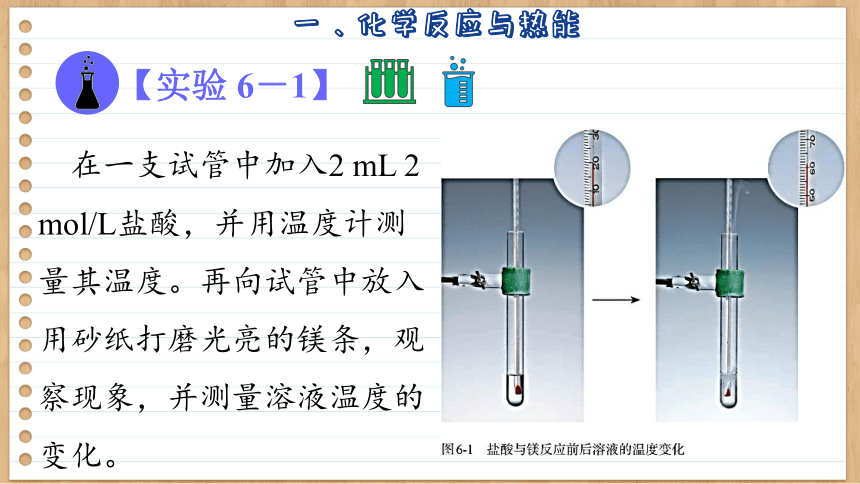
【实验 6-1】
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验现象:
在实验 6-1中,镁条不断溶解,有气泡产生,同时观察到温度计温度升高,说明反应放出了热量。
反应方程式:
Mg+2HCl ═══ MgCl2+H2↑
【实验 6-2】
将 20 g Ba(OH)2·8H2O晶体研细后与 10 g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅
速用玻璃片盖上烧杯,用手触摸杯
壁下部,试着用手拿起烧杯。观察
现象。
实验现象:
在实验 6-2 中,用手触摸烧杯壁下部,烧杯壁冰冷,拿起烧杯,木片上的水滴结冰,和烧杯底部粘结在一起,说明反应吸收了热量。
反应方程式:
Ba(OH)2 8H2O+2NH4Cl ══ NH3↑+BaCl2+10H2O
放热反应和吸热反应
化学上把释放热量的化学反应称为放热反应,如镁条、铝片和盐酸的反应,木炭、氢气、甲烷等在氧气中的燃烧,氢气与氯气的化合等都是放热反应。
把吸收热量的化学反应称为吸热反应,如氢氧化钡和氯化铵的反应,盐酸和碳酸氢钠的反应,灼热的炭与二氧化碳的反应等都是吸热反应。
化学反应过程中为什么会有能量变化 为什么有的化学反应释放热量,有的化学反应吸收热量
常见放热反应
所有的燃烧
中和反应
溶液里的置换
一般的化合反应
铝热反应
常见吸热反应
电离
强碱与铵盐
一般的分解反应
特殊的化合反应(C和CO2反应)
特殊的置换(C和水蒸气、铁和水蒸气)
我们知道,物质中的原子之间是通过化学键相结合的当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。以氢气与氯气化合生成氯化氢的反应为例:
H2 (g) + Cl (g) ═══ 2HCl (g)
H2 (g) + Cl (g) ═══ 2HCl (g)
在 25℃ 和 101 kPa 条件下,断开 1 mol H2 中的化学键要吸收436 kJ的能量,断开 1 mol Cl2,中的化学键要吸收243 kJ 的能量,反应中1 mol H2 和 1mol Cl2 中的化学键断裂所需能量共为679 kJ;而形成 2 mol HCl 中的化学键要释放 862 kJ 的能量。
在 H2 与 Cl2 的反应过程中,释放的能量大于吸收的能量发生了放热反应。
化学键的断裂与形成是化学反应中能量变化的主要原因,化学反应中的物质变化总会伴随着能量变化,通常主要表现为热量的释放或吸收。
一般情况下,如果一个化学反应过程中放出的能量多于吸收的能量,则有能量向环境释放,发生放热反应;反之,放出的能量少于吸收的能量,则需从环境吸收能量,发生吸热反应。
反应热(焓变)
1. 化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
PS:
①符号:△H 单位: kJ/mol 或 kJ·mol-1
②反应热描述的是化学反应前后的热量变化
③反应热描述的是一定温度下的热量变化
④ 任何化学反应都有反应热,表现为吸热反应或者放
热反应
⑤ 反应体系的能量降低(即放热反应),则 H为“-”;
反应体系的能量升高(即 吸热反应),则 H为“+”;
2. 热化学方程式
① 我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?——热化学方程式
表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
② 热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式
H2(g)+I2(g) ═════ 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
能量变化
(1) 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。
物质变化
H2(g)+I2(g) ═════ 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
H2(g)+O2(g) ═════ H2O(g) △H═-241.8kJ/mol
200℃
101kPa
(2) 热化学方程式需注明反应时的温度和压强。
对于 25℃、101kPa时进行的反应可不注明。
普通化学方程式不需注明温度和压强。
(3) 热化学方程式需注明各物质的状态。
普通化学方程式不需注明物质的状态。
H2(g) +1/2 O2(g) ══ H2O(g) △H═-241.8kJ/mol
H2(g)+1/2 O2(g) ══ H2O (1) △H═-285.8kJ/mol
H2(g) +1/2 O2(g) ══H2O(g) H═-241.8kJ/mol
2H2(g)+O2(g) ══ 2H2O(g)
H═-483.6kJ/mol
(4) 热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数,其 H与系数对应成比例。
普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。
3. 书写热化学方程式的注意事项
①化学方程的右边必须写上 H,并用“空格”隔开, H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
② 需注明反应的温度和压强,如不注明条件,即指:25℃ 1.01×105Pa;
③ 物质后需注明物质状态 ( s固体、l液体、g气体、aq溶液中)
④ 热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数
⑤ 根据焓的性质,若化学方程式中各物质的系数加倍,则 H的数值也加倍;若反应逆向进行,则 H改变符号,但绝对值不变
⑥ 热化学方程式一般不要写反应条件。
反应热的有关计算
各种物质都具有能量,物质的组成、结构与状态不同所具有的能量也不同。
放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
因此,一个化学反应是释放热量还是吸收热量,与反应物总能量和生成物总能量的相对大小有关。
1. 由键能计算反应热
化学键的断裂和形成
旧键断裂需要吸收能量,新键形成会放出能量。
键能 (通常指共价键) 断开1mol共价键所吸收的能量或形成1mol共价键所放出的能量
旧键断裂 -吸收能量 436+243=679kJ/mol
新键形成 - 放出能量 431+431=862 kJ/mol
反应放出热量:862kJ/mol-679 kJ/mol=183kJ/mol
所以:一个化学反应是放热还是吸热取决于
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小、与反应条件无关
H=
E(反应物键能总和) - E(生成物键能总和)
2. 反应物和生成物的能量
如图 6-3 所示,如果反应物的总能量高于生成物的总能量,发生反应时会向环境释放能量;
如果反应物的总能量低于生成物的总能量,发生反应时需要从环境吸收能量。
反应过程中能量变化曲线图:
ΔH=生成物总能量-反应物总能量
生成物
反应物
吸收热量
H>0
吸热反应
能量
ΔH>0 或 ΔH 为“+”
ΔH<0 或 ΔH 为“-”
生成物
反应物
能量
H<0
放出热量
放热反应
3. 反应热( ΔH )的计算方法
(1) 由焓变计算:ΔH=E(吸收的能量)-E(放出的能量)
(2) 由键能计算: ΔH=E(反应物键能之和)-E(生成物的键能之和)
(3) 由物质能量计算:
ΔH=E(生成物的总能量)-E(反应物的总能量)
思考:物质具有的能量与其稳定性之间存在什么关系?
物质具有的能量越低越稳定。
一般原子间的化学键越牢固,键能越大,物质越稳定。
4. 放热和吸热反应对比
放热反应 吸热反应
H表现行式 H<0或 H为“-” H>0或 H为“+”
物质总能量变化 生成物的总能量小于反应物的总能量 生成物的总能量大于
反应物的总能量
键能 变化 生成物总键能大于反应物总键能 生成物总键能小于反应物总键能
联系 键能越大,物质能量越低,越稳定,反之键 能越小,物质能量越高,越不稳定。
放热反应和吸热反应
人类利用化学反应中的热能始于火的发现。从早期的以树枝杂草为主要能源,到现代以煤、石油和天然气为主要能源,人类获取热能的主要途径都是通过物质的燃烧。
随着社会的进步和人类生活水平的提高,能源的消耗越来越多 (如图6-4)。
而化石燃料作为人类利用最多的常规能源,其利用过程中面临两方面吸待解决的问题:
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加能源消费量与储量之间的矛盾日益突显;
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO 等是大气污染物的主要来源。
为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁的新能源成为人类的必然选择。
资料卡片~~~~~~~~~~~~~~~~~~~~~~~~~~~
表6-1 2015年我国能源消费总量和构成
节能一方面是减少能源使用,另一方面则要提高能源的利用率。
例如,在燃料利用过程中,节能的主要环节一个是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
另一个环节是能量利用阶段,可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
理想的新能源应具有资源丰富、可以再生、对环境无污染等特点。
目前,人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
思考与讨论
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
答案提示:让学生从工厂、工人、司机、生活等角度自由发挥
信息搜索
(1) 利用互联网 (如国家统计局网站)搜索近10年我国每年的能源消费总量和能源矿产储量的数据及变化趋势,体会节能的重要性和必要性,
(2) 通过查阅书刊或互联网搜索,了解煤和石油产品的燃烧排放物对环境和气候的影响,以及人类正在采取的应对措施。
信息搜索~~~~~~~~~~~~~~~~~~~~~~~~~~~
(1) 利用互联网 (如国家统计局网站) 搜索近10年我国每年的能源消费总量和能源矿产储量的数据及变化趋势,体会节能的重要性和必要性。
(2) 通过查阅书刊或互联网搜索,了解煤和石油产品的燃烧排放物对环境和气候的影响,以及人类正在采取的应对措施。
随堂练习
1. (课本41页第1题) 化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一,化学反应的另一基本特征是 ________________________ ,通常表现为 _________ 的释放或吸收。
化学键的断裂和形成
能量
2. (课本41页第3题) 下列说法错误的是( )
A. 化学反应必然伴随发生能量变化
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 能量变化必然伴随发生化学变化
D. 化学反应中的能量变化主要是由化学键变化引起的
C
解 析
【解析】
A、化学反应必然伴随能量变化,故A正确;
B、焓变的数值与化学计量数对应,故B正确;
C、能量变化不一定伴随化学反应,比如浓硫酸溶于水放热,故C错误;
D、化学反应中的能量变化主要是由化学键的断裂和形成引起的,故D正确;
3. (课本41页第4题)在一定条件下,石墨转化为金刚石要吸收能量,在该条件下,下列结论正确的是 ( )
A. 金刚石比石墨稳定
B. 等质量的金刚石和石墨完全燃烧释放的热量相同
C. 金刚石转化为石墨是吸热反应
D. 1mol C (金刚石)比1mol (石墨)的总能量高
D
解 析
【解析】
A、石墨能量低,能量越低越稳定,A错误;
B、金刚石和石墨能量不同,等质量时,放出的热量不同,B错误;
C、金刚石转化为石墨要放出热量,C错误;
D、石墨转化为金刚石吸收热量,所以金刚石能量高,D正确。
4. 已知键能:N≡N: 946KJ/mol,H-H:436KJ/mol, H-N:391KJ/mol。N2(g)+3H2(g) 2NH3(g),从理论上计算 H为 ( )
A. +1800KJ/mol B. +92KJ/mol
C. -92KJ/mol D. -46KJ/mol
C
【解析】 H = 946kJ/mol+3×436kJ/mol-6×391kJ/mol
= -92kJ/mol
解 析
5. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是 ( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
C
【解析】该反应放热,说明反应物的能量和高于生成物的能量和。
解 析
6. 下列各图中,表示正反应是吸热反应的图是 ( )。
A
解 析
【解析】
放热反应,生成物的能量高于反应物的能量;吸热反应,生成物的能量低于反应物的能量。
二
化学反应与电能
普通锌锰电池
碱性电池
镍
镉
电
池
镍氢电池
在我们生活中由很多的电池,那么大家知道这些电池都是怎么工作的吗?
一、化学能与电能的相互转化
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。
火力发电的原理
那怎么把化学能直接转化为电能的?
火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电 能
要想使氧化还原反应释放的能量直接转化为电能,就要设计一种装置,使反应中的电子转移在一定条件下形成电流。
化学电池就是这样一种装置。
二、原电池
【实验 6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
实验现象:锌片上有气泡,铜片无反应。
Zn+2H+═══ Zn2++H2↑
失2e-
得2e-
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
实验现象:Cu片上有气体逸出
原因分析:Zn片上的电子通过上端导线转移给了Cu片,Cu片将电子传递给了H+,那么如何验证?
(3) 如图 6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验现象:(1) 电流表指针有偏转;
(2) 铜片上有气泡产生;
(3) 锌片不断溶解.
如图6-7所示,上述实验中,当插入稀硫酸的锌片和铜片用导线连接时,由于锌比铜活泼,与稀硫酸作用容易失去电子,被氧化成锌离子而进入溶液。
锌片:Zn-2e- ══ Zn2+ (氧化反应)
电子由锌片通过导线流向铜片,溶液中的氢离子从铜片获得电子,被还原成氢原子,氢原子结合成氢分子从铜片上放出。
铜片:2H++2e- ══ H2↑ (还原反应 )
上述实验和分析表明,通过特定的装置使氧化反应与还原反应分别在两个不同的区域进行,可以使氧化还原反应中转移的电子通过导体发生定向移动,形成电流从而实现化学能向电能的转化。
总反应:_________________________________
Zn+2H+ ══ Zn2++H2↑
原电池:把化学能转变为电能的装置.
在原电池中,电子流出的一极是负极 (如锌片,电极被氧化),电子流入的一极是正极 (如铜片,H+ 在正极上被还原)。
负极:一般活泼金属 → 向外线路提供电子 → 发生氧化反应;
正极: 一般不活泼金属(或石墨) → 接受外线路提供的电子 → 该电极上发生还原反应。
原电池的构成条件
① 两种活泼性不同电极.
(活泼性不同的金属或一种金属和另一种非金属导体)
② 电极必须插入电解质溶液 。
③ 能自发的发生氧化还原反应。
④ 电极用导线相连构成闭合回路。
两极一液成回路
本质:氧化还原反应
探究
简易电池的设计与制作
[目的]
根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
[用品]
水果 (苹果、柑橘或柠檬等 ),食盐水,滤纸,铜片、铁片、铝片等金属片,石黑棒,导线,小型用电器 (发光二极管、电子音乐卡或小电动机等 ),电流表。
[实验]
(1) 水果电池
参考图 6-8 所示水果电池,自选水果及相关用品,制作水果电池。
(2) 简易电池
参考图6-9,制作简易电池,并试验和比较不同材料作电极的效果。
(3) 设计演示原电池的趣味实验
利用发光二极管、电子音乐卡或小电动机等设计一个演示原电池的趣味实验 (如电压不足可将几个电池串联起来 )。
[问题和讨论 ]
(1) 水果电池中,水果的作用是什么
水果起到了电解质溶液的作用。
(2) 通过比较不同材料作电极的简易电池你是否发现电极材料的选择有一些值得注意的问题 请与同学交流你的经验。
a. 活泼性不同的金属;
b. 金属和非金属(非金属必须能导电);
c. 金属与化合物;
d. 惰性电极—氢氧燃料电池,电极均为铂。
电解液的选择:负极材料一般要能与电解液自行发生氧化还原反应。
(3) 在以上实验中,电池不可或缺的构成部分有哪些
电解质溶液、活泼性不同的电极、电流表,水果必须具有一定的酸碱性并且必须可以和电极发生反应。
三、常见的化学电池
1. 锌锰干电池 (一次性电池)
石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
在使用过程中,电子由锌筒(负极) 流向石墨棒 (正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
电极方程式:
负极 (Zn):Zn-2e-=Zn2+
正极(C):2MnO2+2NH4++2e-═ Mn2O3+2NH3+H2O
这种电池放电之后不能充电 (内部的氧化还原反应无法逆向进行),属于一次电池。
总反应方程式:________________________________
______________________________________________
4NH4Cl+2Zn+2MnO2 ═══
[Zn(NH3)4]Cl2+ZnCl2+Mn2O3+H2O
缺点:使用寿命短,易泄露
2、充电电池—铅酸蓄电池(二次电池)
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电 (化学能转化为电能) 与充电 (电能转化为化学能) 的循环。
这种充电电池属于二次电池。
铅酸蓄电池(原电池) 工作时,
总反应为 Pb+PbO2+2H2SO4 2PbSO4+2H2O,
(1) 原电池的电极材料:
电解质__________
正极为__________
负极为__________
充电
放电
PbO2
Pb
H2SO4
(2) 两极的电极反应式:
正极:______________________________________
负极:_________________________
PbO2+2e-+SO42-+4H+ ═ PbSO4+2H2O
Pb-2e-+SO42-═ PbSO4
特点:电压高稳定,可反复使用,安全、方便、可靠。铅易产生氢气损耗,充电时需加水。
用途:目前汽车上使用的大多是铅酸蓄电池 (如图 6-11)。
它还广泛用于国防、生产、生活等领域。
其他蓄电池:镍-氢蓄电池、锂离子电池等
3、燃料电池——高效、环境友好的化学电池
化学电池是新能源和可再生能源的重要组成部分。科学技术的进步加速了电池技术的发展,锌锰电池、铅酸蓄电池等传统电池的性能有了明显提高;各种高效、安全环保的新型化学电池不断涌现,其中鲤离子电池和燃料电池发展较快。
手机、笔记本计算机、照相机和摄像机等申器所用的电池大多为钾离子电池。
介质 H-O燃料电池反应: 2H2+O2 ═ 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
H-O燃料电池曾在1967年首次被用作阿波罗宇宙飞船的电源
2H2-4e- ═ 4H+
O2+4H++4e- ═ 2H2O
2H2-4e- ═ 4H+
O2+2H2O+4e-═ 4OH-
2H2+4OH--4e- ═ 4H2O
O2+2H2O+4e-═ 4OH-
甲烷燃料电池
一、碱性介质下的
1. 负极:_____________________________________
2. 正极:____________________________________
3. 总反应方程式为: _______________________________________________
CH4+10OH--8e- ══ CO32-+7H2O
2O2+8e-+4H2O ══ 8OH-
CH4+2O2+2KOH ══ K2CO3+3H2O
二、酸性介质下
1.负极:_________________________________
2. 正极:________________________________
3. 总反应方程式为:_______________________
CH4-8e-+2H2O ══ CO2+8H+
2O2+8e-+8H+ ══ 4H2O
2O2+CH4 ══ 2H2O+CO2
信息搜索 ~~~~~~~~~~~~~~~~~~~~~~~~~~
通过网络、书籍等渠道,调查了解不同类型电池的性能、构成、特点、应用范围及发展历史,选2~3类列表比较,并结合其发展的前景,谈谈你对研发新型电池意义的理解。
发展中的燃料电池
燃料电池是一种将燃料 (如氢气、甲烷乙醇) 和氧化剂 (如氧气) 的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以超过80%。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
科学·技术·社会 ~~~~~~~~~~~~~~~~~~~~~~
与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领域有广阔的应用前景。
大有发展前景的燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。目前燃料电池的能量转化率可达近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池的噪声及硫氧化物、氮氧化物等废气污染都接近0。
问题讨论:
作为一个电池的消费者,你希望使用怎样的电池?假如你是一个电池的研究生产者,你应该开发生产怎样的电池?
化学与职业~~~~~~~~~~~~~~~~~~~~~~~~~
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;
还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
~~~~~~~~~~~~~~~ 研究与实践 ~~~~~~~~~~~~~~~
了解车用能源
[ 研究目的 ]
人们为给汽车提供动力,提高能源利用率,减少环境污染,在不断开发新的车用能源.通过以下活动,从不同角度分析和比较不同燃料和能量转化方式的优劣,体会开发新的车用能源的重要意义。
[研究任务]
(1) 汽车发展至今,在能源使用上经历了不同的发展阶段。查阅资料,了解汽车发展的过程和车用能源的种类。
(2)以氢气、甲烷(CH4)、辛烷(C8H18) 和乙醇 (C2H6O) 为例(你也可以尝试分析其他燃料),为汽车选择燃料。
① 写出不同燃料发生能量转化时涉及的主要化学反应。
H2热值123KJ/g _______________________________
CH4热值56KJ/g _______________________________
C8H18热值48KJ/g ______________________________
C2H5OH热值26.9KJ/g
____________________________________
2H2+O2 ════ 2H2O
点燃
CH4+2O2 ════ CO2+2H2O
点燃
2C8H18+25O2 ════ 16CO2+18H2O
点燃
C2H5OH+3O2 ════ 2CO2↑+3H2O
点燃
② 查阅资料,比较相同质量的燃料燃烧时放出热量的多少,并结合燃料的物质状态分析其优劣。
③ 从来源、环保等其他角度分析不同燃料的优劣。
从反应和热值来考虑:H2放出热量最多,而且不会产生温室气体CO2,是最理想的能源。
(3)了解蒸汽机、内燃机和燃料电池等的能量转化方式,从转化效率、技术可行性等角度进行比较。
[结果与讨论]
(1) 你最终选择了哪种燃料和哪种能量转化方式 你在选择时重点考虑了哪些因素
(2) 通过了解车用能源的发展过程,你得到什么启示 请与同学讨论。
随堂练习
1. 利用反应 Zn+CuSO4 ══ ZnSO4+Cu 设计一个原电池。在图中方格内画出实验装置图,并指出正极为__________________,电极反应式为_________________________;负极为_______________,电极反应式为________________________。
碳棒、Cu、铂
Cu2++ 2e- ═ Cu
Zn
Zn-2e-= Zn2+
2. (课本41页第5题)下列关于如图所示装置的叙述,错误的是 ( )
A、锌是负极、其质量逐渐减小
B、氢离子在铜表面被还原,产生气泡
C、电流从锌片经导线流向铜片
D、电子从锌片经导线流向铜片
C
【解析】锌铜稀硫酸原电池中,锌为负极,铜为正极,电流由铜经导线流向锌,电子从锌经导线流向铜,故C错误
解 析
3. (课本41页第6题)下列说法正确的是 ( )。
A. 图1所示装置能将化学能转化为电能
B. 图2所示反应为吸热反应
C. 锌锰干电池中,锌筒作正极
D. 蓄电池充电时也发生了氧化还原反应
D
解 析
【解析】
A、图1不能形成闭合回路,不能构成原电池;
B、图2反应物能量高于生成物,为放热反应;
C、锌锰干电池中,锌作负极;
D、蓄电池放电和充电均发生了氧化还原反应。
D正确
4. 如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组 ( )。
A. A是锌,B是铜,C为稀H2SO4
B. A是铜,B是锌,C为稀硫酸
C. A是铁,B是银,C为AgNO3溶液
D. A是Ag,B是铁,C为AgNO3溶液
D
5. 下列图片可构成原电池的是 ( )。
C、D
6. 写出电极反应式和总反应式
正极 :(C) ___________________________
负极 :(Zn) __________________________
总反应:____________________________
Zn-2e-═ Zn2+ (氧化反应)
Cu2++2e- ═ Cu (还原反应)
Zn+Cu2+ ═ Zn2++Cu
正极 :(Cu) __________________________
负极 :(Fe) __________________________
总反应:____________________________
2Ag++2e-═ Ag (还原反应)
Fe -2e-═ Fe2+ (氧化反应)
Fe+2Ag+ ═ Fe2++2Ag
练习与应用
2. 原电池是一种可将_________直接转化为________的装置,其中发生的化学反应属于_________________。原电池的必要组成部分有_________________________ _______________________________________________。
化学能
电能
氧化还原反应
两个活泼性不同的电极、电解质溶液和形成闭合回路。
7. 几位同学以相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
(1) 该实验的目的是探究水果种类和________________
对水果电池电流的影响。
电极间距离
(2) 该实验所用装置中,负极的材料是______________,
该装置将_____________转化为电能。
(3) 能表明水果种类对电流有影响的实验编号是_______,
和____________。
(4) 请你再提出一个可能影响水果电池电流的因素:
______________________________________。
锌片
化学
①
③
电极插入水果中的深度
8. 我国将落实创新、协调、绿色、开放、共享的发展理念,全面推进节能减排和低碳发展,迈向生态文明新时代。为此,如果从不同能源对环境的影响考虑,你认为我国在煤、石油等传统能源和新能源的利用及发展上应采取哪些措施
减少或淘汰传统能源,大力发展新能源。
9. 便携式化学电池使用方便,但仍然存在一些不足,如电乐较低,寿金较短,处理不当可能会造成环境污染。有人认为这些不足是由其制造技术不完善造成的,也有人认为是由其工作原理决定的。你的看法和依据是什么 请查阅资料,与老师和同学交流、讨论。
化学电池电压是其固有特征,无法改变,采用串联的方法可以增大电压;
一次电池放电结束,寿命即告终,充电电池寿命比一次电池的长,燃料电池的寿命最长;
化学电池在存放过程中,极容易变质或发生氧化还原反应,一般低温、干燥保存。
本课结束
This lesson is over
THANKS!
第六章
化学反应与能量
第一节
化学反应与能量变化
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到科学研究等)都离不开能量,而许多能量的利用与化学反应中的能量变化密切相关。
从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
火的发现和使用使人类告别了茹毛饮血的时代,从野蛮走向文明。我们利用的正是燃烧过程中释放的能量,化学反应不仅仅是物质的变化,还伴随有能量的变化。
化学能可以转化为光能、热能、电能等,
当能量以热的形式表现时,化学反应就分
为吸热反应和放热反应。那么化学中都有
哪些放热和吸热反应。
一
化学反应与热能
化石燃料燃烧会释放大量的热。 除了燃烧,其他化学反应也伴随着放热或吸热现象。
【实验 6-1】
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验现象:
在实验 6-1中,镁条不断溶解,有气泡产生,同时观察到温度计温度升高,说明反应放出了热量。
反应方程式:
Mg+2HCl ═══ MgCl2+H2↑
【实验 6-2】
将 20 g Ba(OH)2·8H2O晶体研细后与 10 g NH4Cl 晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅
速用玻璃片盖上烧杯,用手触摸杯
壁下部,试着用手拿起烧杯。观察
现象。
实验现象:
在实验 6-2 中,用手触摸烧杯壁下部,烧杯壁冰冷,拿起烧杯,木片上的水滴结冰,和烧杯底部粘结在一起,说明反应吸收了热量。
反应方程式:
Ba(OH)2 8H2O+2NH4Cl ══ NH3↑+BaCl2+10H2O
放热反应和吸热反应
化学上把释放热量的化学反应称为放热反应,如镁条、铝片和盐酸的反应,木炭、氢气、甲烷等在氧气中的燃烧,氢气与氯气的化合等都是放热反应。
把吸收热量的化学反应称为吸热反应,如氢氧化钡和氯化铵的反应,盐酸和碳酸氢钠的反应,灼热的炭与二氧化碳的反应等都是吸热反应。
化学反应过程中为什么会有能量变化 为什么有的化学反应释放热量,有的化学反应吸收热量
常见放热反应
所有的燃烧
中和反应
溶液里的置换
一般的化合反应
铝热反应
常见吸热反应
电离
强碱与铵盐
一般的分解反应
特殊的化合反应(C和CO2反应)
特殊的置换(C和水蒸气、铁和水蒸气)
我们知道,物质中的原子之间是通过化学键相结合的当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。以氢气与氯气化合生成氯化氢的反应为例:
H2 (g) + Cl (g) ═══ 2HCl (g)
H2 (g) + Cl (g) ═══ 2HCl (g)
在 25℃ 和 101 kPa 条件下,断开 1 mol H2 中的化学键要吸收436 kJ的能量,断开 1 mol Cl2,中的化学键要吸收243 kJ 的能量,反应中1 mol H2 和 1mol Cl2 中的化学键断裂所需能量共为679 kJ;而形成 2 mol HCl 中的化学键要释放 862 kJ 的能量。
在 H2 与 Cl2 的反应过程中,释放的能量大于吸收的能量发生了放热反应。
化学键的断裂与形成是化学反应中能量变化的主要原因,化学反应中的物质变化总会伴随着能量变化,通常主要表现为热量的释放或吸收。
一般情况下,如果一个化学反应过程中放出的能量多于吸收的能量,则有能量向环境释放,发生放热反应;反之,放出的能量少于吸收的能量,则需从环境吸收能量,发生吸热反应。
反应热(焓变)
1. 化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
PS:
①符号:△H 单位: kJ/mol 或 kJ·mol-1
②反应热描述的是化学反应前后的热量变化
③反应热描述的是一定温度下的热量变化
④ 任何化学反应都有反应热,表现为吸热反应或者放
热反应
⑤ 反应体系的能量降低(即放热反应),则 H为“-”;
反应体系的能量升高(即 吸热反应),则 H为“+”;
2. 热化学方程式
① 我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?——热化学方程式
表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
② 热化学方程式
能表示参加反应物质的量和反应热的关系的化学方程式
H2(g)+I2(g) ═════ 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
能量变化
(1) 热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
普通化学方程式只包含物质变化一个部分。
物质变化
H2(g)+I2(g) ═════ 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
H2(g)+O2(g) ═════ H2O(g) △H═-241.8kJ/mol
200℃
101kPa
(2) 热化学方程式需注明反应时的温度和压强。
对于 25℃、101kPa时进行的反应可不注明。
普通化学方程式不需注明温度和压强。
(3) 热化学方程式需注明各物质的状态。
普通化学方程式不需注明物质的状态。
H2(g) +1/2 O2(g) ══ H2O(g) △H═-241.8kJ/mol
H2(g)+1/2 O2(g) ══ H2O (1) △H═-285.8kJ/mol
H2(g) +1/2 O2(g) ══H2O(g) H═-241.8kJ/mol
2H2(g)+O2(g) ══ 2H2O(g)
H═-483.6kJ/mol
(4) 热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数,其 H与系数对应成比例。
普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。
3. 书写热化学方程式的注意事项
①化学方程的右边必须写上 H,并用“空格”隔开, H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
② 需注明反应的温度和压强,如不注明条件,即指:25℃ 1.01×105Pa;
③ 物质后需注明物质状态 ( s固体、l液体、g气体、aq溶液中)
④ 热化学方程式中各物质化学式前面的化学计量数仅表示物质的量并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数
⑤ 根据焓的性质,若化学方程式中各物质的系数加倍,则 H的数值也加倍;若反应逆向进行,则 H改变符号,但绝对值不变
⑥ 热化学方程式一般不要写反应条件。
反应热的有关计算
各种物质都具有能量,物质的组成、结构与状态不同所具有的能量也不同。
放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
因此,一个化学反应是释放热量还是吸收热量,与反应物总能量和生成物总能量的相对大小有关。
1. 由键能计算反应热
化学键的断裂和形成
旧键断裂需要吸收能量,新键形成会放出能量。
键能 (通常指共价键) 断开1mol共价键所吸收的能量或形成1mol共价键所放出的能量
旧键断裂 -吸收能量 436+243=679kJ/mol
新键形成 - 放出能量 431+431=862 kJ/mol
反应放出热量:862kJ/mol-679 kJ/mol=183kJ/mol
所以:一个化学反应是放热还是吸热取决于
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小、与反应条件无关
H=
E(反应物键能总和) - E(生成物键能总和)
2. 反应物和生成物的能量
如图 6-3 所示,如果反应物的总能量高于生成物的总能量,发生反应时会向环境释放能量;
如果反应物的总能量低于生成物的总能量,发生反应时需要从环境吸收能量。
反应过程中能量变化曲线图:
ΔH=生成物总能量-反应物总能量
生成物
反应物
吸收热量
H>0
吸热反应
能量
ΔH>0 或 ΔH 为“+”
ΔH<0 或 ΔH 为“-”
生成物
反应物
能量
H<0
放出热量
放热反应
3. 反应热( ΔH )的计算方法
(1) 由焓变计算:ΔH=E(吸收的能量)-E(放出的能量)
(2) 由键能计算: ΔH=E(反应物键能之和)-E(生成物的键能之和)
(3) 由物质能量计算:
ΔH=E(生成物的总能量)-E(反应物的总能量)
思考:物质具有的能量与其稳定性之间存在什么关系?
物质具有的能量越低越稳定。
一般原子间的化学键越牢固,键能越大,物质越稳定。
4. 放热和吸热反应对比
放热反应 吸热反应
H表现行式 H<0或 H为“-” H>0或 H为“+”
物质总能量变化 生成物的总能量小于反应物的总能量 生成物的总能量大于
反应物的总能量
键能 变化 生成物总键能大于反应物总键能 生成物总键能小于反应物总键能
联系 键能越大,物质能量越低,越稳定,反之键 能越小,物质能量越高,越不稳定。
放热反应和吸热反应
人类利用化学反应中的热能始于火的发现。从早期的以树枝杂草为主要能源,到现代以煤、石油和天然气为主要能源,人类获取热能的主要途径都是通过物质的燃烧。
随着社会的进步和人类生活水平的提高,能源的消耗越来越多 (如图6-4)。
而化石燃料作为人类利用最多的常规能源,其利用过程中面临两方面吸待解决的问题:
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加能源消费量与储量之间的矛盾日益突显;
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO 等是大气污染物的主要来源。
为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁的新能源成为人类的必然选择。
资料卡片~~~~~~~~~~~~~~~~~~~~~~~~~~~
表6-1 2015年我国能源消费总量和构成
节能一方面是减少能源使用,另一方面则要提高能源的利用率。
例如,在燃料利用过程中,节能的主要环节一个是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
另一个环节是能量利用阶段,可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
理想的新能源应具有资源丰富、可以再生、对环境无污染等特点。
目前,人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
思考与讨论
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
答案提示:让学生从工厂、工人、司机、生活等角度自由发挥
信息搜索
(1) 利用互联网 (如国家统计局网站)搜索近10年我国每年的能源消费总量和能源矿产储量的数据及变化趋势,体会节能的重要性和必要性,
(2) 通过查阅书刊或互联网搜索,了解煤和石油产品的燃烧排放物对环境和气候的影响,以及人类正在采取的应对措施。
信息搜索~~~~~~~~~~~~~~~~~~~~~~~~~~~
(1) 利用互联网 (如国家统计局网站) 搜索近10年我国每年的能源消费总量和能源矿产储量的数据及变化趋势,体会节能的重要性和必要性。
(2) 通过查阅书刊或互联网搜索,了解煤和石油产品的燃烧排放物对环境和气候的影响,以及人类正在采取的应对措施。
随堂练习
1. (课本41页第1题) 化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一,化学反应的另一基本特征是 ________________________ ,通常表现为 _________ 的释放或吸收。
化学键的断裂和形成
能量
2. (课本41页第3题) 下列说法错误的是( )
A. 化学反应必然伴随发生能量变化
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 能量变化必然伴随发生化学变化
D. 化学反应中的能量变化主要是由化学键变化引起的
C
解 析
【解析】
A、化学反应必然伴随能量变化,故A正确;
B、焓变的数值与化学计量数对应,故B正确;
C、能量变化不一定伴随化学反应,比如浓硫酸溶于水放热,故C错误;
D、化学反应中的能量变化主要是由化学键的断裂和形成引起的,故D正确;
3. (课本41页第4题)在一定条件下,石墨转化为金刚石要吸收能量,在该条件下,下列结论正确的是 ( )
A. 金刚石比石墨稳定
B. 等质量的金刚石和石墨完全燃烧释放的热量相同
C. 金刚石转化为石墨是吸热反应
D. 1mol C (金刚石)比1mol (石墨)的总能量高
D
解 析
【解析】
A、石墨能量低,能量越低越稳定,A错误;
B、金刚石和石墨能量不同,等质量时,放出的热量不同,B错误;
C、金刚石转化为石墨要放出热量,C错误;
D、石墨转化为金刚石吸收热量,所以金刚石能量高,D正确。
4. 已知键能:N≡N: 946KJ/mol,H-H:436KJ/mol, H-N:391KJ/mol。N2(g)+3H2(g) 2NH3(g),从理论上计算 H为 ( )
A. +1800KJ/mol B. +92KJ/mol
C. -92KJ/mol D. -46KJ/mol
C
【解析】 H = 946kJ/mol+3×436kJ/mol-6×391kJ/mol
= -92kJ/mol
解 析
5. 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是 ( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
C
【解析】该反应放热,说明反应物的能量和高于生成物的能量和。
解 析
6. 下列各图中,表示正反应是吸热反应的图是 ( )。
A
解 析
【解析】
放热反应,生成物的能量高于反应物的能量;吸热反应,生成物的能量低于反应物的能量。
二
化学反应与电能
普通锌锰电池
碱性电池
镍
镉
电
池
镍氢电池
在我们生活中由很多的电池,那么大家知道这些电池都是怎么工作的吗?
一、化学能与电能的相互转化
我们日常使用的电能主要来自火力发电。火力发电是通过化石燃料燃烧时发生的氧化还原反应,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,带动发电机发电。
火力发电的原理
那怎么把化学能直接转化为电能的?
火力发电过程中,化学能经过一系列能量转化过程,间接转化为电能。其中,燃烧(氧化还原反应)是关键。
化学能
燃料燃烧
热能
蒸汽轮机
机械能
发电机
电 能
要想使氧化还原反应释放的能量直接转化为电能,就要设计一种装置,使反应中的电子转移在一定条件下形成电流。
化学电池就是这样一种装置。
二、原电池
【实验 6-3】
(1) 将锌片和铜片插入盛有稀硫酸的烧杯中,观察现象。
实验现象:锌片上有气泡,铜片无反应。
Zn+2H+═══ Zn2++H2↑
失2e-
得2e-
(2) 用导线连接锌片和铜片,观察、比较导线连接前后的现象。
实验现象:Cu片上有气体逸出
原因分析:Zn片上的电子通过上端导线转移给了Cu片,Cu片将电子传递给了H+,那么如何验证?
(3) 如图 6-6所示,用导线在锌片和铜片之间串联一个电流表,观察电流表的指针是否偏转。
实验现象:(1) 电流表指针有偏转;
(2) 铜片上有气泡产生;
(3) 锌片不断溶解.
如图6-7所示,上述实验中,当插入稀硫酸的锌片和铜片用导线连接时,由于锌比铜活泼,与稀硫酸作用容易失去电子,被氧化成锌离子而进入溶液。
锌片:Zn-2e- ══ Zn2+ (氧化反应)
电子由锌片通过导线流向铜片,溶液中的氢离子从铜片获得电子,被还原成氢原子,氢原子结合成氢分子从铜片上放出。
铜片:2H++2e- ══ H2↑ (还原反应 )
上述实验和分析表明,通过特定的装置使氧化反应与还原反应分别在两个不同的区域进行,可以使氧化还原反应中转移的电子通过导体发生定向移动,形成电流从而实现化学能向电能的转化。
总反应:_________________________________
Zn+2H+ ══ Zn2++H2↑
原电池:把化学能转变为电能的装置.
在原电池中,电子流出的一极是负极 (如锌片,电极被氧化),电子流入的一极是正极 (如铜片,H+ 在正极上被还原)。
负极:一般活泼金属 → 向外线路提供电子 → 发生氧化反应;
正极: 一般不活泼金属(或石墨) → 接受外线路提供的电子 → 该电极上发生还原反应。
原电池的构成条件
① 两种活泼性不同电极.
(活泼性不同的金属或一种金属和另一种非金属导体)
② 电极必须插入电解质溶液 。
③ 能自发的发生氧化还原反应。
④ 电极用导线相连构成闭合回路。
两极一液成回路
本质:氧化还原反应
探究
简易电池的设计与制作
[目的]
根据原电池原理,设计和制作简易电池,体会原电池的构成要素。
[用品]
水果 (苹果、柑橘或柠檬等 ),食盐水,滤纸,铜片、铁片、铝片等金属片,石黑棒,导线,小型用电器 (发光二极管、电子音乐卡或小电动机等 ),电流表。
[实验]
(1) 水果电池
参考图 6-8 所示水果电池,自选水果及相关用品,制作水果电池。
(2) 简易电池
参考图6-9,制作简易电池,并试验和比较不同材料作电极的效果。
(3) 设计演示原电池的趣味实验
利用发光二极管、电子音乐卡或小电动机等设计一个演示原电池的趣味实验 (如电压不足可将几个电池串联起来 )。
[问题和讨论 ]
(1) 水果电池中,水果的作用是什么
水果起到了电解质溶液的作用。
(2) 通过比较不同材料作电极的简易电池你是否发现电极材料的选择有一些值得注意的问题 请与同学交流你的经验。
a. 活泼性不同的金属;
b. 金属和非金属(非金属必须能导电);
c. 金属与化合物;
d. 惰性电极—氢氧燃料电池,电极均为铂。
电解液的选择:负极材料一般要能与电解液自行发生氧化还原反应。
(3) 在以上实验中,电池不可或缺的构成部分有哪些
电解质溶液、活泼性不同的电极、电流表,水果必须具有一定的酸碱性并且必须可以和电极发生反应。
三、常见的化学电池
1. 锌锰干电池 (一次性电池)
石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
在使用过程中,电子由锌筒(负极) 流向石墨棒 (正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
电极方程式:
负极 (Zn):Zn-2e-=Zn2+
正极(C):2MnO2+2NH4++2e-═ Mn2O3+2NH3+H2O
这种电池放电之后不能充电 (内部的氧化还原反应无法逆向进行),属于一次电池。
总反应方程式:________________________________
______________________________________________
4NH4Cl+2Zn+2MnO2 ═══
[Zn(NH3)4]Cl2+ZnCl2+Mn2O3+H2O
缺点:使用寿命短,易泄露
2、充电电池—铅酸蓄电池(二次电池)
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电 (化学能转化为电能) 与充电 (电能转化为化学能) 的循环。
这种充电电池属于二次电池。
铅酸蓄电池(原电池) 工作时,
总反应为 Pb+PbO2+2H2SO4 2PbSO4+2H2O,
(1) 原电池的电极材料:
电解质__________
正极为__________
负极为__________
充电
放电
PbO2
Pb
H2SO4
(2) 两极的电极反应式:
正极:______________________________________
负极:_________________________
PbO2+2e-+SO42-+4H+ ═ PbSO4+2H2O
Pb-2e-+SO42-═ PbSO4
特点:电压高稳定,可反复使用,安全、方便、可靠。铅易产生氢气损耗,充电时需加水。
用途:目前汽车上使用的大多是铅酸蓄电池 (如图 6-11)。
它还广泛用于国防、生产、生活等领域。
其他蓄电池:镍-氢蓄电池、锂离子电池等
3、燃料电池——高效、环境友好的化学电池
化学电池是新能源和可再生能源的重要组成部分。科学技术的进步加速了电池技术的发展,锌锰电池、铅酸蓄电池等传统电池的性能有了明显提高;各种高效、安全环保的新型化学电池不断涌现,其中鲤离子电池和燃料电池发展较快。
手机、笔记本计算机、照相机和摄像机等申器所用的电池大多为钾离子电池。
介质 H-O燃料电池反应: 2H2+O2 ═ 2H2O
酸性 负极
正极
中性 负极
正极
碱性 负极
正极
H-O燃料电池曾在1967年首次被用作阿波罗宇宙飞船的电源
2H2-4e- ═ 4H+
O2+4H++4e- ═ 2H2O
2H2-4e- ═ 4H+
O2+2H2O+4e-═ 4OH-
2H2+4OH--4e- ═ 4H2O
O2+2H2O+4e-═ 4OH-
甲烷燃料电池
一、碱性介质下的
1. 负极:_____________________________________
2. 正极:____________________________________
3. 总反应方程式为: _______________________________________________
CH4+10OH--8e- ══ CO32-+7H2O
2O2+8e-+4H2O ══ 8OH-
CH4+2O2+2KOH ══ K2CO3+3H2O
二、酸性介质下
1.负极:_________________________________
2. 正极:________________________________
3. 总反应方程式为:_______________________
CH4-8e-+2H2O ══ CO2+8H+
2O2+8e-+8H+ ══ 4H2O
2O2+CH4 ══ 2H2O+CO2
信息搜索 ~~~~~~~~~~~~~~~~~~~~~~~~~~
通过网络、书籍等渠道,调查了解不同类型电池的性能、构成、特点、应用范围及发展历史,选2~3类列表比较,并结合其发展的前景,谈谈你对研发新型电池意义的理解。
发展中的燃料电池
燃料电池是一种将燃料 (如氢气、甲烷乙醇) 和氧化剂 (如氧气) 的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。燃料电池的能量转化率可以超过80%。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
科学·技术·社会 ~~~~~~~~~~~~~~~~~~~~~~
与常规发电厂相比,其二氧化碳排放量明显降低。燃料电池与干电池或蓄电池的主要差别在于反应物不是储存在电池内部,而是从外部提供,这时电池起着类似试管、烧杯等反应器的作用。
燃料电池的供电量易于调节,能适应用电器负载的变化,而且不需要很长的充电时间,在航天、军事和交通等领域有广阔的应用前景。
大有发展前景的燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。目前燃料电池的能量转化率可达近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池的噪声及硫氧化物、氮氧化物等废气污染都接近0。
问题讨论:
作为一个电池的消费者,你希望使用怎样的电池?假如你是一个电池的研究生产者,你应该开发生产怎样的电池?
化学与职业~~~~~~~~~~~~~~~~~~~~~~~~~
电池研发人员
电池研发与生产、生活和军事等领域的发展密切相关。电池研发人员的工作包括电池构成材料的研制、电池性能的改进和应用的拓展等。以燃料电池为例,研发中需要研究电极、电解质等电池基本构成材料的性质和材料之间的相容性;研究不同类型的电池构成材料在不同用途时对温度、湿度等环境因素的适应性;
还要研究使用什么样的电池材料使电池的容量更大;等等。这些研究工作关系着电池的效率、寿命、安全性、适用性和制造成本。在许多科研机构和生产企业中,都有具备着扎实的化学基础的研究人员从事电池研发工作。
~~~~~~~~~~~~~~~ 研究与实践 ~~~~~~~~~~~~~~~
了解车用能源
[ 研究目的 ]
人们为给汽车提供动力,提高能源利用率,减少环境污染,在不断开发新的车用能源.通过以下活动,从不同角度分析和比较不同燃料和能量转化方式的优劣,体会开发新的车用能源的重要意义。
[研究任务]
(1) 汽车发展至今,在能源使用上经历了不同的发展阶段。查阅资料,了解汽车发展的过程和车用能源的种类。
(2)以氢气、甲烷(CH4)、辛烷(C8H18) 和乙醇 (C2H6O) 为例(你也可以尝试分析其他燃料),为汽车选择燃料。
① 写出不同燃料发生能量转化时涉及的主要化学反应。
H2热值123KJ/g _______________________________
CH4热值56KJ/g _______________________________
C8H18热值48KJ/g ______________________________
C2H5OH热值26.9KJ/g
____________________________________
2H2+O2 ════ 2H2O
点燃
CH4+2O2 ════ CO2+2H2O
点燃
2C8H18+25O2 ════ 16CO2+18H2O
点燃
C2H5OH+3O2 ════ 2CO2↑+3H2O
点燃
② 查阅资料,比较相同质量的燃料燃烧时放出热量的多少,并结合燃料的物质状态分析其优劣。
③ 从来源、环保等其他角度分析不同燃料的优劣。
从反应和热值来考虑:H2放出热量最多,而且不会产生温室气体CO2,是最理想的能源。
(3)了解蒸汽机、内燃机和燃料电池等的能量转化方式,从转化效率、技术可行性等角度进行比较。
[结果与讨论]
(1) 你最终选择了哪种燃料和哪种能量转化方式 你在选择时重点考虑了哪些因素
(2) 通过了解车用能源的发展过程,你得到什么启示 请与同学讨论。
随堂练习
1. 利用反应 Zn+CuSO4 ══ ZnSO4+Cu 设计一个原电池。在图中方格内画出实验装置图,并指出正极为__________________,电极反应式为_________________________;负极为_______________,电极反应式为________________________。
碳棒、Cu、铂
Cu2++ 2e- ═ Cu
Zn
Zn-2e-= Zn2+
2. (课本41页第5题)下列关于如图所示装置的叙述,错误的是 ( )
A、锌是负极、其质量逐渐减小
B、氢离子在铜表面被还原,产生气泡
C、电流从锌片经导线流向铜片
D、电子从锌片经导线流向铜片
C
【解析】锌铜稀硫酸原电池中,锌为负极,铜为正极,电流由铜经导线流向锌,电子从锌经导线流向铜,故C错误
解 析
3. (课本41页第6题)下列说法正确的是 ( )。
A. 图1所示装置能将化学能转化为电能
B. 图2所示反应为吸热反应
C. 锌锰干电池中,锌筒作正极
D. 蓄电池充电时也发生了氧化还原反应
D
解 析
【解析】
A、图1不能形成闭合回路,不能构成原电池;
B、图2反应物能量高于生成物,为放热反应;
C、锌锰干电池中,锌作负极;
D、蓄电池放电和充电均发生了氧化还原反应。
D正确
4. 如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组 ( )。
A. A是锌,B是铜,C为稀H2SO4
B. A是铜,B是锌,C为稀硫酸
C. A是铁,B是银,C为AgNO3溶液
D. A是Ag,B是铁,C为AgNO3溶液
D
5. 下列图片可构成原电池的是 ( )。
C、D
6. 写出电极反应式和总反应式
正极 :(C) ___________________________
负极 :(Zn) __________________________
总反应:____________________________
Zn-2e-═ Zn2+ (氧化反应)
Cu2++2e- ═ Cu (还原反应)
Zn+Cu2+ ═ Zn2++Cu
正极 :(Cu) __________________________
负极 :(Fe) __________________________
总反应:____________________________
2Ag++2e-═ Ag (还原反应)
Fe -2e-═ Fe2+ (氧化反应)
Fe+2Ag+ ═ Fe2++2Ag
练习与应用
2. 原电池是一种可将_________直接转化为________的装置,其中发生的化学反应属于_________________。原电池的必要组成部分有_________________________ _______________________________________________。
化学能
电能
氧化还原反应
两个活泼性不同的电极、电解质溶液和形成闭合回路。
7. 几位同学以相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
(1) 该实验的目的是探究水果种类和________________
对水果电池电流的影响。
电极间距离
(2) 该实验所用装置中,负极的材料是______________,
该装置将_____________转化为电能。
(3) 能表明水果种类对电流有影响的实验编号是_______,
和____________。
(4) 请你再提出一个可能影响水果电池电流的因素:
______________________________________。
锌片
化学
①
③
电极插入水果中的深度
8. 我国将落实创新、协调、绿色、开放、共享的发展理念,全面推进节能减排和低碳发展,迈向生态文明新时代。为此,如果从不同能源对环境的影响考虑,你认为我国在煤、石油等传统能源和新能源的利用及发展上应采取哪些措施
减少或淘汰传统能源,大力发展新能源。
9. 便携式化学电池使用方便,但仍然存在一些不足,如电乐较低,寿金较短,处理不当可能会造成环境污染。有人认为这些不足是由其制造技术不完善造成的,也有人认为是由其工作原理决定的。你的看法和依据是什么 请查阅资料,与老师和同学交流、讨论。
化学电池电压是其固有特征,无法改变,采用串联的方法可以增大电压;
一次电池放电结束,寿命即告终,充电电池寿命比一次电池的长,燃料电池的寿命最长;
化学电池在存放过程中,极容易变质或发生氧化还原反应,一般低温、干燥保存。
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
