7.2 乙烯与有机高分子材料课件(共134张ppt)人教版(2019)必修第二册
文档属性
| 名称 | 7.2 乙烯与有机高分子材料课件(共134张ppt)人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 96.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 19:30:17 | ||
图片预览









文档简介
(共134张PPT)
第七章
有机化合物
第二节
乙烯与有机高分子材料
我们几乎每天都可以看到水果,我们知道,水果在成熟的季节,会逐渐由青色逐渐变为红色和黄色,那么,你知道,是什么物质在起作用吗?
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。
乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
一
乙烯
乙烯的获得
从煤和石油中不仅可以得到多种常用燃料,而且可以从中获得大量的基本化工原料,其中,从石油中获得乙烯,已成为生产乙烯的主要途径;而乙烯的产量也是衡量一个国家化工发展水平的标志。
乙烯还可作水果的催熟剂
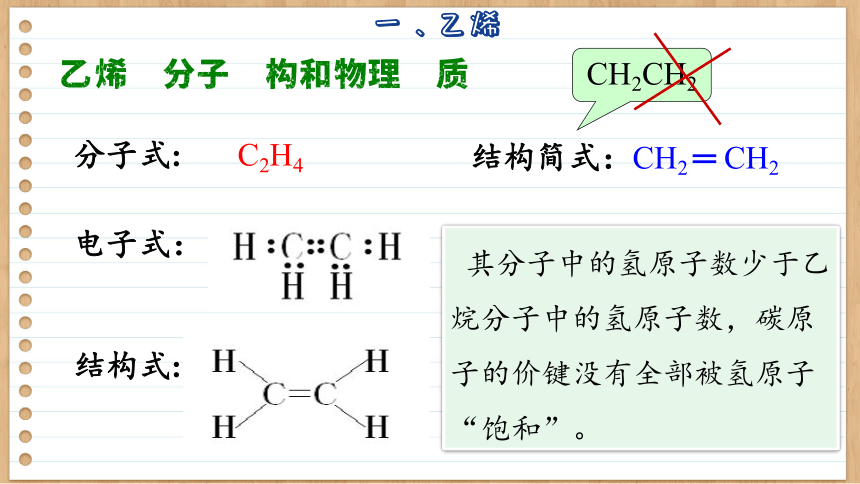
乙烯的分子结构和物理性质
结构式:
分子式:
结构简式:CH2 ═ CH2
CH2CH2
C2H4
电子式:
其分子中的氢原子数少于乙烷分子中的氢原子数,碳原子的价键没有全部被氢原子“饱和”。
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
数据
乙烯
熔点:─ 169 ℃
沸点:─ 104 ℃
密度:1.25 g/cm3
乙烯是一种无色,略有气味的气体,密度比空气略小,难溶于水。可用排水法收集 (不用排空气法)。
乙烯的结构模型
空间构型:
6个原子共平面,键角120°,平面型分子。
球棍模型
比例模型
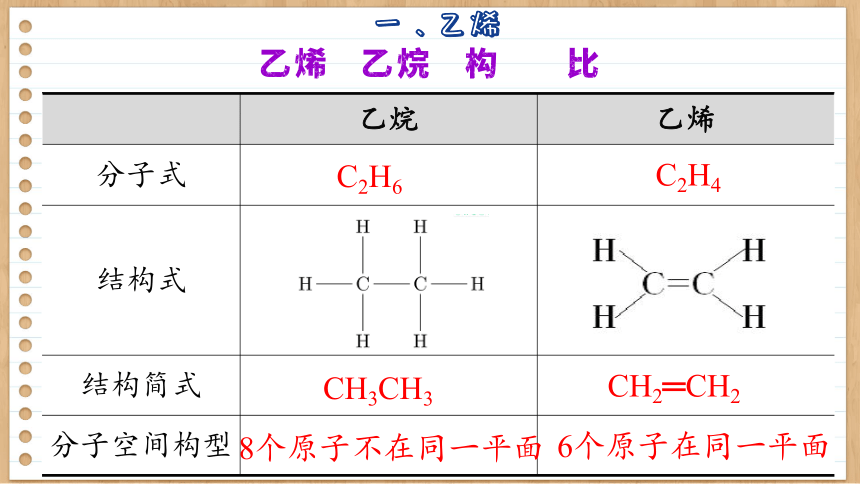
乙烷 乙烯
分子式
结构式
结构简式
分子空间构型
乙烯与乙烷结构的对比
C2H6
C2H4
CH3CH3
CH2═CH2
8个原子不在同一平面
6个原子在同一平面
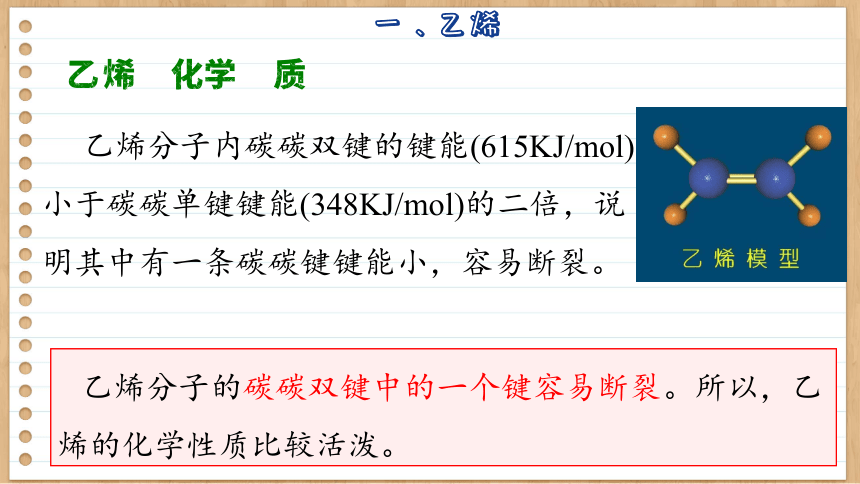
乙烯的化学性质
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,说明其中有一条碳碳键键能小,容易断裂。
乙烯分子的碳碳双键中的一个键容易断裂。所以,乙烯的化学性质比较活泼。
1. 氧化反应
【实验 7-2】
(1) 点燃纯净的乙烯,观察燃烧时的现象。
(2) 将乙烯通入盛有酸性高酸钾溶液的试管中,观察现象。
乙烯能在空气中燃烧,火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量的热。
实验现象:(1) 氧化反应----燃烧
乙烯燃烧
CH2═CH2+2O2 2CO2+2H2O
点燃
思考:为何火焰颜色会明亮?并伴有黑烟?
产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光。
此反应可用于鉴别乙烯和甲烷。
(2) 与酸性 KMnO4 的作用
乙烯常温下即易被氧化剂氧化。如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去。
2. 加成反应
【实验 7-3】
将乙烯通入盛有澳的四氯化碳溶液的试管中,观察现象。
实验现象:溴的四氯化碳溶液 ——红棕色褪去。
反应中,乙烯双键中的一个键断裂,两个澳原子分别加在两个价键不饱和的碳原子上,生成无色的 1,2─二溴乙烷液体。
反应实质:乙烯分子中的碳碳双键断开一个,2个Br分别直接与2个价键不饱和的C结合。
乙烯
溴分子
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
1,2 ─ 二溴乙烷
加成反应的定义
这种有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
乙烯不仅可以与澳发生加成反应,在一定条件下,还可以与氯气、氢气、氯化氢和水等物质发生加成反应。
CH2 ═ CH2+H2 ────→ CH3─CH3 (乙烷)
催化剂
△
CH2═CH2+H2O ───────→ CH3─ CH2─OH
催化剂
加热、加压
工业上可以利用乙烯与水的加成反应制取乙醇。
CH2═CH2+Cl2 ─────→ CH2ClCH2Cl (1,2-二氯乙烷)
一定条件
CH2═CH2+HCl ─────→ CH3CH2Cl(氯乙烷)
一定条件
3. 聚合反应
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物 ——聚乙烯。
C2H4
聚乙烯
加成聚合反应
CH2 ═ CH2+CH2 ═ CH2+CH2═ CH2+···
─────→
··· ─CH2─CH2─CH2─CH2─CH2─ CH2─···
催化剂
这个反应还可以用下式表示:
nCH2═CH2 ──CH2─CH2──
催化剂
[ ]n
聚乙烯
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。
聚合反应在有机高分子材料的生产中有着广泛的应用。
乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
nCH2═CH2 ──CH2─CH2──
催化剂
[ ]n
聚乙烯
聚合反应生成的高分子是由较小的结构单元重复连接而成的。
单体:能形成高分子化合物的低分子化合物CH2═CH2
链节:化学组成相同,可重复的最小单位─CH2─CH2─
聚合度:链节的数目── n
链节和单体的化学组成和相对分子质量可能相同,也可能不同。
聚合物的平均相对分子质量═链节的相对分子质量×n
一块高分子材料是由若干n值不同的高分子材料组成的混合物。
常见聚合反应
nCH2═CH2 ── CH2─CH2 ── 聚乙烯
催化剂
[ ]n
nCH2 ═ CHCH3 聚丙烯
催化剂
── CH2─CH ──
▏
CH3
[ ]n
nCH2═CHCl 聚氯乙烯
催化剂
── CH2─CH──
▏
Cl
[ ]n
思考:聚乙烯、聚氯乙烯等高分子化合物能使溴水褪色吗?
【提示】 聚乙烯、聚氯乙烯中不含 C═C,故不能使溴水褪色。
信息搜索~~~~~~~~~~~~~~~~~~~~~~~~~~~
除了被用作化工原料,乙烯还可以调节植物生长,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
随堂练习
1、下列分子中所有原子都在同一平面上的是 ( )。
A、CH4 B、C2H6
C、CCl4 D、C2H4
D
【解析】甲烷为正四面体结构;乙烷为链状立体结构;四氯化碳为正四面体结构;乙烯为平面结构。
解 析
2、关于乙烯分子结构的说法中,错误的是( )。
A.乙烯分子里含有 C═C 双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中 C═C 双键的键长和乙烷分子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为120 。
C
【解析】反应过程如下:
1mol乙烯和1mol氯气加成,生成1mol的1,2二氯乙烷中,含有4mol氢原子,可以和4mol氯气发生取代反应,共需要5mol氯气。
CH2═CH2+Cl2 CH2Cl CH2Cl(1,2─二氯乙烷)
一定条件
3、1molCH2═CH2与氯气完全加成后再与氯气取代,整个过程最多需Cl2的物质的量为( )。
A. 1mol B. 4mol C. 5mol D. 6mol
C
解 析
4、某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
该烯烃的双键在哪两个碳原子之间?
答案:只能是③④之间
5.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是 ( )。
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
B
二
烃
烃的定义
有机化合物都含有碳元素,还常含有氢、氧,以及氮卤素、硫、磷等元素。
其中仅含碳和氢两种元素的有机化合物称为碳氢化合物,也称为烃。
+
=
烃
t
īng
q
火
气
àn
烃字的由来:
饱和烃和不饱和烃
根据烃分子中碳原子间成键方式的不同,可以对烃进行分类,如图7-13 所示。
① 烃分子中的碳原子之间只以单键结合,剩余价键均与H原子结合,使每个碳原子的化合价都已达到“饱和”。这样的烃叫做饱和烃,也称为烷烃。
烷烃通式:CnH2n+2 (n≥1整数)
甲烷是最简单的烷烃。
② 碳原子所结合的氢原子少于饱和烃里的氢原子的碳氢化合物属于不饱和烃(含有C═C 或 C≡C)。
含有C═C的烃叫做烯烃。烯烃通式为CnH2n (n≥2整数)
烯烃是不饱和烃,乙烯是最简单的烯烃。
③ 含有C≡C的烃叫做炔烃。烯烃通式为 CnH2n─2 (n≥2整数)
炔烃是不饱和烃,乙炔是最简单的炔烃。
乙炔的分子式:C2H2
电子式:
结构式:H─C≡C─H
结构简式:CH≡CH 或 HC≡CH (不饱和烃)
空间结构:直线型,键角180°
炔烃通式:CnH2n─2 (n≥2)
1) 苯结构式
④ 含有苯环的烃叫做芳香烃。苯是最简单的芳香烃,
芳香烃也是不饱和烃。
2) 分子式:C6H6
3) 结构简式:
4) 苯分子是平面六边形的稳定结构;
分子中含有苯环的一类烃属于芳香烃。含一个苯环芳香烃通式:CnH2n-6 (n≥6)
烃
饱和烃 (烷烃)
不饱和链烃
烷烃
烯烃
炔烃
环烷烃
芳香烃─苯及其同系物
CnH2n+2 (n≥1)
CnH2n-2 (n≥2)
CnH2n (n≥3)
CnH2n-6 (n≥6)
CnH2n (n≥2)
⑤ 烷烃和烯烃的物理性质:(随着分子中碳原子的递增)
(1) 直链烃常温下的状态:
C1~C4气态; C5~C16液态; C17以上为固态
(2) 熔沸点逐渐升高。
(3) 密度逐渐增大,但密度均比水小。
(4) 难溶于水,易溶于有机溶剂。
(5) C原子数相同时,支链越多,熔沸点越低。
探 究
烃的分子结构
【目的】
以甲烷、乙烯和乙炔为例,借助模型认识烃的分子结构。
【 活动】
(1) 根据碳原子的成键规律和甲烷、乙烯、乙快的结构式,写出三者的电子式并讨论其分子中有哪些类型的化学键。
(2) 结合以上分析,使用分子结构模型 (或橡皮泥、黏土、泡沫塑料、牙签等代用品) 搭建甲烷、乙烯和乙快分子的球棍模型。展示并描述三者的分子结构特点。
记录:
烃 甲烷 乙烯 乙炔
电子式
化学键
分子结构特点
正四面体
直线形
平面型
极性共价键
极性和非极性共价键
极性和非极性共价键
【问题与讨论】
(1) 比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系,与同学讨论。
甲烷性质比较稳定,是由于4个C─H之间的键是相同的;而乙烯存在的C═C,其中的一条键不稳定,化学性质比较活泼。
(2) 乙炔是甲烷或乙烯的同系物吗?为什么?
不是,同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。结构相似是指:
(1) 碳和碳存在相同的化学键
(2) 结构相似
(3) 在组成上相差一个或者n个CH2
科学史话~~~~~~~~~~~~~~~~~~~~~~~~~~~
芳香族化合物与苯
芳香族化合物是一种习惯说法。历史上芳香族化合物是一类从植物中提取的具有芳香气味的物质。现在这个名称已失去了原来的意义,一般指分子中含有苯环的有机物,它们并不一定有香味。
苯是芳香族化合物的母体,是一种重要的有机化工原料和有机溶剂,被广泛用于生产医药、农药、香料、染料、洗涤剂和合成高分子材料等。早在19世纪初,英国科学家法拉第(M. Faraday,1791-1867)就发现了苯,并将其称为“氢的重碳化合物”。后来法国化学家热拉尔(C-F. Gerhardt,1816-1856)等人又确定了苯的相对分子质量为78分子式为CH。苯分子中氢的相对含量如此之低,看上去是高度不饱和的化合物,应具有比较活泼的化学性质。然而实验事实却否定了以上推测,这使化学家们感到惊讶。苯到底具有怎样的特殊结构呢
奥地利化学家洛施密特(J.Loshmidt.1821—1895)曾提出苯具有环状结构。德国化学家凯库勒 (FA. Kekul,1829-1896)在分析了大量实验事实后认为,苯分子中6个碳原子之间的结合非常牢固,形成了一个很稳定的“核”,可以与其他碳原子相连形成芳香族化合物;而这个稳定的“核”具有闭合的环状结构,由碳原子以单、双键相互交替结合而成( ,习惯上称之为凯库勒式)。
苯的结构的提出具有划时代的意义,有力地推动了有机化学的发展。然而凯库勒式仍存在一定局限。现在人们知道,苯分子具有平面正六边形结构,相邻碳原子之间的键完全相同,其键长介于碳碳单键和碳碳双键的键长之间。
随堂练习
1、既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的 乙烯以得到纯净乙烷的方法是( )
A.通过足量的NaOH (aq)
B.通过足量的溴水
C.在Ni催化、加热条件下通入H2
D.通过足量的酸性KMnO4 (aq)
B
2、制取一氯乙烷最好采用的方法是 ( )
A. 乙烷和氯气反应
B. 乙烯和氯气反应
C. 乙烯和氯化氢反应
D. 甲烷和氯气反应
C
3、一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同,将1.0体积的这种混合气体在氧气中充分燃烧,生成2.0体积的CO2和2.4体积的水蒸气(相同条件下测定)。则混合物中烷烃和烯烃的体积比为( )。
A.3∶1 B.1∶3
C.2∶3 D.3∶2
C
解 析
【解析】相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1∶2,则混合气体中平均碳原子数为:2/1═2,混合物体积与水的物质的量之比为:1∶4.8,则混合物中平均氢原子数为:4.8/1═4.8,由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,设乙烷的体积为x,乙烯的体积为y,混合物中平均氢原子数为:(6x+4y)/(x+y) ═4.8,解得:x:y═2∶3,所以混合气体为乙烷和乙烯,二者的体积之比为2∶3.
4. 聚四氟乙烯俗称塑料王,具有良好的性能和广泛的用途,它的结构简式正确的是 ( )。
A、 ── CF2═CF2 ──
[ ]n
B、── CH2F2═CH2F2──
[ ]n
C、── CHF2═CHF2──
[ ]n
D、──CF2─CF2──
[ ]n
D
5.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶?( )
A、澄清石灰水、浓H2SO4
B、酸性KMnO4溶液、浓H2SO4
C、溴水、浓H2SO4
D、浓H2SO4、酸性KMnO4溶液
C
6. 下列关于乙烯的说法错误的是 ( )。
A.乙烯的化学性质比乙烷活泼
B.相同质量的乙烯和甲烷完全燃烧后产生水的质量,甲烷较多
C.聚乙烯由乙烯聚合而成,故分子中含有很多碳碳双键
D.乙烯生成聚乙烯的反应是乙烯分子相互简称的反应
C
三
有机高分子材料
在我们的生活中存在很多的塑料制品,橡胶制品、纤维制品,这些都是有机物通过化学反应制得的,那么这一节课,我们就来看看这些东西,在生活中的应用吧。
材料是现代社会发展的重要支柱。除了我们学过的金属材料和无机非金属材料,还有一大类非常重要的材料—有机高分子材料,其全球年产量已超过3亿吨,相应的体积超过了同时期生产的钢铁的体积。有机高分子材料在生活和生产的各领域中都有极为广泛的应用。
有机高分子材料
有机高分子材料是继水泥、钢材、木材之后发展迅速的又一大类建筑材料。具有轻质、节能、耐水、耐化学腐蚀、装饰性好、安装方便等优点,已在土木建筑工程中得到广泛应用。
高分子化合物,又称聚合物、高聚物,分子量很大 (一般104~106以上) 有机物质。
常见:塑料、橡胶、化学纤维、胶粘剂、涂料等。
合成高分子材料
合成塑料,占总量的80%。
合成橡胶
合成纤维
合成粘合剂
合成涂料
天然高分子材料
淀粉
纤维素
蛋白质
天然橡胶
1. 塑料
塑料的主要成分是合成树脂,像聚乙烯、聚丙烯聚氯乙烯、酚醛树脂等都是生产塑料的合成树脂。此外,人们还根据需要加入一些具有特定作用的添加剂,如能提高塑性的增塑剂,防止塑料老化的防老剂,以及增强材料着色剂等,再经过压制等加工处理,才能得到各种塑料制品。
塑料的特性:
①优良的加工性能; ②密度小、比强度高;
③耐化学腐蚀性能好; ④电绝缘性好;
⑤耐水性、耐水蒸气性能优越;
⑥装饰性、耐磨性好; 塑料还具有耐光性、隔声、隔热,某些塑料还具有弹性。
几种常见塑料的性能与主要用途
性能:有耐低温和耐化学腐蚀,绝缘性好,无毒;耐热性差,易老化。
① 聚乙烯 (PE)
主要用途:可制成薄膜,用于食品、药物的包装材料,以及日常用品、绝缘材料等。
② 聚氯乙烯 (PVC)
性能:绝缘性好,耐化学腐蚀、机械强度较高;热稳 定性差。
主要用途:可制成薄膜、管道、日常用品、绝缘材料等。
③ 聚苯乙烯 (PS)
性能:绝缘性好,耐化学腐蚀,无毒;质脆,耐热性差。
主要用途:可制成日常用品,绝缘材料,还可制成泡沫塑料用于防震、保温、隔音
④ 聚四氟乙烯 (PTFE)
性能:耐化学腐蚀,耐溶剂性好,耐低温、高温,绝缘性好;加工困难。
主要用途:可制成化工、医药等行业使用的耐腐蚀、耐高温、耐低温制品。
⑤ 聚丙烯 (PP)
性能:机械强度较高,绝缘性好,耐化学腐蚀,无毒;低温发脆,容易老化。
主要用途:可制成薄膜、管道、日常用品、包装材料等
⑥ 聚甲基丙烯酸甲酯 (PMMA,俗称有机玻璃)
性能:透光性好,易加工;耐磨性较差,能溶于有机溶剂。
主要用途:可制成飞机和车辆的风挡,光学仪器、医疗器械、广告牌等。
有机玻璃
⑧ 脲醛塑料 (俗称电玉,英文缩写:UF)
性能:绝缘性好,耐溶剂性好;不耐酸。
主要用途:可制成电器开关,插座及日常用品
2. 橡胶
橡胶是一类具有高弹性的高分子材料,是制造汽车飞机轮胎和各种密封材料所必需的原料。
人们很早就知道从橡胶树等植物中获得天然橡胶,但天然橡胶远不能满足人们的需要,于是化学家开始研究如何用化学方法人工合成橡胶。
经过分析发现,天然橡胶的主要成分是聚异戊二烯。
合成橡胶
通过模仿天然橡胶的分子组成和结构,人们以异戊二烯为单体进行聚合反应,制得了异戊橡胶。异戊橡胶的性能与天然橡胶十分接近,又被称为合成天然橡胶。随着技术的发展,人们还开发了丁苯橡胶、顺丁橡胶、氯丁橡胶等一系列合成橡胶。
合成橡胶的种类很多,有丁苯橡胶、顺丁橡胶、合成天然橡胶、丁腈橡胶、氯丁橡胶、乙丙橡胶、硅橡胶等品种。 产量占第一位的_______________,次之的是_______________。
顺丁橡胶
丁苯橡胶
常见的合成橡胶
丁苯橡胶是以丁二烯和苯乙烯为单体,在乳液或溶液中用催化剂催化共聚所得的高分子弹性体。
丁苯橡胶是一种不饱和型橡胶,丁苯橡胶很容易与其它高不饱和通用橡胶并用,尤其是与天然胶或顺丁胶并用,经配合调整可以克服丁苯橡胶的缺点。
① 丁苯胶
② 顺丁橡胶
顺丁橡胶是以丁二烯为单体,在定向聚合催化剂的作用下,采用溶液聚合 方法而制得的弹性聚合物。
顺丁橡胶是不饱和橡胶,具有与天然橡胶类似的化学性质,可与硫磺及氧等反应。与天然橡胶比较,其硫化速度较慢,耐老化和耐热性能好。
③ 氯丁橡胶
氯丁胶是氯丁二烯单体聚合的弹性体,主要分为通用型、专用型以及氯丁胶乳三种类型,模压产品通常选择使用通用型氯丁橡胶 。
氯丁橡胶性能 :有良好的耐老化性和耐热性能; 耐燃烧性好 ; 耐油性和耐化学腐蚀性好; 粘着性好 ; 透气性好;可用金属氧化物流化。
许多橡胶具有线型结构,有一定弹性,但强度和韧性差。为了克服这些缺点,工业上常用硫与橡胶作用进行橡胶硫化,使线型的高分子链之间通过硫原子形成化学键产生交联,形成网状结构。硫化橡胶具有更好的强度、韧性、弹性和化学稳定性。人们还开发了耐热和耐酸、碱腐蚀的氟橡胶,耐高温和严寒的硅橡胶等特种橡胶。
特种橡胶在航空、航天和国防等尖端技术领域中发挥着重要的作用。
3. 纤维
人类用棉花、羊毛、蚕丝和麻等天然纤维纺纱织布已有悠久的历史,但天然纤维无论是在产量上还是在质量上都不能满足人类的需要。
随着化学科学的发展,人类开始用化学方法将农林产品中的纤维素、蛋白质等天然高分子加工成黏胶纤维、大豆蛋白纤维等再生纤维,后来发展到以石油、天然气和煤等为原料制成有机小分子单体,再经聚合反应生产合成纤维。
再生纤维与合成纤维统称为化学纤维。
常见的合成纤维有聚丙烯纤维 (丙纶 )、聚氯乙烯纤维(氯纶)、聚丙烯晴纤维 (睛纶 )、聚对苯二甲酸乙二酷纤维(涤纶) 和聚既胺纤维(锦纶、芳纶)等。
合成纤维具有强度高、弹性好、耐磨、耐化学腐蚀、不易虫蛀等优良性能,除了供人类穿着外,还可以制成绳索、渔网、工业用滤布,以及飞机、船舶的结构材料等,广泛应用于工农业生产的各个领域。
纤维
化学纤维
天然纤维:羊毛、棉花、蚕丝、麻
合成纤维:如六大纶等
人造纤维:如人造丝、人造棉等
六大纶:六大纶包括涤纶、锦纶、腈纶、丙纶、维纶、氯纶。目前产量占第一位的是涤纶
合成纤维——六大纶
① 最挺括的纤维——涤纶,聚酯纤维 (PET)
1953年正式投产,性能优异,已经成为合成纤维中产量最大的品种。
特性:抗皱性和保型性比羊毛好;强度比羊毛高1倍,比羊毛高3倍,湿强度不低于干强度;耐热性和热稳定性也是通用合成纤维最好的。
② 保暖性最好的纤维——氯纶,PVC
静电作用强,保暖性好,作内衣对关节炎有一定的辅助疗效。但是耐热性差。
③ 结实耐磨的纤维——尼龙 (我国又称锦纶),聚酰胺纤维。 是世界上最早实现工业化的纤维。
特性:耐磨性最好;强度比羊毛高2倍,比羊毛高4.5倍,重量只有棉花的1/3;透气性不好。
④最耐晒的纤维——腈纶
特性:蓬松卷曲,十分柔软,弹性好;有腈基,因而耐晒性特好;缺点是易起毛球、耐磨性差。
⑤ 质量最轻的纤维——丙纶。丙纶纤维性能好,价格便宜--------最大的用途是制成扁丝,用作包装绳和编织袋。
⑥聚乙烯醇缩甲醛纤维-----维纶,也叫维尼纶。其性能接近棉花,有“合成棉花”之称,是现有合成纤维中吸湿性最大的品种。
维纶主要用于制作外衣、棉毛衫裤、运动衫等针织物,还可用于帆布、渔网、外科手术缝线、自行车轮胎帘子线、过滤材料等。
高强度的纤维
高强度的纤维——碳纤维
含碳量在90%以上的高强度纤维。耐高温居所有化纤之首。用腈纶和粘胶纤维做原料,经高温氧化碳化而成。是制造航天航空等高技术器材的优良材料。
高强度合成纤维——芳纶。
芳纶 (全称聚苯二甲酰苯二胺),是一种新型高科技合成纤维,具有超高强度、高模量和耐高温、耐酸耐碱、重量轻、绝缘、抗老化、生命周期长等优良性能,广泛应用于复合材料、防弹制品、建材、特种防护服装、电子设备等领域。芳纶的发现,被认为是材料界一个非常重要的历史进程。
生活知识——常用纤维洗涤方法
尼龙(NYLON):
洗后易干,适用一般洗剂,避免长时间暴晒,以免衣服变黄,故应晾在阴凉通风处,熨时用垫布熨烫温度为120-130度。
棉 (COTTON):
用肥皂或中性洗衣剂洗涤,勿使用含荧光剂洗衣粉,不能浸泡漂白剂。棉制品易发霉,因此必须保证其干燥再加以收藏,请勿使用烘衣机。
羊毛 (WOOL):
以干洗为最佳清洗方式,如果标示可用水洗时,禁用热水、碱性或浓酸洗剂。不太脏时,在30℃的中性洗剂水中溶解后,再放入洗涤,轻轻搓洗,不能用刷子洗。洗后自然平放晾干,盖上一层白布再晒太阳,避免阳光直接照肘;熨烫时,温度需适中(约14O℃),最好能在熨品上垫一块布。
思考与讨论
请利用图示或表格等形式,对学过的常见材料进行归纳和分类,并注明其性能特点和主要用途。
合成有机高分子材料,如塑料、合成橡胶、合成纤维等在我们的日常生活中随处可见,它的性能特点及主要用途如下表所示:
材料种类 性能特点 主要用途
塑料 强度高、密度小、耐腐蚀、易加工 薄膜、包装材料、绝缘材料
橡胶 高弹性、耐磨、强度高 汽车、飞机轮船、密封材料
合成纤维 强度高、弹性好、耐供人类穿着、制成绳索、渔网等磨、耐化学腐蚀 供人类穿着、制成绳索、渔网等
科学·技术·社会 ~~~~~~~~~~~~~~~~~~~~~~
黏合剂和涂料
黏合剂又称胶黏剂,日常生活中常用的耀糊、胶水就是最普通的黏合剂。黏合剂根据来源可分为天然黏合剂和合成黏合剂。人们很早就使用动物的皮或鱼熬胶,用于黏结木材。合成黏合剂的黏结力强,性能优异得到了广泛的应用。近几十年来,汽车、电子等行业的发展对黏合剂的性能提出了更高的要求,一系列具有耐高温、耐低温、导电、导磁和导热等性能的特种黏合剂相继问世。
涂料是一类含有机高分子的混合液或粉末,能在物体表面形成附着坚固的涂膜,油漆就是一种常见的涂料。涂料可用于建筑船舶、车辆,以及家电、家具的保护和装饰。特种涂料在化工、航空等领域具有重要的用途。
随堂练习
1. 人造纤维和合成纤维有何区别?
答案:人造纤维的主要原料是天然高分子化合物,主要是纤维素;而合成纤维的主要原料是石油化工或煤化工产品——气态或液态烃及其衍生物,是小分子化合物。
2. 复合材料的优点是( )
①强度高 ②质量轻 ③耐高温 ④耐腐蚀
A. 仅①④ B. 仅②③
C. 除③外 D. 全部
D
3. 现代建筑装饰材料日新月异,更新换代很快,但都具有一个共同的缺点,易燃易引起火灾。由其判断现代建筑材料的主要成分是( )。
A.大理石 B.硅酸盐
C.有机物 D.金属化合物
C
练习与应用
1. 乙烯与甲烷在分子结构上的主要差异是__________
_______________________________。乙烯的化学性质与甲烷的相比,较为________。乙烯属于____________ (填“饱和烃”或“不饱和烃”),在一定条件下可以发生________反应和_______反应。
乙烯含碳碳双键、甲烷只有单键
活泼
不饱和烃
加成
氧化
2. 下列过程中发生的化学反应属于加成反应的是 ( )
A. 用光照射甲烷与氯气的混合气体
B. 将乙烯通入澳的四氯化碳溶液中
C. 在镍做催化剂的条件下,乙烯与氢气反应
D. 甲烷在空气中不完全燃烧
BC
3. 根据乙烯的性质可以推测丙烯 (CH2═CH─CH3) 的性质,下列说法错误的是 ( )。
A. 丙烯能使酸性高锰酸钾溶液褪色
B. 丙烯能在空气中燃烧
C. 丙烯与澳发生加成反应的产物是 CH2Br─CH2─CH2Br
D. 聚丙烯的结构可以表示为──CH2─CH──
│
CH3
[ ]n
C
4. 下列叙述正确的是 ( )。
A. 高分子材料能以石油、煤等化石燃料为原料进行生产
B. 聚乙烯的分子中含有碳碳双键
C. 高分子材料中的有机物分子均呈链状结构
D. 橡胶硫化的过程中发生了化学反应
D
5. 下列反应中,属于取代反应的是__________(填序号,下同),属于氧化反应的是__________,属于加成反应的是___________。
①由乙烯制乙醇 ②乙烷在空气中燃烧
③乙烯使的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤乙烷在光照下与氯气反应
⑤
② ④
① ③
6. 比较甲烷与氯气、乙烯与的反应,以及甲烷和乙烯在空气中燃烧时发生的反应,将反应类型、反应条件、生成物和反应时发生的现象填入下表。
反应物 反应类型 反应条件 生成物 现象
甲烷、氯气 取代反应 光照 一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢 气体颜色消失,试管内壁生成油状液体、试管内液面上升
反应物 反应类型 反应条件 生成物 现象
乙烯、溴 加成反应 常温常压 1,2─二溴乙烷 溴水褪色
甲烷、氧气 氧化反应 点燃 二氧化碳和水 燃烧、放热、产生淡蓝色火焰
乙烯、氧气 氧化反应 点燃 二氧化碳和水 燃烧、放热、火焰明亮伴有黑烟
7. 请写出以下反应的化学方程式。
(1) 乙烯与氯气发生加成反应。
乙烯与氯气发生加成反应生成1,2—二氯乙烯,化学方程式:
CH2═CH2+Cl2→CClH2-CClH2;
(2) 乙烯与氯化氢发生加成反应。
乙烯与氯化氢发生加成反应生成氯乙烷,化学方程式:
CH2═CH2+HCl → CH3CH2Cl;
(3) 氯乙烯(CH2 ═ CHCl) 发生加聚反应生成聚氯乙烯。
氯乙烯制取聚氯乙烯化学方程式:
nCH2═CHCl ──────→ ──CH2─CH──
催化剂
[ ]n
│
Cl
8. 汽车车身两侧遮罩车轮的挡板(翼子板 ),传统上多使用金属材料制造,现在已有塑料材质的问世这种改变可能有哪些好处请查阅资料,结合塑料的性能进行说明,并了解汽车上还有哪些部件使用了有机高分子材料。
汽车上面塑料零件和产品制作方便,可任意加工这些优点都使塑料在许多生产和生活领域大量代替了金属。
汽车轮胎用的橡胶是典型的高分子材料。车身塑料件大多是ABS工程塑料,座椅是聚氨酷泡沫塑料外包聚氨醋人造革或真皮,仪表版包的大部分也是聚氨醋,车体目前大多数是金属薄板但有少数概念车为碳纤维增强塑料的。聚氨酷材料目前是汽车上用的最多的高分子材料,几乎各个部位都能使用。这些轻质耐用的材料的使用,还大大降低了车出危险时对车主和行人的受伤程度。
本课结束
This lesson is over
THANKS!
第七章
有机化合物
第二节
乙烯与有机高分子材料
我们几乎每天都可以看到水果,我们知道,水果在成熟的季节,会逐渐由青色逐渐变为红色和黄色,那么,你知道,是什么物质在起作用吗?
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。
乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
一
乙烯
乙烯的获得
从煤和石油中不仅可以得到多种常用燃料,而且可以从中获得大量的基本化工原料,其中,从石油中获得乙烯,已成为生产乙烯的主要途径;而乙烯的产量也是衡量一个国家化工发展水平的标志。
乙烯还可作水果的催熟剂
乙烯的分子结构和物理性质
结构式:
分子式:
结构简式:CH2 ═ CH2
CH2CH2
C2H4
电子式:
其分子中的氢原子数少于乙烷分子中的氢原子数,碳原子的价键没有全部被氢原子“饱和”。
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
数据
乙烯
熔点:─ 169 ℃
沸点:─ 104 ℃
密度:1.25 g/cm3
乙烯是一种无色,略有气味的气体,密度比空气略小,难溶于水。可用排水法收集 (不用排空气法)。
乙烯的结构模型
空间构型:
6个原子共平面,键角120°,平面型分子。
球棍模型
比例模型
乙烷 乙烯
分子式
结构式
结构简式
分子空间构型
乙烯与乙烷结构的对比
C2H6
C2H4
CH3CH3
CH2═CH2
8个原子不在同一平面
6个原子在同一平面
乙烯的化学性质
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,说明其中有一条碳碳键键能小,容易断裂。
乙烯分子的碳碳双键中的一个键容易断裂。所以,乙烯的化学性质比较活泼。
1. 氧化反应
【实验 7-2】
(1) 点燃纯净的乙烯,观察燃烧时的现象。
(2) 将乙烯通入盛有酸性高酸钾溶液的试管中,观察现象。
乙烯能在空气中燃烧,火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量的热。
实验现象:(1) 氧化反应----燃烧
乙烯燃烧
CH2═CH2+2O2 2CO2+2H2O
点燃
思考:为何火焰颜色会明亮?并伴有黑烟?
产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光。
此反应可用于鉴别乙烯和甲烷。
(2) 与酸性 KMnO4 的作用
乙烯常温下即易被氧化剂氧化。如将乙烯通入酸性KMnO4溶液,溶液的紫色褪去。
2. 加成反应
【实验 7-3】
将乙烯通入盛有澳的四氯化碳溶液的试管中,观察现象。
实验现象:溴的四氯化碳溶液 ——红棕色褪去。
反应中,乙烯双键中的一个键断裂,两个澳原子分别加在两个价键不饱和的碳原子上,生成无色的 1,2─二溴乙烷液体。
反应实质:乙烯分子中的碳碳双键断开一个,2个Br分别直接与2个价键不饱和的C结合。
乙烯
溴分子
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
乙烯和溴的反应原理
1,2 ─ 二溴乙烷
加成反应的定义
这种有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
乙烯不仅可以与澳发生加成反应,在一定条件下,还可以与氯气、氢气、氯化氢和水等物质发生加成反应。
CH2 ═ CH2+H2 ────→ CH3─CH3 (乙烷)
催化剂
△
CH2═CH2+H2O ───────→ CH3─ CH2─OH
催化剂
加热、加压
工业上可以利用乙烯与水的加成反应制取乙醇。
CH2═CH2+Cl2 ─────→ CH2ClCH2Cl (1,2-二氯乙烷)
一定条件
CH2═CH2+HCl ─────→ CH3CH2Cl(氯乙烷)
一定条件
3. 聚合反应
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物 ——聚乙烯。
C2H4
聚乙烯
加成聚合反应
CH2 ═ CH2+CH2 ═ CH2+CH2═ CH2+···
─────→
··· ─CH2─CH2─CH2─CH2─CH2─ CH2─···
催化剂
这个反应还可以用下式表示:
nCH2═CH2 ──CH2─CH2──
催化剂
[ ]n
聚乙烯
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。
聚合反应在有机高分子材料的生产中有着广泛的应用。
乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
nCH2═CH2 ──CH2─CH2──
催化剂
[ ]n
聚乙烯
聚合反应生成的高分子是由较小的结构单元重复连接而成的。
单体:能形成高分子化合物的低分子化合物CH2═CH2
链节:化学组成相同,可重复的最小单位─CH2─CH2─
聚合度:链节的数目── n
链节和单体的化学组成和相对分子质量可能相同,也可能不同。
聚合物的平均相对分子质量═链节的相对分子质量×n
一块高分子材料是由若干n值不同的高分子材料组成的混合物。
常见聚合反应
nCH2═CH2 ── CH2─CH2 ── 聚乙烯
催化剂
[ ]n
nCH2 ═ CHCH3 聚丙烯
催化剂
── CH2─CH ──
▏
CH3
[ ]n
nCH2═CHCl 聚氯乙烯
催化剂
── CH2─CH──
▏
Cl
[ ]n
思考:聚乙烯、聚氯乙烯等高分子化合物能使溴水褪色吗?
【提示】 聚乙烯、聚氯乙烯中不含 C═C,故不能使溴水褪色。
信息搜索~~~~~~~~~~~~~~~~~~~~~~~~~~~
除了被用作化工原料,乙烯还可以调节植物生长,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
随堂练习
1、下列分子中所有原子都在同一平面上的是 ( )。
A、CH4 B、C2H6
C、CCl4 D、C2H4
D
【解析】甲烷为正四面体结构;乙烷为链状立体结构;四氯化碳为正四面体结构;乙烯为平面结构。
解 析
2、关于乙烯分子结构的说法中,错误的是( )。
A.乙烯分子里含有 C═C 双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中 C═C 双键的键长和乙烷分子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为120 。
C
【解析】反应过程如下:
1mol乙烯和1mol氯气加成,生成1mol的1,2二氯乙烷中,含有4mol氢原子,可以和4mol氯气发生取代反应,共需要5mol氯气。
CH2═CH2+Cl2 CH2Cl CH2Cl(1,2─二氯乙烷)
一定条件
3、1molCH2═CH2与氯气完全加成后再与氯气取代,整个过程最多需Cl2的物质的量为( )。
A. 1mol B. 4mol C. 5mol D. 6mol
C
解 析
4、某烯烃和氢气加成后的产物如图:
CH3—C—CH2—CH3
CH3
CH3
①
②
③
④
⑤
⑥
该烯烃的双键在哪两个碳原子之间?
答案:只能是③④之间
5.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是 ( )。
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有澄清石灰水的洗气瓶
B
二
烃
烃的定义
有机化合物都含有碳元素,还常含有氢、氧,以及氮卤素、硫、磷等元素。
其中仅含碳和氢两种元素的有机化合物称为碳氢化合物,也称为烃。
+
=
烃
t
īng
q
火
气
àn
烃字的由来:
饱和烃和不饱和烃
根据烃分子中碳原子间成键方式的不同,可以对烃进行分类,如图7-13 所示。
① 烃分子中的碳原子之间只以单键结合,剩余价键均与H原子结合,使每个碳原子的化合价都已达到“饱和”。这样的烃叫做饱和烃,也称为烷烃。
烷烃通式:CnH2n+2 (n≥1整数)
甲烷是最简单的烷烃。
② 碳原子所结合的氢原子少于饱和烃里的氢原子的碳氢化合物属于不饱和烃(含有C═C 或 C≡C)。
含有C═C的烃叫做烯烃。烯烃通式为CnH2n (n≥2整数)
烯烃是不饱和烃,乙烯是最简单的烯烃。
③ 含有C≡C的烃叫做炔烃。烯烃通式为 CnH2n─2 (n≥2整数)
炔烃是不饱和烃,乙炔是最简单的炔烃。
乙炔的分子式:C2H2
电子式:
结构式:H─C≡C─H
结构简式:CH≡CH 或 HC≡CH (不饱和烃)
空间结构:直线型,键角180°
炔烃通式:CnH2n─2 (n≥2)
1) 苯结构式
④ 含有苯环的烃叫做芳香烃。苯是最简单的芳香烃,
芳香烃也是不饱和烃。
2) 分子式:C6H6
3) 结构简式:
4) 苯分子是平面六边形的稳定结构;
分子中含有苯环的一类烃属于芳香烃。含一个苯环芳香烃通式:CnH2n-6 (n≥6)
烃
饱和烃 (烷烃)
不饱和链烃
烷烃
烯烃
炔烃
环烷烃
芳香烃─苯及其同系物
CnH2n+2 (n≥1)
CnH2n-2 (n≥2)
CnH2n (n≥3)
CnH2n-6 (n≥6)
CnH2n (n≥2)
⑤ 烷烃和烯烃的物理性质:(随着分子中碳原子的递增)
(1) 直链烃常温下的状态:
C1~C4气态; C5~C16液态; C17以上为固态
(2) 熔沸点逐渐升高。
(3) 密度逐渐增大,但密度均比水小。
(4) 难溶于水,易溶于有机溶剂。
(5) C原子数相同时,支链越多,熔沸点越低。
探 究
烃的分子结构
【目的】
以甲烷、乙烯和乙炔为例,借助模型认识烃的分子结构。
【 活动】
(1) 根据碳原子的成键规律和甲烷、乙烯、乙快的结构式,写出三者的电子式并讨论其分子中有哪些类型的化学键。
(2) 结合以上分析,使用分子结构模型 (或橡皮泥、黏土、泡沫塑料、牙签等代用品) 搭建甲烷、乙烯和乙快分子的球棍模型。展示并描述三者的分子结构特点。
记录:
烃 甲烷 乙烯 乙炔
电子式
化学键
分子结构特点
正四面体
直线形
平面型
极性共价键
极性和非极性共价键
极性和非极性共价键
【问题与讨论】
(1) 比较甲烷和乙烯的化学性质,分析其与二者的分子结构之间存在哪些联系,与同学讨论。
甲烷性质比较稳定,是由于4个C─H之间的键是相同的;而乙烯存在的C═C,其中的一条键不稳定,化学性质比较活泼。
(2) 乙炔是甲烷或乙烯的同系物吗?为什么?
不是,同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。结构相似是指:
(1) 碳和碳存在相同的化学键
(2) 结构相似
(3) 在组成上相差一个或者n个CH2
科学史话~~~~~~~~~~~~~~~~~~~~~~~~~~~
芳香族化合物与苯
芳香族化合物是一种习惯说法。历史上芳香族化合物是一类从植物中提取的具有芳香气味的物质。现在这个名称已失去了原来的意义,一般指分子中含有苯环的有机物,它们并不一定有香味。
苯是芳香族化合物的母体,是一种重要的有机化工原料和有机溶剂,被广泛用于生产医药、农药、香料、染料、洗涤剂和合成高分子材料等。早在19世纪初,英国科学家法拉第(M. Faraday,1791-1867)就发现了苯,并将其称为“氢的重碳化合物”。后来法国化学家热拉尔(C-F. Gerhardt,1816-1856)等人又确定了苯的相对分子质量为78分子式为CH。苯分子中氢的相对含量如此之低,看上去是高度不饱和的化合物,应具有比较活泼的化学性质。然而实验事实却否定了以上推测,这使化学家们感到惊讶。苯到底具有怎样的特殊结构呢
奥地利化学家洛施密特(J.Loshmidt.1821—1895)曾提出苯具有环状结构。德国化学家凯库勒 (FA. Kekul,1829-1896)在分析了大量实验事实后认为,苯分子中6个碳原子之间的结合非常牢固,形成了一个很稳定的“核”,可以与其他碳原子相连形成芳香族化合物;而这个稳定的“核”具有闭合的环状结构,由碳原子以单、双键相互交替结合而成( ,习惯上称之为凯库勒式)。
苯的结构的提出具有划时代的意义,有力地推动了有机化学的发展。然而凯库勒式仍存在一定局限。现在人们知道,苯分子具有平面正六边形结构,相邻碳原子之间的键完全相同,其键长介于碳碳单键和碳碳双键的键长之间。
随堂练习
1、既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的 乙烯以得到纯净乙烷的方法是( )
A.通过足量的NaOH (aq)
B.通过足量的溴水
C.在Ni催化、加热条件下通入H2
D.通过足量的酸性KMnO4 (aq)
B
2、制取一氯乙烷最好采用的方法是 ( )
A. 乙烷和氯气反应
B. 乙烯和氯气反应
C. 乙烯和氯化氢反应
D. 甲烷和氯气反应
C
3、一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同,将1.0体积的这种混合气体在氧气中充分燃烧,生成2.0体积的CO2和2.4体积的水蒸气(相同条件下测定)。则混合物中烷烃和烯烃的体积比为( )。
A.3∶1 B.1∶3
C.2∶3 D.3∶2
C
解 析
【解析】相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1∶2,则混合气体中平均碳原子数为:2/1═2,混合物体积与水的物质的量之比为:1∶4.8,则混合物中平均氢原子数为:4.8/1═4.8,由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,设乙烷的体积为x,乙烯的体积为y,混合物中平均氢原子数为:(6x+4y)/(x+y) ═4.8,解得:x:y═2∶3,所以混合气体为乙烷和乙烯,二者的体积之比为2∶3.
4. 聚四氟乙烯俗称塑料王,具有良好的性能和广泛的用途,它的结构简式正确的是 ( )。
A、 ── CF2═CF2 ──
[ ]n
B、── CH2F2═CH2F2──
[ ]n
C、── CHF2═CHF2──
[ ]n
D、──CF2─CF2──
[ ]n
D
5.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶?( )
A、澄清石灰水、浓H2SO4
B、酸性KMnO4溶液、浓H2SO4
C、溴水、浓H2SO4
D、浓H2SO4、酸性KMnO4溶液
C
6. 下列关于乙烯的说法错误的是 ( )。
A.乙烯的化学性质比乙烷活泼
B.相同质量的乙烯和甲烷完全燃烧后产生水的质量,甲烷较多
C.聚乙烯由乙烯聚合而成,故分子中含有很多碳碳双键
D.乙烯生成聚乙烯的反应是乙烯分子相互简称的反应
C
三
有机高分子材料
在我们的生活中存在很多的塑料制品,橡胶制品、纤维制品,这些都是有机物通过化学反应制得的,那么这一节课,我们就来看看这些东西,在生活中的应用吧。
材料是现代社会发展的重要支柱。除了我们学过的金属材料和无机非金属材料,还有一大类非常重要的材料—有机高分子材料,其全球年产量已超过3亿吨,相应的体积超过了同时期生产的钢铁的体积。有机高分子材料在生活和生产的各领域中都有极为广泛的应用。
有机高分子材料
有机高分子材料是继水泥、钢材、木材之后发展迅速的又一大类建筑材料。具有轻质、节能、耐水、耐化学腐蚀、装饰性好、安装方便等优点,已在土木建筑工程中得到广泛应用。
高分子化合物,又称聚合物、高聚物,分子量很大 (一般104~106以上) 有机物质。
常见:塑料、橡胶、化学纤维、胶粘剂、涂料等。
合成高分子材料
合成塑料,占总量的80%。
合成橡胶
合成纤维
合成粘合剂
合成涂料
天然高分子材料
淀粉
纤维素
蛋白质
天然橡胶
1. 塑料
塑料的主要成分是合成树脂,像聚乙烯、聚丙烯聚氯乙烯、酚醛树脂等都是生产塑料的合成树脂。此外,人们还根据需要加入一些具有特定作用的添加剂,如能提高塑性的增塑剂,防止塑料老化的防老剂,以及增强材料着色剂等,再经过压制等加工处理,才能得到各种塑料制品。
塑料的特性:
①优良的加工性能; ②密度小、比强度高;
③耐化学腐蚀性能好; ④电绝缘性好;
⑤耐水性、耐水蒸气性能优越;
⑥装饰性、耐磨性好; 塑料还具有耐光性、隔声、隔热,某些塑料还具有弹性。
几种常见塑料的性能与主要用途
性能:有耐低温和耐化学腐蚀,绝缘性好,无毒;耐热性差,易老化。
① 聚乙烯 (PE)
主要用途:可制成薄膜,用于食品、药物的包装材料,以及日常用品、绝缘材料等。
② 聚氯乙烯 (PVC)
性能:绝缘性好,耐化学腐蚀、机械强度较高;热稳 定性差。
主要用途:可制成薄膜、管道、日常用品、绝缘材料等。
③ 聚苯乙烯 (PS)
性能:绝缘性好,耐化学腐蚀,无毒;质脆,耐热性差。
主要用途:可制成日常用品,绝缘材料,还可制成泡沫塑料用于防震、保温、隔音
④ 聚四氟乙烯 (PTFE)
性能:耐化学腐蚀,耐溶剂性好,耐低温、高温,绝缘性好;加工困难。
主要用途:可制成化工、医药等行业使用的耐腐蚀、耐高温、耐低温制品。
⑤ 聚丙烯 (PP)
性能:机械强度较高,绝缘性好,耐化学腐蚀,无毒;低温发脆,容易老化。
主要用途:可制成薄膜、管道、日常用品、包装材料等
⑥ 聚甲基丙烯酸甲酯 (PMMA,俗称有机玻璃)
性能:透光性好,易加工;耐磨性较差,能溶于有机溶剂。
主要用途:可制成飞机和车辆的风挡,光学仪器、医疗器械、广告牌等。
有机玻璃
⑧ 脲醛塑料 (俗称电玉,英文缩写:UF)
性能:绝缘性好,耐溶剂性好;不耐酸。
主要用途:可制成电器开关,插座及日常用品
2. 橡胶
橡胶是一类具有高弹性的高分子材料,是制造汽车飞机轮胎和各种密封材料所必需的原料。
人们很早就知道从橡胶树等植物中获得天然橡胶,但天然橡胶远不能满足人们的需要,于是化学家开始研究如何用化学方法人工合成橡胶。
经过分析发现,天然橡胶的主要成分是聚异戊二烯。
合成橡胶
通过模仿天然橡胶的分子组成和结构,人们以异戊二烯为单体进行聚合反应,制得了异戊橡胶。异戊橡胶的性能与天然橡胶十分接近,又被称为合成天然橡胶。随着技术的发展,人们还开发了丁苯橡胶、顺丁橡胶、氯丁橡胶等一系列合成橡胶。
合成橡胶的种类很多,有丁苯橡胶、顺丁橡胶、合成天然橡胶、丁腈橡胶、氯丁橡胶、乙丙橡胶、硅橡胶等品种。 产量占第一位的_______________,次之的是_______________。
顺丁橡胶
丁苯橡胶
常见的合成橡胶
丁苯橡胶是以丁二烯和苯乙烯为单体,在乳液或溶液中用催化剂催化共聚所得的高分子弹性体。
丁苯橡胶是一种不饱和型橡胶,丁苯橡胶很容易与其它高不饱和通用橡胶并用,尤其是与天然胶或顺丁胶并用,经配合调整可以克服丁苯橡胶的缺点。
① 丁苯胶
② 顺丁橡胶
顺丁橡胶是以丁二烯为单体,在定向聚合催化剂的作用下,采用溶液聚合 方法而制得的弹性聚合物。
顺丁橡胶是不饱和橡胶,具有与天然橡胶类似的化学性质,可与硫磺及氧等反应。与天然橡胶比较,其硫化速度较慢,耐老化和耐热性能好。
③ 氯丁橡胶
氯丁胶是氯丁二烯单体聚合的弹性体,主要分为通用型、专用型以及氯丁胶乳三种类型,模压产品通常选择使用通用型氯丁橡胶 。
氯丁橡胶性能 :有良好的耐老化性和耐热性能; 耐燃烧性好 ; 耐油性和耐化学腐蚀性好; 粘着性好 ; 透气性好;可用金属氧化物流化。
许多橡胶具有线型结构,有一定弹性,但强度和韧性差。为了克服这些缺点,工业上常用硫与橡胶作用进行橡胶硫化,使线型的高分子链之间通过硫原子形成化学键产生交联,形成网状结构。硫化橡胶具有更好的强度、韧性、弹性和化学稳定性。人们还开发了耐热和耐酸、碱腐蚀的氟橡胶,耐高温和严寒的硅橡胶等特种橡胶。
特种橡胶在航空、航天和国防等尖端技术领域中发挥着重要的作用。
3. 纤维
人类用棉花、羊毛、蚕丝和麻等天然纤维纺纱织布已有悠久的历史,但天然纤维无论是在产量上还是在质量上都不能满足人类的需要。
随着化学科学的发展,人类开始用化学方法将农林产品中的纤维素、蛋白质等天然高分子加工成黏胶纤维、大豆蛋白纤维等再生纤维,后来发展到以石油、天然气和煤等为原料制成有机小分子单体,再经聚合反应生产合成纤维。
再生纤维与合成纤维统称为化学纤维。
常见的合成纤维有聚丙烯纤维 (丙纶 )、聚氯乙烯纤维(氯纶)、聚丙烯晴纤维 (睛纶 )、聚对苯二甲酸乙二酷纤维(涤纶) 和聚既胺纤维(锦纶、芳纶)等。
合成纤维具有强度高、弹性好、耐磨、耐化学腐蚀、不易虫蛀等优良性能,除了供人类穿着外,还可以制成绳索、渔网、工业用滤布,以及飞机、船舶的结构材料等,广泛应用于工农业生产的各个领域。
纤维
化学纤维
天然纤维:羊毛、棉花、蚕丝、麻
合成纤维:如六大纶等
人造纤维:如人造丝、人造棉等
六大纶:六大纶包括涤纶、锦纶、腈纶、丙纶、维纶、氯纶。目前产量占第一位的是涤纶
合成纤维——六大纶
① 最挺括的纤维——涤纶,聚酯纤维 (PET)
1953年正式投产,性能优异,已经成为合成纤维中产量最大的品种。
特性:抗皱性和保型性比羊毛好;强度比羊毛高1倍,比羊毛高3倍,湿强度不低于干强度;耐热性和热稳定性也是通用合成纤维最好的。
② 保暖性最好的纤维——氯纶,PVC
静电作用强,保暖性好,作内衣对关节炎有一定的辅助疗效。但是耐热性差。
③ 结实耐磨的纤维——尼龙 (我国又称锦纶),聚酰胺纤维。 是世界上最早实现工业化的纤维。
特性:耐磨性最好;强度比羊毛高2倍,比羊毛高4.5倍,重量只有棉花的1/3;透气性不好。
④最耐晒的纤维——腈纶
特性:蓬松卷曲,十分柔软,弹性好;有腈基,因而耐晒性特好;缺点是易起毛球、耐磨性差。
⑤ 质量最轻的纤维——丙纶。丙纶纤维性能好,价格便宜--------最大的用途是制成扁丝,用作包装绳和编织袋。
⑥聚乙烯醇缩甲醛纤维-----维纶,也叫维尼纶。其性能接近棉花,有“合成棉花”之称,是现有合成纤维中吸湿性最大的品种。
维纶主要用于制作外衣、棉毛衫裤、运动衫等针织物,还可用于帆布、渔网、外科手术缝线、自行车轮胎帘子线、过滤材料等。
高强度的纤维
高强度的纤维——碳纤维
含碳量在90%以上的高强度纤维。耐高温居所有化纤之首。用腈纶和粘胶纤维做原料,经高温氧化碳化而成。是制造航天航空等高技术器材的优良材料。
高强度合成纤维——芳纶。
芳纶 (全称聚苯二甲酰苯二胺),是一种新型高科技合成纤维,具有超高强度、高模量和耐高温、耐酸耐碱、重量轻、绝缘、抗老化、生命周期长等优良性能,广泛应用于复合材料、防弹制品、建材、特种防护服装、电子设备等领域。芳纶的发现,被认为是材料界一个非常重要的历史进程。
生活知识——常用纤维洗涤方法
尼龙(NYLON):
洗后易干,适用一般洗剂,避免长时间暴晒,以免衣服变黄,故应晾在阴凉通风处,熨时用垫布熨烫温度为120-130度。
棉 (COTTON):
用肥皂或中性洗衣剂洗涤,勿使用含荧光剂洗衣粉,不能浸泡漂白剂。棉制品易发霉,因此必须保证其干燥再加以收藏,请勿使用烘衣机。
羊毛 (WOOL):
以干洗为最佳清洗方式,如果标示可用水洗时,禁用热水、碱性或浓酸洗剂。不太脏时,在30℃的中性洗剂水中溶解后,再放入洗涤,轻轻搓洗,不能用刷子洗。洗后自然平放晾干,盖上一层白布再晒太阳,避免阳光直接照肘;熨烫时,温度需适中(约14O℃),最好能在熨品上垫一块布。
思考与讨论
请利用图示或表格等形式,对学过的常见材料进行归纳和分类,并注明其性能特点和主要用途。
合成有机高分子材料,如塑料、合成橡胶、合成纤维等在我们的日常生活中随处可见,它的性能特点及主要用途如下表所示:
材料种类 性能特点 主要用途
塑料 强度高、密度小、耐腐蚀、易加工 薄膜、包装材料、绝缘材料
橡胶 高弹性、耐磨、强度高 汽车、飞机轮船、密封材料
合成纤维 强度高、弹性好、耐供人类穿着、制成绳索、渔网等磨、耐化学腐蚀 供人类穿着、制成绳索、渔网等
科学·技术·社会 ~~~~~~~~~~~~~~~~~~~~~~
黏合剂和涂料
黏合剂又称胶黏剂,日常生活中常用的耀糊、胶水就是最普通的黏合剂。黏合剂根据来源可分为天然黏合剂和合成黏合剂。人们很早就使用动物的皮或鱼熬胶,用于黏结木材。合成黏合剂的黏结力强,性能优异得到了广泛的应用。近几十年来,汽车、电子等行业的发展对黏合剂的性能提出了更高的要求,一系列具有耐高温、耐低温、导电、导磁和导热等性能的特种黏合剂相继问世。
涂料是一类含有机高分子的混合液或粉末,能在物体表面形成附着坚固的涂膜,油漆就是一种常见的涂料。涂料可用于建筑船舶、车辆,以及家电、家具的保护和装饰。特种涂料在化工、航空等领域具有重要的用途。
随堂练习
1. 人造纤维和合成纤维有何区别?
答案:人造纤维的主要原料是天然高分子化合物,主要是纤维素;而合成纤维的主要原料是石油化工或煤化工产品——气态或液态烃及其衍生物,是小分子化合物。
2. 复合材料的优点是( )
①强度高 ②质量轻 ③耐高温 ④耐腐蚀
A. 仅①④ B. 仅②③
C. 除③外 D. 全部
D
3. 现代建筑装饰材料日新月异,更新换代很快,但都具有一个共同的缺点,易燃易引起火灾。由其判断现代建筑材料的主要成分是( )。
A.大理石 B.硅酸盐
C.有机物 D.金属化合物
C
练习与应用
1. 乙烯与甲烷在分子结构上的主要差异是__________
_______________________________。乙烯的化学性质与甲烷的相比,较为________。乙烯属于____________ (填“饱和烃”或“不饱和烃”),在一定条件下可以发生________反应和_______反应。
乙烯含碳碳双键、甲烷只有单键
活泼
不饱和烃
加成
氧化
2. 下列过程中发生的化学反应属于加成反应的是 ( )
A. 用光照射甲烷与氯气的混合气体
B. 将乙烯通入澳的四氯化碳溶液中
C. 在镍做催化剂的条件下,乙烯与氢气反应
D. 甲烷在空气中不完全燃烧
BC
3. 根据乙烯的性质可以推测丙烯 (CH2═CH─CH3) 的性质,下列说法错误的是 ( )。
A. 丙烯能使酸性高锰酸钾溶液褪色
B. 丙烯能在空气中燃烧
C. 丙烯与澳发生加成反应的产物是 CH2Br─CH2─CH2Br
D. 聚丙烯的结构可以表示为──CH2─CH──
│
CH3
[ ]n
C
4. 下列叙述正确的是 ( )。
A. 高分子材料能以石油、煤等化石燃料为原料进行生产
B. 聚乙烯的分子中含有碳碳双键
C. 高分子材料中的有机物分子均呈链状结构
D. 橡胶硫化的过程中发生了化学反应
D
5. 下列反应中,属于取代反应的是__________(填序号,下同),属于氧化反应的是__________,属于加成反应的是___________。
①由乙烯制乙醇 ②乙烷在空气中燃烧
③乙烯使的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤乙烷在光照下与氯气反应
⑤
② ④
① ③
6. 比较甲烷与氯气、乙烯与的反应,以及甲烷和乙烯在空气中燃烧时发生的反应,将反应类型、反应条件、生成物和反应时发生的现象填入下表。
反应物 反应类型 反应条件 生成物 现象
甲烷、氯气 取代反应 光照 一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢 气体颜色消失,试管内壁生成油状液体、试管内液面上升
反应物 反应类型 反应条件 生成物 现象
乙烯、溴 加成反应 常温常压 1,2─二溴乙烷 溴水褪色
甲烷、氧气 氧化反应 点燃 二氧化碳和水 燃烧、放热、产生淡蓝色火焰
乙烯、氧气 氧化反应 点燃 二氧化碳和水 燃烧、放热、火焰明亮伴有黑烟
7. 请写出以下反应的化学方程式。
(1) 乙烯与氯气发生加成反应。
乙烯与氯气发生加成反应生成1,2—二氯乙烯,化学方程式:
CH2═CH2+Cl2→CClH2-CClH2;
(2) 乙烯与氯化氢发生加成反应。
乙烯与氯化氢发生加成反应生成氯乙烷,化学方程式:
CH2═CH2+HCl → CH3CH2Cl;
(3) 氯乙烯(CH2 ═ CHCl) 发生加聚反应生成聚氯乙烯。
氯乙烯制取聚氯乙烯化学方程式:
nCH2═CHCl ──────→ ──CH2─CH──
催化剂
[ ]n
│
Cl
8. 汽车车身两侧遮罩车轮的挡板(翼子板 ),传统上多使用金属材料制造,现在已有塑料材质的问世这种改变可能有哪些好处请查阅资料,结合塑料的性能进行说明,并了解汽车上还有哪些部件使用了有机高分子材料。
汽车上面塑料零件和产品制作方便,可任意加工这些优点都使塑料在许多生产和生活领域大量代替了金属。
汽车轮胎用的橡胶是典型的高分子材料。车身塑料件大多是ABS工程塑料,座椅是聚氨酷泡沫塑料外包聚氨醋人造革或真皮,仪表版包的大部分也是聚氨醋,车体目前大多数是金属薄板但有少数概念车为碳纤维增强塑料的。聚氨酷材料目前是汽车上用的最多的高分子材料,几乎各个部位都能使用。这些轻质耐用的材料的使用,还大大降低了车出危险时对车主和行人的受伤程度。
本课结束
This lesson is over
THANKS!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
