化学人教版(2019)选择性必修1 1.1.3热化学方程式(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.3热化学方程式(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 254.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 16:47:06 | ||
图片预览






文档简介
第3课时 热化学方程式
燃烧热
第一节 化学反应与能量的变化
第一章 化学反应与能量
人教版(2019)高中化学选择性必修1
学习目标
1.认识热化学方程式,了解热化学方程式表示的意义。(宏观辨识与微观探析)
2.理解热化学方程式书写规则,能用热化学方程式表示反应中的能量变化。(变化观念与平衡思想)
3.认识燃烧热。结合不同物质的燃烧热数值,讨论选择燃料的依据。(证据推理与模型认知)
教学过程
【思考】我们已经知道了该如何表示化学反应中的物质变化,又知道了如何表示反应热。该怎样将这两者同时表示出来呢?
化学反应中的物质变化
没能表明反应中的能量变化
有什么不足?
化学方程式
可以表明什么?
H2+Cl2
2HCl
点燃
教学过程
②H2(g) + Cl2(g) === 2HCl(g) ?H=?184.6 kJ/mol
思考与讨论
下列两个方程的有什么区别?意义相同吗?
①H2 + Cl2 === 2HCl
点燃
教学过程
知识点一
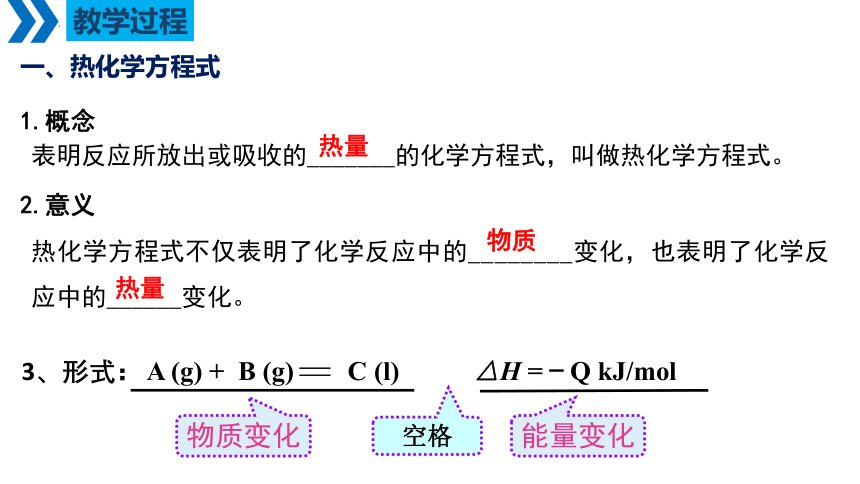
一、热化学方程式
1.概念
表明反应所放出或吸收的_______的化学方程式,叫做热化学方程式。
热量
2.意义
热化学方程式不仅表明了化学反应中的________变化,也表明了化学反应中的______变化。
热量
物质
A (g) + B (g) C (l) △H =-Q kJ/mol
3、形式:
物质变化
能量变化
空格
课堂练习
①2H2(g) + O2(g) === 2H2O(g) ΔH =﹣483.6 kJ/mol
表示2mol氢气与1mol氧气完全反应生成2mol水蒸气,放出483.6 kJ的热量。
②C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
表示在25 ℃和101 kPa下, 1 mol C(s)和1 mol H2O(g)完全反应生成1mol CO(g)和1 mol H2(g)时吸收131.3 kJ的热量。
1、请说出下列热化学方程式的意义
教学过程
阅读教材P10
△H必须与方程式一一对应。
教学过程
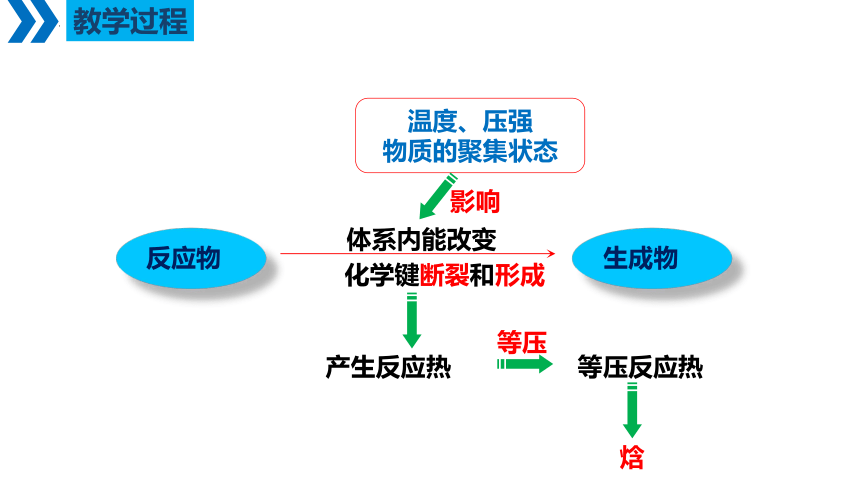
反应物
生成物
温度、压强
物质的聚集状态
体系内能改变
产生反应热
等压
等压反应热
焓
影响
化学键断裂和形成
教学过程
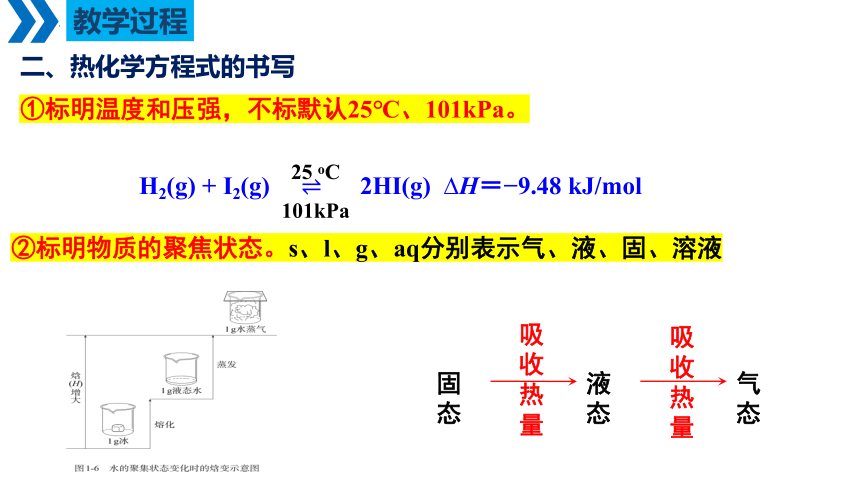
二、热化学方程式的书写
①标明温度和压强,不标默认25℃、101kPa。
H2(g) + I2(g) ? 2HI(g) ?H=?9.48 kJ/mol
?
25 oC
101kPa
固态
液态
气态
吸收
热量
吸收
热量
②标明物质的聚焦状态。s、l、g、aq分别表示气、液、固、溶液
教学过程
热化学方程式的化学计量系数仅表示物质的量,不表示分子数。
③化学计量系数可以是整数或分数。
反应①的△H是反应②的两倍。
教学过程
书写步骤
一写方程式
二标状态
四标△H
三标条件
五标数值
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态
标明反应的温度和压强(101kPa、25℃时可不标注)
在方程式后写出△H,并根据信息注明△H的“+”或“-”
根据化学计量数计算写出△H的值,并注明单位
课堂练习
(1)0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,其热化学方程式为;
(2)当1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量,请写出该反应的热化学方程式。
(3)煤气的主要成分为CO和H2,常温下14 g CO完全燃烧,放出141.5 kJ热量。
1、根据信息,写出热化学方程式
教学过程
2、(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。
(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。
(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。
请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
教学过程
3、 判断下列热化学方程式的书写是否正确?
(1)1 mol液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ 热量:N2H4(l)+O2(g) N2(g)+2H2O(g) ΔH=+642 kJ·mol-1 ( )
(2) 已知:H2(g)+???????? O2(g) H2O(l) ΔH=-286 kJ·mol-1,则 2H2O(l) 2H2(g)+O2(g) ΔH=+572 kJ ( )
(3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量。 ( )
?
×
×
×
?
?
教学过程
热化学方程式正误判断:
一审“+、-”
二审单位
三审状态
四审数值
对应性
放热反应△H为“-”,吸热反应△H为“+”
单位一定为“kJ/mol”,易错写成“mol”或漏写
物质的状态必须正确,特别是溶液中的反应易写错
反应热的数值必须与热化学方程式中的化学计量数相对应,即化学计量数与△H成正比;当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
教学过程
H2(g) + I2(g) ? 2HI(g) ?H1=?9.48 kJ/mol ①
?
2HI(g) ? H2(g) + I2(g) ?H2= kJ/mol ②
?
+9.48
(1)化学方程式换方向,?H变符号。
思考与讨论:?H必须与方程式一一对应,它们之间有怎样的关系呢?
对于可逆反应,?H的意义:
指的是反应物完全变成生成物,所释放或吸收的热量。实际放出释放或吸收的热量小于理论值。
教学过程
①H2(g)+ ???????? O2 = H2O(g) ?H1=-241.8 kJ/mol
?
②H2O(g) = H2O(l) ?H2=-44.0 kJ/mol
③H2(g)+ ???????? O2 = H2O(l) ?H3=-285.8 kJ/mol
?
①式+②式=③式
?H1 + ?H2 = ?H3
(2)化学方程式相加,?H相加。
教学过程
H2(g) + Cl2(g) = 2HCl(g) ?H1=?184.6 kJ/mol ①
H2(g) + Cl2(g) =2HCl(g) ?H2=?92.3 kJ/mol ②
1
2
1
2
(3)化学计量系数扩大n倍,?H扩大n倍。
教学过程
①化学方程式换方向,?H变符号。
③化学方程式相加,?H相加。
②化学计量系数扩大n倍,?H扩大n倍。
小结:热化学方程式的运算规则
教学过程
根据化学反应的情况不同,反应热分为多种,如中和热、燃烧热、溶解热等。那么什么是“燃烧热”呢?它的含义是什么?是不是物质燃烧放出的热量就叫燃烧热呢?
教学过程
三、燃烧热
1.定义:在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热,单位是kJ·mol-1。
指定产物:完全燃烧生成指定产物是指单质或化合物燃烧后变成最稳定的物质。完全燃烧时,下列元素要生成对应的物质:
C → ;H → ;
S → ;N→ 。
CO2(g)
H2O(l)
SO2(g)
N2(g)
例:H2(g)+ ????????O2(g)==H2O(l) ?H =- 285.8kJ/mol
?
意义:氢气的燃烧热是285.8kJ ? mol-1或氢气的燃烧热是△H=-akJ ? mol-l
教学过程
名称
化学式
ΔH/kJ·mol-1
名称
化学式
ΔH/kJ·mol-1
石墨
C(s)
-393.5
乙烷
C2H6(g)
-1559.8
金刚石
C(s)
-395.0
乙烯
C2H4(g)
-1411.0
氢气
H2(g)
-285.8
乙炔
C2H2(g)
-1299.6
一氧化碳
CO(g)
-283.0
乙醇
C2H5OH(l)
-1366.8
甲烷
CH4(g)
-890.3
丙烷
C3H8(g)
-2219.9
甲醇
CH3OH(l)
-726.5
苯
C6H6(l)
-3267.5
某些物质的燃烧热(25℃、101kPa)课本P120附录I
教学过程
第③项;
①中C2H6(g)的物质的量是2 mol,②中水为气态均不能表示乙烷燃烧热的热化学方程式。
已知乙烷燃烧的热化学方程式如下,其中哪项能表示乙烷燃烧热的热化学方程式?对于不能表示乙烷燃烧热的热化学方程式,说明理由。
①2C2H6(g)+7O2(g) 4CO2(g)+6H2O(l) ΔH=-3119.6 kJ/mol
②C2H6(g)+7/2O2(g) 2CO2(g)+3H2O(g) ΔH=-1427.8 kJ/mol
③C2H6(g)+7/2O2(g) 2CO2(g)+3H2O(l) ΔH=-1559.8 kJ/mol
思考与讨论:
√
课堂练习
1、25℃,101 kPa,1 mol CH4 完全燃烧,放出 890.31 kJ 的热量,这就是 CH4 的燃烧热。用热化学方程式表示如下:
2、25℃,101 kPa,1 mol CH3CH2OH 完全燃烧,放出 1366.8 kJ 的热量,这就是 CH3CH2OH 的燃烧热。用热化学方程式表示如下:
课堂练习
1、0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,写出乙炔燃烧的热化学方程式和燃烧热的热化学方程式。
其热化学方程式为 :
表示燃烧热的热化学方程式为 :
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= -2599.2kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1299.6kJ/mol
可燃物的物质的量发生变化,其燃烧热变吗?
课后任务
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液氧汽油
肼类燃料(肼、偏二甲肼)
液氧煤油
液氢液氧
长征六号、“长征七号”运载火箭采用液氧煤油推进剂,长征九号、11号使用液氧加煤油作为燃料
“长征五号”运载火箭采用液氢液氧推进剂
长征一号:硝酸-27S+偏二甲肼;长征二号系列、长征四号系列:四氧化二氮加偏二甲肼,长征三号系列使用了四氧化二氮加偏二甲肼,液氧液氢推进剂
长征二号F遥十三,长征二号F遥十六
了解液体火箭推进剂的发展
教学过程
课堂小结
热化学
方程式
书写
正误判断
燃烧热
概念
注意问题
一种特定的反应热
表示
谢谢观看!
燃烧热
第一节 化学反应与能量的变化
第一章 化学反应与能量
人教版(2019)高中化学选择性必修1
学习目标
1.认识热化学方程式,了解热化学方程式表示的意义。(宏观辨识与微观探析)
2.理解热化学方程式书写规则,能用热化学方程式表示反应中的能量变化。(变化观念与平衡思想)
3.认识燃烧热。结合不同物质的燃烧热数值,讨论选择燃料的依据。(证据推理与模型认知)
教学过程
【思考】我们已经知道了该如何表示化学反应中的物质变化,又知道了如何表示反应热。该怎样将这两者同时表示出来呢?
化学反应中的物质变化
没能表明反应中的能量变化
有什么不足?
化学方程式
可以表明什么?
H2+Cl2
2HCl
点燃
教学过程
②H2(g) + Cl2(g) === 2HCl(g) ?H=?184.6 kJ/mol
思考与讨论
下列两个方程的有什么区别?意义相同吗?
①H2 + Cl2 === 2HCl
点燃
教学过程
知识点一
一、热化学方程式
1.概念
表明反应所放出或吸收的_______的化学方程式,叫做热化学方程式。
热量
2.意义
热化学方程式不仅表明了化学反应中的________变化,也表明了化学反应中的______变化。
热量
物质
A (g) + B (g) C (l) △H =-Q kJ/mol
3、形式:
物质变化
能量变化
空格
课堂练习
①2H2(g) + O2(g) === 2H2O(g) ΔH =﹣483.6 kJ/mol
表示2mol氢气与1mol氧气完全反应生成2mol水蒸气,放出483.6 kJ的热量。
②C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol
表示在25 ℃和101 kPa下, 1 mol C(s)和1 mol H2O(g)完全反应生成1mol CO(g)和1 mol H2(g)时吸收131.3 kJ的热量。
1、请说出下列热化学方程式的意义
教学过程
阅读教材P10
△H必须与方程式一一对应。
教学过程
反应物
生成物
温度、压强
物质的聚集状态
体系内能改变
产生反应热
等压
等压反应热
焓
影响
化学键断裂和形成
教学过程
二、热化学方程式的书写
①标明温度和压强,不标默认25℃、101kPa。
H2(g) + I2(g) ? 2HI(g) ?H=?9.48 kJ/mol
?
25 oC
101kPa
固态
液态
气态
吸收
热量
吸收
热量
②标明物质的聚焦状态。s、l、g、aq分别表示气、液、固、溶液
教学过程
热化学方程式的化学计量系数仅表示物质的量,不表示分子数。
③化学计量系数可以是整数或分数。
反应①的△H是反应②的两倍。
教学过程
书写步骤
一写方程式
二标状态
四标△H
三标条件
五标数值
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态
标明反应的温度和压强(101kPa、25℃时可不标注)
在方程式后写出△H,并根据信息注明△H的“+”或“-”
根据化学计量数计算写出△H的值,并注明单位
课堂练习
(1)0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,其热化学方程式为;
(2)当1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量,请写出该反应的热化学方程式。
(3)煤气的主要成分为CO和H2,常温下14 g CO完全燃烧,放出141.5 kJ热量。
1、根据信息,写出热化学方程式
教学过程
2、(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。
(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。
(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。
请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
教学过程
3、 判断下列热化学方程式的书写是否正确?
(1)1 mol液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ 热量:N2H4(l)+O2(g) N2(g)+2H2O(g) ΔH=+642 kJ·mol-1 ( )
(2) 已知:H2(g)+???????? O2(g) H2O(l) ΔH=-286 kJ·mol-1,则 2H2O(l) 2H2(g)+O2(g) ΔH=+572 kJ ( )
(3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量。 ( )
?
×
×
×
?
?
教学过程
热化学方程式正误判断:
一审“+、-”
二审单位
三审状态
四审数值
对应性
放热反应△H为“-”,吸热反应△H为“+”
单位一定为“kJ/mol”,易错写成“mol”或漏写
物质的状态必须正确,特别是溶液中的反应易写错
反应热的数值必须与热化学方程式中的化学计量数相对应,即化学计量数与△H成正比;当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
教学过程
H2(g) + I2(g) ? 2HI(g) ?H1=?9.48 kJ/mol ①
?
2HI(g) ? H2(g) + I2(g) ?H2= kJ/mol ②
?
+9.48
(1)化学方程式换方向,?H变符号。
思考与讨论:?H必须与方程式一一对应,它们之间有怎样的关系呢?
对于可逆反应,?H的意义:
指的是反应物完全变成生成物,所释放或吸收的热量。实际放出释放或吸收的热量小于理论值。
教学过程
①H2(g)+ ???????? O2 = H2O(g) ?H1=-241.8 kJ/mol
?
②H2O(g) = H2O(l) ?H2=-44.0 kJ/mol
③H2(g)+ ???????? O2 = H2O(l) ?H3=-285.8 kJ/mol
?
①式+②式=③式
?H1 + ?H2 = ?H3
(2)化学方程式相加,?H相加。
教学过程
H2(g) + Cl2(g) = 2HCl(g) ?H1=?184.6 kJ/mol ①
H2(g) + Cl2(g) =2HCl(g) ?H2=?92.3 kJ/mol ②
1
2
1
2
(3)化学计量系数扩大n倍,?H扩大n倍。
教学过程
①化学方程式换方向,?H变符号。
③化学方程式相加,?H相加。
②化学计量系数扩大n倍,?H扩大n倍。
小结:热化学方程式的运算规则
教学过程
根据化学反应的情况不同,反应热分为多种,如中和热、燃烧热、溶解热等。那么什么是“燃烧热”呢?它的含义是什么?是不是物质燃烧放出的热量就叫燃烧热呢?
教学过程
三、燃烧热
1.定义:在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热,单位是kJ·mol-1。
指定产物:完全燃烧生成指定产物是指单质或化合物燃烧后变成最稳定的物质。完全燃烧时,下列元素要生成对应的物质:
C → ;H → ;
S → ;N→ 。
CO2(g)
H2O(l)
SO2(g)
N2(g)
例:H2(g)+ ????????O2(g)==H2O(l) ?H =- 285.8kJ/mol
?
意义:氢气的燃烧热是285.8kJ ? mol-1或氢气的燃烧热是△H=-akJ ? mol-l
教学过程
名称
化学式
ΔH/kJ·mol-1
名称
化学式
ΔH/kJ·mol-1
石墨
C(s)
-393.5
乙烷
C2H6(g)
-1559.8
金刚石
C(s)
-395.0
乙烯
C2H4(g)
-1411.0
氢气
H2(g)
-285.8
乙炔
C2H2(g)
-1299.6
一氧化碳
CO(g)
-283.0
乙醇
C2H5OH(l)
-1366.8
甲烷
CH4(g)
-890.3
丙烷
C3H8(g)
-2219.9
甲醇
CH3OH(l)
-726.5
苯
C6H6(l)
-3267.5
某些物质的燃烧热(25℃、101kPa)课本P120附录I
教学过程
第③项;
①中C2H6(g)的物质的量是2 mol,②中水为气态均不能表示乙烷燃烧热的热化学方程式。
已知乙烷燃烧的热化学方程式如下,其中哪项能表示乙烷燃烧热的热化学方程式?对于不能表示乙烷燃烧热的热化学方程式,说明理由。
①2C2H6(g)+7O2(g) 4CO2(g)+6H2O(l) ΔH=-3119.6 kJ/mol
②C2H6(g)+7/2O2(g) 2CO2(g)+3H2O(g) ΔH=-1427.8 kJ/mol
③C2H6(g)+7/2O2(g) 2CO2(g)+3H2O(l) ΔH=-1559.8 kJ/mol
思考与讨论:
√
课堂练习
1、25℃,101 kPa,1 mol CH4 完全燃烧,放出 890.31 kJ 的热量,这就是 CH4 的燃烧热。用热化学方程式表示如下:
2、25℃,101 kPa,1 mol CH3CH2OH 完全燃烧,放出 1366.8 kJ 的热量,这就是 CH3CH2OH 的燃烧热。用热化学方程式表示如下:
课堂练习
1、0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,写出乙炔燃烧的热化学方程式和燃烧热的热化学方程式。
其热化学方程式为 :
表示燃烧热的热化学方程式为 :
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= -2599.2kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1299.6kJ/mol
可燃物的物质的量发生变化,其燃烧热变吗?
课后任务
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液氧汽油
肼类燃料(肼、偏二甲肼)
液氧煤油
液氢液氧
长征六号、“长征七号”运载火箭采用液氧煤油推进剂,长征九号、11号使用液氧加煤油作为燃料
“长征五号”运载火箭采用液氢液氧推进剂
长征一号:硝酸-27S+偏二甲肼;长征二号系列、长征四号系列:四氧化二氮加偏二甲肼,长征三号系列使用了四氧化二氮加偏二甲肼,液氧液氢推进剂
长征二号F遥十三,长征二号F遥十六
了解液体火箭推进剂的发展
教学过程
课堂小结
热化学
方程式
书写
正误判断
燃烧热
概念
注意问题
一种特定的反应热
表示
谢谢观看!
