1.3 电能转化为化学能——电解课件(共88张ppt)鲁科版(2019)选择性必修一第1章第3节
文档属性
| 名称 | 1.3 电能转化为化学能——电解课件(共88张ppt)鲁科版(2019)选择性必修一第1章第3节 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 21:09:00 | ||
图片预览










文档简介
(共88张PPT)
电能转化为化学能——电解
第一课时
电解的原理
金属钠与氯气在常温下就可以发生氧化还原反应生成氯化钠,同时放出大量的热:
2Na(s)+Cl2(g) =2NaCl(s)
△H=-822.3kJ·mol-1
反之,若以氯化钠为原料制备金属钠,则需要从外界获得能量(如电能)。
在生产实践中,人们是如何利用电能,以氯化钠为原料制取金属钠的呢?
电能与化学能之间的相互转化具有重要的实用价值。通过将电能转化为化学能,可以使许多在通常条件下不能发生的反应得以进行,这对于化工生产、金属冶炼、实验室研究以及人们的日常生活都具有十分重要的意义。
电解是将电能转化为化学能的过程。
工业冶炼金属钠的原理
电解:将电能转化为化学能的过程
2NaCl(熔融 ) ===2Na+Cl2↑
通电
电解意义:
使许多在通常条件下不能发生的反应得以进行
电解的原理
图1—3—2为工业上利用电解熔融氯化钠的方法生产金属钠所用装置的示意图。容器中盛有熔融氯化钠,两侧分别插入石墨片和铁片作为电 极材料,两个电极分别与电源的正极和负极相连。
讨论:
1.接通直流电源后,熔融氯化钠中的Na+和Cl-各向哪个方向移动?
2.移动到两个电极表面的将分别发生什么变化?
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl--2e- = Cl2
2Na++ 2e- = 2Na
氧化反应
还原反应
总反应:2NaCl=== 2Na+Cl2↑
电解
电解熔融氯化钠
1.电解
2.电解池
3.电解池构成
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程过程。
将电能转化为化学能得装置。
直流电源
固体电极材料
电解质溶液或熔融电解质
阳极
阴极
发生氧化反应
发生还原反应
电
源
负极
正极
阴极
阳极
电子流出
电子流入
离
子
导
体
阳离子
阴离子
电
极
移向
移向
得电子,还原反应
失电子,氧化反应
阳极:失电子发生氧化反应
2Cl--2e- = Cl2
阴极:得电子发生还原反应
2Na++ 2e- = 2Na
总反应:2NaCl=== 2Na+Cl2↑
电解
对比原电池和电解池,请分析:
1.原电池和电解池在工作原理上有何异同?
2.原电池和电解池在装置构成上有何异同?
异同 原电池 电解池
工作原理 不同
相同
装置构成 不同
相同
自发进行氧化还原反应
化学能转化为电能
使难以发生的氧化还原反应发生
电能转化为化学电能
两电极上分别发生氧化和还原反应
无电源
有直流电源
电极反应物、电极材料、离子导体和电子导体
原电池是通过氧化还原反应将化学能直接转化为电能的装置;电解池是在直流电作用下迫使反应物发生氧化还原反应,从而将电能转化为化学能的装置。
在原电池和电解池的工作过程中,氧化反应和还原反应分别在两极进行。其中,阴极发生还原反应,阳极发生氧化反应。
因此,从铜锌原电池的内电路看,锌极是阳极,铜极是阴极。
在装置构成上,原电池和电解池都需要有电极反应物、电极材料、离子导体和电子导体,只是电解池还需要外接直流电源。
二、电解原理的应用
电解饱和食盐水
按图 1-3-3 所示组装电解装置,电极材料为石墨,离子导体为饱和食盐水。
1.请你分析饱和食盐水中可能存在哪些离子,在电场中它们的移动方向如何,可能发生的电极反应是什么。
2.接通电源,观察电极表面出现的现象。根据已有的化学知识,设法检验两极附近溶液组成的变化并判断气体产物。
3.判断阴极和阳极,写出电极反应和该电解反应的化学方程式。
现象 电极反应
阴极
阳极
电解反应的化学方程式:
_____________________________________________
在饱和食盐水中,Na+和水电离出的H+移向连接电源负极的阴极材料,H-在阴极材料上发生还原反应:
2H + +2e -=======H 2 ↑
C1和水电离出的 OH 移向连接电源正极的阳极材料,C1在阳极材料上发生氧化反应
2Cl--2e-=======Cl2 ↑
水的电离
水是一种极弱的电解质,水分子能电离出极少量的H+和OH-。水的电离过程达到平衡状态时可以表示为:
H2O H++OH-,
当H+或OH-的浓度改变时,该平衡会发生移动。
电解氯化铜溶液的实验
碳棒上有一层红色的物质析出
有气泡,湿润KI-淀 粉试纸变蓝,气体有刺激性气味
Cu2+移向阴极,在阴极得电子发生还原反应
Cl-移向阳极,在阳极失电子发生氧化反应
离子放电顺序
离子在电极表面得到或失去电子的过程通常叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。根据大量的实验事实,人们总结出一些离子的放电顺序。
阴极上,金属阳离子得电子能力越强越先放电。通常,常见阳离子的放电顺序为:
离子的放电顺序
阴极放电顺序(阳离子得电子能力)
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
Al3+~ K+水溶液中不放电,熔融状态放电
阳极放电顺序(阴离子失电子能力)
活性金属电极>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
含氧酸根、 F-在水溶液中不放电
1.用铜做电极,电解H2SO4溶液,分析两极反应现象,写出电极反应式
阳极Cu
Cu 阴极
电极逐渐溶解,溶液逐渐变蓝
氢
气
H2SO4溶液
阳极: Cu - 2e- =Cu2+
阴极: 2H ++ 2e- = H2 ↑
Cu+ H2SO4 H2 ↑ + CuSO4
电解
阳极材料为金属(除铂、金等惰性金属除外)时,通常金属阳极材料优先失去电子。
阳极材料为石墨时,电解质溶液中的阴离子失去电子,阴离子失电子能力越强越先放电。
2.用石墨做电极,电解Na2SO4溶液,分析两极反应现象,写出电极反应式
阳极
阴极
氧气
氢
气
Na2SO4溶液
阳极: 4OH- - 4e- =2H2O+O2 ↑
阴极: 4H ++ 4e- = 2H2 ↑
2H2O 2H2 ↑ + O2 ↑
电解
电解 Na2SO4溶液,实质时电解了水
3.用石墨做电极,电解NaCl溶液,分析两极反应现象,写出电极反应式
阳极
阴极
氯气
氢
气
NaCl溶液
阳极: 2Cl- - 2e- = Cl 2↑
阴极: 2H ++ 2e- =H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
电解NaCl溶液,溶质中阴离子放电,水电离出的氢离子放电。
4.用石墨做电极,电解CuSO4溶液,分析两极反应现象,写出电极反应式
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
阳极
阴极
氧
气
铜
CuSO4溶液
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
电解CuSO4溶液,溶质中阳离子放电,水电离出的氢氧根放电。
阳极
阴极
氧
气
铜
CuSO4溶液
电解规律(惰性电极)
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
电解的原理
电解
电解池
电解池构成
电解的原理
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程过程。
将电能转化为化学能得装置。
直流电源
电极材料
离子导体和电子导体
电极的判断
离子的移动方向
电极反应式
阴阳离子的放电顺序
第二课时
电解原理的应用
1.电解是将直流电通过___________或__________ ,在两个电极上分别发生__________和__________的过程。
2.电解池是将 转化为 的装置。
熔融电解质
电解质溶液
氧化反应
还原反应
电能
化学能
3.电解池中与电源负极相连的电极称为 极,发生 反应。与电源正极相连的电极称为 极,发生 反应。阳离子移向电解池的 极,阴离子移向电解池的 极。
阴
还原
阳
氧化
阴
阳
4.常见阳离子的放电顺序为
。
常见阴离子的放电顺序为_______________________________________________。
Ag+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+
S2->I->Br->Cl->OH->SO42-
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。主要有3种工艺隔膜法,双电解池法,水银电解池法。
我国最早的氯碱工厂是1930年投产的上海天原电化厂(现上海天原化工厂的前身),日产烧碱2t。到1949年解放时,全国只有少数几家氯碱厂,烧碱年产量仅1.5万吨,氯产品只有盐酸、液氯、漂白粉等几种。
活动探究
电解饱和食盐水
1.请你分析饱和食盐水中可能存在哪些离子,在电场中他们的移动方向如何,可能发生的电极反应是什么?
阳离子
阴离子
H+
Na+
Cl-
OH-
移向
阴极
移向
阳极
2H+ +2e- =H2
Na+ +e- =Na
2Cl- -2e- =Cl2
4OH- -4e- =2H2O+O2
可能电极反应
可能电极反应
1.电解食盐水制备烧碱、氢气和氯气
2.接通电源,观察发生电极表面现象。根据已有的化学知识,设法检验两极附近附近溶液组成的变化并判断气体产物。
湿润的KI-淀粉试纸检验阳极产物
酚酞试液检验阴极产物
3.判断阴极和阳极,写出电极反应式和电解反应的化学方程式。
现象 电极反应式
阴极
阳极
电解反应的化学方程式
生成无色气体,
滴加酚酞溶液变红
生成黄绿色气体
2H++2e-= H2↑
2Cl--2e-== Cl2↑
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
通电
===
2H2O+2e-= H2↑+2OH-
1.阴极区溶液中生成的越来越多OH-越来越多,氢氧根移向阳极,会产生什么影响?
Cl2 +2 NaOH =NaCl + NaClO + H2O
2.生成物H2和Cl2混合有什么危险?
混合遇火或强光能反应、爆炸
3.如何阻止OH-越向阳极移动。且不让生成物H2和Cl2混合?
使用离子交换膜将电解池两极区分开
4.工业电解食盐水两电极的产物分别是什么?
阴极产物氢气和烧碱;阳极产物为氯气
工业电解食盐水制备烧碱
离子交换膜(简称离子膜):
高分子膜 ,选择性的使物质通过
阳离子交换膜:
只允许阳离子通过,把电解槽隔成阴极室和阳极室
工业电解食盐水制备烧碱
电解食盐水是氯碱工业的基础。工业电解食盐水制备烧碱时必须阻止 OH 移向阳极,以使 Na+ 和 OH- 在阴极溶液中富集。目前,比较先进的方法是用阳离子交换膜将两极溶液分开。
离子交换膜(简称离子膜)是一类高分子膜,它能选择性地使物质通过。
阳离子能通过阳离子交换膜,而阴离子则不能通过。
在电解食盐水的过程中,Na不断从阳极区进)阴极区,而阴极区不断产生的 OH 只能留在阴极附近的溶液中,因此由阴极附近的溶液可以得到浓度较高的 NaOH 溶液。
阴极产物
阳极产物
阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e -= H2↑
总反应:
2NaCl+2H2O====2NaOH+H2↑+Cl2↑
电解
2.铜的电解精炼
黄铜矿 粗铜 精铜
2.铜的电解精炼
阳极材料:粗铜
(Zn、Fe、Ni、Cu、Ag、Au等)
阴极材料:纯铜
离子导体: CuSO4溶液
铜精炼阳极炉车间
思考:
1.两电极上放电的微粒是什么?写出电极反应式。
2.电解精炼后电解质溶液的浓度如何变化?
阳极: Zn-2e-=Zn2+
Fe - 2e- = Fe2+
Ni-2e-=Ni2+
Cu-2e-=Cu2+
Ag、Au
阴极:Cu2++2e-=Cu
阳极泥
硫酸铜溶液浓度减小
镀金接头 镀锌铁桶
镀金银碗 镀铬货架
3.电镀
定义:利用电解原理在金属表面镀上一薄层其它金属或合金的方法
目的:提高金属的抗腐蚀能力、耐磨性或改善金属制品的外观
铁钉镀铜
实验目的
设计一个电镀装置并实施实验,给铁钉镀铜。
实验用品
铁钉、铜片、石墨棒、CuSO4溶液;
烧杯、导线、电源
设计电镀装置的基本思路
电镀装置包括阴、阳极材料,阴阳极反应物,离子导体和电子导体。与电解相比,电镀具有独特的目的。如何利用电解装置实现电镀呢?在设计电镀装置时,通常需要重点考虑以下两个方面的问题:
方法引导
1.如何使镀层金属或合金沉积在待镀金属(镀件)表面?
镀件做阴极,使镀层金属阳离子在阴极放电析出
2.是否需要补充消耗的镀层物质?如何补充?
用镀层金属做阳极
实验方案设计及实施
设计思路及依据 实验装置 实验现象
确定阴极 阴极材料:
阴极反应物:
确定阳极 阳极材料:
阳极反应物:
构成 闭合回路 离子导体:
电子导体:
铁钉
Cu2+
铜
铜
CuSO4溶液
导线
铜电极逐渐溶解;
铁钉表面覆盖一层红色物质。
1.尝试分析你设计的实验装置的工作原理。
阳极反应:Cu-2e-==Cu2+
阴极反应:Cu2++2e-==Cu
2.为了让镀层很好的附着在镀件上,可以采取哪些措施?
提高镀层表面的洁净和平整程度
电镀液中加入有关助剂
设计电镀装置的基本思路
电镀装置包括阴、阳极材料,阴、阳极反应物,离子导体和电子导体。与电解相比,电镀具有独特的目的。
如何利用电解装置实现电镀呢 在设计电镀装量时,通常需要重点考虑以下两个方面的问题:
1.如何使镀层金属或合金沉积在待镀金属(镀件)表面
2.是否需要补充消耗的镀层物质 如何补充
电镀装置
阳极材料:
镀层金属/惰性电极材料
阴极材料:镀件
电镀液:含有镀层金属阳离子的盐溶液
直流电源
思考:
镀层金属做阳极材料时,电镀液的浓度如何变化?
电镀液浓度基本保持不变
电镀是电解原理的一种重要应用,所用的装置与电解装置相同。
在本实验中,铜盐液作为电镀液,待镀的铁钉作为阴极,铜片作为阳极。
在电镀过程中,电镀液中的 。H + 和 OH -等不参加电极反应,两极上发生的电极反应分别为:
由此例可见,在电镀装置中,镀件用作阴极材料;镀层金属用作阳极材料,利用其化溶解来提供镀层金属,也可以用惰性电极材料做阳极材料,由电镀液提供镀层金属。
电镀液通常采用含有镀层金属离子的盐溶液。镀层能否很好地附着在镀件上,与镀层表面的洁净和平整程度有很大的关系。
电镀时,为了得到均匀、光洁、致密的镀层,往往需要在电镀液中加人有关助剂。
电解工业上还常利用电解法获得钠、镁、氟等元素的单质。除了实现物质转化外,人们还可以利用电解将电能转化为化学能,从而实现能量的储存。
二次电池的充电过程实际上就是通过电解来实现的。以铅蓄电池为例,两极板上的硫酸铅在电流作用下重新转化为铅和二氧化铅,将化学能存储其中。
充电宝、电动汽车等的电池都是利用电解来实现小规模储能的,利用电解原理的大规模储能技术则在电力工业中具有非常重要的应用。
电化学储能技术
在电力工业中,发电、输电、配电、用电必须同时完成,但居民用电量存在着高峰与低谷时段,并呈现出明显的季节性。如果能够将发电厂的电能存储起来,需要时再释放,可以有效地降低成本。目前,液流电池是电化学储能领域的一个研究热点,其优点是储能容量大、使用寿命长。以全钒液流电池为例,酸性溶液中钒通常以 V2+、V3+、VO2+、,等形式存在。
一种简单钒液流电池的结构及工作原理示意图如图 1-3-6 所示,其电解液存储在储液罐中,使用时将电解液分别泵入阴极室和阳极室中。充电时,VO2+在阳极被氧化为, V3+在阴极被还原为V2+
具有较高能量的产物被泵回储液罐,将能量储存起来。放电时,发生相反的过程储液罐中的离子被泵回,在正极室和负极室分别得到或失去电子,释放电能。
由于储液罐和反应场所是分离的,液流电池能够突破传统电池的体积限制,这样就可以将储液罐做得很大以增大储能容量。
以液流电池为代表的电化学储能技术可为可再生能源发电提供有力的支持,缓冲昼夜、季节的用电变化对电网的影响。2022年10月,首个国家级大型化学储能项目——辽宁大连液流电池储能调峰电站一期工程正式并网发电。
1.写出下列电解池中各部分的作用并分析其工作原理;再写出电极反应与总反应的化学方程式。
锌作阳极,镀件作阴极,电镀液用含有锌离子的盐溶液
电镀车间
电解
2NaCl (熔融) == 2Na + Cl2↑
MgCl2 (熔融) == Mg + Cl2↑
电解
2Al2O3 (熔融) === 4Al + 3O2↑
电解
冰晶石
金属Na
PbSO4(s)+2e-====Pb(s)+SO42-(aq)
还原反应
阴极:
阳极:
PbSO4(s)+2H2O(l)-2e-====PbO2(s)+4H+(aq)+SO42-(aq)
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4(s)+2H2O(l)==== Pb(s)+PbO2(s)+2H2SO4(aq)
二次电池充电
钠、镁、氟等活泼金属或非金属单质
钠、镁、氟等活泼金属或非金属单质
金属的提纯
制备烧碱、氢气和氯气
电能转化为化学能——电解
第一课时
电解的原理
金属钠与氯气在常温下就可以发生氧化还原反应生成氯化钠,同时放出大量的热:
2Na(s)+Cl2(g) =2NaCl(s)
△H=-822.3kJ·mol-1
反之,若以氯化钠为原料制备金属钠,则需要从外界获得能量(如电能)。
在生产实践中,人们是如何利用电能,以氯化钠为原料制取金属钠的呢?
电能与化学能之间的相互转化具有重要的实用价值。通过将电能转化为化学能,可以使许多在通常条件下不能发生的反应得以进行,这对于化工生产、金属冶炼、实验室研究以及人们的日常生活都具有十分重要的意义。
电解是将电能转化为化学能的过程。
工业冶炼金属钠的原理
电解:将电能转化为化学能的过程
2NaCl(熔融 ) ===2Na+Cl2↑
通电
电解意义:
使许多在通常条件下不能发生的反应得以进行
电解的原理
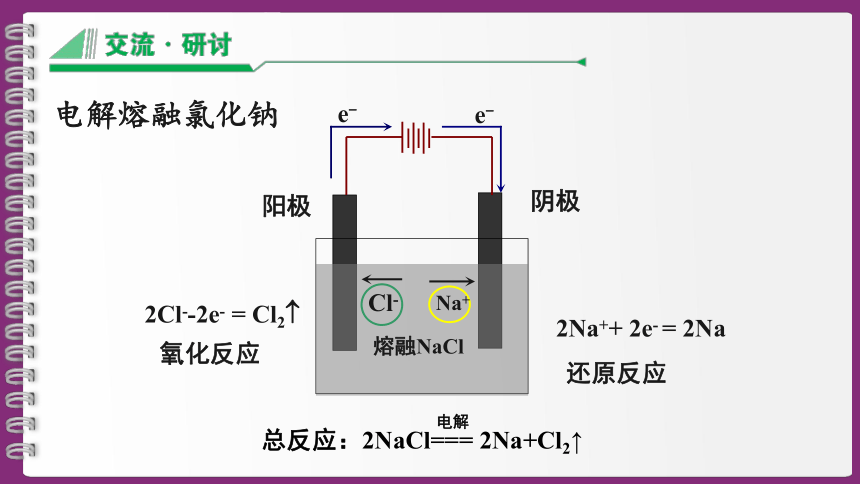
图1—3—2为工业上利用电解熔融氯化钠的方法生产金属钠所用装置的示意图。容器中盛有熔融氯化钠,两侧分别插入石墨片和铁片作为电 极材料,两个电极分别与电源的正极和负极相连。
讨论:
1.接通直流电源后,熔融氯化钠中的Na+和Cl-各向哪个方向移动?
2.移动到两个电极表面的将分别发生什么变化?
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl--2e- = Cl2
2Na++ 2e- = 2Na
氧化反应
还原反应
总反应:2NaCl=== 2Na+Cl2↑
电解
电解熔融氯化钠
1.电解
2.电解池
3.电解池构成
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程过程。
将电能转化为化学能得装置。
直流电源
固体电极材料
电解质溶液或熔融电解质
阳极
阴极
发生氧化反应
发生还原反应
电
源
负极
正极
阴极
阳极
电子流出
电子流入
离
子
导
体
阳离子
阴离子
电
极
移向
移向
得电子,还原反应
失电子,氧化反应
阳极:失电子发生氧化反应
2Cl--2e- = Cl2
阴极:得电子发生还原反应
2Na++ 2e- = 2Na
总反应:2NaCl=== 2Na+Cl2↑
电解
对比原电池和电解池,请分析:
1.原电池和电解池在工作原理上有何异同?
2.原电池和电解池在装置构成上有何异同?
异同 原电池 电解池
工作原理 不同
相同
装置构成 不同
相同
自发进行氧化还原反应
化学能转化为电能
使难以发生的氧化还原反应发生
电能转化为化学电能
两电极上分别发生氧化和还原反应
无电源
有直流电源
电极反应物、电极材料、离子导体和电子导体
原电池是通过氧化还原反应将化学能直接转化为电能的装置;电解池是在直流电作用下迫使反应物发生氧化还原反应,从而将电能转化为化学能的装置。
在原电池和电解池的工作过程中,氧化反应和还原反应分别在两极进行。其中,阴极发生还原反应,阳极发生氧化反应。
因此,从铜锌原电池的内电路看,锌极是阳极,铜极是阴极。
在装置构成上,原电池和电解池都需要有电极反应物、电极材料、离子导体和电子导体,只是电解池还需要外接直流电源。
二、电解原理的应用
电解饱和食盐水
按图 1-3-3 所示组装电解装置,电极材料为石墨,离子导体为饱和食盐水。
1.请你分析饱和食盐水中可能存在哪些离子,在电场中它们的移动方向如何,可能发生的电极反应是什么。
2.接通电源,观察电极表面出现的现象。根据已有的化学知识,设法检验两极附近溶液组成的变化并判断气体产物。
3.判断阴极和阳极,写出电极反应和该电解反应的化学方程式。
现象 电极反应
阴极
阳极
电解反应的化学方程式:
_____________________________________________
在饱和食盐水中,Na+和水电离出的H+移向连接电源负极的阴极材料,H-在阴极材料上发生还原反应:
2H + +2e -=======H 2 ↑
C1和水电离出的 OH 移向连接电源正极的阳极材料,C1在阳极材料上发生氧化反应
2Cl--2e-=======Cl2 ↑
水的电离
水是一种极弱的电解质,水分子能电离出极少量的H+和OH-。水的电离过程达到平衡状态时可以表示为:
H2O H++OH-,
当H+或OH-的浓度改变时,该平衡会发生移动。
电解氯化铜溶液的实验
碳棒上有一层红色的物质析出
有气泡,湿润KI-淀 粉试纸变蓝,气体有刺激性气味
Cu2+移向阴极,在阴极得电子发生还原反应
Cl-移向阳极,在阳极失电子发生氧化反应
离子放电顺序
离子在电极表面得到或失去电子的过程通常叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。根据大量的实验事实,人们总结出一些离子的放电顺序。
阴极上,金属阳离子得电子能力越强越先放电。通常,常见阳离子的放电顺序为:
离子的放电顺序
阴极放电顺序(阳离子得电子能力)
Ag+>Hg2+> Fe3+> Cu2+>H+(浓度大)>Pb2+>Sn2+>Fe2+>Zn2+>H+(浓度小) >Al3+>Mg2+>Na+ >Ca2+>K+
Al3+~ K+水溶液中不放电,熔融状态放电
阳极放电顺序(阴离子失电子能力)
活性金属电极>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
含氧酸根、 F-在水溶液中不放电
1.用铜做电极,电解H2SO4溶液,分析两极反应现象,写出电极反应式
阳极Cu
Cu 阴极
电极逐渐溶解,溶液逐渐变蓝
氢
气
H2SO4溶液
阳极: Cu - 2e- =Cu2+
阴极: 2H ++ 2e- = H2 ↑
Cu+ H2SO4 H2 ↑ + CuSO4
电解
阳极材料为金属(除铂、金等惰性金属除外)时,通常金属阳极材料优先失去电子。
阳极材料为石墨时,电解质溶液中的阴离子失去电子,阴离子失电子能力越强越先放电。
2.用石墨做电极,电解Na2SO4溶液,分析两极反应现象,写出电极反应式
阳极
阴极
氧气
氢
气
Na2SO4溶液
阳极: 4OH- - 4e- =2H2O+O2 ↑
阴极: 4H ++ 4e- = 2H2 ↑
2H2O 2H2 ↑ + O2 ↑
电解
电解 Na2SO4溶液,实质时电解了水
3.用石墨做电极,电解NaCl溶液,分析两极反应现象,写出电极反应式
阳极
阴极
氯气
氢
气
NaCl溶液
阳极: 2Cl- - 2e- = Cl 2↑
阴极: 2H ++ 2e- =H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑
电解
电解NaCl溶液,溶质中阴离子放电,水电离出的氢离子放电。
4.用石墨做电极,电解CuSO4溶液,分析两极反应现象,写出电极反应式
阳极: 4OH- - 4e- = 2H2O+O2 ↑
阴极:Cu2++ 2e- = Cu
阳极
阴极
氧
气
铜
CuSO4溶液
2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4
电解
电解CuSO4溶液,溶质中阳离子放电,水电离出的氢氧根放电。
阳极
阴极
氧
气
铜
CuSO4溶液
电解规律(惰性电极)
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅱ
Ⅲ
Ⅳ
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+
Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH
电解的原理
电解
电解池
电解池构成
电解的原理
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程过程。
将电能转化为化学能得装置。
直流电源
电极材料
离子导体和电子导体
电极的判断
离子的移动方向
电极反应式
阴阳离子的放电顺序
第二课时
电解原理的应用
1.电解是将直流电通过___________或__________ ,在两个电极上分别发生__________和__________的过程。
2.电解池是将 转化为 的装置。
熔融电解质
电解质溶液
氧化反应
还原反应
电能
化学能
3.电解池中与电源负极相连的电极称为 极,发生 反应。与电源正极相连的电极称为 极,发生 反应。阳离子移向电解池的 极,阴离子移向电解池的 极。
阴
还原
阳
氧化
阴
阳
4.常见阳离子的放电顺序为
。
常见阴离子的放电顺序为_______________________________________________。
Ag+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+
S2->I->Br->Cl->OH->SO42-
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。主要有3种工艺隔膜法,双电解池法,水银电解池法。
我国最早的氯碱工厂是1930年投产的上海天原电化厂(现上海天原化工厂的前身),日产烧碱2t。到1949年解放时,全国只有少数几家氯碱厂,烧碱年产量仅1.5万吨,氯产品只有盐酸、液氯、漂白粉等几种。
活动探究
电解饱和食盐水
1.请你分析饱和食盐水中可能存在哪些离子,在电场中他们的移动方向如何,可能发生的电极反应是什么?
阳离子
阴离子
H+
Na+
Cl-
OH-
移向
阴极
移向
阳极
2H+ +2e- =H2
Na+ +e- =Na
2Cl- -2e- =Cl2
4OH- -4e- =2H2O+O2
可能电极反应
可能电极反应
1.电解食盐水制备烧碱、氢气和氯气
2.接通电源,观察发生电极表面现象。根据已有的化学知识,设法检验两极附近附近溶液组成的变化并判断气体产物。
湿润的KI-淀粉试纸检验阳极产物
酚酞试液检验阴极产物
3.判断阴极和阳极,写出电极反应式和电解反应的化学方程式。
现象 电极反应式
阴极
阳极
电解反应的化学方程式
生成无色气体,
滴加酚酞溶液变红
生成黄绿色气体
2H++2e-= H2↑
2Cl--2e-== Cl2↑
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
通电
===
2H2O+2e-= H2↑+2OH-
1.阴极区溶液中生成的越来越多OH-越来越多,氢氧根移向阳极,会产生什么影响?
Cl2 +2 NaOH =NaCl + NaClO + H2O
2.生成物H2和Cl2混合有什么危险?
混合遇火或强光能反应、爆炸
3.如何阻止OH-越向阳极移动。且不让生成物H2和Cl2混合?
使用离子交换膜将电解池两极区分开
4.工业电解食盐水两电极的产物分别是什么?
阴极产物氢气和烧碱;阳极产物为氯气
工业电解食盐水制备烧碱
离子交换膜(简称离子膜):
高分子膜 ,选择性的使物质通过
阳离子交换膜:
只允许阳离子通过,把电解槽隔成阴极室和阳极室
工业电解食盐水制备烧碱
电解食盐水是氯碱工业的基础。工业电解食盐水制备烧碱时必须阻止 OH 移向阳极,以使 Na+ 和 OH- 在阴极溶液中富集。目前,比较先进的方法是用阳离子交换膜将两极溶液分开。
离子交换膜(简称离子膜)是一类高分子膜,它能选择性地使物质通过。
阳离子能通过阳离子交换膜,而阴离子则不能通过。
在电解食盐水的过程中,Na不断从阳极区进)阴极区,而阴极区不断产生的 OH 只能留在阴极附近的溶液中,因此由阴极附近的溶液可以得到浓度较高的 NaOH 溶液。
阴极产物
阳极产物
阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e -= H2↑
总反应:
2NaCl+2H2O====2NaOH+H2↑+Cl2↑
电解
2.铜的电解精炼
黄铜矿 粗铜 精铜
2.铜的电解精炼
阳极材料:粗铜
(Zn、Fe、Ni、Cu、Ag、Au等)
阴极材料:纯铜
离子导体: CuSO4溶液
铜精炼阳极炉车间
思考:
1.两电极上放电的微粒是什么?写出电极反应式。
2.电解精炼后电解质溶液的浓度如何变化?
阳极: Zn-2e-=Zn2+
Fe - 2e- = Fe2+
Ni-2e-=Ni2+
Cu-2e-=Cu2+
Ag、Au
阴极:Cu2++2e-=Cu
阳极泥
硫酸铜溶液浓度减小
镀金接头 镀锌铁桶
镀金银碗 镀铬货架
3.电镀
定义:利用电解原理在金属表面镀上一薄层其它金属或合金的方法
目的:提高金属的抗腐蚀能力、耐磨性或改善金属制品的外观
铁钉镀铜
实验目的
设计一个电镀装置并实施实验,给铁钉镀铜。
实验用品
铁钉、铜片、石墨棒、CuSO4溶液;
烧杯、导线、电源
设计电镀装置的基本思路
电镀装置包括阴、阳极材料,阴阳极反应物,离子导体和电子导体。与电解相比,电镀具有独特的目的。如何利用电解装置实现电镀呢?在设计电镀装置时,通常需要重点考虑以下两个方面的问题:
方法引导
1.如何使镀层金属或合金沉积在待镀金属(镀件)表面?
镀件做阴极,使镀层金属阳离子在阴极放电析出
2.是否需要补充消耗的镀层物质?如何补充?
用镀层金属做阳极
实验方案设计及实施
设计思路及依据 实验装置 实验现象
确定阴极 阴极材料:
阴极反应物:
确定阳极 阳极材料:
阳极反应物:
构成 闭合回路 离子导体:
电子导体:
铁钉
Cu2+
铜
铜
CuSO4溶液
导线
铜电极逐渐溶解;
铁钉表面覆盖一层红色物质。
1.尝试分析你设计的实验装置的工作原理。
阳极反应:Cu-2e-==Cu2+
阴极反应:Cu2++2e-==Cu
2.为了让镀层很好的附着在镀件上,可以采取哪些措施?
提高镀层表面的洁净和平整程度
电镀液中加入有关助剂
设计电镀装置的基本思路
电镀装置包括阴、阳极材料,阴、阳极反应物,离子导体和电子导体。与电解相比,电镀具有独特的目的。
如何利用电解装置实现电镀呢 在设计电镀装量时,通常需要重点考虑以下两个方面的问题:
1.如何使镀层金属或合金沉积在待镀金属(镀件)表面
2.是否需要补充消耗的镀层物质 如何补充
电镀装置
阳极材料:
镀层金属/惰性电极材料
阴极材料:镀件
电镀液:含有镀层金属阳离子的盐溶液
直流电源
思考:
镀层金属做阳极材料时,电镀液的浓度如何变化?
电镀液浓度基本保持不变
电镀是电解原理的一种重要应用,所用的装置与电解装置相同。
在本实验中,铜盐液作为电镀液,待镀的铁钉作为阴极,铜片作为阳极。
在电镀过程中,电镀液中的 。H + 和 OH -等不参加电极反应,两极上发生的电极反应分别为:
由此例可见,在电镀装置中,镀件用作阴极材料;镀层金属用作阳极材料,利用其化溶解来提供镀层金属,也可以用惰性电极材料做阳极材料,由电镀液提供镀层金属。
电镀液通常采用含有镀层金属离子的盐溶液。镀层能否很好地附着在镀件上,与镀层表面的洁净和平整程度有很大的关系。
电镀时,为了得到均匀、光洁、致密的镀层,往往需要在电镀液中加人有关助剂。
电解工业上还常利用电解法获得钠、镁、氟等元素的单质。除了实现物质转化外,人们还可以利用电解将电能转化为化学能,从而实现能量的储存。
二次电池的充电过程实际上就是通过电解来实现的。以铅蓄电池为例,两极板上的硫酸铅在电流作用下重新转化为铅和二氧化铅,将化学能存储其中。
充电宝、电动汽车等的电池都是利用电解来实现小规模储能的,利用电解原理的大规模储能技术则在电力工业中具有非常重要的应用。
电化学储能技术
在电力工业中,发电、输电、配电、用电必须同时完成,但居民用电量存在着高峰与低谷时段,并呈现出明显的季节性。如果能够将发电厂的电能存储起来,需要时再释放,可以有效地降低成本。目前,液流电池是电化学储能领域的一个研究热点,其优点是储能容量大、使用寿命长。以全钒液流电池为例,酸性溶液中钒通常以 V2+、V3+、VO2+、,等形式存在。
一种简单钒液流电池的结构及工作原理示意图如图 1-3-6 所示,其电解液存储在储液罐中,使用时将电解液分别泵入阴极室和阳极室中。充电时,VO2+在阳极被氧化为, V3+在阴极被还原为V2+
具有较高能量的产物被泵回储液罐,将能量储存起来。放电时,发生相反的过程储液罐中的离子被泵回,在正极室和负极室分别得到或失去电子,释放电能。
由于储液罐和反应场所是分离的,液流电池能够突破传统电池的体积限制,这样就可以将储液罐做得很大以增大储能容量。
以液流电池为代表的电化学储能技术可为可再生能源发电提供有力的支持,缓冲昼夜、季节的用电变化对电网的影响。2022年10月,首个国家级大型化学储能项目——辽宁大连液流电池储能调峰电站一期工程正式并网发电。
1.写出下列电解池中各部分的作用并分析其工作原理;再写出电极反应与总反应的化学方程式。
锌作阳极,镀件作阴极,电镀液用含有锌离子的盐溶液
电镀车间
电解
2NaCl (熔融) == 2Na + Cl2↑
MgCl2 (熔融) == Mg + Cl2↑
电解
2Al2O3 (熔融) === 4Al + 3O2↑
电解
冰晶石
金属Na
PbSO4(s)+2e-====Pb(s)+SO42-(aq)
还原反应
阴极:
阳极:
PbSO4(s)+2H2O(l)-2e-====PbO2(s)+4H+(aq)+SO42-(aq)
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4(s)+2H2O(l)==== Pb(s)+PbO2(s)+2H2SO4(aq)
二次电池充电
钠、镁、氟等活泼金属或非金属单质
钠、镁、氟等活泼金属或非金属单质
金属的提纯
制备烧碱、氢气和氯气
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
