3.1 水与水溶液(共62张PPT)
文档属性
| 名称 | 3.1 水与水溶液(共62张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 00:00:00 | ||
图片预览










文档简介
(共62张PPT)
水与水溶液
第一课时
水的电离 电解质在水溶液中的存在形态
1.电解质:__________ 或__________能导电的_______ 。
非电解质:__________和_________均不能导电的_____________。
2.如何判断如何判断一种物质是电解质还是非电解质?
电解质:酸、碱、盐、活泼金属氧化物。
非电解质:多数有机物,非金属氧化物、部分氢化物
知识回顾
溶于水
熔融状态
溶于水
熔融状态
化合物
化合物
通过化学必修课程的学习,你已知道电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗 为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会怎样
经过多次纯化处理的水仍具有导电性的原因是什么?
(1)水是一种极弱的电解质,能微弱电离,存在电离平衡
(2)水的离子积——Kw
Kw=C平(H+)×C平(OH-)
一.水的电离
H2O
H++OH-
一定温度下,水电离出的H+和OH-浓度的乘积为一定值,称为水的离子积常数(Kw),简称水的离子积。
思考:根据化学平衡原理,水的离子积会受什么外界条件影响?
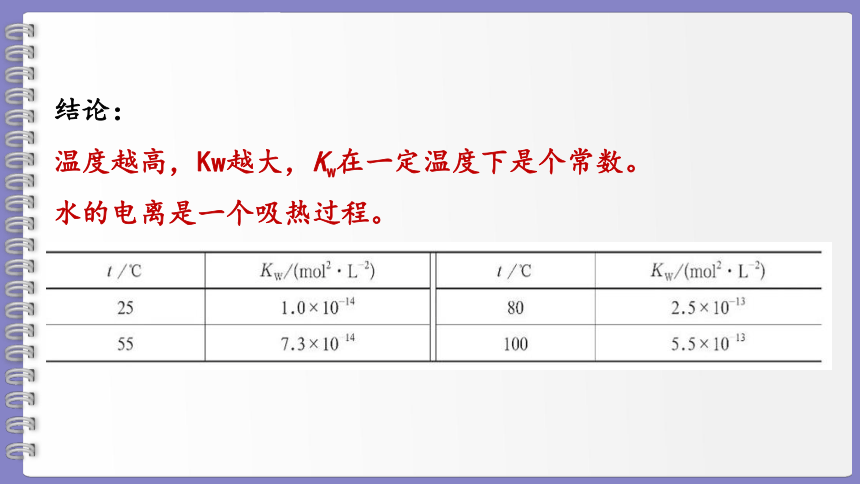
不同温度下水的离子积常数
结论:
温度越高,Kw越大,Kw在一定温度下是个常数。
水的电离是一个吸热过程。
①Kw是温度函数,一定温度下Kw是一个常数。25℃时,Kw=10-14
②Kw只随温度的升高而增大,与C(H+) 、 C(OH-)无关。
③Kw适用于一定温度下任何稀的电解质溶液。
④在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
注意:
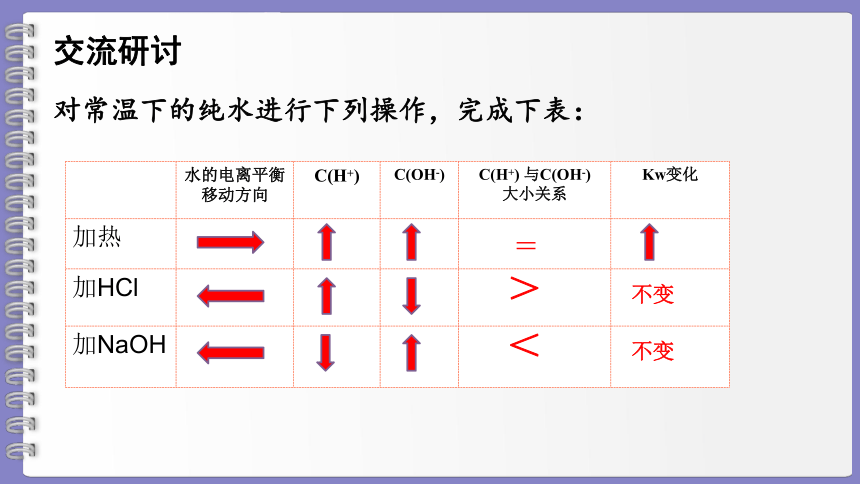
对常温下的纯水进行下列操作,完成下表:
交流研讨
水的电离平衡移动方向 C(H+) C(OH-) C(H+) 与C(OH-) 大小关系 Kw变化
加热
加HCl
加NaOH
>
=
<
不变
不变
影响水电离平衡的因素
①升高温度,促进水的电离。
②加入酸
增大C(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则C(OH-)必然会减小。
归纳总结
③加入碱
增大C(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则C(OH-)必然会减小。
判断下列说法是否正确:
①水的离子积常数Kw=10-14
②温度升高,纯水中的c平(H+)增大,c平(OH-)减小
③水的电离程度很小,纯水中主要存在形态是水分子
④在纯水中加入少量硫酸铵,可促进水的电离,使水的离子积增大
⑤不管是纯水还是在酸、碱、盐溶液中,水电离产生的C平(H+)和C平(OH-)始终相等。
由Kw的数值很小可知,水的电离程度很小,其主要存在形态是水分子,因此纯水的导电能力很弱。加入电解质后导电能力增强,不同的电解质其导电能力是否相同?影响溶液导电性因素是什么?
溶液导电性
自由移动离子浓度大小
离子所带电荷
电解质溶液的导电能力一样吗
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力增强。请通过实验判断下列溶液的导电能力是否相同。
实验:
在四个烧杯中分别盛有等体积、等浓度(0.5mol·L-1)的盐酸、氨水、CH3COOH溶液、NaCI溶液,按图3-1-1所示装置连接仪器,接通电源,注意观察灯泡的亮度。
CH3COOH溶液
盐酸
氨水
NaCl溶液
实验现象:在体积和浓度相同的条件下,盐酸、NaCl 溶液的灯泡亮度比CH3COOH溶液、氨水的亮。
实验结论:在体积和浓度相同的条件下,盐酸、NaCl 溶液的导电能力比CH3COOH溶液、氨水的强。
1.电解质溶液导电的本质是什么?
溶液中存在能够自由移动的离子
2.实验中各水溶液导电能力不同的原因是什么?
溶液中离子浓度不同,离子浓度越高导电能力就越强
3.氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种状态存在?
均发生了电离,氯化氢以离子形式存在,醋酸主要以分子形式存在,少量以离子形式存在
在稀的水溶液中能完全电离的电解质称为强电解质
书写强电解质的电离方程式时常用符号“==========”
氯化氢和氯化钠的电离方程式分别为:
这种在溶于水时部分电离的电解质称为弱电解质
水是极弱的电解质。弱电解质溶液中存在着电离平衡。
CH3COOH分子、H+、CH3COO-
H+、Cl-
常见强酸:
常见强碱:
常见弱酸:
常见弱碱:
HCl、HNO3、H2SO4、HClO4、HBr、HI
NaOH、KOH、Ca(OH)2、Ba(OH)2
H2CO3、HClO、H2SO3、CHCOOH、HF、H2S
NH3·H2O、Cu(OH)2、Fe(OH)3等
1.强电解质溶液的导电性一定比弱电解质溶液的导电性强吗?
电解质的强弱与导电能力没有直接关系;
2.易溶的电解质都是强电解质,难溶的电解质都是弱电解质,对吗?
电解质的强弱与物质的溶解性也没有关系。
下列物质中:①CO2 ②HCl ③NH3 ④HClO
⑤Cu ⑥NaOH ⑦NH3·H2O
⑧NaHCO3 ⑨Cu(OH)2 ⑩BaSO4
属于强电解质的是 ;
属于弱电解质的是 。
②⑥⑧⑩
④⑦⑨
强电解质:完全电离 用“==”
弱电解质:不完全电离用“ ”
2.电离方程式的书写
HCl=H++Cl-
NaCI=Na++CI-
CH3COOH H++CH3COO-
NH3 H2O NH4++OH-
写出下列物质在水中的电离方程式
①Cu(OH)2 ____________________________
②Ca(OH)2 _____________________________
③HClO______________________________
④H2SO4 _______________________________
Cu(OH)2 Cu2++2OH-
Ca(OH)2 =Ca2++2OH-
HClO H++ClO-
H2SO4 =2H++SO42-
⑤NaHSO4 ____________________________
⑥NaHCO3 ____________________________
特别提醒:
在写电离方程式时强酸的酸式盐能电离出氢离子,弱酸的酸式盐不能电离出氢离子。
NaHSO4 =Na+ +H++SO42-
NaHCO3 = Na+ + HCO3-
溶剂化作用
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合分子”或“水合离子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫作溶剂化作用。
视野拓展
1.水的电离
H2O
H++OH-
Kw=C平(H+)×C平(OH-)
温度、加酸、加碱
课堂小结
2.电解质在水溶液中存在形态
完全电离
强酸、强碱、绝大多数盐
部分电离
弱酸、弱碱、水
=
水溶液的酸碱性与PH
知识回顾
1.水的电离方程式______________________________________。
2.水的离子积Kw= 。25℃Kw= 。
1.0×10-14mol2·L-2
C平(H+) C平(OH-)
H2O
H++OH-
3.纯水升高温度,
C(H+) ,C(OH-) ,Kw= 。
加酸C(H+) ,C(OH-) ,Kw= 。
加碱C(H+) ,C(OH-) ,Kw= 。
增大
增大
增大
不变
不变
增大
减小
减小
增大
由于水的电离,在水溶液中始终存在着H+和OH-,而且稀水溶液中C平(H+)和C平(OH-)的乘积也等于水的离子积。那么,水溶液中H+、OH-的浓度与溶液的酸碱性有什么关系呢 水溶液的酸碱度又如何量度呢
利用水的离子积可以计算溶液中H+或OH-的浓度的浓度。例如,室温下测得某酸溶液中的C平(H+)为1.0×10-5mol·L-1,根据
Kw=C平(H+) C平(OH-)=1.0×10-14mol2·L-2
可得该酸溶液中的C平(OH-)为∶
C平(OH-)=
Kw
C平(H+)
=
1.0×10-14mol2·L-2
1.0×10-5mol·L-1
=
1.0×10-9mol·L-1
1.下表列出了室温下一些溶液的C平(H+)或C平(OH-),请填上空缺的数据。
化合物 C/(mol/L) C平(H+)/(mol/L) C平(OH-)/(mol/L)
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
2.由表中的数据能找出什么规律
在酸性溶液中也存在着OH-,只是H+的浓度比OH-的浓度大;在碱性溶液中也存在着H+,只是OH-的浓度比H+的浓度大。
水溶液的酸碱性与C平(H+)和C平(OH-)的相对大小的关系为∶
C平(H+)>C平(OH-)
C平(H+)=C平(OH-)
C平(H+)1.水溶液的酸碱性
溶液呈碱性,且C平(OH-)越大碱性越强
溶液呈酸性,且C平(H+)越大酸性越强
溶液呈中性
1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
■加酸后Kw =1×10-14
酸溶液中Kw =c(H+)酸 · c(OH-)水
■加碱后Kw =1×10-14
碱溶液中Kw =c(OH-)碱·c(H+)水
迁移应用
=c(H+)水
=c(OH-)水
① 任何水溶液中H+和OH-总是同时存在的,只是相对含量不同.
②Kw适用于一定温度下任何稀的电解质溶液。常温下,任何稀的水溶液中,Kw=C平(H+)×C平(OH-)=1×10-14
归纳总结
③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)
酸性溶液一般可忽略水电离出的C(H+),碱性溶液可忽略水电离出的C(OH-)。
④根据Kw=C平(H+)×C平(OH-) 在特定温度下为定值,C平(H+) 和C平(OH-) 可以互求.
(1)可以用C平(H+)或C平(OH-)的大小表示溶液的酸碱度
2.溶液酸碱度的表示方法
C平(H+)越大酸性越强
C平(OH-)越大碱性越强
(2)可以用pH大小表示溶液的酸碱度
pH与溶液中H+浓度的关系?
pH=-lgC平(H+)
pH越大,C平(H+)越小,碱性越强
已知:KW100℃=10-12
1.在100 ℃ 时,纯水中c(H+)为多少?
2.c(H+) >1×10—7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
3.100℃纯水的PH为多少?
4.PH=7的溶液是否一定是中性溶液?
交流研讨
10-6
不能,纯水呈中性
6
不一定,100℃纯水PH6为中性,PH等7为碱性。
溶液酸碱性本质上取决于C平(H+)和C平(OH-)相对大小,因此不能用 c(H+)等于多少来判断溶液酸、碱性,也不能根据pH大小来判断溶液的酸碱性。
特别说明:
25 ℃ 时,中性溶液的C平(H+)=10-7,PH=7。
室温下,溶液酸碱性与C平(H+)和PH关系
归纳总结
c(H+)与c(OH-)的相对大小 c(H+)的范围(25 ℃ ) pH的范围(25 ℃)
中性溶液 c(OH-)c(H+) c(H+) =1.0×10-7 mol·L-1 PH=7
酸性溶液 c(OH-)c(H+) c(H+) >1.0×10-7 mol·L-1 PH<7
碱性溶液 c(OH-)c(H+) c(H+) <1.0×10-7 mol·L-1 PH>7
【例】室温条件下,测得强碱NaOH溶液的浓度为1.0×10-3mol·L-1,计算该溶液的PH。
解:NaOH=== Na+ + OH-
C/mol·L-1 1.0×10-3 1.0×10-3
因为 KW=C平(H+) C平(OH-)
所以 C平(H+)=
PH=-lgC平(H+)=
KW
C平(OH-)
1.0×10-14
1.0×10-3
=
=11.0
KW
C平(OH-)
答:该溶液的PH为11.0 。
某温度下纯水的pH=6。请据此回答下列问题:
(1)pH=7的溶液呈_________(填“酸性”“中性”或“碱性”)。
(2)该温度下0.1 mol·L-1的盐酸的pH=________。
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=________。
碱性
1
11
3.溶液酸碱度的测定方法
(1)酸碱指示剂:估计溶液的pH范围
(2)广泛pH试纸:测量出溶液的整数pH
(3)pH计(酸度计):精确测定溶液pH
思考交流
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
(1)酸碱指示剂:估计溶液的pH范围
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
使用方法:
用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
(2)广泛pH试纸:测量出溶液的整数pH
注意:
①试纸不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
(3) pH计(酸度计):精确测定溶液pH
溶液的
酸碱性
根本依据
常用依据
测定方法
酸性
中性
碱性
C平(H+)>C平(OH-)
C平(H+)=C平(OH-)
C平(H+)25 ℃
C平(H+)
>10-7 酸性
=10-7 中性
<10-7 碱性
pH
>7 碱性
=7 中性
<7 酸性
酸碱指示剂
pH试纸
pH计
课堂小结
水与水溶液
第一课时
水的电离 电解质在水溶液中的存在形态
1.电解质:__________ 或__________能导电的_______ 。
非电解质:__________和_________均不能导电的_____________。
2.如何判断如何判断一种物质是电解质还是非电解质?
电解质:酸、碱、盐、活泼金属氧化物。
非电解质:多数有机物,非金属氧化物、部分氢化物
知识回顾
溶于水
熔融状态
溶于水
熔融状态
化合物
化合物
通过化学必修课程的学习,你已知道电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗 为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会怎样
经过多次纯化处理的水仍具有导电性的原因是什么?
(1)水是一种极弱的电解质,能微弱电离,存在电离平衡
(2)水的离子积——Kw
Kw=C平(H+)×C平(OH-)
一.水的电离
H2O
H++OH-
一定温度下,水电离出的H+和OH-浓度的乘积为一定值,称为水的离子积常数(Kw),简称水的离子积。
思考:根据化学平衡原理,水的离子积会受什么外界条件影响?
不同温度下水的离子积常数
结论:
温度越高,Kw越大,Kw在一定温度下是个常数。
水的电离是一个吸热过程。
①Kw是温度函数,一定温度下Kw是一个常数。25℃时,Kw=10-14
②Kw只随温度的升高而增大,与C(H+) 、 C(OH-)无关。
③Kw适用于一定温度下任何稀的电解质溶液。
④在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
注意:
对常温下的纯水进行下列操作,完成下表:
交流研讨
水的电离平衡移动方向 C(H+) C(OH-) C(H+) 与C(OH-) 大小关系 Kw变化
加热
加HCl
加NaOH
>
=
<
不变
不变
影响水电离平衡的因素
①升高温度,促进水的电离。
②加入酸
增大C(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则C(OH-)必然会减小。
归纳总结
③加入碱
增大C(H+),则平衡向左移动,水的电离被抑制,由于水的电离平衡仍然存在,Kw不变,则C(OH-)必然会减小。
判断下列说法是否正确:
①水的离子积常数Kw=10-14
②温度升高,纯水中的c平(H+)增大,c平(OH-)减小
③水的电离程度很小,纯水中主要存在形态是水分子
④在纯水中加入少量硫酸铵,可促进水的电离,使水的离子积增大
⑤不管是纯水还是在酸、碱、盐溶液中,水电离产生的C平(H+)和C平(OH-)始终相等。
由Kw的数值很小可知,水的电离程度很小,其主要存在形态是水分子,因此纯水的导电能力很弱。加入电解质后导电能力增强,不同的电解质其导电能力是否相同?影响溶液导电性因素是什么?
溶液导电性
自由移动离子浓度大小
离子所带电荷
电解质溶液的导电能力一样吗
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力增强。请通过实验判断下列溶液的导电能力是否相同。
实验:
在四个烧杯中分别盛有等体积、等浓度(0.5mol·L-1)的盐酸、氨水、CH3COOH溶液、NaCI溶液,按图3-1-1所示装置连接仪器,接通电源,注意观察灯泡的亮度。
CH3COOH溶液
盐酸
氨水
NaCl溶液
实验现象:在体积和浓度相同的条件下,盐酸、NaCl 溶液的灯泡亮度比CH3COOH溶液、氨水的亮。
实验结论:在体积和浓度相同的条件下,盐酸、NaCl 溶液的导电能力比CH3COOH溶液、氨水的强。
1.电解质溶液导电的本质是什么?
溶液中存在能够自由移动的离子
2.实验中各水溶液导电能力不同的原因是什么?
溶液中离子浓度不同,离子浓度越高导电能力就越强
3.氯化氢、醋酸等电解质在溶于水的过程中发生了哪些变化?它们最终以何种状态存在?
均发生了电离,氯化氢以离子形式存在,醋酸主要以分子形式存在,少量以离子形式存在
在稀的水溶液中能完全电离的电解质称为强电解质
书写强电解质的电离方程式时常用符号“==========”
氯化氢和氯化钠的电离方程式分别为:
这种在溶于水时部分电离的电解质称为弱电解质
水是极弱的电解质。弱电解质溶液中存在着电离平衡。
CH3COOH分子、H+、CH3COO-
H+、Cl-
常见强酸:
常见强碱:
常见弱酸:
常见弱碱:
HCl、HNO3、H2SO4、HClO4、HBr、HI
NaOH、KOH、Ca(OH)2、Ba(OH)2
H2CO3、HClO、H2SO3、CHCOOH、HF、H2S
NH3·H2O、Cu(OH)2、Fe(OH)3等
1.强电解质溶液的导电性一定比弱电解质溶液的导电性强吗?
电解质的强弱与导电能力没有直接关系;
2.易溶的电解质都是强电解质,难溶的电解质都是弱电解质,对吗?
电解质的强弱与物质的溶解性也没有关系。
下列物质中:①CO2 ②HCl ③NH3 ④HClO
⑤Cu ⑥NaOH ⑦NH3·H2O
⑧NaHCO3 ⑨Cu(OH)2 ⑩BaSO4
属于强电解质的是 ;
属于弱电解质的是 。
②⑥⑧⑩
④⑦⑨
强电解质:完全电离 用“==”
弱电解质:不完全电离用“ ”
2.电离方程式的书写
HCl=H++Cl-
NaCI=Na++CI-
CH3COOH H++CH3COO-
NH3 H2O NH4++OH-
写出下列物质在水中的电离方程式
①Cu(OH)2 ____________________________
②Ca(OH)2 _____________________________
③HClO______________________________
④H2SO4 _______________________________
Cu(OH)2 Cu2++2OH-
Ca(OH)2 =Ca2++2OH-
HClO H++ClO-
H2SO4 =2H++SO42-
⑤NaHSO4 ____________________________
⑥NaHCO3 ____________________________
特别提醒:
在写电离方程式时强酸的酸式盐能电离出氢离子,弱酸的酸式盐不能电离出氢离子。
NaHSO4 =Na+ +H++SO42-
NaHCO3 = Na+ + HCO3-
溶剂化作用
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合分子”或“水合离子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫作溶剂化作用。
视野拓展
1.水的电离
H2O
H++OH-
Kw=C平(H+)×C平(OH-)
温度、加酸、加碱
课堂小结
2.电解质在水溶液中存在形态
完全电离
强酸、强碱、绝大多数盐
部分电离
弱酸、弱碱、水
=
水溶液的酸碱性与PH
知识回顾
1.水的电离方程式______________________________________。
2.水的离子积Kw= 。25℃Kw= 。
1.0×10-14mol2·L-2
C平(H+) C平(OH-)
H2O
H++OH-
3.纯水升高温度,
C(H+) ,C(OH-) ,Kw= 。
加酸C(H+) ,C(OH-) ,Kw= 。
加碱C(H+) ,C(OH-) ,Kw= 。
增大
增大
增大
不变
不变
增大
减小
减小
增大
由于水的电离,在水溶液中始终存在着H+和OH-,而且稀水溶液中C平(H+)和C平(OH-)的乘积也等于水的离子积。那么,水溶液中H+、OH-的浓度与溶液的酸碱性有什么关系呢 水溶液的酸碱度又如何量度呢
利用水的离子积可以计算溶液中H+或OH-的浓度的浓度。例如,室温下测得某酸溶液中的C平(H+)为1.0×10-5mol·L-1,根据
Kw=C平(H+) C平(OH-)=1.0×10-14mol2·L-2
可得该酸溶液中的C平(OH-)为∶
C平(OH-)=
Kw
C平(H+)
=
1.0×10-14mol2·L-2
1.0×10-5mol·L-1
=
1.0×10-9mol·L-1
1.下表列出了室温下一些溶液的C平(H+)或C平(OH-),请填上空缺的数据。
化合物 C/(mol/L) C平(H+)/(mol/L) C平(OH-)/(mol/L)
HCl 1.0×10-2 1.0×10-2
HNO3 1.0×10-3 1.0×10-3
NaOH 1.0×10-2 1.0×10-2
KOH 1.0×10-3 1.0×10-3
1.0×10-12
1.0×10-11
1.0×10-12
1.0×10-11
2.由表中的数据能找出什么规律
在酸性溶液中也存在着OH-,只是H+的浓度比OH-的浓度大;在碱性溶液中也存在着H+,只是OH-的浓度比H+的浓度大。
水溶液的酸碱性与C平(H+)和C平(OH-)的相对大小的关系为∶
C平(H+)>C平(OH-)
C平(H+)=C平(OH-)
C平(H+)
溶液呈碱性,且C平(OH-)越大碱性越强
溶液呈酸性,且C平(H+)越大酸性越强
溶液呈中性
1、在25℃ 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
2、在25℃ 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
■加酸后Kw =1×10-14
酸溶液中Kw =c(H+)酸 · c(OH-)水
■加碱后Kw =1×10-14
碱溶液中Kw =c(OH-)碱·c(H+)水
迁移应用
=c(H+)水
=c(OH-)水
① 任何水溶液中H+和OH-总是同时存在的,只是相对含量不同.
②Kw适用于一定温度下任何稀的电解质溶液。常温下,任何稀的水溶液中,Kw=C平(H+)×C平(OH-)=1×10-14
归纳总结
③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)
酸性溶液一般可忽略水电离出的C(H+),碱性溶液可忽略水电离出的C(OH-)。
④根据Kw=C平(H+)×C平(OH-) 在特定温度下为定值,C平(H+) 和C平(OH-) 可以互求.
(1)可以用C平(H+)或C平(OH-)的大小表示溶液的酸碱度
2.溶液酸碱度的表示方法
C平(H+)越大酸性越强
C平(OH-)越大碱性越强
(2)可以用pH大小表示溶液的酸碱度
pH与溶液中H+浓度的关系?
pH=-lgC平(H+)
pH越大,C平(H+)越小,碱性越强
已知:KW100℃=10-12
1.在100 ℃ 时,纯水中c(H+)为多少?
2.c(H+) >1×10—7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
3.100℃纯水的PH为多少?
4.PH=7的溶液是否一定是中性溶液?
交流研讨
10-6
不能,纯水呈中性
6
不一定,100℃纯水PH6为中性,PH等7为碱性。
溶液酸碱性本质上取决于C平(H+)和C平(OH-)相对大小,因此不能用 c(H+)等于多少来判断溶液酸、碱性,也不能根据pH大小来判断溶液的酸碱性。
特别说明:
25 ℃ 时,中性溶液的C平(H+)=10-7,PH=7。
室温下,溶液酸碱性与C平(H+)和PH关系
归纳总结
c(H+)与c(OH-)的相对大小 c(H+)的范围(25 ℃ ) pH的范围(25 ℃)
中性溶液 c(OH-)c(H+) c(H+) =1.0×10-7 mol·L-1 PH=7
酸性溶液 c(OH-)c(H+) c(H+) >1.0×10-7 mol·L-1 PH<7
碱性溶液 c(OH-)c(H+) c(H+) <1.0×10-7 mol·L-1 PH>7
【例】室温条件下,测得强碱NaOH溶液的浓度为1.0×10-3mol·L-1,计算该溶液的PH。
解:NaOH=== Na+ + OH-
C/mol·L-1 1.0×10-3 1.0×10-3
因为 KW=C平(H+) C平(OH-)
所以 C平(H+)=
PH=-lgC平(H+)=
KW
C平(OH-)
1.0×10-14
1.0×10-3
=
=11.0
KW
C平(OH-)
答:该溶液的PH为11.0 。
某温度下纯水的pH=6。请据此回答下列问题:
(1)pH=7的溶液呈_________(填“酸性”“中性”或“碱性”)。
(2)该温度下0.1 mol·L-1的盐酸的pH=________。
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=________。
碱性
1
11
3.溶液酸碱度的测定方法
(1)酸碱指示剂:估计溶液的pH范围
(2)广泛pH试纸:测量出溶液的整数pH
(3)pH计(酸度计):精确测定溶液pH
思考交流
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
(1)酸碱指示剂:估计溶液的pH范围
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
使用方法:
用镊子撕取一小片pH试纸放于洁净干燥的表面皿(或玻璃片)上,用洁净干燥的玻璃棒蘸取待测液点在试纸中部,待试纸显色稳定后与标准比色卡对比,读出pH。
(2)广泛pH试纸:测量出溶液的整数pH
注意:
①试纸不能用水润湿
②不能将试纸伸到溶液中
③广泛pH试纸只能读出整数
(3) pH计(酸度计):精确测定溶液pH
溶液的
酸碱性
根本依据
常用依据
测定方法
酸性
中性
碱性
C平(H+)>C平(OH-)
C平(H+)=C平(OH-)
C平(H+)
C平(H+)
>10-7 酸性
=10-7 中性
<10-7 碱性
pH
>7 碱性
=7 中性
<7 酸性
酸碱指示剂
pH试纸
pH计
课堂小结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
