3.4 离子反应课件(共78张ppt)鲁科版(2019)选择性必修一第3章
文档属性
| 名称 | 3.4 离子反应课件(共78张ppt)鲁科版(2019)选择性必修一第3章 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 21:19:49 | ||
图片预览











文档简介
(共78张PPT)
离子反应
第一课时
离子反应发生的条件
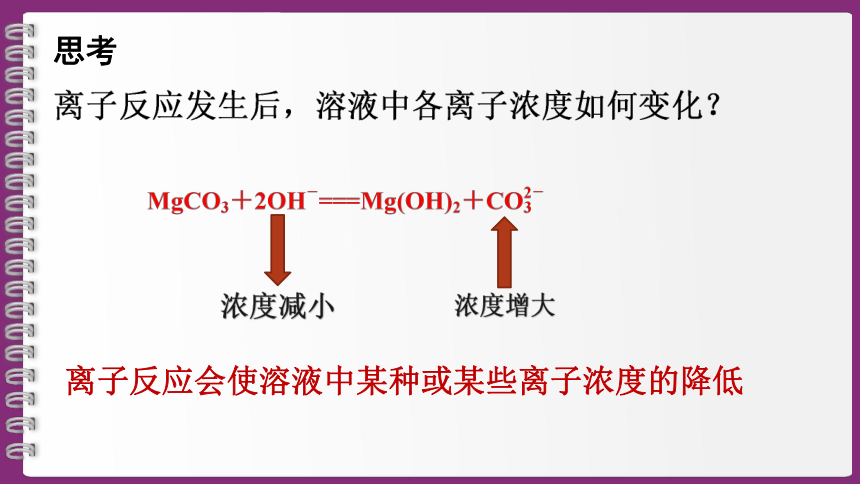
SO42-+Ba2+==BaSO4↓
Ca(OH) 2+CO32-==CaCO3↓+2OH-
CO32-+2H+==CO2↑+H2O
Zn+2H+==H2↑+Zn2+
CH3COO-+H+==CH3COOH
2I-+Br2==I2+2Br -
一.离子反应发生的条件
浓度减小
浓度增大
离子反应会使溶液中某种或某些离子浓度的降低
思考
NH4++OH-==NH3 H2O
NH4++OH-==NH3↑+H2O。
CO32-+2H+===H2O+CO2↑
归纳总结
4.发生氧化还原反应
铜锌原电池反应的离子方程式:Zn+Cu2+===Zn2++Cu
电解饱和食盐水的离子方程式:2Cl-+2H2O=====2OH-+H2↑+Cl2↑
通电
4.发生氧化还原反应
如何判断离子反应的方向
通常可利用“△H - T△S判据”、平衡常数判据等来判断离子反应的方向。
1.“△H - T△S判据”在等温、等压及除了体积功以外不做其他功的条件下,利用“△H - T△S判据”可以判断离子反应能否正向自发进行。例如,室温时,下列△H - T△S <0的离子反应都能正向自发进行:
2.平衡常数判据
平衡常数K反映了反应趋势的大小,因而可根据平衡常数来判断一个离子反应能否正向自发进行。下列离子反应的平衡常数很大,表明反应正向进行的趋势很大,当反应物的浓度很小时,就可以满足Q归纳总结
回顾思考
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.[OH-]=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的[H+]=1×10-11 mol·L-1的溶液中:K+、Na+、[Al(OH)4]-、CO32-
B
2.写出下列与量有关的离子方程式
(1)过量的二氧化硫通入氢氧化钠溶液反应的离子方程式________________________________________________ (2)向NaHSO4溶液中逐滴滴入Ba(OH)2溶液至沉淀完全
________________________________________________
SO2+OH-==HSO3-
H++SO42-+Ba2++OH-===BaSO4↓+H2O
溶液至中性_______________________________________________。
(3)向同浓度的NaBr、NaI混合溶液中滴入少量氯水
________________________________________________________________
2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
2I-+Cl2==I2+2Cl-
应用指导
与量有关的离子方程式的书写注意问题:
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
应用指导
离子反应发生的条件
发生复分解反应
发生氧化还原反应
发生双水解反应
发生络合反应
生成沉淀
生成弱电解质
生成气体或挥发性物质
氧化性离子与还原性离子
原电池反应
电解池反应
课堂小结
第二课时
离子反应的应用
生成沉淀
生成弱电解质
生成气体或挥发性物质
发生氧化还原反应
知识回顾
5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O
NH4++OH-==NH3↑+H2O。
1.物质检验与含量测定
二.离子反应的应用
如溶液中SO的浓度,用Ba2+将其转化为BaSO4沉淀,再称量沉淀的质量求得。
强酸溶液中H+的浓度可以用已知准确浓度的强碱溶液滴定的方法获得。
如溶液中MnO的浓度可以用已知准确浓度的Fe2+溶液滴定获得。
c(H+)V(H+)=c(OH- )V(OH-)
1.酸式滴定管与碱式滴定管有哪些差异?分析如此设计的原因?
玻璃塞
玻璃球
橡皮管
标注:规格、温度
实验仪器
酸式滴定管
碱式滴定管
蝴蝶夹
酚酞溶液:无色变为红色
读数时眼睛平视滴定管液面
放液前读数未整数
平行滴定三次,取平均值
实验方案设计及实施
实 验 方 案
数 据 记 录 编号 酸溶液体积 碱溶液体积 待测盐酸浓度
V1 V2 V酸 V1’ V2’ V碱 C酸 C酸(平均)
①
②
③
数据处理
酸被稀释,V酸偏大,计算得c碱偏大。
碱增多,滴定用V酸偏大,计算得c碱偏大。
思考
中和滴定误差分析
操作方法 误差分析
1.放标准液的滴定管未用标准液润洗
2.盛待测液的锥形瓶用前用待测液润洗
3.滴定前滴定管尖嘴有气泡,完毕气泡消失
4.滴定前仰视读数,滴定完毕正确读数
5.滴定前正确读数,滴定完毕俯视读数
6.滴定中向锥形瓶加入蒸馏水
c待偏高
c待偏高
c待偏高
c待偏低
c待偏低
c待无影响
滴定管的使用方法
1.滴定管是一种具有精确刻度、内径均匀的细长玻璃管,可以准确地控制流出液体的体积。滴定管有酸式滴定管和碱式滴定管之分,分别用来盛装酸性溶液和碱性溶液。
2.使用时,先用蒸馏水洗涤滴定管,再用待盛溶液润洗2~3次后,注入待盛溶液。注意驱赶滴定管尖嘴部分中的气泡。记录读数V1,读至小数点后第二位。
3.如图 3-4-6 所示,将滴定管中溶液逐滴滴入锥形瓶中,并不断摇动锥形瓶使溶液混合均匀;至锥形瓶中溶液颜色发生突变时,停止滴加,记录读数V2,读至小数点后第二位。
4.滴加溶液的体积为 V2 – V1 。为了使结果更可靠,应该重复进行三次滴定,最终取三次滴定结果的平均值。现在已有了酸碱通用的聚四氟乙烯滴定管,其结构与酸式滴定管相同。
讨论
突跃范围
20.02mL
19.98mL
2Cl-+2H2O===2OH-+Cl2↑+H2↑。
通电
2H2O==O2↑+4H+
4H++HCO3-==2H2O+CO2 ↑
H+
交流·研讨
3.生活中常见的离子反应
(1)胃酸与胃舒平
胃舒平的主要成分是Al(OH)3,而胃酸的主要成分是HCl,当胃酸过多时,可以服用胃舒平以达到中和胃酸的目的。
Al(OH)3+3H+===Al3++3H2O。
【通用名】复方氢氧化铝
【商品名】胃舒平
【化学方程式】Al(OH)3+3HCl=AlCl3+3H2O
【主要成分】:含氢氧化铝、三硅酸镁、颠茄流浸膏等
【用法】:口服:每次2~4片, 每日3次。5岁以下每次1片,饭前半小时或胃痛发作时咬碎服。
(2)硬水的形成
自然界里含有Ca2+、Mg2+较多的水称为硬水。有一种硬水(暂时硬水)是水中溶解的CO2与岩石中的CaCO3和MgCO3发生反应生成可溶性的碳酸氢盐而使Ca2+、Mg2+进入水中形成的。所发生的主要反应为:
CaCO3+H2O+CO2===Ca2++2HCO3-
MgCO3+H2O+CO2===Mg2++2HCO3-
(3)硬水的软化
①加热法:
加热可以使2HCO3-分解,生成的CO32-与Mg2+、Ca2+结合成沉淀,起到软化硬水的作用。发生的反应为:
Ca2++2HCO3- === CaCO3↓+H2O+CO2↑,
Mg2++2HCO3-=== MgCO3↓+H2O+CO2↑。
△
△
②沉淀法:在硬水中加入Na2CO3等沉淀剂也可以降低Mg2+、Ca2+浓度,起到软化硬水的作用。发生的反应为:
Ca2++CO32-===CaCO3↓,Mg2++CO32-===MgCO3↓。
1.根据离子反应发生的条件,举例说明哪些常见离子在溶液中不能大量共存
2.举例说明哪些常见物质可以通过离子反应制备。
3.列举离子反应在生产、生活中的应用实例。
离子反应的应用
1.物质检验与含量测定
2.物质制备与纯化
3.生活中常见的离子反应
离子检验
离子浓度测定
沉淀法
酸碱中和滴定法
氧化还原反应滴定法
氯碱工业
粗盐提纯
污水处理
胃酸与胃舒平
硬水的形成
硬水的软化
课堂小结
离子反应
第一课时
离子反应发生的条件
SO42-+Ba2+==BaSO4↓
Ca(OH) 2+CO32-==CaCO3↓+2OH-
CO32-+2H+==CO2↑+H2O
Zn+2H+==H2↑+Zn2+
CH3COO-+H+==CH3COOH
2I-+Br2==I2+2Br -
一.离子反应发生的条件
浓度减小
浓度增大
离子反应会使溶液中某种或某些离子浓度的降低
思考
NH4++OH-==NH3 H2O
NH4++OH-==NH3↑+H2O。
CO32-+2H+===H2O+CO2↑
归纳总结
4.发生氧化还原反应
铜锌原电池反应的离子方程式:Zn+Cu2+===Zn2++Cu
电解饱和食盐水的离子方程式:2Cl-+2H2O=====2OH-+H2↑+Cl2↑
通电
4.发生氧化还原反应
如何判断离子反应的方向
通常可利用“△H - T△S判据”、平衡常数判据等来判断离子反应的方向。
1.“△H - T△S判据”在等温、等压及除了体积功以外不做其他功的条件下,利用“△H - T△S判据”可以判断离子反应能否正向自发进行。例如,室温时,下列△H - T△S <0的离子反应都能正向自发进行:
2.平衡常数判据
平衡常数K反映了反应趋势的大小,因而可根据平衡常数来判断一个离子反应能否正向自发进行。下列离子反应的平衡常数很大,表明反应正向进行的趋势很大,当反应物的浓度很小时,就可以满足Q
回顾思考
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.[OH-]=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的[H+]=1×10-11 mol·L-1的溶液中:K+、Na+、[Al(OH)4]-、CO32-
B
2.写出下列与量有关的离子方程式
(1)过量的二氧化硫通入氢氧化钠溶液反应的离子方程式________________________________________________ (2)向NaHSO4溶液中逐滴滴入Ba(OH)2溶液至沉淀完全
________________________________________________
SO2+OH-==HSO3-
H++SO42-+Ba2++OH-===BaSO4↓+H2O
溶液至中性_______________________________________________。
(3)向同浓度的NaBr、NaI混合溶液中滴入少量氯水
________________________________________________________________
2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
2I-+Cl2==I2+2Cl-
应用指导
与量有关的离子方程式的书写注意问题:
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
应用指导
离子反应发生的条件
发生复分解反应
发生氧化还原反应
发生双水解反应
发生络合反应
生成沉淀
生成弱电解质
生成气体或挥发性物质
氧化性离子与还原性离子
原电池反应
电解池反应
课堂小结
第二课时
离子反应的应用
生成沉淀
生成弱电解质
生成气体或挥发性物质
发生氧化还原反应
知识回顾
5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O
NH4++OH-==NH3↑+H2O。
1.物质检验与含量测定
二.离子反应的应用
如溶液中SO的浓度,用Ba2+将其转化为BaSO4沉淀,再称量沉淀的质量求得。
强酸溶液中H+的浓度可以用已知准确浓度的强碱溶液滴定的方法获得。
如溶液中MnO的浓度可以用已知准确浓度的Fe2+溶液滴定获得。
c(H+)V(H+)=c(OH- )V(OH-)
1.酸式滴定管与碱式滴定管有哪些差异?分析如此设计的原因?
玻璃塞
玻璃球
橡皮管
标注:规格、温度
实验仪器
酸式滴定管
碱式滴定管
蝴蝶夹
酚酞溶液:无色变为红色
读数时眼睛平视滴定管液面
放液前读数未整数
平行滴定三次,取平均值
实验方案设计及实施
实 验 方 案
数 据 记 录 编号 酸溶液体积 碱溶液体积 待测盐酸浓度
V1 V2 V酸 V1’ V2’ V碱 C酸 C酸(平均)
①
②
③
数据处理
酸被稀释,V酸偏大,计算得c碱偏大。
碱增多,滴定用V酸偏大,计算得c碱偏大。
思考
中和滴定误差分析
操作方法 误差分析
1.放标准液的滴定管未用标准液润洗
2.盛待测液的锥形瓶用前用待测液润洗
3.滴定前滴定管尖嘴有气泡,完毕气泡消失
4.滴定前仰视读数,滴定完毕正确读数
5.滴定前正确读数,滴定完毕俯视读数
6.滴定中向锥形瓶加入蒸馏水
c待偏高
c待偏高
c待偏高
c待偏低
c待偏低
c待无影响
滴定管的使用方法
1.滴定管是一种具有精确刻度、内径均匀的细长玻璃管,可以准确地控制流出液体的体积。滴定管有酸式滴定管和碱式滴定管之分,分别用来盛装酸性溶液和碱性溶液。
2.使用时,先用蒸馏水洗涤滴定管,再用待盛溶液润洗2~3次后,注入待盛溶液。注意驱赶滴定管尖嘴部分中的气泡。记录读数V1,读至小数点后第二位。
3.如图 3-4-6 所示,将滴定管中溶液逐滴滴入锥形瓶中,并不断摇动锥形瓶使溶液混合均匀;至锥形瓶中溶液颜色发生突变时,停止滴加,记录读数V2,读至小数点后第二位。
4.滴加溶液的体积为 V2 – V1 。为了使结果更可靠,应该重复进行三次滴定,最终取三次滴定结果的平均值。现在已有了酸碱通用的聚四氟乙烯滴定管,其结构与酸式滴定管相同。
讨论
突跃范围
20.02mL
19.98mL
2Cl-+2H2O===2OH-+Cl2↑+H2↑。
通电
2H2O==O2↑+4H+
4H++HCO3-==2H2O+CO2 ↑
H+
交流·研讨
3.生活中常见的离子反应
(1)胃酸与胃舒平
胃舒平的主要成分是Al(OH)3,而胃酸的主要成分是HCl,当胃酸过多时,可以服用胃舒平以达到中和胃酸的目的。
Al(OH)3+3H+===Al3++3H2O。
【通用名】复方氢氧化铝
【商品名】胃舒平
【化学方程式】Al(OH)3+3HCl=AlCl3+3H2O
【主要成分】:含氢氧化铝、三硅酸镁、颠茄流浸膏等
【用法】:口服:每次2~4片, 每日3次。5岁以下每次1片,饭前半小时或胃痛发作时咬碎服。
(2)硬水的形成
自然界里含有Ca2+、Mg2+较多的水称为硬水。有一种硬水(暂时硬水)是水中溶解的CO2与岩石中的CaCO3和MgCO3发生反应生成可溶性的碳酸氢盐而使Ca2+、Mg2+进入水中形成的。所发生的主要反应为:
CaCO3+H2O+CO2===Ca2++2HCO3-
MgCO3+H2O+CO2===Mg2++2HCO3-
(3)硬水的软化
①加热法:
加热可以使2HCO3-分解,生成的CO32-与Mg2+、Ca2+结合成沉淀,起到软化硬水的作用。发生的反应为:
Ca2++2HCO3- === CaCO3↓+H2O+CO2↑,
Mg2++2HCO3-=== MgCO3↓+H2O+CO2↑。
△
△
②沉淀法:在硬水中加入Na2CO3等沉淀剂也可以降低Mg2+、Ca2+浓度,起到软化硬水的作用。发生的反应为:
Ca2++CO32-===CaCO3↓,Mg2++CO32-===MgCO3↓。
1.根据离子反应发生的条件,举例说明哪些常见离子在溶液中不能大量共存
2.举例说明哪些常见物质可以通过离子反应制备。
3.列举离子反应在生产、生活中的应用实例。
离子反应的应用
1.物质检验与含量测定
2.物质制备与纯化
3.生活中常见的离子反应
离子检验
离子浓度测定
沉淀法
酸碱中和滴定法
氧化还原反应滴定法
氯碱工业
粗盐提纯
污水处理
胃酸与胃舒平
硬水的形成
硬水的软化
课堂小结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
