3.3 沉淀溶解平衡课件(共62张ppt)鲁科版(2019)选择性必修一第3章
文档属性
| 名称 | 3.3 沉淀溶解平衡课件(共62张ppt)鲁科版(2019)选择性必修一第3章 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 21:19:02 | ||
图片预览











文档简介
(共62张PPT)
沉淀溶解平衡
1.举例说明学过的“平衡”,它们有哪些特征?
复习回顾
Kw = c(H+ ).c(OH-)
特征: 逆、等、动、定、变
水解平衡 FeCl3+3H2O Fe(OH)3+3HCl
电离平衡 H2O H+ +OH-
化学平衡 2NO2 N2O4
2.平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
加热可以使天然水中的Ca(HCO3)2与Mg (HCO3)2分别分解形成CaCO3与 MgCO3沉淀。有的同学可能认为水垢的成分应为 CaCO3与MgCO3的混合物,但实际上水垢的主要成分却是CaCO3与 Mg(OH)2的混合物,你知道其中的与 Mg(OH)2 是怎样生成的吗
联想质疑
在处理污水时,可以向其中加入FeS固体,以除去Cu2+、Hg2+、Pb +等重金属离子。在此过程中发生了哪些化学反应
1.在以往的学习过程中我们按溶解度不同把物质怎么分类?
2.难溶物一点都不溶吗?
3.预测难溶物溶解过程是否也存在平衡状态?如何用实验证明?(以难溶物PbI2为例)
问题思考
难溶、微溶、可溶、易溶
难溶≠不溶
沉淀的溶解平衡
第一课时
沉淀溶解平衡与溶度积
Pbl2固体的淀溶解平衡
1.在盛有少量难溶的Pbl2黄色固体的试管中,加入约3mL蒸馏水,充分振荡后静置
2.待上层液体变澄清后,即得到Pbl2饱和溶液,向其中滴加几0.1ml·L-1Pbl2溶液,观察实验现象。
你能解释所观察到的现象吗
观察思考
现象:
结论:
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中也存在溶解平衡。
上层清液中生成黄色沉淀
上层清液中含有Pb2+,部分Pbl2溶于水,存在溶液中存在Pbl2溶解平衡。
Pbl2(S) Pb2+(aq) +2l-(aq)
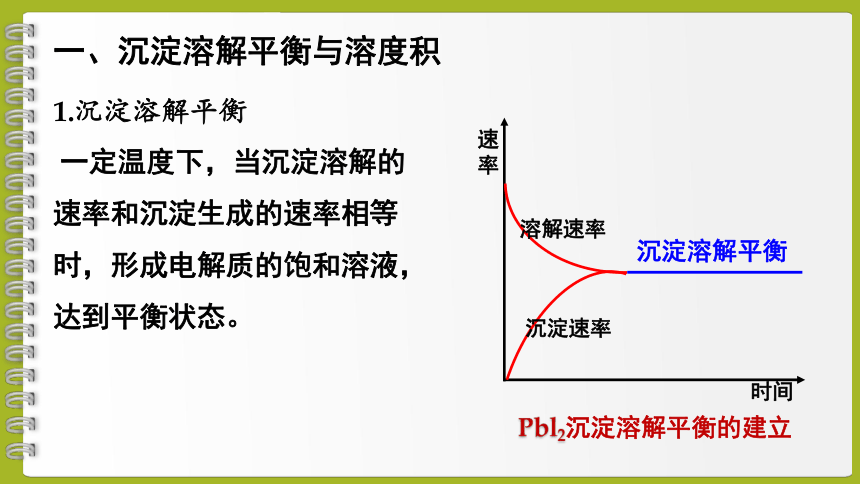
1.沉淀溶解平衡
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态。
一、沉淀溶解平衡与溶度积
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
Pbl2沉淀溶解平衡的建立
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态。
Pbl2(S) Pb2+(aq)+2l-(aq)
溶解
沉淀
沉淀溶解平衡具有其他平衡的特征
逆、等、动、定、变
溶解平衡方程式
溶解平衡也存在溶解平衡常数,称为溶度积常数或溶度积,通常用Ksp表示。
溶解平衡方程式:
溶度积常数表达式:
2.溶度积常数
Pbl2(S) Pb2+(aq) +2l-(aq)
Ksp=c平(Pb2+) c平2(l-)
写出下列难溶物溶解平衡方程式和溶度积表达式
迁移应用
Ksp=C平(Cl-)C平( Ag+)
Ksp=C平(I-)C平( Ag+)
Ksp=C平(CrO4-)C平2( Ag+)
影响溶度积常数大小的因素是什么?溶度积常数的含义是什么?根据下表进行分析,溶度积与溶解度有什么关系?
思考交流
难溶物 Ksp
AgCl 1.8×10-10 1.8×10-4
AgBr 5.4×10-13 8.4×10-6
AgI 8.5×10-17 2.1×10-7
Ag2CrO4 1.1×10-12 2.2×10-3
影响Ksp的因素:
Ksp的大小只与难溶电解质本身的性质和温度有关
Ksp的意义:
相同类型的难溶电解质,在同温度下,Ksp越大,溶解度越大;不同类型的难溶电解质,应通过计算才能进行比较。
常温下将AgCl固体通入到下列溶液中,计算相应离子浓度,已知常温下Ksp(AgCl)=1.8×10-10
迁移应用
将AgCl固体投入0.1molAgNO3溶液中 [Cl-]=
将AgCl固体投入0.1molNaCl溶液中 [Ag+]=
1.8×10-9 mol L-1
1.8×10-9 mol L-1
用平衡移动理论解释AgCl固体在上述溶液中溶解度变小的原因?
Ksp的大小只与难溶电解质本身的性质和温度有关,改变离子浓度Ksp不变,平衡发生移动。
思考
你还能想到哪些影响溶解平衡的因素?以CaCO3溶解平衡为例,小组讨论完成下列表格
CaCO3(S) Ca2+(aq) + CO32-(aq) △H>0
交流研讨
条件 Ksp 改变条件瞬间的浓度熵Q Ksp与Q相对大小关系 移动方向 沉淀的物质的量变化
升温
加入Na2CO3固体
通入HCl气体
加水稀释
不变
不变
不变
不变
QQQ Q>Ksp
正向移动
正向移动
正向移动
逆向移动
外界因素对沉淀溶解平衡的影响
①温度:升高温度,多数沉淀溶解平衡向_________的方向移动;少数沉淀溶解平衡向生成沉淀方向移动,如Ca(OH)2的溶解平衡。
②浓度:加水稀释,平衡向_______方向移动。
归纳总结
溶解
溶解
③相同离子:加入与难溶电解质构成中相同的离子,平衡向_____________ 的方向移动。
④反应离子:加入可与难溶电解质溶解所得的离子反应的物质,平衡向_______的方向移动。
溶解
生成沉淀
若用Q表示电解质溶液某一时刻的离子积:Q=[c(Mn+)]m · [c(Am-)]n
根据平衡原理, Ksp与浓度商Q的相对大小与沉淀的生成和溶解有什么关系?
回顾思考
Q> Ksp
Q= Ksp
Q< Ksp
溶液未达饱和,无沉淀析出
平衡向生成沉淀方向移动,生成沉淀。
难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液
将4×10-3mol/L的AgNO3溶液与4×10-3mol/L的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10
C(Ag+)=2 ×10-3, c(Cl-)= 2 ×10-3
Qc=2 ×10-3× 2 ×10-3 =4.0 ×10-6 >1.8×10-10
Qc>Ksp 所以有AgCl沉淀析出
迁移应用
温度
溶解程度
Qc与Ksp 相对大小判断沉淀生成与溶解
课堂小结
第二课时
沉淀溶解平衡的应用
改变影响沉淀溶解平衡的条件,若Ksp>Q,溶液_____(饱和、过饱和、未饱和)则沉淀会________(溶解、析出);若Ksp知识回顾
未饱和
溶解
过饱和
析出
饱和
美丽的溶洞是如何形成的?
1.沉淀的溶解与生成
二.沉淀溶解平衡的应用
利用X射线对钡元素穿透能力较差的特性,医学生在进行消化系统的X射线透视时,常采用钡盐作为内服药剂,而Ba2+有剧毒,因此选择钡餐药剂应选择难溶性的钡盐,试用溶解平衡理论解释,为何BaSO4和BaCO3均难溶于水,钡餐药剂选择了BaSO4而不是BaCO3呢?
联想质疑
Ksp =5.1×10-9mol2 L-2,
BaCO3(S) Ba2+(aq)+CO32- (aq)
BaCO3(S) Ba2+(aq)+CO32- (aq)
+
2H+
H2O+CO2
平衡正向移动
QBa2+浓度增大而导致人体中毒
BaCO3的沉淀溶解平衡
Ksp =1.1×10-10 mol2 L-2
BaSO4(S) Ba2+(aq)+SO42- (aq)
BaSO4(S) Ba2+(aq)+SO42- (aq)
+
2H+
平衡不移动
Q=Ksp
不反应
Ba2+浓度可以保持在安全范围内,因此可用作钡餐。
BaSO4的沉淀溶解平衡
当体液中c(Ba2+)<1×10-5 mol L-1时,几乎不会对身体造成影响,5 %的Na2SO4溶液中c(SO42-)=0.35mol/L,试着通过计算解释为什么Ba2+中毒可服用5 %Na2SO4溶液解毒。已知常温下Ksp(BaSO4)=1.1×10-10 mol2 L-2
迁移应用
<1×10-5 mol L-1时
1.溶洞里美丽的石笋、钟乳石和石柱是大自然创造的奇迹。石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出。
交流·研讨
这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。请写出上述过程所涉及反应的化学方程式,并从沉淀溶解平衡的角度进行解释。
2.珊瑚虫是海洋中的一种腔肠动物,它们可以从周围的海水中获取 CO2 和HCO3-,经反应形成珊瑚∶
Ca2++2HCO3-= CaCO3+CO2+H2O
珊瑚周围藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他化石燃料等因素,都会干扰珊瑚的形成,甚至造成珊瑚虫死亡。请分析这些因素影响珊瑚生长的原因。
①潮湿的岩洞内CO2浓度较大的地方形成Ca(HCO3)2造成岩石被侵蚀.
②溶有Ca(HCO3)2的水从岩洞顶滴下时,水分蒸发,二氧化碳逸出,导致CaCO3沉淀析出,形成奇形怪状的石笋和钟乳石.
CaCO3+CO2+H2O==Ca(HCO3)2
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
2HCO3-
+
H2O+CO2
CaCO3 Ca2+ + CO32-
沉淀生成
沉淀溶解
人口增长、人类大规模砍伐森林、燃烧煤和其他化石燃料等会使海水中CO2浓度增大,从而干扰珊瑚的形成,造成珊瑚虫死亡。
Ca2++2HCO3- CaCO3+CO2+H2O
CO2浓度增大,平衡左移
逐渐消失的珊瑚
ZnS转化为CuS
请观察以下实验的现象,并尝试用沉淀溶解平衡的原理进行解释。
①在一支试管中加入2mL0.1 mol·L-1ZnSO4溶液,再滴入适量1mol·L-1Na2S溶液,观察沉淀的生成。
观察·思考
②静置后倾去上层清液,并用蒸馏水洗涤沉淀2~ 3次。
③向沉淀中滴加适量0.1 mol·L-1CuSO,溶液,振摇试管。
生成白色沉淀,向沉淀中加入CuSO4溶液后白色沉淀变为黑色
现象:
CuS
ZnS
CuSO4溶液
分析:
Ksp(CuS) Ksp(ZnS) CuS的溶解度远小于ZnS
ZnS(S) Zn2+(aq) + S2- (aq)
+
Cu2+(aq)
CuS(S)
平衡正向移动
沉淀转化的实质
沉淀溶解平衡的移动
一般规律
一种沉淀可以转化为更难溶的沉淀;两种难溶物的溶解能力差别越大,这种转化的趋势越大。
2.沉淀的转化
在工业废水处理过程中为何可用FeS等作为沉淀剂除去 废水中的Cu2+、Hg2+、Pb2+等重金属离子。
迁移应用
根据Ksp数据可知FeS溶解能力远远大于CuS、HgS、PbS的溶解能力,因此可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
身边的化学
由计算得知Mg(OH)2饱和溶液中的Mg2+浓度比MgCO3饱和溶液中的小,表明 Mg(OH)2 更难溶。
天然水中含有Ca(HCO3)2、Mg(HCO3)2、MgSO4、CaSO4、CaCl2、MgCl2等钙盐和镁盐,在煮沸过程中可发生以下反应∶
Ca(HCO3)==CaCO3↓+CO2↑+H2O Mg(HCO3)==MgCO3↓+CO2↑+H2O
Q>Ksp氧氧化镁沉淀生成。
因此,持续加热可以使碳酸镁逐渐转化为更难溶的氧氧化镁。
这样,水垢的主要成分就成为碳酸钙和氢氧化镁的混合物了。
身边的化学
使CaCO3和Mg(OH)2的沉淀溶解平衡向沉淀溶解的方向移动,从而使水垢逐渐溶解而将其除去。
沉淀溶解平衡的应用
Ksp>Q
Ksp难溶物的溶解能力差别越大,转化的趋势越大。
课堂小结
沉淀溶解平衡
1.举例说明学过的“平衡”,它们有哪些特征?
复习回顾
Kw = c(H+ ).c(OH-)
特征: 逆、等、动、定、变
水解平衡 FeCl3+3H2O Fe(OH)3+3HCl
电离平衡 H2O H+ +OH-
化学平衡 2NO2 N2O4
2.平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
加热可以使天然水中的Ca(HCO3)2与Mg (HCO3)2分别分解形成CaCO3与 MgCO3沉淀。有的同学可能认为水垢的成分应为 CaCO3与MgCO3的混合物,但实际上水垢的主要成分却是CaCO3与 Mg(OH)2的混合物,你知道其中的与 Mg(OH)2 是怎样生成的吗
联想质疑
在处理污水时,可以向其中加入FeS固体,以除去Cu2+、Hg2+、Pb +等重金属离子。在此过程中发生了哪些化学反应
1.在以往的学习过程中我们按溶解度不同把物质怎么分类?
2.难溶物一点都不溶吗?
3.预测难溶物溶解过程是否也存在平衡状态?如何用实验证明?(以难溶物PbI2为例)
问题思考
难溶、微溶、可溶、易溶
难溶≠不溶
沉淀的溶解平衡
第一课时
沉淀溶解平衡与溶度积
Pbl2固体的淀溶解平衡
1.在盛有少量难溶的Pbl2黄色固体的试管中,加入约3mL蒸馏水,充分振荡后静置
2.待上层液体变澄清后,即得到Pbl2饱和溶液,向其中滴加几0.1ml·L-1Pbl2溶液,观察实验现象。
你能解释所观察到的现象吗
观察思考
现象:
结论:
沉淀是难溶物,但不是绝对不溶,只不过溶解度很小,难溶物在水中也存在溶解平衡。
上层清液中生成黄色沉淀
上层清液中含有Pb2+,部分Pbl2溶于水,存在溶液中存在Pbl2溶解平衡。
Pbl2(S) Pb2+(aq) +2l-(aq)
1.沉淀溶解平衡
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态。
一、沉淀溶解平衡与溶度积
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
Pbl2沉淀溶解平衡的建立
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态。
Pbl2(S) Pb2+(aq)+2l-(aq)
溶解
沉淀
沉淀溶解平衡具有其他平衡的特征
逆、等、动、定、变
溶解平衡方程式
溶解平衡也存在溶解平衡常数,称为溶度积常数或溶度积,通常用Ksp表示。
溶解平衡方程式:
溶度积常数表达式:
2.溶度积常数
Pbl2(S) Pb2+(aq) +2l-(aq)
Ksp=c平(Pb2+) c平2(l-)
写出下列难溶物溶解平衡方程式和溶度积表达式
迁移应用
Ksp=C平(Cl-)C平( Ag+)
Ksp=C平(I-)C平( Ag+)
Ksp=C平(CrO4-)C平2( Ag+)
影响溶度积常数大小的因素是什么?溶度积常数的含义是什么?根据下表进行分析,溶度积与溶解度有什么关系?
思考交流
难溶物 Ksp
AgCl 1.8×10-10 1.8×10-4
AgBr 5.4×10-13 8.4×10-6
AgI 8.5×10-17 2.1×10-7
Ag2CrO4 1.1×10-12 2.2×10-3
影响Ksp的因素:
Ksp的大小只与难溶电解质本身的性质和温度有关
Ksp的意义:
相同类型的难溶电解质,在同温度下,Ksp越大,溶解度越大;不同类型的难溶电解质,应通过计算才能进行比较。
常温下将AgCl固体通入到下列溶液中,计算相应离子浓度,已知常温下Ksp(AgCl)=1.8×10-10
迁移应用
将AgCl固体投入0.1molAgNO3溶液中 [Cl-]=
将AgCl固体投入0.1molNaCl溶液中 [Ag+]=
1.8×10-9 mol L-1
1.8×10-9 mol L-1
用平衡移动理论解释AgCl固体在上述溶液中溶解度变小的原因?
Ksp的大小只与难溶电解质本身的性质和温度有关,改变离子浓度Ksp不变,平衡发生移动。
思考
你还能想到哪些影响溶解平衡的因素?以CaCO3溶解平衡为例,小组讨论完成下列表格
CaCO3(S) Ca2+(aq) + CO32-(aq) △H>0
交流研讨
条件 Ksp 改变条件瞬间的浓度熵Q Ksp与Q相对大小关系 移动方向 沉淀的物质的量变化
升温
加入Na2CO3固体
通入HCl气体
加水稀释
不变
不变
不变
不变
Q
正向移动
正向移动
正向移动
逆向移动
外界因素对沉淀溶解平衡的影响
①温度:升高温度,多数沉淀溶解平衡向_________的方向移动;少数沉淀溶解平衡向生成沉淀方向移动,如Ca(OH)2的溶解平衡。
②浓度:加水稀释,平衡向_______方向移动。
归纳总结
溶解
溶解
③相同离子:加入与难溶电解质构成中相同的离子,平衡向_____________ 的方向移动。
④反应离子:加入可与难溶电解质溶解所得的离子反应的物质,平衡向_______的方向移动。
溶解
生成沉淀
若用Q表示电解质溶液某一时刻的离子积:Q=[c(Mn+)]m · [c(Am-)]n
根据平衡原理, Ksp与浓度商Q的相对大小与沉淀的生成和溶解有什么关系?
回顾思考
Q> Ksp
Q= Ksp
Q< Ksp
溶液未达饱和,无沉淀析出
平衡向生成沉淀方向移动,生成沉淀。
难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液
将4×10-3mol/L的AgNO3溶液与4×10-3mol/L的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10
C(Ag+)=2 ×10-3, c(Cl-)= 2 ×10-3
Qc=2 ×10-3× 2 ×10-3 =4.0 ×10-6 >1.8×10-10
Qc>Ksp 所以有AgCl沉淀析出
迁移应用
温度
溶解程度
Qc与Ksp 相对大小判断沉淀生成与溶解
课堂小结
第二课时
沉淀溶解平衡的应用
改变影响沉淀溶解平衡的条件,若Ksp>Q,溶液_____(饱和、过饱和、未饱和)则沉淀会________(溶解、析出);若Ksp
未饱和
溶解
过饱和
析出
饱和
美丽的溶洞是如何形成的?
1.沉淀的溶解与生成
二.沉淀溶解平衡的应用
利用X射线对钡元素穿透能力较差的特性,医学生在进行消化系统的X射线透视时,常采用钡盐作为内服药剂,而Ba2+有剧毒,因此选择钡餐药剂应选择难溶性的钡盐,试用溶解平衡理论解释,为何BaSO4和BaCO3均难溶于水,钡餐药剂选择了BaSO4而不是BaCO3呢?
联想质疑
Ksp =5.1×10-9mol2 L-2,
BaCO3(S) Ba2+(aq)+CO32- (aq)
BaCO3(S) Ba2+(aq)+CO32- (aq)
+
2H+
H2O+CO2
平衡正向移动
Q
BaCO3的沉淀溶解平衡
Ksp =1.1×10-10 mol2 L-2
BaSO4(S) Ba2+(aq)+SO42- (aq)
BaSO4(S) Ba2+(aq)+SO42- (aq)
+
2H+
平衡不移动
Q=Ksp
不反应
Ba2+浓度可以保持在安全范围内,因此可用作钡餐。
BaSO4的沉淀溶解平衡
当体液中c(Ba2+)<1×10-5 mol L-1时,几乎不会对身体造成影响,5 %的Na2SO4溶液中c(SO42-)=0.35mol/L,试着通过计算解释为什么Ba2+中毒可服用5 %Na2SO4溶液解毒。已知常温下Ksp(BaSO4)=1.1×10-10 mol2 L-2
迁移应用
<1×10-5 mol L-1时
1.溶洞里美丽的石笋、钟乳石和石柱是大自然创造的奇迹。石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出。
交流·研讨
这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。请写出上述过程所涉及反应的化学方程式,并从沉淀溶解平衡的角度进行解释。
2.珊瑚虫是海洋中的一种腔肠动物,它们可以从周围的海水中获取 CO2 和HCO3-,经反应形成珊瑚∶
Ca2++2HCO3-= CaCO3+CO2+H2O
珊瑚周围藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他化石燃料等因素,都会干扰珊瑚的形成,甚至造成珊瑚虫死亡。请分析这些因素影响珊瑚生长的原因。
①潮湿的岩洞内CO2浓度较大的地方形成Ca(HCO3)2造成岩石被侵蚀.
②溶有Ca(HCO3)2的水从岩洞顶滴下时,水分蒸发,二氧化碳逸出,导致CaCO3沉淀析出,形成奇形怪状的石笋和钟乳石.
CaCO3+CO2+H2O==Ca(HCO3)2
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
2HCO3-
+
H2O+CO2
CaCO3 Ca2+ + CO32-
沉淀生成
沉淀溶解
人口增长、人类大规模砍伐森林、燃烧煤和其他化石燃料等会使海水中CO2浓度增大,从而干扰珊瑚的形成,造成珊瑚虫死亡。
Ca2++2HCO3- CaCO3+CO2+H2O
CO2浓度增大,平衡左移
逐渐消失的珊瑚
ZnS转化为CuS
请观察以下实验的现象,并尝试用沉淀溶解平衡的原理进行解释。
①在一支试管中加入2mL0.1 mol·L-1ZnSO4溶液,再滴入适量1mol·L-1Na2S溶液,观察沉淀的生成。
观察·思考
②静置后倾去上层清液,并用蒸馏水洗涤沉淀2~ 3次。
③向沉淀中滴加适量0.1 mol·L-1CuSO,溶液,振摇试管。
生成白色沉淀,向沉淀中加入CuSO4溶液后白色沉淀变为黑色
现象:
CuS
ZnS
CuSO4溶液
分析:
Ksp(CuS) Ksp(ZnS) CuS的溶解度远小于ZnS
ZnS(S) Zn2+(aq) + S2- (aq)
+
Cu2+(aq)
CuS(S)
平衡正向移动
沉淀转化的实质
沉淀溶解平衡的移动
一般规律
一种沉淀可以转化为更难溶的沉淀;两种难溶物的溶解能力差别越大,这种转化的趋势越大。
2.沉淀的转化
在工业废水处理过程中为何可用FeS等作为沉淀剂除去 废水中的Cu2+、Hg2+、Pb2+等重金属离子。
迁移应用
根据Ksp数据可知FeS溶解能力远远大于CuS、HgS、PbS的溶解能力,因此可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
FeS(s)+Hg2+(aq) HgS(s)+Fe2+(aq)
身边的化学
由计算得知Mg(OH)2饱和溶液中的Mg2+浓度比MgCO3饱和溶液中的小,表明 Mg(OH)2 更难溶。
天然水中含有Ca(HCO3)2、Mg(HCO3)2、MgSO4、CaSO4、CaCl2、MgCl2等钙盐和镁盐,在煮沸过程中可发生以下反应∶
Ca(HCO3)==CaCO3↓+CO2↑+H2O Mg(HCO3)==MgCO3↓+CO2↑+H2O
Q>Ksp氧氧化镁沉淀生成。
因此,持续加热可以使碳酸镁逐渐转化为更难溶的氧氧化镁。
这样,水垢的主要成分就成为碳酸钙和氢氧化镁的混合物了。
身边的化学
使CaCO3和Mg(OH)2的沉淀溶解平衡向沉淀溶解的方向移动,从而使水垢逐渐溶解而将其除去。
沉淀溶解平衡的应用
Ksp>Q
Ksp
课堂小结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
