专题6 第三单元 化学能与电能的转化 课件 (共46张PPT) 苏教版(2019) 必修 第二册
文档属性
| 名称 | 专题6 第三单元 化学能与电能的转化 课件 (共46张PPT) 苏教版(2019) 必修 第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 00:00:00 | ||
图片预览










文档简介
(共46张PPT)
专题6
化学反应与能量变化
第三单元
化学能与电能的转化
我们已经知道,化学反应伴有吸热或放热现象,这是化学能与热能相互转化的表现。除热能以外,化学能还可以转化为光能、机械能、电能等其他形式的能量。各种各样的电池就是化学能与电能转化的最好体现。
家用干电池
纽扣电池
手机电池
化学能转化为电能
在现代生活中,化学电源发挥着越来越重要的作用。大到人造卫星、飞机、新能源汽车,小到电脑、手机、电子手表,都离不开化学电源。尤其是电子产品的日趋丰富,化学电源与人类生活的关系越来越密切。那么,化学电源是如何对外提供电能的呢
基础实验
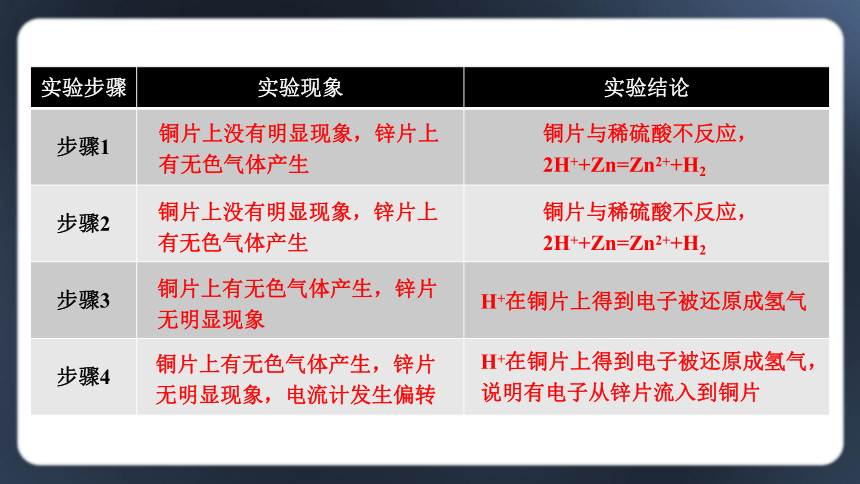
完成下列实验,将观察到的实验现象和得到的实验结论填入下表。
化学能转化为电能的实验
1.把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
2.把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
3.用导线把步骤2中的锌片和铜片连起来,观察实验现象。
4.在步骤3的导线中间连接一个灵敏电流计 (右图),观察实验现象。
原电池示意图
通过步骤4的实验可以看出,锌片逐渐溶解,铜片表面有气泡产生,电流计指针发生偏转,说明这个装置可以将化学能转化为电能。
反应过程中的电流是这样形成的:
1.在锌片(负极)上,锌失去电子形成锌离子(Zn2+) 进入溶液:Zn - 2e- ===Zn2+。电子经锌电极流向导线。
2.从锌电极流出的电子经导线通过电流计流入铜电极。
3.在铜片(正极)上,流入铜电极的电子使溶液中的氢离子还原成氢气:2H+ + 2e-===H2,
4.铜电极附近溶液中的氢离子减少,电解质溶液中的阳离子向铜电极附近发生定向迁移,使电极和溶液形成电流回路。
上述化学能转化为电能的反应可表示为
Zn + 2H+ === Zn2++ H2
实验步骤 实验现象 实验结论
步骤1
步骤2
步骤3
步骤4
铜片上没有明显现象,锌片上有无色气体产生
铜片与稀硫酸不反应,
2H++Zn=Zn2++H2
铜片上没有明显现象,锌片上有无色气体产生
铜片与稀硫酸不反应,
2H++Zn=Zn2++H2
铜片上有无色气体产生,锌片无明显现象
H+在铜片上得到电子被还原成氢气
铜片上有无色气体产生,锌片无明显现象,电流计发生偏转
H+在铜片上得到电子被还原成氢气,说明有电子从锌片流入到铜片
我们把将化学能转变为电能的装置称为原电池。在原电池中,两个电极上分别发生氧化反应和还原反应。还原剂在负极发生氧化反应,失去电子;电子通过导线由原电池的负极流向正极,氧化剂在正极得到电子发生还原反应。原电池就是这样通过化学反应将化学能转化为电能的。
原电池反应原理示意图
1.你能确定原电池的正、负极吗?原电池在工作时电流是如何移动的?
2.你能说出原电池的工作原理吗?试写出发生的在二个电极上的离子反应方程式。
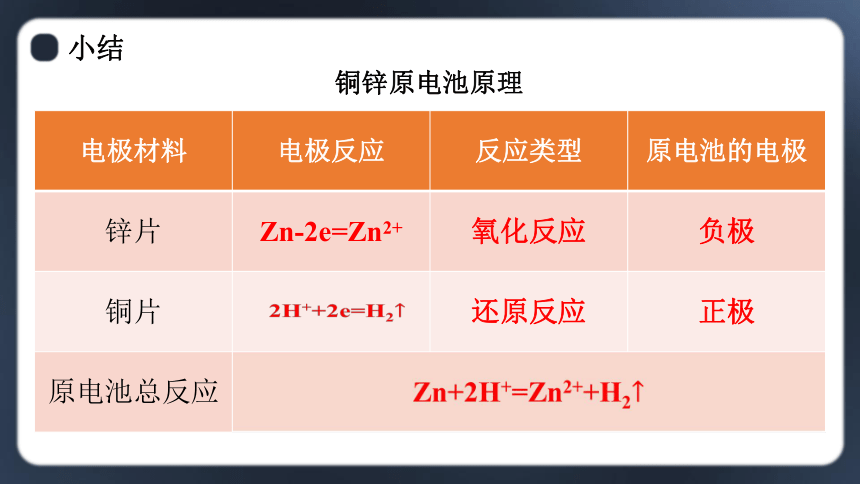
锌片为负极,铜片为正极。电子由锌片经导线流向铜片,电流由铜片流出,从锌片流入。
原电池的工作原理为:氧化还原反应。
Zn-2e=Zn2+ 2H++2e- =H2
铜锌原电池原理
电极材料 电极反应 反应类型 原电池的电极
锌片 Zn-2e=Zn2+ 氧化反应 负极
铜片 还原反应 正极
原电池总反应 Zn+2H+=Zn2++H2
2H++2e=H2
小结
一、原电池:将化学能转变为电能的装置
G
稀硫酸
锌
铜
H+
H+
H+
e-
e-
e-
e-
e-
e-
Zn:还原剂,失去电子发生氧化反应
电子从锌极流出
负极
电子从锌极流出
流入铜极
Cu:氧化剂,得去电子发生还原反应
二、原电池的工作原理
正极
三、原电池反应的本质
氧化还原反应
下列反应中,能够形成原电池的是:
√
√
√
×
×
×
思考:
如果形成原电池需要满足哪些条件?
形成原电池需要满足的条件
1.活泼性不同的两个电极(负极:较活泼的金属;正极:较不活泼的金属。);
2.电极需插进电解质溶液中;
3.有自发的氧化还原反应;
4.必须形成闭合回路。
两极一液成闭合
原电池电极的判断
1.根据电极材料判断
负极:较活泼的金属;
正极:较不活泼的金属或非金属导体
2.根据电极反应判断
失电子的反应 氧化反应 负极
得电子的反应 还原反应 正极
思考:如何判断原电池的正、负极?
3.根据电子或电流流动方向判断
电子从负极流出沿导线流入正极
电流从正极流出沿导线注入负极
原电池电极的判断
4.根据离子的定向移动方向(溶液内)
阳离子向正极移动;阴离子向正极移动;
原电池的应用
在实验室制氢气时(Zn+2H+=Zn2++H2),加入少量CuSO4溶液后,发现反应速率加快了。可能的原因是什么?
形成原电池,可以加快反应的速率
下列情况是否形成了原电池?若是,写出两极反应的方程式。
A
Fe
C
负极:2Fe-4e=2Fe2+
正极:2H2O+O2+4e=4OH-
思考:
为什么钢铁在潮湿的空气中很容易被腐蚀。
原电池的应用小结
1.比较金属活动性强弱(活泼的金属作负极);
2.比较反应速率(构成原电池反应一般比普通反应快);
3.金属的腐蚀与防护(腐蚀速度比一般快)。
拓展视野
钢铁的电化学腐蚀原理及其应用
钢铁在潮湿的空气中很容易被腐蚀,因为在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,水膜里含有少量H+、OH-和氧气等,从而形成一层电解质溶液,它与钢铁里的铁和少量碳形成了无数微小的原电池。在这些微小的原电池中,主要发生了下列反应:
负极(铁): 2Fe - 4e- === 2Fe2+
正极(碳) : 2H2O+O2+ 4e- === 4OH-
铁失去电子被氧化,Fe2+与OH -结合成Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3。
4Fe(OH)2+ O2 +2H2O === 4Fe(OH)3
钢铁的电化学腐蚀原理示意图
Fe(OH)3在一定条件下发生脱水反应,生成红色的铁锈(主要成分为Fe2O3·nH2O)。
不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫作电化学腐蚀。
钢铁电化学腐蚀的原理在生活中应用广泛。例如,生活中常用的取暖产品——暖贴,就是以此原理制成的。暖贴的内部含有铁粉、活性炭、食盐、蛭石、木粉的混合物。铁粉、活性炭、食盐一旦与空气中的氧气和水蒸气接触就会形成原电池,木粉能够吸水并保持水分,蛭石能够保温。原电池的形成加快了铁被氧气氧化的速率,短时间内产生较多的热,供人们取暖。
暖贴的内部结构示意图
化学电源
依据原电池反应的原理,我们可以设计一个装置,通过氧化还原反应即可实现化学能向电能的转化。
实验探究
利用铜片、锌片 (可从废旧干电池中拆取) 或铝片、纯碱溶液、白醋(或橙子、橘子) 等日常生活中的材料即可制作简易电池。如图所示,利用橘子、金属片以及导线等制作的简易电池能使电流计指针偏转。
由橘子制成的简易电池
简易电池无法长久稳定地使用,于是人们发明并制造了多种多样的能够较长时间稳定持续供电的化学电源。化学电源的能量转化率比燃料燃烧高得多。化学电源不仅在生活中得到了广泛的应用,在高科技领域乃至航天技术中也是不可或缺的。
化学电源有一次电池、二次电池和燃料电池之分。一次电池用过之后不能复原,二次电池充电后能继续使用
概念:将化学能变成电能的装置
分类:
①一次电池:不可充电电池,如干电池
②二次电池:可充电电池,如蓄电池
③燃料电池
优点:
①能量转化率高,供能稳定可靠
②可以制成各种形状、大小,使用方便
③易维护
拓展视野
常见化学电源
化学电源在生产、生活中应用十分广泛。常见化学电源主要有锌锰干电池、银锌纽扣电池、铅蓄电池等。它们的组成及反应原理如下表所示。
铅蓄电池
常见化学电源的组成与反应原理
氢氧燃料电池反应原理示意图
当电池与用电器相连时,电池中能转化成电能的化学能是一定的,一旦电能耗尽后便无法继续放电,此时一次电池需要更换电池,二次电池需连接电源充电。
拓展视野
简易燃料电池的制备
1. 将碳电极放在高温火焰上灼烧到红热,迅速浸入冷水中,制得多孔碳棒电极。选用0.5 mol·L-1的Na2SO4 溶液为电解质溶液。电源用3~6 V直流电源,发光二极管的起辉电压为1.7 V,电流为0.6mA。将上述材料组装成简易的燃料电池装置(下图)。
2.按下开关S1,接通电源,电解溶液约半分钟,碳棒上分别产生明显的气泡。
3. 断开开关S1,按下开关S2,可以观察到二极管的发光现象。
自制燃料电池装置示意图
随着科技的发展,越来越多的新型电池面世,其中锂离子电池是笔记本电脑、手机等数码产品中使用最为广泛的电池。它兴起于20世纪90年代,具有供电稳定、可反复充放电、使用寿命长、便携、无污染等优点,在一定程度上改变了人们的生活方式。
与原电池将化学能转化为电能相反,电解池是将电能转化为化学能的装置。在生产、生活实际中,许多化学反应都是通过电解的方法来实现的。例如,电解水制得氢气和氧气:电解饱和食盐水制备烧碱、氯气和氢气。在这些例子中,电能转化为化学能。利用电解我们可以获得普通化学方法难以制备的物质。
电解与电解池
电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
电解池:借助于电流引起氧化还原反应装置。
构成条件:
1.与外加电源相连的电极;2.有电解质溶液;3.形成闭合回路。
能量转化:电能转化为化学能
用途:获得普通化学方法难以制备的物质。
原电池、电解池的异同点
原电池 电解池
定义
形成条件
电极名称
电极反应
化学能转变成电能的装置。自发的氧化还原反应。
将电能转变成化学能的装置。非自发氧化还原反应。
1.活性不同的两电极;2.电解质溶液;3.形成闭合回路
1.两极接直流电源;2.电极插入电解质溶液;3.形成闭合回路
负极:较活泼金属;正极:较不活泼金属(或能导电非金属)
阳极:电源正极相连;阴极:电源负极相连
负极:氧化反应;正极:还原反应
阳极:氧化反应;阴极:还原反应
拓展视野
电解在物质制备中的应用
钠、镁、铝、钙等单质的化学性质很活泼,不能在自然界中稳定存在,用普通的化学方法难以将它们制备出来。工业上采用电解的方法制取这些金属单质。以石墨作为电解池的两个电极电解熔融的氧化铝 (氧化铝的熔点特别高,需要加入冰晶石以帮助其熔化) 可得到单质铝。
在直流电作用下,铝离子在阴极得到电子,被还原为单质铝。
阴极:Al3+ + 3e- ===Al
氧离子在阳极失去电子,被氧化为氧原子,并结合成氧分子。
阳极:2O2-- 4e- === O2
上述反应可综合表示为:
2Al2O3==== 4Al+3O2
通电
与电解熔融的氧化铝类似,电解熔融的氯化钠、氯化镁、氯化钙可分别得到钠、镁、钙的单质和氯气。
电解的方法能使通常条件下无法自发进行的化学反应进行下去,在一些活泼单质的制取、金属的精炼、某些有机化合物的合成中应用广泛。
练习
1.有甲、乙、丙三种金属,将它们放在稀硫酸中,只有乙无明显现象。若用导线将甲、丙相连后放入稀硫酸,只有丙电极上产生大量气泡,这三种金属的活动性顺序是( )
A. 甲>丙>乙 B. 甲>乙>丙 C. 丙>乙>甲 D. 乙>甲>丙
A
2.在锌与铜组成的原电池中,下列说法正确的是( )
A.锌是负极,发生还原反应 B.锌是负极,发生氧化反应
C.铜是负极,发生还原反应 D.铜是负极,发生氧化反应
B
3.如图所示装置中,电流表A发生偏转,a极逐渐变细,同时b极逐渐变粗,c为电解质溶液,则a、b、c应是下列各组中的 ( )
A.a是Fe、b是Ag、c为AgNO3溶液
B.a是Ag、b是Fe、c为AgNO3溶液
C.a是Zn、b是Cu、c为稀H2SO4
D.a是Cu、b是Zn、c为稀H2SO4
A
A B C D
电极材料 Cu、C Cu、Ag Cu、Zn Fe、Zn
电解质溶液 Fe(NO3)3(aq) FeSO4(aq) FeCl3(aq) CuSO4(aq)
4.按下列选项要求组成的原电池中,原电池的总反应为Cu+2Fe3+=Cu2++2Fe2+的是( )
A.A B.B C.C D.D
A
5.少量铁粉与100 mL 0.01 mol/L的硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的总量,可以使用如下方法中的( )
A.加入l00 mL0.02 mol/L的盐酸 B.加入少量硫酸氢钠固体
C.加入少量CuSO4固体 D.降低温度
B
完成课后相关练习
谢谢观看
谢谢观看
专题6
化学反应与能量变化
第三单元
化学能与电能的转化
我们已经知道,化学反应伴有吸热或放热现象,这是化学能与热能相互转化的表现。除热能以外,化学能还可以转化为光能、机械能、电能等其他形式的能量。各种各样的电池就是化学能与电能转化的最好体现。
家用干电池
纽扣电池
手机电池
化学能转化为电能
在现代生活中,化学电源发挥着越来越重要的作用。大到人造卫星、飞机、新能源汽车,小到电脑、手机、电子手表,都离不开化学电源。尤其是电子产品的日趋丰富,化学电源与人类生活的关系越来越密切。那么,化学电源是如何对外提供电能的呢
基础实验
完成下列实验,将观察到的实验现象和得到的实验结论填入下表。
化学能转化为电能的实验
1.把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,观察实验现象。
2.把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,观察实验现象。
3.用导线把步骤2中的锌片和铜片连起来,观察实验现象。
4.在步骤3的导线中间连接一个灵敏电流计 (右图),观察实验现象。
原电池示意图
通过步骤4的实验可以看出,锌片逐渐溶解,铜片表面有气泡产生,电流计指针发生偏转,说明这个装置可以将化学能转化为电能。
反应过程中的电流是这样形成的:
1.在锌片(负极)上,锌失去电子形成锌离子(Zn2+) 进入溶液:Zn - 2e- ===Zn2+。电子经锌电极流向导线。
2.从锌电极流出的电子经导线通过电流计流入铜电极。
3.在铜片(正极)上,流入铜电极的电子使溶液中的氢离子还原成氢气:2H+ + 2e-===H2,
4.铜电极附近溶液中的氢离子减少,电解质溶液中的阳离子向铜电极附近发生定向迁移,使电极和溶液形成电流回路。
上述化学能转化为电能的反应可表示为
Zn + 2H+ === Zn2++ H2
实验步骤 实验现象 实验结论
步骤1
步骤2
步骤3
步骤4
铜片上没有明显现象,锌片上有无色气体产生
铜片与稀硫酸不反应,
2H++Zn=Zn2++H2
铜片上没有明显现象,锌片上有无色气体产生
铜片与稀硫酸不反应,
2H++Zn=Zn2++H2
铜片上有无色气体产生,锌片无明显现象
H+在铜片上得到电子被还原成氢气
铜片上有无色气体产生,锌片无明显现象,电流计发生偏转
H+在铜片上得到电子被还原成氢气,说明有电子从锌片流入到铜片
我们把将化学能转变为电能的装置称为原电池。在原电池中,两个电极上分别发生氧化反应和还原反应。还原剂在负极发生氧化反应,失去电子;电子通过导线由原电池的负极流向正极,氧化剂在正极得到电子发生还原反应。原电池就是这样通过化学反应将化学能转化为电能的。
原电池反应原理示意图
1.你能确定原电池的正、负极吗?原电池在工作时电流是如何移动的?
2.你能说出原电池的工作原理吗?试写出发生的在二个电极上的离子反应方程式。
锌片为负极,铜片为正极。电子由锌片经导线流向铜片,电流由铜片流出,从锌片流入。
原电池的工作原理为:氧化还原反应。
Zn-2e=Zn2+ 2H++2e- =H2
铜锌原电池原理
电极材料 电极反应 反应类型 原电池的电极
锌片 Zn-2e=Zn2+ 氧化反应 负极
铜片 还原反应 正极
原电池总反应 Zn+2H+=Zn2++H2
2H++2e=H2
小结
一、原电池:将化学能转变为电能的装置
G
稀硫酸
锌
铜
H+
H+
H+
e-
e-
e-
e-
e-
e-
Zn:还原剂,失去电子发生氧化反应
电子从锌极流出
负极
电子从锌极流出
流入铜极
Cu:氧化剂,得去电子发生还原反应
二、原电池的工作原理
正极
三、原电池反应的本质
氧化还原反应
下列反应中,能够形成原电池的是:
√
√
√
×
×
×
思考:
如果形成原电池需要满足哪些条件?
形成原电池需要满足的条件
1.活泼性不同的两个电极(负极:较活泼的金属;正极:较不活泼的金属。);
2.电极需插进电解质溶液中;
3.有自发的氧化还原反应;
4.必须形成闭合回路。
两极一液成闭合
原电池电极的判断
1.根据电极材料判断
负极:较活泼的金属;
正极:较不活泼的金属或非金属导体
2.根据电极反应判断
失电子的反应 氧化反应 负极
得电子的反应 还原反应 正极
思考:如何判断原电池的正、负极?
3.根据电子或电流流动方向判断
电子从负极流出沿导线流入正极
电流从正极流出沿导线注入负极
原电池电极的判断
4.根据离子的定向移动方向(溶液内)
阳离子向正极移动;阴离子向正极移动;
原电池的应用
在实验室制氢气时(Zn+2H+=Zn2++H2),加入少量CuSO4溶液后,发现反应速率加快了。可能的原因是什么?
形成原电池,可以加快反应的速率
下列情况是否形成了原电池?若是,写出两极反应的方程式。
A
Fe
C
负极:2Fe-4e=2Fe2+
正极:2H2O+O2+4e=4OH-
思考:
为什么钢铁在潮湿的空气中很容易被腐蚀。
原电池的应用小结
1.比较金属活动性强弱(活泼的金属作负极);
2.比较反应速率(构成原电池反应一般比普通反应快);
3.金属的腐蚀与防护(腐蚀速度比一般快)。
拓展视野
钢铁的电化学腐蚀原理及其应用
钢铁在潮湿的空气中很容易被腐蚀,因为在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,水膜里含有少量H+、OH-和氧气等,从而形成一层电解质溶液,它与钢铁里的铁和少量碳形成了无数微小的原电池。在这些微小的原电池中,主要发生了下列反应:
负极(铁): 2Fe - 4e- === 2Fe2+
正极(碳) : 2H2O+O2+ 4e- === 4OH-
铁失去电子被氧化,Fe2+与OH -结合成Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3。
4Fe(OH)2+ O2 +2H2O === 4Fe(OH)3
钢铁的电化学腐蚀原理示意图
Fe(OH)3在一定条件下发生脱水反应,生成红色的铁锈(主要成分为Fe2O3·nH2O)。
不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫作电化学腐蚀。
钢铁电化学腐蚀的原理在生活中应用广泛。例如,生活中常用的取暖产品——暖贴,就是以此原理制成的。暖贴的内部含有铁粉、活性炭、食盐、蛭石、木粉的混合物。铁粉、活性炭、食盐一旦与空气中的氧气和水蒸气接触就会形成原电池,木粉能够吸水并保持水分,蛭石能够保温。原电池的形成加快了铁被氧气氧化的速率,短时间内产生较多的热,供人们取暖。
暖贴的内部结构示意图
化学电源
依据原电池反应的原理,我们可以设计一个装置,通过氧化还原反应即可实现化学能向电能的转化。
实验探究
利用铜片、锌片 (可从废旧干电池中拆取) 或铝片、纯碱溶液、白醋(或橙子、橘子) 等日常生活中的材料即可制作简易电池。如图所示,利用橘子、金属片以及导线等制作的简易电池能使电流计指针偏转。
由橘子制成的简易电池
简易电池无法长久稳定地使用,于是人们发明并制造了多种多样的能够较长时间稳定持续供电的化学电源。化学电源的能量转化率比燃料燃烧高得多。化学电源不仅在生活中得到了广泛的应用,在高科技领域乃至航天技术中也是不可或缺的。
化学电源有一次电池、二次电池和燃料电池之分。一次电池用过之后不能复原,二次电池充电后能继续使用
概念:将化学能变成电能的装置
分类:
①一次电池:不可充电电池,如干电池
②二次电池:可充电电池,如蓄电池
③燃料电池
优点:
①能量转化率高,供能稳定可靠
②可以制成各种形状、大小,使用方便
③易维护
拓展视野
常见化学电源
化学电源在生产、生活中应用十分广泛。常见化学电源主要有锌锰干电池、银锌纽扣电池、铅蓄电池等。它们的组成及反应原理如下表所示。
铅蓄电池
常见化学电源的组成与反应原理
氢氧燃料电池反应原理示意图
当电池与用电器相连时,电池中能转化成电能的化学能是一定的,一旦电能耗尽后便无法继续放电,此时一次电池需要更换电池,二次电池需连接电源充电。
拓展视野
简易燃料电池的制备
1. 将碳电极放在高温火焰上灼烧到红热,迅速浸入冷水中,制得多孔碳棒电极。选用0.5 mol·L-1的Na2SO4 溶液为电解质溶液。电源用3~6 V直流电源,发光二极管的起辉电压为1.7 V,电流为0.6mA。将上述材料组装成简易的燃料电池装置(下图)。
2.按下开关S1,接通电源,电解溶液约半分钟,碳棒上分别产生明显的气泡。
3. 断开开关S1,按下开关S2,可以观察到二极管的发光现象。
自制燃料电池装置示意图
随着科技的发展,越来越多的新型电池面世,其中锂离子电池是笔记本电脑、手机等数码产品中使用最为广泛的电池。它兴起于20世纪90年代,具有供电稳定、可反复充放电、使用寿命长、便携、无污染等优点,在一定程度上改变了人们的生活方式。
与原电池将化学能转化为电能相反,电解池是将电能转化为化学能的装置。在生产、生活实际中,许多化学反应都是通过电解的方法来实现的。例如,电解水制得氢气和氧气:电解饱和食盐水制备烧碱、氯气和氢气。在这些例子中,电能转化为化学能。利用电解我们可以获得普通化学方法难以制备的物质。
电解与电解池
电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
电解池:借助于电流引起氧化还原反应装置。
构成条件:
1.与外加电源相连的电极;2.有电解质溶液;3.形成闭合回路。
能量转化:电能转化为化学能
用途:获得普通化学方法难以制备的物质。
原电池、电解池的异同点
原电池 电解池
定义
形成条件
电极名称
电极反应
化学能转变成电能的装置。自发的氧化还原反应。
将电能转变成化学能的装置。非自发氧化还原反应。
1.活性不同的两电极;2.电解质溶液;3.形成闭合回路
1.两极接直流电源;2.电极插入电解质溶液;3.形成闭合回路
负极:较活泼金属;正极:较不活泼金属(或能导电非金属)
阳极:电源正极相连;阴极:电源负极相连
负极:氧化反应;正极:还原反应
阳极:氧化反应;阴极:还原反应
拓展视野
电解在物质制备中的应用
钠、镁、铝、钙等单质的化学性质很活泼,不能在自然界中稳定存在,用普通的化学方法难以将它们制备出来。工业上采用电解的方法制取这些金属单质。以石墨作为电解池的两个电极电解熔融的氧化铝 (氧化铝的熔点特别高,需要加入冰晶石以帮助其熔化) 可得到单质铝。
在直流电作用下,铝离子在阴极得到电子,被还原为单质铝。
阴极:Al3+ + 3e- ===Al
氧离子在阳极失去电子,被氧化为氧原子,并结合成氧分子。
阳极:2O2-- 4e- === O2
上述反应可综合表示为:
2Al2O3==== 4Al+3O2
通电
与电解熔融的氧化铝类似,电解熔融的氯化钠、氯化镁、氯化钙可分别得到钠、镁、钙的单质和氯气。
电解的方法能使通常条件下无法自发进行的化学反应进行下去,在一些活泼单质的制取、金属的精炼、某些有机化合物的合成中应用广泛。
练习
1.有甲、乙、丙三种金属,将它们放在稀硫酸中,只有乙无明显现象。若用导线将甲、丙相连后放入稀硫酸,只有丙电极上产生大量气泡,这三种金属的活动性顺序是( )
A. 甲>丙>乙 B. 甲>乙>丙 C. 丙>乙>甲 D. 乙>甲>丙
A
2.在锌与铜组成的原电池中,下列说法正确的是( )
A.锌是负极,发生还原反应 B.锌是负极,发生氧化反应
C.铜是负极,发生还原反应 D.铜是负极,发生氧化反应
B
3.如图所示装置中,电流表A发生偏转,a极逐渐变细,同时b极逐渐变粗,c为电解质溶液,则a、b、c应是下列各组中的 ( )
A.a是Fe、b是Ag、c为AgNO3溶液
B.a是Ag、b是Fe、c为AgNO3溶液
C.a是Zn、b是Cu、c为稀H2SO4
D.a是Cu、b是Zn、c为稀H2SO4
A
A B C D
电极材料 Cu、C Cu、Ag Cu、Zn Fe、Zn
电解质溶液 Fe(NO3)3(aq) FeSO4(aq) FeCl3(aq) CuSO4(aq)
4.按下列选项要求组成的原电池中,原电池的总反应为Cu+2Fe3+=Cu2++2Fe2+的是( )
A.A B.B C.C D.D
A
5.少量铁粉与100 mL 0.01 mol/L的硫酸反应,反应速率太慢。为了加快此反应速率而不改变H2的总量,可以使用如下方法中的( )
A.加入l00 mL0.02 mol/L的盐酸 B.加入少量硫酸氢钠固体
C.加入少量CuSO4固体 D.降低温度
B
完成课后相关练习
谢谢观看
谢谢观看
