1.1.3 能源的充分利用 课件 (共25张PPT) 苏教版(2019) 选择性必修1
文档属性
| 名称 | 1.1.3 能源的充分利用 课件 (共25张PPT) 苏教版(2019) 选择性必修1 |  | |
| 格式 | ppt | ||
| 文件大小 | 423.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 22:32:24 | ||
图片预览








文档简介
(共25张PPT)
选 择 性 必 修 一
学
化
J
S
第一单元 化学反应的热效应
3 能源的充分利用
能源是指可以提供能量的自然资源,是国民经济和社会发展的重要物质基础,包括化石燃料、阳光、风力、流水、潮汐等。我国目前使用的主要能源仍然是化石燃料,但化石燃料的蕴藏量有限,且不可再生,因此,能源的开源节流是事关人类可持续发展的重大问题之一。
通常我们使用的能量的主要形式是热能和电能,热能主要通过燃烧煤、石油、天然气等物质而获得。从节约能源的角度考虑,怎样衡量不同物质的燃烧效率呢?
交流讨论
燃料燃烧过程中释放的热能是人类生产和生活所需要能量的重要来源。质量相同、组成不同的燃料,完全燃烧后释放的热不相等。
人们通常用标准燃烧热或热值来衡量燃料燃烧时释放的热的多少。
在101 kPa下,1 mol 物质完全燃烧的反应热叫做该物质的标准燃烧热,1 g 物质完全燃烧的反应热叫做该物质的热值。
物质完全燃烧是指物质中所含有的氮元素转化为 N2 (g),氢元素转化为 H2O(l),碳元素转化为 CO2 (g)。
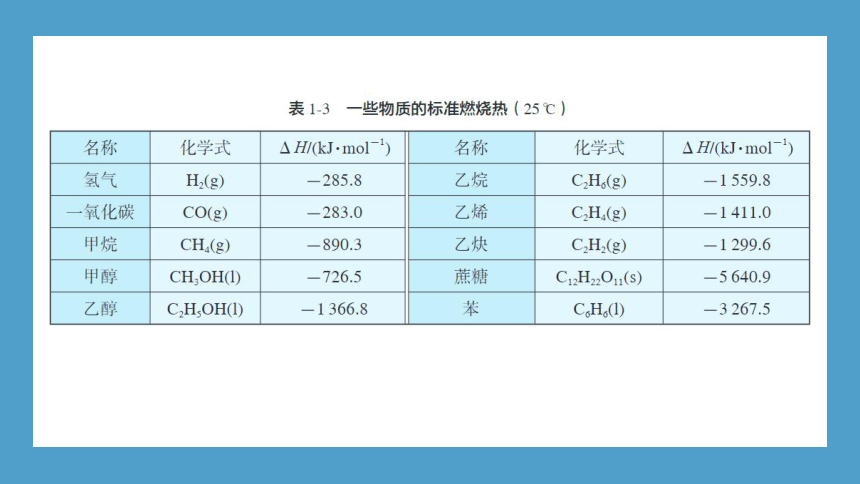
由表1-3所示物质的标准燃烧热可知,在101 kPa下,1 mol H2 (g) 与1 mol CO(g)完全燃烧放出的热,分别为285.8 kJ和283.0 kJ,两者非常接近。对气体而言,热值较大的有H2、CH4、C2H6等。
=可燃物的物质的量×标准燃烧热
物质完全燃烧放出的热量
标准燃烧热 中和热
相同点 能量变化
△H
不同点 标准
含义
标准燃烧热和中和热的区别与联系
放热反应
△H<0,单位相同
1mol可燃物
生成1mol水
1mol反应物完全燃烧放出的热量,不同反应物,标准燃烧热不同
中和反应生成1mol水放出的热量,强酸强碱中和热的数值都约为57.3kJ/mol
选择决策
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:
C(s)、CO(g) 和 H2(g) 完全燃烧的热化学方程式分别为:
甲同学根据1 mol CO(g)和1 mol H2 (g) 燃烧放出的热的总和比1 mol C(s) 燃烧放出的热多,认为:“煤炭燃烧时加少量的水,可以使煤炭燃烧放出更多的热。”
乙同学根据盖斯定律作出了下列循环图:
乙同学认为:“将煤转化为水煤气再燃烧放出的热与直接燃烧煤放出的热一样多,而将煤转化为水煤气会增加消耗,因此,将煤转化为水煤气得不偿失。”
将煤转化为水煤气在燃烧放出的热量与直接燃烧放出的热量相等,且将煤转化为水煤气会增加能耗,但是将煤转化为水煤气有两个优点:
1.固体煤转化为气体,极大的提高燃烧效率。
2.通过转化除去了S,避免了SO2气体的产生。
你认为他们的观点正确吗?请将你的想法与同学交流讨论。
拓展视野
今天的人类如何选择燃料?这是一个摆在我们面前的
严峻话题。过去,我们常用一些高热值的“自然资源”(如煤、石油、天然气等)作为燃料。如19世纪前50年,人类多采用木材作为燃料;19世纪中期开始,煤的使用量逐渐上升;20世纪中期,石油、天然气的使用量占绝对优势。
燃料的选择
工业和日常生活中选择何种物质作为燃料,不仅取决于
其热值大小,还与燃料的稳定性、来源、价格、运输、对环
境的影响、使用的安全性等多方面因素有关,应加以综合考
虑。在这些因素中,保护环境必须放在首位。化石燃料的大量使用造成的最大问题是环境污染。
目前,针对煤燃烧产生硫氧化物和氮氧化物的事实,常对煤进行液化和气化处理,除去有害成分,使之转化为更清洁、更便利的燃料。又如,乙硼烷是一种热值很高的燃料(其热值是煤的2倍多),但它密度小、沸点低、难储存、毒性强,所以,在一般条件下,乙硼烷会被限制用作燃料。
随着人类文明的高速发展,人类对能源的需求量迅猛增长,开发新能源成为当前国际能源研究领域的重要课题,人类理想中的新能源应具有资源丰富、可再生、无污染或少污染等特点,只有这样才能实现人类社会绿色、生态化、可持续的发展。
当前,我国大力倡导“构建清洁低碳、安全高效的能源体系”,降低能耗,努力开发和研究太阳能、氢能、风能、地热能、潮汐能和生物质能等多种形式的能源及其应用。
调查探究
1. 请查阅近年来我国消耗的化石燃料的有关数据,并与其他国家作比较,用你的观点阐述当前发展绿色能源的重要意义。
2. 请调查了解本地区厂矿企业及家庭所使用的主要燃料,用所学知识提出提高家用燃料燃烧效率的可行性建议。
1.25℃、101KPa 1g甲醇液体完全燃烧生成气态二氧化碳和液态水,放出热量22.68kJ,则表示甲醇标准燃烧热的热化学方程式正确的是( )
A.
B.
C.
D.
B
课堂训练
(2)已知丙烯的标准燃烧热为2058 kJ·mol-1,请写出丙烯燃烧的热化学方程式___________。
2.(1)已知:
① 2H2(g)+O2(g)=2H2O(l) △H1=-a kJ mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =-bkJ mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = -c kJ mol-1
写出甲醇蒸气的标准燃烧热: 。
CH3CH=CH2(g) +9/2O2(g)= 3CO2(g) + 3H2O(l) ΔH=-2058 kJ·mol-1
3.下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则浓H2SO4和Ba(OH)2反应的反应热为ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.碳燃烧生成一氧化碳时,放出的热量为碳的标准燃烧热
D.乙炔的标准燃烧热为1299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)反应的ΔH=-2599.2kJ·mol-1
D
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第一单元 化学反应的热效应
3 能源的充分利用
能源是指可以提供能量的自然资源,是国民经济和社会发展的重要物质基础,包括化石燃料、阳光、风力、流水、潮汐等。我国目前使用的主要能源仍然是化石燃料,但化石燃料的蕴藏量有限,且不可再生,因此,能源的开源节流是事关人类可持续发展的重大问题之一。
通常我们使用的能量的主要形式是热能和电能,热能主要通过燃烧煤、石油、天然气等物质而获得。从节约能源的角度考虑,怎样衡量不同物质的燃烧效率呢?
交流讨论
燃料燃烧过程中释放的热能是人类生产和生活所需要能量的重要来源。质量相同、组成不同的燃料,完全燃烧后释放的热不相等。
人们通常用标准燃烧热或热值来衡量燃料燃烧时释放的热的多少。
在101 kPa下,1 mol 物质完全燃烧的反应热叫做该物质的标准燃烧热,1 g 物质完全燃烧的反应热叫做该物质的热值。
物质完全燃烧是指物质中所含有的氮元素转化为 N2 (g),氢元素转化为 H2O(l),碳元素转化为 CO2 (g)。
由表1-3所示物质的标准燃烧热可知,在101 kPa下,1 mol H2 (g) 与1 mol CO(g)完全燃烧放出的热,分别为285.8 kJ和283.0 kJ,两者非常接近。对气体而言,热值较大的有H2、CH4、C2H6等。
=可燃物的物质的量×标准燃烧热
物质完全燃烧放出的热量
标准燃烧热 中和热
相同点 能量变化
△H
不同点 标准
含义
标准燃烧热和中和热的区别与联系
放热反应
△H<0,单位相同
1mol可燃物
生成1mol水
1mol反应物完全燃烧放出的热量,不同反应物,标准燃烧热不同
中和反应生成1mol水放出的热量,强酸强碱中和热的数值都约为57.3kJ/mol
选择决策
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:
C(s)、CO(g) 和 H2(g) 完全燃烧的热化学方程式分别为:
甲同学根据1 mol CO(g)和1 mol H2 (g) 燃烧放出的热的总和比1 mol C(s) 燃烧放出的热多,认为:“煤炭燃烧时加少量的水,可以使煤炭燃烧放出更多的热。”
乙同学根据盖斯定律作出了下列循环图:
乙同学认为:“将煤转化为水煤气再燃烧放出的热与直接燃烧煤放出的热一样多,而将煤转化为水煤气会增加消耗,因此,将煤转化为水煤气得不偿失。”
将煤转化为水煤气在燃烧放出的热量与直接燃烧放出的热量相等,且将煤转化为水煤气会增加能耗,但是将煤转化为水煤气有两个优点:
1.固体煤转化为气体,极大的提高燃烧效率。
2.通过转化除去了S,避免了SO2气体的产生。
你认为他们的观点正确吗?请将你的想法与同学交流讨论。
拓展视野
今天的人类如何选择燃料?这是一个摆在我们面前的
严峻话题。过去,我们常用一些高热值的“自然资源”(如煤、石油、天然气等)作为燃料。如19世纪前50年,人类多采用木材作为燃料;19世纪中期开始,煤的使用量逐渐上升;20世纪中期,石油、天然气的使用量占绝对优势。
燃料的选择
工业和日常生活中选择何种物质作为燃料,不仅取决于
其热值大小,还与燃料的稳定性、来源、价格、运输、对环
境的影响、使用的安全性等多方面因素有关,应加以综合考
虑。在这些因素中,保护环境必须放在首位。化石燃料的大量使用造成的最大问题是环境污染。
目前,针对煤燃烧产生硫氧化物和氮氧化物的事实,常对煤进行液化和气化处理,除去有害成分,使之转化为更清洁、更便利的燃料。又如,乙硼烷是一种热值很高的燃料(其热值是煤的2倍多),但它密度小、沸点低、难储存、毒性强,所以,在一般条件下,乙硼烷会被限制用作燃料。
随着人类文明的高速发展,人类对能源的需求量迅猛增长,开发新能源成为当前国际能源研究领域的重要课题,人类理想中的新能源应具有资源丰富、可再生、无污染或少污染等特点,只有这样才能实现人类社会绿色、生态化、可持续的发展。
当前,我国大力倡导“构建清洁低碳、安全高效的能源体系”,降低能耗,努力开发和研究太阳能、氢能、风能、地热能、潮汐能和生物质能等多种形式的能源及其应用。
调查探究
1. 请查阅近年来我国消耗的化石燃料的有关数据,并与其他国家作比较,用你的观点阐述当前发展绿色能源的重要意义。
2. 请调查了解本地区厂矿企业及家庭所使用的主要燃料,用所学知识提出提高家用燃料燃烧效率的可行性建议。
1.25℃、101KPa 1g甲醇液体完全燃烧生成气态二氧化碳和液态水,放出热量22.68kJ,则表示甲醇标准燃烧热的热化学方程式正确的是( )
A.
B.
C.
D.
B
课堂训练
(2)已知丙烯的标准燃烧热为2058 kJ·mol-1,请写出丙烯燃烧的热化学方程式___________。
2.(1)已知:
① 2H2(g)+O2(g)=2H2O(l) △H1=-a kJ mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =-bkJ mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = -c kJ mol-1
写出甲醇蒸气的标准燃烧热: 。
CH3CH=CH2(g) +9/2O2(g)= 3CO2(g) + 3H2O(l) ΔH=-2058 kJ·mol-1
3.下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则浓H2SO4和Ba(OH)2反应的反应热为ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.碳燃烧生成一氧化碳时,放出的热量为碳的标准燃烧热
D.乙炔的标准燃烧热为1299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)反应的ΔH=-2599.2kJ·mol-1
D
看
观
谢
谢
