1.2.1 原电池的工作原理 课件 (共32张PPT) 苏教版(2019) 选择性必修1
文档属性
| 名称 | 1.2.1 原电池的工作原理 课件 (共32张PPT) 苏教版(2019) 选择性必修1 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 22:34:17 | ||
图片预览








文档简介
(共32张PPT)
选 择 性 必 修 一
学
化
J
S
第二单元 化学能与电能的转化
1 原电池的工作原理
请回顾必修第二册所学的原电池,讨论其装置特点。
温故知新
1.原电池构成的条件
(1)有能自发进行的氧化还原反应
(2)活动性不同的两导体作电极:
①活动性不同的金属或非金属导体(如石墨)
②两相同的导体(如Pt黑)但吸附有不同的物质导致其活动性不同
(3)有电解质溶液;
(4)形成闭合回路
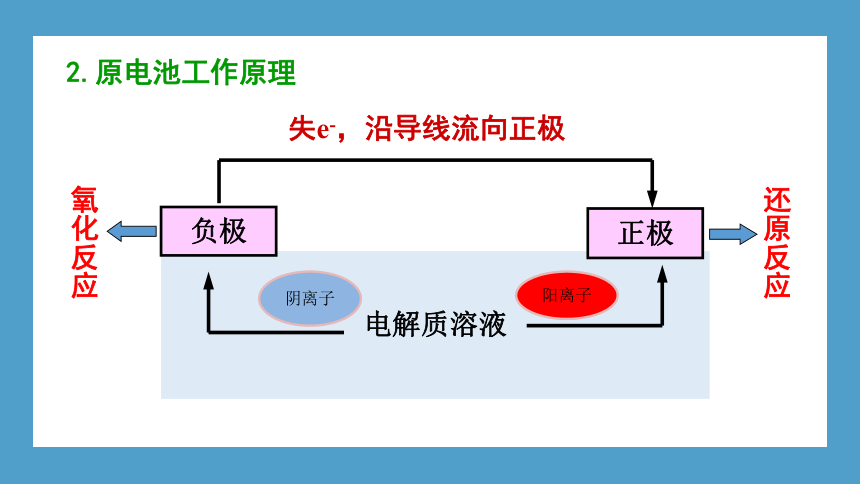
电解质溶液
失e-,沿导线流向正极
负极
正极
氧化反应
还原反应
2.原电池工作原理
阴离子
阳离子
书写该原电池的电极反应式:
Zn-2e-= Zn2+
Cu2+ + 2e-=Cu
负极
正极
Zn+ Cu2+ =Zn2++ Cu
电池反应
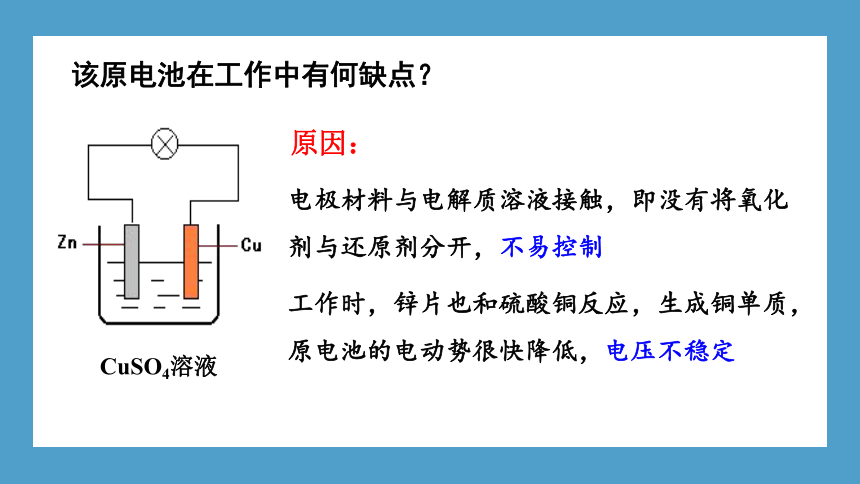
电极材料与电解质溶液接触,即没有将氧化剂与还原剂分开,不易控制
工作时,锌片也和硫酸铜反应,生成铜单质,原电池的电动势很快降低,电压不稳定
CuSO4溶液
原因:
该原电池在工作中有何缺点?
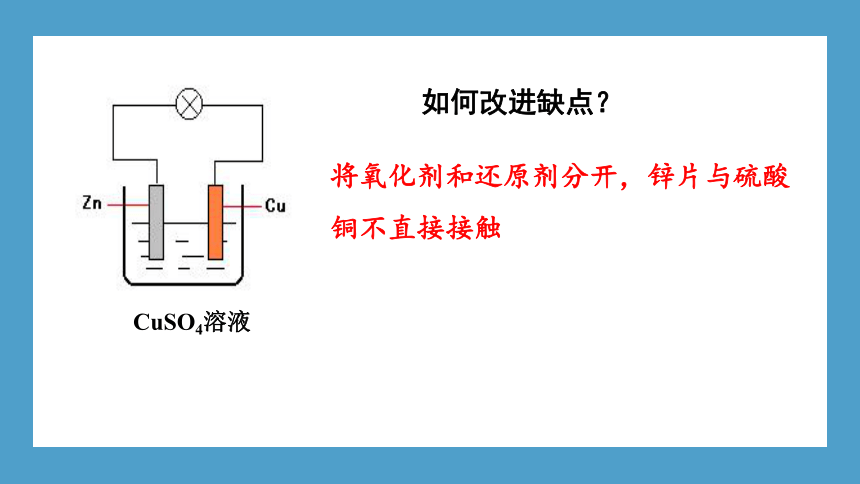
如何改进缺点?
CuSO4溶液
将氧化剂和还原剂分开,锌片与硫酸铜不直接接触
在化学必修内容学习的基础上,我们通过下列实验进一步研究原电池的工作原理。
实验探究
完成下列实验探究活动,分析锌与硫酸铜溶液反应中的能量转化。
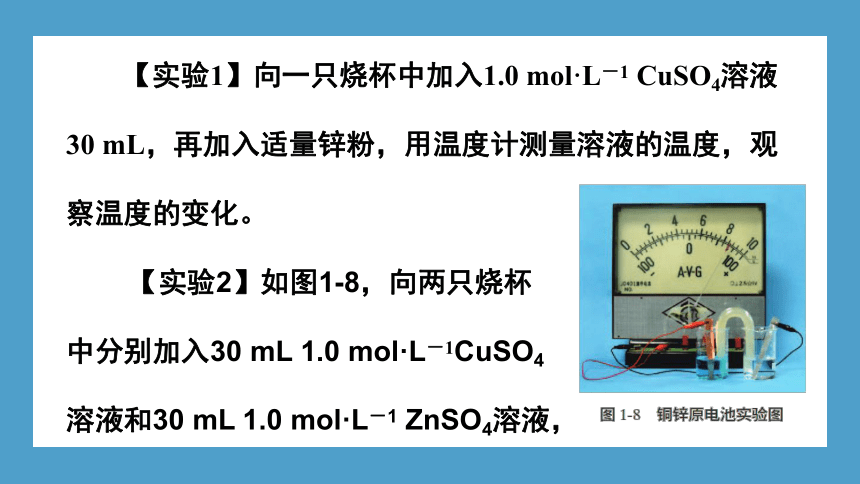
【实验1】向一只烧杯中加入1.0 mol·L-1 CuSO4溶液30 mL,再加入适量锌粉,用温度计测量溶液的温度,观察温度的变化。
【实验2】如图1-8,向两只烧杯
中分别加入30 mL 1.0 mol·L-1CuSO4
溶液和30 mL 1.0 mol·L-1 ZnSO4溶液,
将用导线与电流计相连接的锌片和铜片分别插入ZnSO4和CuSO4溶液中,将盐桥(注:盐桥中通常是装有含KCl饱和溶液的琼脂,离子在盐桥中能移动)两端分别插入两只烧杯内的电解质溶液中,观察实验现象。取出盐桥,再观察实验现象。
1、如果按下图所示, 将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液分别通过导线与电流计连接,会形成原电池吗?为什么?
ZnSO4
Zn Cu
CuSO4
A
【思考】
不会有电流产生,因为没有形成闭合回路。
2、在连个烧杯之间加一个联通装置,观察现象。
ZnSO4
Zn Cu
H2SO4
A
有稳定的电流产生,形成原电池装置。
联通两个烧杯的装置,叫做盐桥。
盐桥的作用?
1、导电,形成闭合回路。
2、提供离子,平衡电荷。
注意:若撤去盐桥或将盐桥换成导线,则不能构成闭合回路。
1. 分析图1-9,写出实验2中发生反应的化学方程式和离子方程式。
2. 指出实验1和实验2中能量变化的主要形式。
金属锌与硫酸铜溶液的反应为:
Zn(s)+Cu2+(aq) =Zn2+(aq) +Cu(s) ΔH=-216.81 kJ·mol-1
在通常情况下,该反应过程中化学能转化为热能。如果该反应在原电池中进行,化学能将转化为电能。
在如图1-8的铜锌原电池中,锌片为负极,Zn失去电子,被氧化成Zn2+ 进入ZnSO4溶液,锌片逐渐溶解。负极的电极反应式如下:
Zn-2e-=Zn2+
铜片为正极,锌片上释放的电子经过导线流向铜片,CuSO4溶液中的Cu2+从铜片上得到电子,被还原成金属铜并沉积在铜片上。正极的电极反应式如下:
Cu2++2e-=Cu
在反应中,盐桥中的Cl-移向ZnSO4溶液,K+移向CuSO4溶液,使两电解质溶液均保持电中性,氧化还原反应得以继续进行。铜锌原电池中发生的电池总反应式为:
从上述实验可以看出,原电池由两个半电池组成。半电池包括电极材料和电解质溶液,两个隔离的半电池通过盐桥连接起来。在原电池中,负极上发生氧化反应,给出电子;正极上发生还原反应,得到电子。电流通过导线由原电池的正极流向负极,即电子由负极流向正极。
双液原电池的工作原理
ZnSO4
Zn Cu
H2SO4
A
负极
Zn-2e-= Zn2+
e-
e-
Cu2+ + 2e-=Cu
正极
Zn2+
Cl-
K+
Cu2+
阳离子→正极
阴离子→负极
Cl-→负极
K+→正极
实验探究
根据离子反应Cu2++Fe=Cu+Fe2+设计一个原电池,并与同学讨论解决下列问题。
1. 画出原电池构造示意图,并指出正、负极。
2. 写出该原电池的电极反应式。
负极:
正极:
3. 参考画出的示意图,制作原电池并检测电流。
4. 你还能设计其他原电池吗?将你的设计方案与同学交流。
①将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式
②确定电极材料
负极:Fe-2e-====Fe2+
正极:Cu2+ +2e-==Cu
先确定负极材料,负极材料一般是对应的金属单质。
然后再确定正极材料。正极材料没有负极活泼。
③确定电解质溶液
电解质溶液一般要能够与负极发生反应。
④构成闭合回路
CuSO4溶液
Fe
FeSO4
Fe Cu
CuSO4
A
1.下列叙述中,可以说明金属甲比金属乙活泼性强的是( )
C.用甲、乙作电极组成原电池时,甲作负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出
B.在氧化还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
C
课堂训练
2.依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为_________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e- = Ag
Cu -2e- = Cu2+
负(Cu)
正(Ag)
盐桥
X
Y
CuSO4溶液
电流计
Ag
A
3.判断下列原电池的正、负极,并写出电极反应式和电池反应式。
【思考】
1、越活泼的金属一定作负极吗?
2、归纳电极反应式的书写方法
负极:2Al+8OH--6e-==2AlO2-+4H2O
正极:6H2O+6e-==6OH- +3H2↑
总反应:2Al+2OH-+2H2O==2AlO2-+3H2↑
稀硫酸
负极: Mg-2e-==Mg2+
正极: 2H++2e-==H2↑
总反应:Mg+2H+==Mg2++H2↑
原电池正、负极的判断方法:
(1)根据组成原电池两极的材料判断:
(2)根据现象判断:
一般溶解的一极为负极;增重或有气泡放出的为正极。
(3)根据两极的反应判断:
发生氧化反应的为负极;发生还原反应的为正极。
(4)根据电流方向或电子流动方向判断:
(5)根据电解质溶液内离子的定向移动判断:
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第二单元 化学能与电能的转化
1 原电池的工作原理
请回顾必修第二册所学的原电池,讨论其装置特点。
温故知新
1.原电池构成的条件
(1)有能自发进行的氧化还原反应
(2)活动性不同的两导体作电极:
①活动性不同的金属或非金属导体(如石墨)
②两相同的导体(如Pt黑)但吸附有不同的物质导致其活动性不同
(3)有电解质溶液;
(4)形成闭合回路
电解质溶液
失e-,沿导线流向正极
负极
正极
氧化反应
还原反应
2.原电池工作原理
阴离子
阳离子
书写该原电池的电极反应式:
Zn-2e-= Zn2+
Cu2+ + 2e-=Cu
负极
正极
Zn+ Cu2+ =Zn2++ Cu
电池反应
电极材料与电解质溶液接触,即没有将氧化剂与还原剂分开,不易控制
工作时,锌片也和硫酸铜反应,生成铜单质,原电池的电动势很快降低,电压不稳定
CuSO4溶液
原因:
该原电池在工作中有何缺点?
如何改进缺点?
CuSO4溶液
将氧化剂和还原剂分开,锌片与硫酸铜不直接接触
在化学必修内容学习的基础上,我们通过下列实验进一步研究原电池的工作原理。
实验探究
完成下列实验探究活动,分析锌与硫酸铜溶液反应中的能量转化。
【实验1】向一只烧杯中加入1.0 mol·L-1 CuSO4溶液30 mL,再加入适量锌粉,用温度计测量溶液的温度,观察温度的变化。
【实验2】如图1-8,向两只烧杯
中分别加入30 mL 1.0 mol·L-1CuSO4
溶液和30 mL 1.0 mol·L-1 ZnSO4溶液,
将用导线与电流计相连接的锌片和铜片分别插入ZnSO4和CuSO4溶液中,将盐桥(注:盐桥中通常是装有含KCl饱和溶液的琼脂,离子在盐桥中能移动)两端分别插入两只烧杯内的电解质溶液中,观察实验现象。取出盐桥,再观察实验现象。
1、如果按下图所示, 将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液分别通过导线与电流计连接,会形成原电池吗?为什么?
ZnSO4
Zn Cu
CuSO4
A
【思考】
不会有电流产生,因为没有形成闭合回路。
2、在连个烧杯之间加一个联通装置,观察现象。
ZnSO4
Zn Cu
H2SO4
A
有稳定的电流产生,形成原电池装置。
联通两个烧杯的装置,叫做盐桥。
盐桥的作用?
1、导电,形成闭合回路。
2、提供离子,平衡电荷。
注意:若撤去盐桥或将盐桥换成导线,则不能构成闭合回路。
1. 分析图1-9,写出实验2中发生反应的化学方程式和离子方程式。
2. 指出实验1和实验2中能量变化的主要形式。
金属锌与硫酸铜溶液的反应为:
Zn(s)+Cu2+(aq) =Zn2+(aq) +Cu(s) ΔH=-216.81 kJ·mol-1
在通常情况下,该反应过程中化学能转化为热能。如果该反应在原电池中进行,化学能将转化为电能。
在如图1-8的铜锌原电池中,锌片为负极,Zn失去电子,被氧化成Zn2+ 进入ZnSO4溶液,锌片逐渐溶解。负极的电极反应式如下:
Zn-2e-=Zn2+
铜片为正极,锌片上释放的电子经过导线流向铜片,CuSO4溶液中的Cu2+从铜片上得到电子,被还原成金属铜并沉积在铜片上。正极的电极反应式如下:
Cu2++2e-=Cu
在反应中,盐桥中的Cl-移向ZnSO4溶液,K+移向CuSO4溶液,使两电解质溶液均保持电中性,氧化还原反应得以继续进行。铜锌原电池中发生的电池总反应式为:
从上述实验可以看出,原电池由两个半电池组成。半电池包括电极材料和电解质溶液,两个隔离的半电池通过盐桥连接起来。在原电池中,负极上发生氧化反应,给出电子;正极上发生还原反应,得到电子。电流通过导线由原电池的正极流向负极,即电子由负极流向正极。
双液原电池的工作原理
ZnSO4
Zn Cu
H2SO4
A
负极
Zn-2e-= Zn2+
e-
e-
Cu2+ + 2e-=Cu
正极
Zn2+
Cl-
K+
Cu2+
阳离子→正极
阴离子→负极
Cl-→负极
K+→正极
实验探究
根据离子反应Cu2++Fe=Cu+Fe2+设计一个原电池,并与同学讨论解决下列问题。
1. 画出原电池构造示意图,并指出正、负极。
2. 写出该原电池的电极反应式。
负极:
正极:
3. 参考画出的示意图,制作原电池并检测电流。
4. 你还能设计其他原电池吗?将你的设计方案与同学交流。
①将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式
②确定电极材料
负极:Fe-2e-====Fe2+
正极:Cu2+ +2e-==Cu
先确定负极材料,负极材料一般是对应的金属单质。
然后再确定正极材料。正极材料没有负极活泼。
③确定电解质溶液
电解质溶液一般要能够与负极发生反应。
④构成闭合回路
CuSO4溶液
Fe
FeSO4
Fe Cu
CuSO4
A
1.下列叙述中,可以说明金属甲比金属乙活泼性强的是( )
C.用甲、乙作电极组成原电池时,甲作负极
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出
B.在氧化还原反应中,甲比乙失去的电子多
D.同价态的阳离子,甲比乙的氧化性强
C
课堂训练
2.依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;
电解质溶液Y是___________;
(2)银电极为电池的________极,
发生的电极反应为_________________
X电极上发生的电极反应为_________________;
(3)外电路中的电子是从_______电极流向________电极。
铜(或Cu)
AgNO3溶液
正
Ag++e- = Ag
Cu -2e- = Cu2+
负(Cu)
正(Ag)
盐桥
X
Y
CuSO4溶液
电流计
Ag
A
3.判断下列原电池的正、负极,并写出电极反应式和电池反应式。
【思考】
1、越活泼的金属一定作负极吗?
2、归纳电极反应式的书写方法
负极:2Al+8OH--6e-==2AlO2-+4H2O
正极:6H2O+6e-==6OH- +3H2↑
总反应:2Al+2OH-+2H2O==2AlO2-+3H2↑
稀硫酸
负极: Mg-2e-==Mg2+
正极: 2H++2e-==H2↑
总反应:Mg+2H+==Mg2++H2↑
原电池正、负极的判断方法:
(1)根据组成原电池两极的材料判断:
(2)根据现象判断:
一般溶解的一极为负极;增重或有气泡放出的为正极。
(3)根据两极的反应判断:
发生氧化反应的为负极;发生还原反应的为正极。
(4)根据电流方向或电子流动方向判断:
(5)根据电解质溶液内离子的定向移动判断:
看
观
谢
谢
