2.1.1 化学反应速率的表示方法(共32张PPT) 苏教版(2019) 选择性必修1
文档属性
| 名称 | 2.1.1 化学反应速率的表示方法(共32张PPT) 苏教版(2019) 选择性必修1 |

|
|
| 格式 | ppt | ||
| 文件大小 | 552.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
选 择 性 必 修 一
学
化
J
S
第一单元 化学反应速率
1 化学反应速率的表示方法
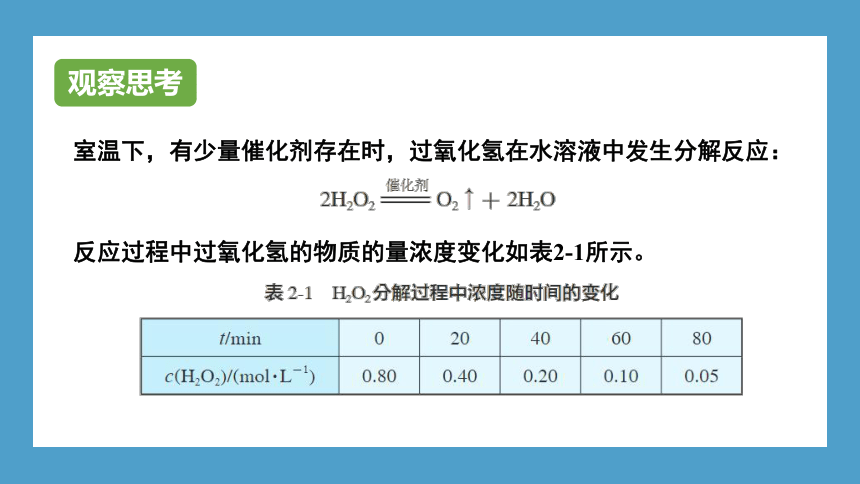
室温下,有少量催化剂存在时,过氧化氢在水溶液中发生分解反应:
观察思考
反应过程中过氧化氢的物质的量浓度变化如表2-1所示。
1. 在右边的坐标中作出H2O2分解反应的浓度-时间曲线。
2. 以10 min为时间间隔,请观察任意一个
10 min间隔内H2O2的物质的量浓度的改变
值。这些数据给你什么启迪?
化学反应速率可以用单位时间内反应物浓度(通常使用物质的量浓度)的减少或者生成物浓度的增加来表示。
对于化学反应:
aA+bB=cC+dD
若以v表示化学反应速率,Δc表示反应物或生成物物质的量浓度的变化(取绝对值),Δt表示一定的时间间隔,则A、B、C、D四种物质对应的化学反应速率为:
反应物或生成物的浓度变化的单位可以用mol·L-1表示,反应时间的单位可以用s、min、h(秒、分钟、小时)等表示。
根据 求得的反应速率是在时间间隔Δt内化学反应的平均速率。若时间间隔Δt非常小,则平均速率接近某一时刻的瞬时速率。瞬时速率也可以在物质的浓度随时间的变化曲线上通过数学方法求得。
③速率关系式: aA+bB=cC+dD,
v(A)∶v(B)∶v(C)∶v(D) = a : b : c : d
化学反应速率的特点:
①化学反应速率表示的是一段时间内的平均速率,均取正值。
②同一反应的速率可用不同物质来表示,其数值可能不同,但意义相同,表示反应速率的物质不用纯固体或纯液体。
补充:△c(A):△c(B):△c(C):△c(D)= a : b : c : d
△n(A):△n(B):△n(C):△n(D)= a : b : c : d
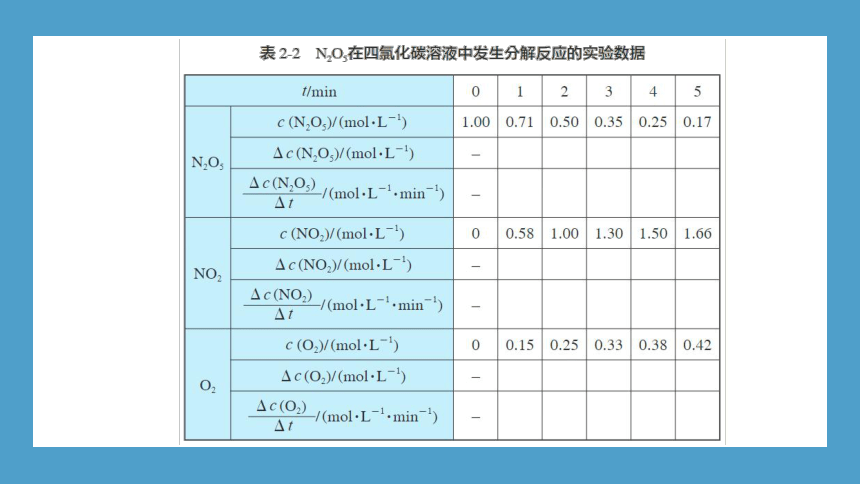
N2O5在四氯化碳溶液中的分解反应为:
2N2O5 === 4NO2+O2
实验测得,在67 °C时,反应体系中各物质的浓度随时间的变化如表2-2所示。
交流讨论
1. 请分别用反应物和生成物的物质的量浓度在单位时间内的变化来表示该反应的速率,将计算结果填入表2-2。
2. 通过计算可以发现,虽然反应物和生成物的物质的量浓度在单位时间内的变化都可表示该反应的速率,但是其数值却不一定相同。请将其数值与化学方程式中相应物质前的化学计量数进行比较,归纳总结它们之间的关系。
化学反应速率可通过实验测定。要测定不同时刻反应物或生成物的浓度,可观察、测量体系中某一物质的相关性质,再进行适当的转换和计算。例如,过氧化氢的分解反应中有气体生成,可以测量在一定温度和压强下释放出来的气体的体积;当溶液中存在有色物质时,随着反应的进行,溶液的颜色不断变化,可以用比色的方法测定溶液颜色的深浅,再根据溶液颜色的深浅与有色物质浓度的正比关系,确定反应物或生成物在不同时刻的浓度。
1.在一密闭的2L容器中装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中SO3的体积分数占混合气体的50%,请计算:
(1)2min末SO3的浓度;(2)2min内SO2的平均反应速率。
化学反应速率的计算方法
“三段式”法
△n的比等于化学计量数之比
根据题意可知:
解得:x=1.2mol
2.
△c的比等于化学计量数之比
盐酸与大理石反应生成CO2气体,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率。请完成下列化学反应速率的测定实验。
实验探究
1. 如图2-4所示,在锥形瓶中放入5 g大理石,加入20 mL1 mol ·L-1盐酸。每隔10 s观测玻璃注射器中气体的体积,将实验数据记录到表2-3中。
2. 以mL·s-1为反应速率的单位,计算每10 s时间间隔内的反应速率,将计算结果填入表2-3中。
3. 以反应时间为横坐标,产生气体的体积为纵坐标,在右边的坐标中绘制CO2气体体积[V(CO 2 )]-反应时间(t)曲线图。
4. 比较你与其他同学的实验结果,如有明显
差异,分析产生差异的可能原因。
0.4
1.0
1.1
1.3
0.9
0.8
4
14
25
38
47
55
(1)连接好仪器后,需要检查___________,再加入药品进行实验.
(2)从反应速率随时间变化的数据可知,本实验中反应速率与________和__________有关.
装置气密性
溶液温度
H+的浓度
本实验除了以上方法测定反应速率外,你还能提出其他方法测定反应速率吗?
1.测定相同时间内收集CO2的体积或收集等量CO2所用的时间。
2.测定一段时间内剩余CaCO3的质量。
3.测定一段时间内H+浓度的变化。
上述实验是在一定温度和压强下,测定一定时间内释放的二氧化碳气体体积,直接求得其平均速率(用mL·s-1来表示),也可将CO2的体积差转化成盐酸的浓度差求算反应速率(用mol·L-1·s-1表示)。
总结:化学反应速率的测定
1.量气法
盐酸与大理石反应生成CO2气体,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率。
2.比色法
当溶液中存在有色物质时,随着反应的进行,溶液的颜色不断变化,可以用比色的方法测定溶液颜色的深浅,再根据溶液颜色的深浅与有色物质浓度的正比关系,确定反应物或生成物在不同时刻的浓度。
3.电导法
根据离子导电能力的差异,通过电导率的变化测定反应物中离子浓度变化,从而计算化学反应速率。
4.激光技术也可以应用到化学反应速率的测定。
自1850年以威廉米测定蔗糖水解反应速率作为化学动力学研究的开端至今,化学动力学的理论和实验研究取得了重大进展。其研究不仅涉及一般的反应,还涉及聚合反应、催化反应、爆炸反应、生化反应、光化学反应以及化学振荡反应等特殊反应的动力学规律。20世纪40年代基元反应速率理论提出后,化学动力学研究开始深入到微观领域。
科学史话
化学动力学的发展
由于闪光光解技术的应用,寿命短暂的自由基相继被发现。至20世纪70年代,闪光光解技术的时间分辨率达到10-9 s(纳秒,ns)和10-12 s(皮秒,ps)的水平。而激光技术的应用,又使化学动力学的研究进入了分子动态学的领域。
自20世纪80年代初产生了6×10-15 s(飞秒,fs)的超短光脉冲以来,许多化学和物理学家利用飞秒激光研究超快速化学、物理和生物过程的动力学。
其中,具有埃及和美国双重国籍的化学和物理学家泽维尔在利用飞秒激光脉冲研究化学反应方面取得了开拓性的进展,作出了杰出的贡献,并因此获得1999年的诺贝尔化学奖。
课堂训练
B
2.已知:反应 A + 3B = 2C + 2D
在四种不同条件下的反应速率为:
(1)v(A)=0.3 mol/(L·s) (2)v(B)=0.6 mol/(L·s)
(3)v(C)=0.4 mol/(L·s) (4)v(D)=0.45 mol/(L·s)
则该反应速率的快慢顺序为 。
(1)>(4)>(2)=(3)
3.某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:
图Ⅰ 图Ⅱ
(1)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 ________________。
(2)实验结束后,得到的结论是___________________________________。
(3)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是_______________________________。
收集到气体的体积
其他条件相同时,锌粉比锌粒反应的速率快
调节滴定管的高度使得两侧液面相平
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第一单元 化学反应速率
1 化学反应速率的表示方法
室温下,有少量催化剂存在时,过氧化氢在水溶液中发生分解反应:
观察思考
反应过程中过氧化氢的物质的量浓度变化如表2-1所示。
1. 在右边的坐标中作出H2O2分解反应的浓度-时间曲线。
2. 以10 min为时间间隔,请观察任意一个
10 min间隔内H2O2的物质的量浓度的改变
值。这些数据给你什么启迪?
化学反应速率可以用单位时间内反应物浓度(通常使用物质的量浓度)的减少或者生成物浓度的增加来表示。
对于化学反应:
aA+bB=cC+dD
若以v表示化学反应速率,Δc表示反应物或生成物物质的量浓度的变化(取绝对值),Δt表示一定的时间间隔,则A、B、C、D四种物质对应的化学反应速率为:
反应物或生成物的浓度变化的单位可以用mol·L-1表示,反应时间的单位可以用s、min、h(秒、分钟、小时)等表示。
根据 求得的反应速率是在时间间隔Δt内化学反应的平均速率。若时间间隔Δt非常小,则平均速率接近某一时刻的瞬时速率。瞬时速率也可以在物质的浓度随时间的变化曲线上通过数学方法求得。
③速率关系式: aA+bB=cC+dD,
v(A)∶v(B)∶v(C)∶v(D) = a : b : c : d
化学反应速率的特点:
①化学反应速率表示的是一段时间内的平均速率,均取正值。
②同一反应的速率可用不同物质来表示,其数值可能不同,但意义相同,表示反应速率的物质不用纯固体或纯液体。
补充:△c(A):△c(B):△c(C):△c(D)= a : b : c : d
△n(A):△n(B):△n(C):△n(D)= a : b : c : d
N2O5在四氯化碳溶液中的分解反应为:
2N2O5 === 4NO2+O2
实验测得,在67 °C时,反应体系中各物质的浓度随时间的变化如表2-2所示。
交流讨论
1. 请分别用反应物和生成物的物质的量浓度在单位时间内的变化来表示该反应的速率,将计算结果填入表2-2。
2. 通过计算可以发现,虽然反应物和生成物的物质的量浓度在单位时间内的变化都可表示该反应的速率,但是其数值却不一定相同。请将其数值与化学方程式中相应物质前的化学计量数进行比较,归纳总结它们之间的关系。
化学反应速率可通过实验测定。要测定不同时刻反应物或生成物的浓度,可观察、测量体系中某一物质的相关性质,再进行适当的转换和计算。例如,过氧化氢的分解反应中有气体生成,可以测量在一定温度和压强下释放出来的气体的体积;当溶液中存在有色物质时,随着反应的进行,溶液的颜色不断变化,可以用比色的方法测定溶液颜色的深浅,再根据溶液颜色的深浅与有色物质浓度的正比关系,确定反应物或生成物在不同时刻的浓度。
1.在一密闭的2L容器中装有4molSO2和2molO2,在一定条件下开始反应。2min末测得容器中SO3的体积分数占混合气体的50%,请计算:
(1)2min末SO3的浓度;(2)2min内SO2的平均反应速率。
化学反应速率的计算方法
“三段式”法
△n的比等于化学计量数之比
根据题意可知:
解得:x=1.2mol
2.
△c的比等于化学计量数之比
盐酸与大理石反应生成CO2气体,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率。请完成下列化学反应速率的测定实验。
实验探究
1. 如图2-4所示,在锥形瓶中放入5 g大理石,加入20 mL1 mol ·L-1盐酸。每隔10 s观测玻璃注射器中气体的体积,将实验数据记录到表2-3中。
2. 以mL·s-1为反应速率的单位,计算每10 s时间间隔内的反应速率,将计算结果填入表2-3中。
3. 以反应时间为横坐标,产生气体的体积为纵坐标,在右边的坐标中绘制CO2气体体积[V(CO 2 )]-反应时间(t)曲线图。
4. 比较你与其他同学的实验结果,如有明显
差异,分析产生差异的可能原因。
0.4
1.0
1.1
1.3
0.9
0.8
4
14
25
38
47
55
(1)连接好仪器后,需要检查___________,再加入药品进行实验.
(2)从反应速率随时间变化的数据可知,本实验中反应速率与________和__________有关.
装置气密性
溶液温度
H+的浓度
本实验除了以上方法测定反应速率外,你还能提出其他方法测定反应速率吗?
1.测定相同时间内收集CO2的体积或收集等量CO2所用的时间。
2.测定一段时间内剩余CaCO3的质量。
3.测定一段时间内H+浓度的变化。
上述实验是在一定温度和压强下,测定一定时间内释放的二氧化碳气体体积,直接求得其平均速率(用mL·s-1来表示),也可将CO2的体积差转化成盐酸的浓度差求算反应速率(用mol·L-1·s-1表示)。
总结:化学反应速率的测定
1.量气法
盐酸与大理石反应生成CO2气体,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率。
2.比色法
当溶液中存在有色物质时,随着反应的进行,溶液的颜色不断变化,可以用比色的方法测定溶液颜色的深浅,再根据溶液颜色的深浅与有色物质浓度的正比关系,确定反应物或生成物在不同时刻的浓度。
3.电导法
根据离子导电能力的差异,通过电导率的变化测定反应物中离子浓度变化,从而计算化学反应速率。
4.激光技术也可以应用到化学反应速率的测定。
自1850年以威廉米测定蔗糖水解反应速率作为化学动力学研究的开端至今,化学动力学的理论和实验研究取得了重大进展。其研究不仅涉及一般的反应,还涉及聚合反应、催化反应、爆炸反应、生化反应、光化学反应以及化学振荡反应等特殊反应的动力学规律。20世纪40年代基元反应速率理论提出后,化学动力学研究开始深入到微观领域。
科学史话
化学动力学的发展
由于闪光光解技术的应用,寿命短暂的自由基相继被发现。至20世纪70年代,闪光光解技术的时间分辨率达到10-9 s(纳秒,ns)和10-12 s(皮秒,ps)的水平。而激光技术的应用,又使化学动力学的研究进入了分子动态学的领域。
自20世纪80年代初产生了6×10-15 s(飞秒,fs)的超短光脉冲以来,许多化学和物理学家利用飞秒激光研究超快速化学、物理和生物过程的动力学。
其中,具有埃及和美国双重国籍的化学和物理学家泽维尔在利用飞秒激光脉冲研究化学反应方面取得了开拓性的进展,作出了杰出的贡献,并因此获得1999年的诺贝尔化学奖。
课堂训练
B
2.已知:反应 A + 3B = 2C + 2D
在四种不同条件下的反应速率为:
(1)v(A)=0.3 mol/(L·s) (2)v(B)=0.6 mol/(L·s)
(3)v(C)=0.4 mol/(L·s) (4)v(D)=0.45 mol/(L·s)
则该反应速率的快慢顺序为 。
(1)>(4)>(2)=(3)
3.某学生设计如下图Ⅰ装置,测定2 mol/L的硫酸与锌粒和锌粉反应的速率。请回答:
图Ⅰ 图Ⅱ
(1)按照图Ⅰ装置实验时,他限定了两次实验时间均为10 min,他还需要测定的另一个数据是 ________________。
(2)实验结束后,得到的结论是___________________________________。
(3)该生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是_______________________________。
收集到气体的体积
其他条件相同时,锌粉比锌粒反应的速率快
调节滴定管的高度使得两侧液面相平
看
观
谢
谢
