2.3.2压强变化对化学平衡的影响课件(共15张ppt)苏教版选择性必修1
文档属性
| 名称 | 2.3.2压强变化对化学平衡的影响课件(共15张ppt)苏教版选择性必修1 |

|
|
| 格式 | ppt | ||
| 文件大小 | 732.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 00:00:00 | ||
图片预览





文档简介
(共15张PPT)
选 择 性 必 修 一
学
化
J
S
第三单元 化学平衡的移动
2 压强变化对化学平衡的影响
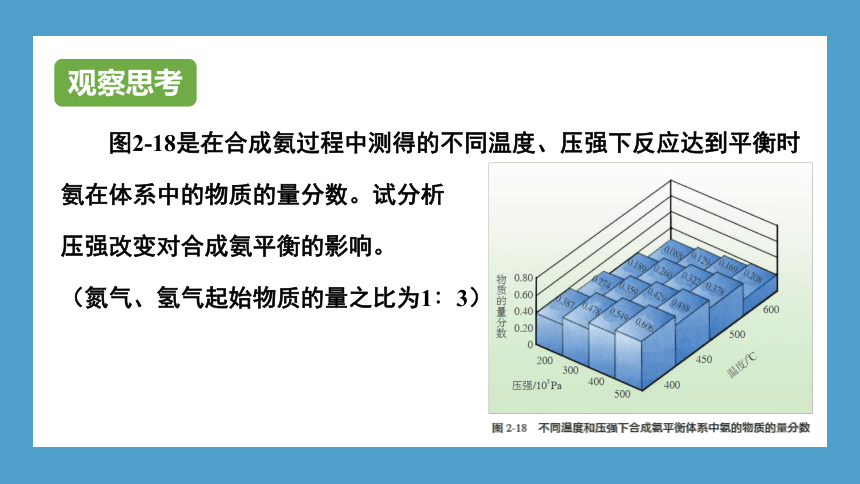
图2-18是在合成氨过程中测得的不同温度、压强下反应达到平衡时氨在体系中的物质的量分数。试分析
压强改变对合成氨平衡的影响。
(氮气、氢气起始物质的量之比为1∶3)
观察思考
在一定温度下,对某些有气体参加的可逆反应,通过改变反应容器的体积改变体系的压强,即改变了平衡体系中各物质的浓度,我们就可以通过浓度的变化运用Qc和K的关系分析压强对化学平衡移动的影响。
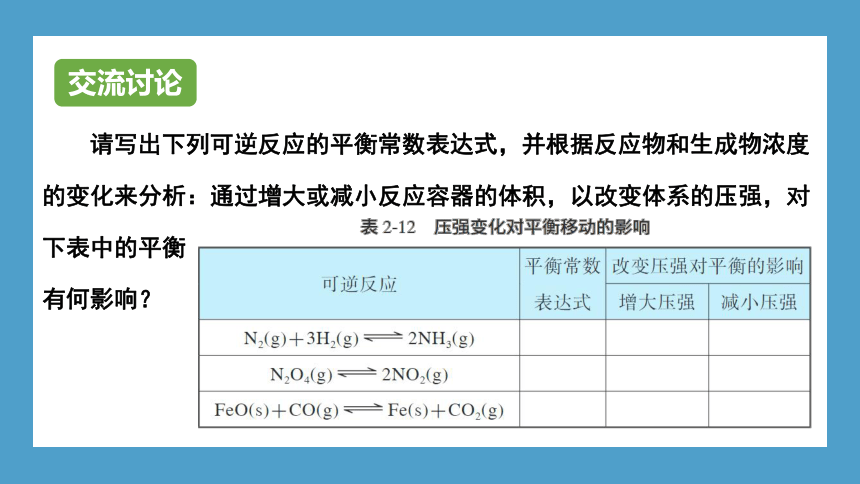
请写出下列可逆反应的平衡常数表达式,并根据反应物和生成物浓度的变化来分析:通过增大或减小反应容器的体积,以改变体系的压强,对下表中的平衡
有何影响?
交流讨论
若将有气体参加的可逆反应简单表示成:
则平衡常数可表示为:
减小容器的体积以增大压强,则反应物的浓度和生成物的浓度将同时增大。
分析体系压强的改变对物质浓度的影响,不难发现:
若a > b,即正反应方向是气体分子数目减小的反应,增大压强,平衡正向(气态物质分子数减少的方向)移动;
若a = b,即反应前后气体分子数目不变的反应,改变反应体系的压强,平衡不发生移动;
若a < b,即正反应方向是气体分子数目增大的反应,增大压强,平衡逆向(气态物质分子数减少的方向)移动。
反应2NO2 N2O4是ΔV≠0的可逆反应,反应物NO2是红棕色气体,生成物N2O4是无色气体。反应体系的颜色深浅与体系中NO2的浓度成正比。色度传感器(也称色度计)能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。
拓展视野
利用色度传感器探究压强对化学平衡的影响
按图2-19连接好实验装置,在注射器中收集一定量的NO2气体。打开实验模板,校正色度计,再推动注射器的活塞将一定量的NO2充入比色皿中,并将注射器的活塞上下移动几次使气体混合均匀。将比色皿置于色度计样品槽内,点击“开始”,并通过推拉注射器活塞改变体系压强,系统自动记录透射率的变化(图2-20)。
图2-20中,A B段是将活塞迅速向下推时透射率的瞬间变化,此时因体系体积减小导致NO2浓度瞬间增大;而B C段的透射率增大,NO 2浓度减小,说明平衡正向发生了移动;C D段表示体系在此压强下又达到一个新的平衡状态;D E段是松开活塞,体系又恢复到原来的平衡状态的反映。A D段的数据表明:增大压强平衡向着气体体积减小的方向发生了移动。请你尝试解释E J中各段透射率变化的原因,并将你的结论与同学交流。
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2 2NH3。已知加入1molN2和4mol H2时,达到平衡后生成amolNH3。在恒温恒压下欲保持平衡时各组分的体积分数不变。填写下列空白:
课堂训练
已知
编号 起始状态物质的量(mol) 平衡时NH3的物质的量(mol)
N2 H2 NH3
1 4 0 a
(1) 1.5 6 0
(2) 1 0.5a
0
0.5
1.5a
小结
条件 等效条件 结果
恒温恒容 投料换算成相同物质表示时量相同 两次平衡时各组分百分含量、n、c均相同(全等平衡)
恒温恒容
(△n(g)=0) 投料换算成相同物质表示时等比例 两平衡时各组分百分含量相同,n、c同比例变化 (相似平衡)
恒温恒压 投料换算成相同物质表示时等比例 两次平衡时各组分百分含量、c相同,n同比例变化( 相似平衡)
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第三单元 化学平衡的移动
2 压强变化对化学平衡的影响
图2-18是在合成氨过程中测得的不同温度、压强下反应达到平衡时氨在体系中的物质的量分数。试分析
压强改变对合成氨平衡的影响。
(氮气、氢气起始物质的量之比为1∶3)
观察思考
在一定温度下,对某些有气体参加的可逆反应,通过改变反应容器的体积改变体系的压强,即改变了平衡体系中各物质的浓度,我们就可以通过浓度的变化运用Qc和K的关系分析压强对化学平衡移动的影响。
请写出下列可逆反应的平衡常数表达式,并根据反应物和生成物浓度的变化来分析:通过增大或减小反应容器的体积,以改变体系的压强,对下表中的平衡
有何影响?
交流讨论
若将有气体参加的可逆反应简单表示成:
则平衡常数可表示为:
减小容器的体积以增大压强,则反应物的浓度和生成物的浓度将同时增大。
分析体系压强的改变对物质浓度的影响,不难发现:
若a > b,即正反应方向是气体分子数目减小的反应,增大压强,平衡正向(气态物质分子数减少的方向)移动;
若a = b,即反应前后气体分子数目不变的反应,改变反应体系的压强,平衡不发生移动;
若a < b,即正反应方向是气体分子数目增大的反应,增大压强,平衡逆向(气态物质分子数减少的方向)移动。
反应2NO2 N2O4是ΔV≠0的可逆反应,反应物NO2是红棕色气体,生成物N2O4是无色气体。反应体系的颜色深浅与体系中NO2的浓度成正比。色度传感器(也称色度计)能感受被分辨物体的色度,并转换成可输出信号由计算机自动记录透射率的变化,颜色越深,透射率越小。
拓展视野
利用色度传感器探究压强对化学平衡的影响
按图2-19连接好实验装置,在注射器中收集一定量的NO2气体。打开实验模板,校正色度计,再推动注射器的活塞将一定量的NO2充入比色皿中,并将注射器的活塞上下移动几次使气体混合均匀。将比色皿置于色度计样品槽内,点击“开始”,并通过推拉注射器活塞改变体系压强,系统自动记录透射率的变化(图2-20)。
图2-20中,A B段是将活塞迅速向下推时透射率的瞬间变化,此时因体系体积减小导致NO2浓度瞬间增大;而B C段的透射率增大,NO 2浓度减小,说明平衡正向发生了移动;C D段表示体系在此压强下又达到一个新的平衡状态;D E段是松开活塞,体系又恢复到原来的平衡状态的反映。A D段的数据表明:增大压强平衡向着气体体积减小的方向发生了移动。请你尝试解释E J中各段透射率变化的原因,并将你的结论与同学交流。
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2 2NH3。已知加入1molN2和4mol H2时,达到平衡后生成amolNH3。在恒温恒压下欲保持平衡时各组分的体积分数不变。填写下列空白:
课堂训练
已知
编号 起始状态物质的量(mol) 平衡时NH3的物质的量(mol)
N2 H2 NH3
1 4 0 a
(1) 1.5 6 0
(2) 1 0.5a
0
0.5
1.5a
小结
条件 等效条件 结果
恒温恒容 投料换算成相同物质表示时量相同 两次平衡时各组分百分含量、n、c均相同(全等平衡)
恒温恒容
(△n(g)=0) 投料换算成相同物质表示时等比例 两平衡时各组分百分含量相同,n、c同比例变化 (相似平衡)
恒温恒压 投料换算成相同物质表示时等比例 两次平衡时各组分百分含量、c相同,n同比例变化( 相似平衡)
看
观
谢
谢
