3.3.2 影响盐类水解的因素 课件(共15张PPT)
文档属性
| 名称 | 3.3.2 影响盐类水解的因素 课件(共15张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 318.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 11:25:09 | ||
图片预览






文档简介
(共15张PPT)
选 择 性 必 修 一
学
化
J
S
第三单元 盐类的水解
2 影响盐类水解的因素
我们已经知道,化学平衡会受到浓度、温度等因素的影响。盐类的水解也是一种水溶液中的化学平衡,那么这些因素会怎样影响盐类的水解平衡呢?
已知HClO、CH3COOH、HNO2都是弱酸,25 °C时它们的电离平衡常数依次为2.95×10-8、1.8×10-5、5.6×10-4。试推测0.1 mol·L-1 NaClO、CH3COONa、NaNO2溶液pH的大小顺序。用pH计测量上述溶液的pH,将测定的结果与你的推测相比较,并对实验结果进行解释。
实验探究
在盐类水解的过程中,若生成的弱电解质越难电离,则生成弱电解质的倾向越大,盐水解的程度就越大,溶液中c(H+)和c(OH-)的差别越大。也就是说,盐自身的组成和性质对其在水溶液中的水解平衡有着本质影响。
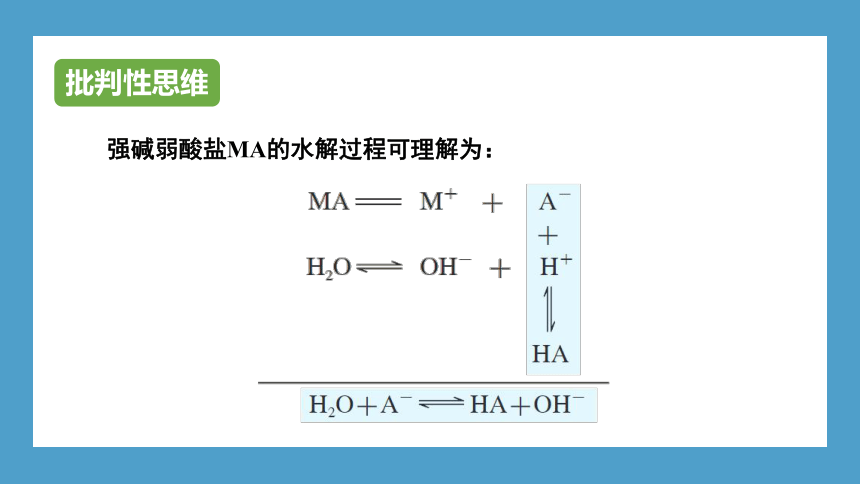
强碱弱酸盐MA的水解过程可理解为:
批判性思维
1. 请写出水解反应A-+H2O HA+OH-的平衡常数(Kh)的表达式。
2. 若常温下弱酸HA的电离平衡常数为Ka,水的离子积常数为Kw,请分析Kh与Ka和Kw间的关系。
3. 根据2的结论,你是否能发现盐的水解程度与盐的相对应的弱酸或弱碱的强弱之间的关系?把你的想法与同学进行交流。
除了盐的组成外,温度、盐溶液的浓度和溶液的酸碱性等因素对盐类的水解平衡也存在着一定的影响。
1. 从Fe(NO3)3的组成上看,Fe(NO3)3在溶液中是否容易发生水解?水解的产物是什么?Fe(NO3)3溶液的酸碱性如何?请简要分析并写出Fe(NO3)3水解的化学方程式和离子方程式。
观察思考
2. 观察下列实验,将实验现象、实验结论以及对实验结果的解释记录到表3-13中。
【实验1】在小烧杯中加入20 mL 0.1 mol·L-1 Fe(NO3)3溶液,用pH计测量该溶液的pH。
【实验2】在另一只小烧杯中加入5 mL 0.1 mol·L-1 Fe(NO3)3溶液,加水稀释到50 mL,请预测稀释后溶液的pH。用pH计测量稀释后溶液的pH,将所得数据与你的预测进行比较。
【实验3】在A、B、C三支试管中各加入相同体积0.1 mol·L-1
Fe(NO3)3溶液。将A试管在酒精灯火焰上加热到溶液沸腾,向B试管中加入3滴6 mol·L-1 HNO3溶液。观察A、B试管中溶液的颜色,并与C试管进行比较。
实验表明,盐溶液的浓度越小,水解的程度越大;水解反应是中和反应的逆过程,是吸热反应,升高温度能够促进盐类的水解;溶液的酸碱性对盐类水解的影响与盐的类型有关,酸性溶液能抑制强酸弱碱盐的水解,碱性溶液能抑制强碱弱酸盐的水解。
在科学研究和生产、生活中,人们常常根据需要促进或抑制盐的水解。例如,在实验室配制氯化铁溶液时,先将氯化铁溶于盐酸,再加水稀释,增加溶液中氢离子的浓度以抑制铁离子的水解;制备氢氧化铁胶体时,向沸水中滴加氯化铁溶液,持续加热保持沸腾以促进铁离子的水解。又如,人们常将纯碱溶于热水中清洗油污,通过升高温度促进纯碱水解以增强溶液的碱性,增强去污效果。
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第三单元 盐类的水解
2 影响盐类水解的因素
我们已经知道,化学平衡会受到浓度、温度等因素的影响。盐类的水解也是一种水溶液中的化学平衡,那么这些因素会怎样影响盐类的水解平衡呢?
已知HClO、CH3COOH、HNO2都是弱酸,25 °C时它们的电离平衡常数依次为2.95×10-8、1.8×10-5、5.6×10-4。试推测0.1 mol·L-1 NaClO、CH3COONa、NaNO2溶液pH的大小顺序。用pH计测量上述溶液的pH,将测定的结果与你的推测相比较,并对实验结果进行解释。
实验探究
在盐类水解的过程中,若生成的弱电解质越难电离,则生成弱电解质的倾向越大,盐水解的程度就越大,溶液中c(H+)和c(OH-)的差别越大。也就是说,盐自身的组成和性质对其在水溶液中的水解平衡有着本质影响。
强碱弱酸盐MA的水解过程可理解为:
批判性思维
1. 请写出水解反应A-+H2O HA+OH-的平衡常数(Kh)的表达式。
2. 若常温下弱酸HA的电离平衡常数为Ka,水的离子积常数为Kw,请分析Kh与Ka和Kw间的关系。
3. 根据2的结论,你是否能发现盐的水解程度与盐的相对应的弱酸或弱碱的强弱之间的关系?把你的想法与同学进行交流。
除了盐的组成外,温度、盐溶液的浓度和溶液的酸碱性等因素对盐类的水解平衡也存在着一定的影响。
1. 从Fe(NO3)3的组成上看,Fe(NO3)3在溶液中是否容易发生水解?水解的产物是什么?Fe(NO3)3溶液的酸碱性如何?请简要分析并写出Fe(NO3)3水解的化学方程式和离子方程式。
观察思考
2. 观察下列实验,将实验现象、实验结论以及对实验结果的解释记录到表3-13中。
【实验1】在小烧杯中加入20 mL 0.1 mol·L-1 Fe(NO3)3溶液,用pH计测量该溶液的pH。
【实验2】在另一只小烧杯中加入5 mL 0.1 mol·L-1 Fe(NO3)3溶液,加水稀释到50 mL,请预测稀释后溶液的pH。用pH计测量稀释后溶液的pH,将所得数据与你的预测进行比较。
【实验3】在A、B、C三支试管中各加入相同体积0.1 mol·L-1
Fe(NO3)3溶液。将A试管在酒精灯火焰上加热到溶液沸腾,向B试管中加入3滴6 mol·L-1 HNO3溶液。观察A、B试管中溶液的颜色,并与C试管进行比较。
实验表明,盐溶液的浓度越小,水解的程度越大;水解反应是中和反应的逆过程,是吸热反应,升高温度能够促进盐类的水解;溶液的酸碱性对盐类水解的影响与盐的类型有关,酸性溶液能抑制强酸弱碱盐的水解,碱性溶液能抑制强碱弱酸盐的水解。
在科学研究和生产、生活中,人们常常根据需要促进或抑制盐的水解。例如,在实验室配制氯化铁溶液时,先将氯化铁溶于盐酸,再加水稀释,增加溶液中氢离子的浓度以抑制铁离子的水解;制备氢氧化铁胶体时,向沸水中滴加氯化铁溶液,持续加热保持沸腾以促进铁离子的水解。又如,人们常将纯碱溶于热水中清洗油污,通过升高温度促进纯碱水解以增强溶液的碱性,增强去污效果。
看
观
谢
谢
