3.3.1 盐类水解的原理 课件(共17张PPT)
文档属性
| 名称 | 3.3.1 盐类水解的原理 课件(共17张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 650.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 00:00:00 | ||
图片预览






文档简介
(共17张PPT)
选 择 性 必 修 一
学
化
J
S
第三单元 盐类的水解
1 盐类水解的原理
从组成看,Na2CO3、NaHCO3都是盐,为什么其水溶液均显碱性?为什么铵盐(如NH4Cl等)用作化肥时不能与碱性物质混合使用?
温故知新
我们已经知道,酸的水溶液显酸性,碱的水溶液显碱性。那么,有的盐溶液为什么也有一定的酸碱性呢?
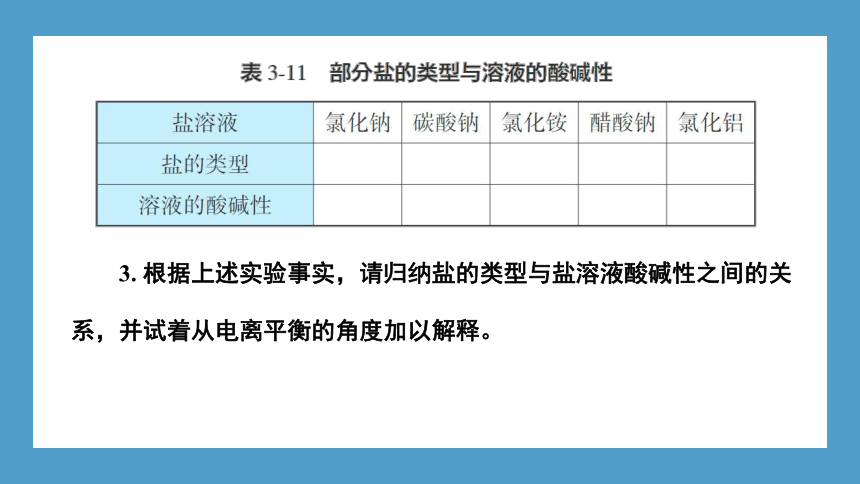
1. 根据形成该盐的酸和碱的强弱,将表3-11中的盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类填空。
2. 请选择合适的实验方法测定下列溶液的酸碱性,并将结果记录在表3-11中。
实验探究
3. 根据上述实验事实,请归纳盐的类型与盐溶液酸碱性之间的关系,并试着从电离平衡的角度加以解释。
实验表明,并非所有盐的溶液都显中性。一般来说,强酸强碱盐(如NaCl、KNO3等)的溶液显中性,强酸弱碱盐[如NH4Cl、AlCl3、Fe2(SO4)3等]的溶液显酸性,强碱弱酸盐(如Na2SO3、K2CO3、CH3COONa等)的溶液显碱性。
从微观上看,溶液的酸碱性取决于溶液中哪些微粒浓度的变化?为什么不同类型的盐溶于水后,溶液的酸碱性会有差异?
批判性思维
弱酸或弱碱形成的盐溶于水后,弱酸的酸根阴离子或弱碱的金属阳离子(或铵根离子)会与水电离出的H+ 或OH- 结合生成弱电解质,导致溶液中c(H+)和c(OH-)的相对大小发生改变,使溶液呈现酸性或碱性。
氯化钠溶于水后电离出的Na+ 和Cl- 都不能与水电离出的H+ 或OH- 结合,溶液中c(H+)=c(OH-),溶液保持中性。因此,强酸强碱盐溶于水后,溶液显中性。
氯化铵溶于水后电离出NH4+和Cl-,NH4+与水电离出的OH-结合生成弱电解质NH3·H2O,导致溶液中c(H+)>c(OH-),溶液变为酸性。因此,强酸弱碱盐溶于水后,溶液显酸性。
醋酸钠溶于水后电离出Na+和CH3COO- ,CH3COO-与水电离出的H+结合生成弱电解质CH3COOH,导致溶液中c(H+)<c(OH-),溶液变为碱性。因此,强碱弱酸盐溶于水后,溶液显碱性。
由此可见,盐溶于水后电离出的阳离子或阴离子结合水电离出的OH- 或H+ 生成弱电解质,促使水的电离平衡向着水电离的方向移动,最终使盐溶液显示酸性或碱性。像这样,盐在水溶液中电离出的离子与水电离出的H+ 或OH- 结合生成弱电解质的反应,称为盐类的水解。
由于盐类的水解过程是一个可逆过程,因此在书写水解反应的化学方程式时,应用“ ”代替“ ”。例如,醋酸钠的水解反应可用如下化学方程式表示:
或用如下离子方程式表示:
多元弱酸的酸根水解是分步进行的。例如,碳酸钠的水解反应分两步进行,各步反应的离子方程式可表示为:
其中,第一步水解的程度要远大于第二步水解的程度。
1. 推测NH4NO3溶液和NaClO溶液的酸碱性,说出你的理由,并写出上述盐发生水解反应的化学方程式和离子方程式。
2. 实验测得常温下NaHCO3溶液的pH>7,请从电离和水解两方面分析NaHCO3溶液显碱性的原因。
学以致用
通过分析盐类水解的过程可以发现,盐类的水解平衡可用如下表达式表示:
盐类的水解反应可以看成酸碱中和反应的逆过程。我们可以根据生成盐的酸和碱的相对强弱,来判断盐溶液的酸碱性。
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第三单元 盐类的水解
1 盐类水解的原理
从组成看,Na2CO3、NaHCO3都是盐,为什么其水溶液均显碱性?为什么铵盐(如NH4Cl等)用作化肥时不能与碱性物质混合使用?
温故知新
我们已经知道,酸的水溶液显酸性,碱的水溶液显碱性。那么,有的盐溶液为什么也有一定的酸碱性呢?
1. 根据形成该盐的酸和碱的强弱,将表3-11中的盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类填空。
2. 请选择合适的实验方法测定下列溶液的酸碱性,并将结果记录在表3-11中。
实验探究
3. 根据上述实验事实,请归纳盐的类型与盐溶液酸碱性之间的关系,并试着从电离平衡的角度加以解释。
实验表明,并非所有盐的溶液都显中性。一般来说,强酸强碱盐(如NaCl、KNO3等)的溶液显中性,强酸弱碱盐[如NH4Cl、AlCl3、Fe2(SO4)3等]的溶液显酸性,强碱弱酸盐(如Na2SO3、K2CO3、CH3COONa等)的溶液显碱性。
从微观上看,溶液的酸碱性取决于溶液中哪些微粒浓度的变化?为什么不同类型的盐溶于水后,溶液的酸碱性会有差异?
批判性思维
弱酸或弱碱形成的盐溶于水后,弱酸的酸根阴离子或弱碱的金属阳离子(或铵根离子)会与水电离出的H+ 或OH- 结合生成弱电解质,导致溶液中c(H+)和c(OH-)的相对大小发生改变,使溶液呈现酸性或碱性。
氯化钠溶于水后电离出的Na+ 和Cl- 都不能与水电离出的H+ 或OH- 结合,溶液中c(H+)=c(OH-),溶液保持中性。因此,强酸强碱盐溶于水后,溶液显中性。
氯化铵溶于水后电离出NH4+和Cl-,NH4+与水电离出的OH-结合生成弱电解质NH3·H2O,导致溶液中c(H+)>c(OH-),溶液变为酸性。因此,强酸弱碱盐溶于水后,溶液显酸性。
醋酸钠溶于水后电离出Na+和CH3COO- ,CH3COO-与水电离出的H+结合生成弱电解质CH3COOH,导致溶液中c(H+)<c(OH-),溶液变为碱性。因此,强碱弱酸盐溶于水后,溶液显碱性。
由此可见,盐溶于水后电离出的阳离子或阴离子结合水电离出的OH- 或H+ 生成弱电解质,促使水的电离平衡向着水电离的方向移动,最终使盐溶液显示酸性或碱性。像这样,盐在水溶液中电离出的离子与水电离出的H+ 或OH- 结合生成弱电解质的反应,称为盐类的水解。
由于盐类的水解过程是一个可逆过程,因此在书写水解反应的化学方程式时,应用“ ”代替“ ”。例如,醋酸钠的水解反应可用如下化学方程式表示:
或用如下离子方程式表示:
多元弱酸的酸根水解是分步进行的。例如,碳酸钠的水解反应分两步进行,各步反应的离子方程式可表示为:
其中,第一步水解的程度要远大于第二步水解的程度。
1. 推测NH4NO3溶液和NaClO溶液的酸碱性,说出你的理由,并写出上述盐发生水解反应的化学方程式和离子方程式。
2. 实验测得常温下NaHCO3溶液的pH>7,请从电离和水解两方面分析NaHCO3溶液显碱性的原因。
学以致用
通过分析盐类水解的过程可以发现,盐类的水解平衡可用如下表达式表示:
盐类的水解反应可以看成酸碱中和反应的逆过程。我们可以根据生成盐的酸和碱的相对强弱,来判断盐溶液的酸碱性。
看
观
谢
谢
