3.2.2 酸碱中和滴定 课件(共31张PPT)
文档属性
| 名称 | 3.2.2 酸碱中和滴定 课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-20 22:39:41 | ||
图片预览











文档简介
(共31张PPT)
选 择 性 必 修 一
学
化
J
S
第二单元 溶液的酸碱性
2 酸碱中和滴定
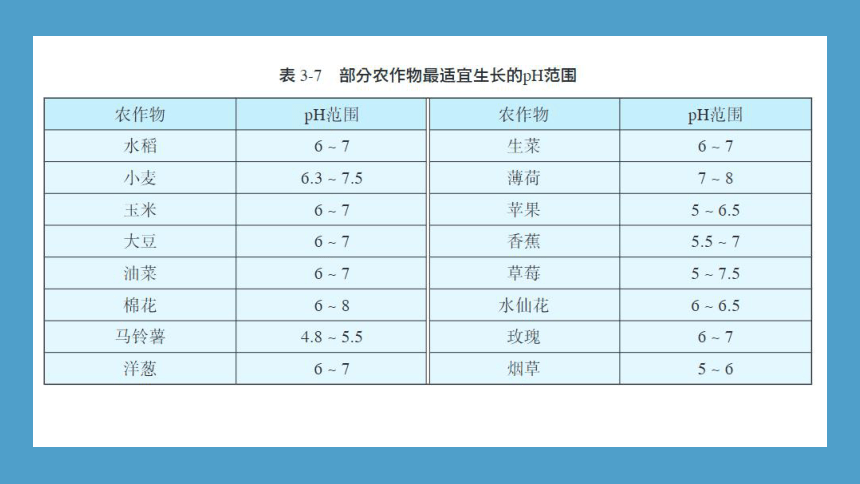
在工业生产中,溶液的pH常常是影响产品质量和产量的关键因素,人们经常利用酸碱中和反应来调节溶液的pH;在农业生产中,不同农作物对土壤酸碱性的要求不同,有不同的最适宜生长的pH范围(表3-7),人们也常用酸碱中和反应来改良土壤;在环保领域,酸性废水(或碱性废水)也是通过投入碱性物质(或酸性物质)进行中和的方法进行处理的。
所以,测定和控制溶液的酸碱性,对生产、生活和科学研究等都具有重要意义。为测定溶液的酸碱性,常用酸碱中和滴定(acid-base titration)的方法。
学科提炼
酸碱中和滴定是一种快速、准确地测量未知浓度酸、碱溶液浓度的方法。将已知浓度的酸(或碱)溶液与一定体积、未知浓度的碱(或酸)溶液反应,反应完全时测定消耗的已知浓度酸(或碱)溶液的体积,根据参加反应的酸、碱的物质的量对应关系,即可推算出未知浓度的碱(或酸)溶液的浓度。
酸碱中和滴定原理
在酸碱中和滴定的操作中,滴定管是最主要的仪器。滴定管可分为酸式滴定管和碱式滴定管,如图3-14所示。
一般来说,酸式滴定管用于盛放酸性或中性溶液,碱式滴定管用于盛放碱性溶液。还有一种既能盛放酸性溶液又能盛放碱性溶液的滴定管,它的活塞由聚四氟乙烯制成,既耐酸又耐碱,如图3-15所示。
若溶液中的物质见光易分解,则可用棕色滴定管盛放,如图3-16所示。
方法导引
1. 使用滴定管之前,应检查活塞是否漏水,确保活塞不漏水方可使用。
使用滴定管的注意事项
2. 加入酸、碱溶液之前,要用待装的酸、碱溶液分别润洗酸式滴定管、碱式滴定管内壁2~3次。方法是:从滴定管上口加入3~5 mL待装的酸或碱溶液,倾斜着转动滴定管,使液体润湿滴定管内壁;再将液体从滴定管下部放入预置的烧杯中(对于酸式滴定管,轻轻转动活塞;对于碱式滴定管,轻轻挤压玻璃球)。
3. 注入待装的酸、碱溶液至滴定管“0”刻度以上2~3 mL,用滴定管夹固定滴定管。轻轻转动酸式滴定管的活塞,或轻轻挤压碱式滴定管的玻璃球,使滴定管的尖嘴部分充满溶液,并调整管中液面至“0”或“0”刻度以下,记录读数V0。
4. 使用酸式滴定管时,用左手控制活塞,拇指在管前,食指、中指在管后,手指略微弯曲,轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液,旋转活塞,溶液即可流出。使用碱式滴定管时,左手拇指在前,食指在后,捏住乳胶管中玻璃球的偏上部位,挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出(图3-17)
5. 滴定过程中,滴加溶液的速度不能过快,一般以每秒3~4滴为宜。接近终点时,应逐渐减慢滴加的速度,减为每次加入1滴溶液。滴加完毕后记录读数V1,则反应消耗溶液的体积为V1-V0。
依据中和滴定原理和滴定的操作要求,滴定时,应选择适宜浓度的标准溶液和恰当的指示剂,及时记录实验数据。实验完成后,可绘制出滴定曲线,并根据酸与碱反应的定量关系计算出待测溶液的物质的量浓度。
实验探究
按照如下步骤,小组合作完成中和滴定曲线的绘制。
1. 向酸式滴定管中注入0.100 0 mol ·L-1盐酸,向碱式滴定管中注入0.100 0 mol·L-1氢氧化钠溶液。
2. 认真阅读pH计的使用说明,熟悉pH计的使用方法,并进行操作练习。
3. 从酸式滴定管放出20.00 mL盐酸至锥形瓶中,再滴加2滴酚酞试液作为指示剂,用pH计测定其pH并记录在表3-8中。
4. 通过碱式滴定管向盐酸中滴加氢氧化钠溶液,并不断振荡。边滴定边测定锥形瓶内溶液的pH,记录在表3-8中。反应开始时记录的间隔可稍大,接近终点时逐渐减小间隔,最终每加一滴溶液记录一次数据[可参考下列滴加溶液的间隔(单位:mL):5.00、10.00、15.00、18.00、19.00、19.60、19.95、20.00、20.05、21.00、22.00、30.00]。
5. 根据表3-8的数据,以氢氧化钠溶液的体积V为横坐标,溶液的pH为纵坐标,在下图中绘制滴定曲线。
不少酸碱中和反应无明显现象,无法通过肉眼观察来判断它们是否恰好完全反应。因此,在滴定过程中,应当使用恰当的指示剂来指示反应的终点。对于不同的酸碱中和反应,我们应根据实际情况选用指示剂。指示剂的选择可依据中和滴定曲线来确定。
拓展视野
一般来说,酸碱指示剂通常是一些有机弱酸或有机弱碱,它们在水溶液中存在着电离平衡。例如,某一弱酸型酸碱指示剂(用HIn表示)在溶液中存在着如下电离平衡:
酸碱指示剂的作用原理
HIn和In-的颜色不同。当溶液的酸碱性改变时,氢离子浓度发生变化,HIn的电离平衡发生移动,HIn和In-的浓度随之改变,颜色就会出现变化。表3-9给出了几种常见酸碱指示剂的变色范围。
从理论上来说,强酸、强碱完全反应时,溶液的pH应为7,滴定时应选用在pH=7时变色的指示剂。但从图3-20所示的中和滴定曲线上可以看出,当氢氧化钠溶液的体积从19.98 mL变为20.02 mL时,溶液的pH从4.3突跃至9.7。因此,只要选择变色范围在这一范围内的指示剂就不会造成较大的误差。
利用pH传感器技术,可以即时采集酸碱滴定过程中溶液pH的数据,并借助计算机以图像形式直观显示出来,得到反应过程中pH随加入标准溶液体积而发生变化的曲线图
(图3-21)。
基础实验
按照如下步骤测定未知浓度盐酸的物质的量浓度。
1. 向已润洗过的碱式滴定管中注入0.100 0 mol·L-1 NaOH标准溶液,调节管内液面至“0”或“0”刻度以下,记录读数V1。
2. 向已润洗过的酸式滴定管中注入未知浓度的盐酸,调节管内液面至“0”或“0”刻度以下,记录读数V2。
强酸与强碱的中和滴定
3. 取一只洁净的锥形瓶,从酸式滴定管中放出约25 mL盐酸于瓶中,记录读数V3。
4. 向盛放盐酸的锥形瓶中滴加2滴酚酞试液,将锥形瓶移至碱式滴定管下,轻轻挤压玻璃球,向锥形瓶中缓慢滴加NaOH溶液,边滴加边振荡锥形瓶。在接近终点时,半滴半滴地滴入溶液,当加入半滴后溶液恰好出现浅红色且30 s内红色不褪去,则达到滴定终点,记录滴定管读数V4。
5. 重复上述操作,并将数据填入表3-10。
6. 计算待测盐酸的物质的量浓度,求出三次测定数值的平均值。若几次测定结果相差较大,应重新进行测定。
看
观
谢
谢
选 择 性 必 修 一
学
化
J
S
第二单元 溶液的酸碱性
2 酸碱中和滴定
在工业生产中,溶液的pH常常是影响产品质量和产量的关键因素,人们经常利用酸碱中和反应来调节溶液的pH;在农业生产中,不同农作物对土壤酸碱性的要求不同,有不同的最适宜生长的pH范围(表3-7),人们也常用酸碱中和反应来改良土壤;在环保领域,酸性废水(或碱性废水)也是通过投入碱性物质(或酸性物质)进行中和的方法进行处理的。
所以,测定和控制溶液的酸碱性,对生产、生活和科学研究等都具有重要意义。为测定溶液的酸碱性,常用酸碱中和滴定(acid-base titration)的方法。
学科提炼
酸碱中和滴定是一种快速、准确地测量未知浓度酸、碱溶液浓度的方法。将已知浓度的酸(或碱)溶液与一定体积、未知浓度的碱(或酸)溶液反应,反应完全时测定消耗的已知浓度酸(或碱)溶液的体积,根据参加反应的酸、碱的物质的量对应关系,即可推算出未知浓度的碱(或酸)溶液的浓度。
酸碱中和滴定原理
在酸碱中和滴定的操作中,滴定管是最主要的仪器。滴定管可分为酸式滴定管和碱式滴定管,如图3-14所示。
一般来说,酸式滴定管用于盛放酸性或中性溶液,碱式滴定管用于盛放碱性溶液。还有一种既能盛放酸性溶液又能盛放碱性溶液的滴定管,它的活塞由聚四氟乙烯制成,既耐酸又耐碱,如图3-15所示。
若溶液中的物质见光易分解,则可用棕色滴定管盛放,如图3-16所示。
方法导引
1. 使用滴定管之前,应检查活塞是否漏水,确保活塞不漏水方可使用。
使用滴定管的注意事项
2. 加入酸、碱溶液之前,要用待装的酸、碱溶液分别润洗酸式滴定管、碱式滴定管内壁2~3次。方法是:从滴定管上口加入3~5 mL待装的酸或碱溶液,倾斜着转动滴定管,使液体润湿滴定管内壁;再将液体从滴定管下部放入预置的烧杯中(对于酸式滴定管,轻轻转动活塞;对于碱式滴定管,轻轻挤压玻璃球)。
3. 注入待装的酸、碱溶液至滴定管“0”刻度以上2~3 mL,用滴定管夹固定滴定管。轻轻转动酸式滴定管的活塞,或轻轻挤压碱式滴定管的玻璃球,使滴定管的尖嘴部分充满溶液,并调整管中液面至“0”或“0”刻度以下,记录读数V0。
4. 使用酸式滴定管时,用左手控制活塞,拇指在管前,食指、中指在管后,手指略微弯曲,轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液,旋转活塞,溶液即可流出。使用碱式滴定管时,左手拇指在前,食指在后,捏住乳胶管中玻璃球的偏上部位,挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出(图3-17)
5. 滴定过程中,滴加溶液的速度不能过快,一般以每秒3~4滴为宜。接近终点时,应逐渐减慢滴加的速度,减为每次加入1滴溶液。滴加完毕后记录读数V1,则反应消耗溶液的体积为V1-V0。
依据中和滴定原理和滴定的操作要求,滴定时,应选择适宜浓度的标准溶液和恰当的指示剂,及时记录实验数据。实验完成后,可绘制出滴定曲线,并根据酸与碱反应的定量关系计算出待测溶液的物质的量浓度。
实验探究
按照如下步骤,小组合作完成中和滴定曲线的绘制。
1. 向酸式滴定管中注入0.100 0 mol ·L-1盐酸,向碱式滴定管中注入0.100 0 mol·L-1氢氧化钠溶液。
2. 认真阅读pH计的使用说明,熟悉pH计的使用方法,并进行操作练习。
3. 从酸式滴定管放出20.00 mL盐酸至锥形瓶中,再滴加2滴酚酞试液作为指示剂,用pH计测定其pH并记录在表3-8中。
4. 通过碱式滴定管向盐酸中滴加氢氧化钠溶液,并不断振荡。边滴定边测定锥形瓶内溶液的pH,记录在表3-8中。反应开始时记录的间隔可稍大,接近终点时逐渐减小间隔,最终每加一滴溶液记录一次数据[可参考下列滴加溶液的间隔(单位:mL):5.00、10.00、15.00、18.00、19.00、19.60、19.95、20.00、20.05、21.00、22.00、30.00]。
5. 根据表3-8的数据,以氢氧化钠溶液的体积V为横坐标,溶液的pH为纵坐标,在下图中绘制滴定曲线。
不少酸碱中和反应无明显现象,无法通过肉眼观察来判断它们是否恰好完全反应。因此,在滴定过程中,应当使用恰当的指示剂来指示反应的终点。对于不同的酸碱中和反应,我们应根据实际情况选用指示剂。指示剂的选择可依据中和滴定曲线来确定。
拓展视野
一般来说,酸碱指示剂通常是一些有机弱酸或有机弱碱,它们在水溶液中存在着电离平衡。例如,某一弱酸型酸碱指示剂(用HIn表示)在溶液中存在着如下电离平衡:
酸碱指示剂的作用原理
HIn和In-的颜色不同。当溶液的酸碱性改变时,氢离子浓度发生变化,HIn的电离平衡发生移动,HIn和In-的浓度随之改变,颜色就会出现变化。表3-9给出了几种常见酸碱指示剂的变色范围。
从理论上来说,强酸、强碱完全反应时,溶液的pH应为7,滴定时应选用在pH=7时变色的指示剂。但从图3-20所示的中和滴定曲线上可以看出,当氢氧化钠溶液的体积从19.98 mL变为20.02 mL时,溶液的pH从4.3突跃至9.7。因此,只要选择变色范围在这一范围内的指示剂就不会造成较大的误差。
利用pH传感器技术,可以即时采集酸碱滴定过程中溶液pH的数据,并借助计算机以图像形式直观显示出来,得到反应过程中pH随加入标准溶液体积而发生变化的曲线图
(图3-21)。
基础实验
按照如下步骤测定未知浓度盐酸的物质的量浓度。
1. 向已润洗过的碱式滴定管中注入0.100 0 mol·L-1 NaOH标准溶液,调节管内液面至“0”或“0”刻度以下,记录读数V1。
2. 向已润洗过的酸式滴定管中注入未知浓度的盐酸,调节管内液面至“0”或“0”刻度以下,记录读数V2。
强酸与强碱的中和滴定
3. 取一只洁净的锥形瓶,从酸式滴定管中放出约25 mL盐酸于瓶中,记录读数V3。
4. 向盛放盐酸的锥形瓶中滴加2滴酚酞试液,将锥形瓶移至碱式滴定管下,轻轻挤压玻璃球,向锥形瓶中缓慢滴加NaOH溶液,边滴加边振荡锥形瓶。在接近终点时,半滴半滴地滴入溶液,当加入半滴后溶液恰好出现浅红色且30 s内红色不褪去,则达到滴定终点,记录滴定管读数V4。
5. 重复上述操作,并将数据填入表3-10。
6. 计算待测盐酸的物质的量浓度,求出三次测定数值的平均值。若几次测定结果相差较大,应重新进行测定。
看
观
谢
谢
