【高效课堂】人教A版(2019)高中化学必修2--5.1.3硫酸
文档属性
| 名称 | 【高效课堂】人教A版(2019)高中化学必修2--5.1.3硫酸 |  | |
| 格式 | pptx | ||
| 文件大小 | 46.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 09:27:36 | ||
图片预览






文档简介
(共28张PPT)
第一节 硫及其化合物
第3课时:硫酸
第五章
新人教版 化学 必修二
硫酸的工业制法
01
硫酸的性质
02
硫酸的工业制法
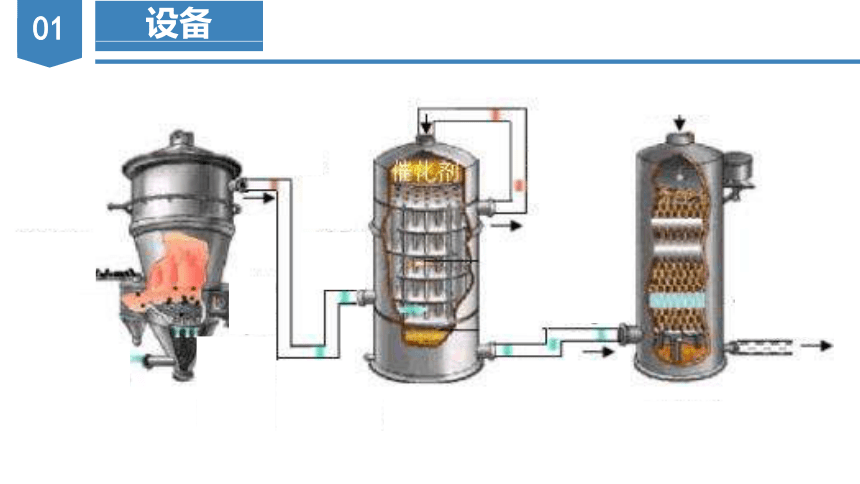
设备
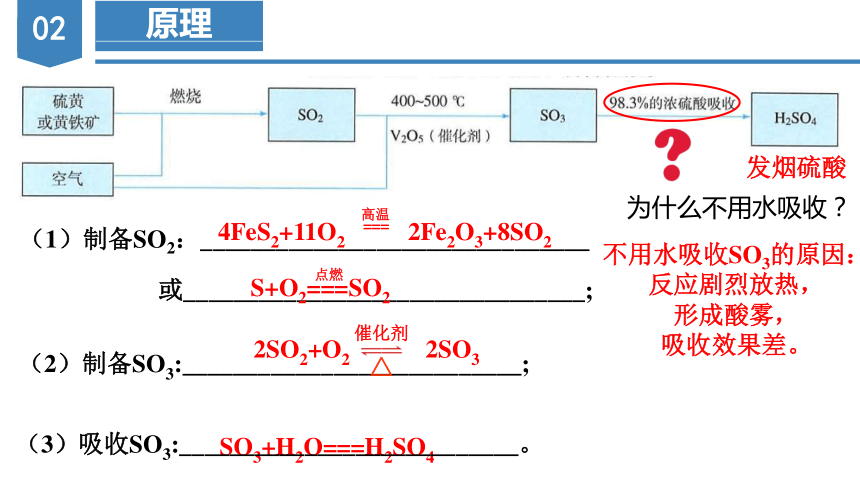
(1)制备SO2:_______________________________
或________________________________;
原理
(2)制备SO3:___________________________;
SO3+H2O===H2SO4
4FeS2+11O2 2Fe2O3+8SO2
高温
===
2SO2+O2 2SO3
△
催化剂
点燃
S+O2===SO2
(3)吸收SO3:___________________________。
发烟硫酸
不用水吸收SO3的原因:
反应剧烈放热,
形成酸雾,
吸收效果差。
为什么不用水吸收?
硫酸的性质
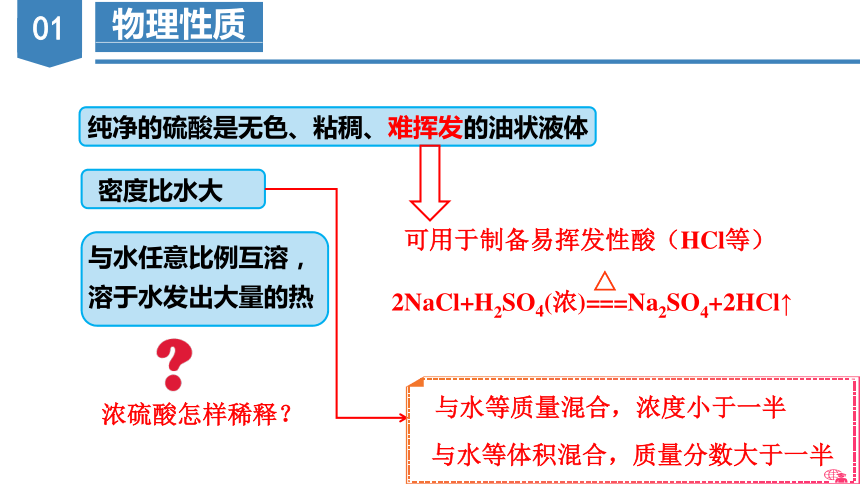
物理性质
密度比水大
与水任意比例互溶,溶于水发出大量的热
纯净的硫酸是无色、粘稠、难挥发的油状液体
可用于制备易挥发性酸(HCl等)
2NaCl+H2SO4(浓)===Na2SO4+2HCl↑
△
与水等质量混合,浓度小于一半
与水等体积混合,质量分数大于一半
浓硫酸怎样稀释?
物理性质
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌。
微点拨
浓硫酸的稀释方法
稀硫酸的化学性质
硫酸是二元强酸,具有酸的通性。
(2) 酸的通性
与指示剂显色
如石蕊变红
与活泼金属反应
如Zn、Fe
与碱反应
如NaOH
与碱性氧化物反应
如CuO
与弱酸盐反应
如Na2CO3
(1) 电离方程式
稀硫酸
H2SO4===2H++SO42-
1. 写出下列反应的离子方程式:
(1)稀硫酸与活泼金属反应,如Zn:______________________。
(2)稀硫酸与金属氧化物反应,如CuO:______________________。
(3)稀硫酸与碱反应,如NaOH: ____________________________。
(4)稀硫酸与部分盐反应,如Na2CO3: _______________________。
Zn+2H+===Zn2++H2↑
CuO+2H+===Cu2++H2O
OH-+H+===H2O
+2H+===CO2↑+H2O
课堂检测
浓硫酸的化学性质
(1)浓硫酸能吸收存在于周围环境中的水分
常用做干燥剂
吸水性
可用来干燥与它不起反应的气体,
如 H2、O2、Cl2、CO2、CO、CH4、
SO2、N2、NO2、NO、HCl。
不能干燥NH3、H2S、HBr、HI
(2)浓硫酸能吸收结晶水合物的水
CuSO4·5H2O====CuSO4 + 5H2O
浓硫酸
浓硫酸的化学性质
将蔗糖、纸张、棉布和木材等有机物中的氢、氧元素按水的组成比脱去
脱水性
浓硫酸的化学性质
脱水性
现象:
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
浓硫酸的化学性质
强氧化性
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
(1)与 非金属单质反应
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
①浓硫酸只体现氧化性
微提醒
②反应条件为加热
课堂检测
如何用实验方法证明木炭与浓硫酸 反应的产物?
提供以下试剂与装置(装置可多次使用):
KMnO4溶液
饱和NaHCO3
品红
澄清石灰水
无水硫酸铜
品红
澄清石灰水
课堂检测
证明含H2O
证明含SO2
除去SO2
证明无SO2
证明含CO2
浓硫酸的化学性质
强氧化性
(2)与 金属单质反应
大多数金属(Au、Pt除外)可被浓硫酸氧化
①常温下
与Fe、Al接触时,会使金属表面生成一层致密的氧化膜而钝化,阻止内部的金属继续与浓硫酸反应。
因此,冷的浓硫酸可以用铁制或铝制容器储存
化学变化
②加热下
实验5-2
实验5-2
实验现象
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面_______________________
b试管中的品红溶液逐渐变为________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
浓硫酸的化学性质
强氧化性
(2)与 金属单质反应
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
①浓硫酸体现氧化性和酸性
微提醒
②反应条件为加热
③浓硫酸与金属反应不生成氢气
浓硫酸的化学性质
如H2S、HI、HBr、FeCl2等
强氧化性
(1)与 非金属单质反应
(2)与 金属单质反应
(3)与具有还原性的化合物反应
H2S+H2SO4(浓) === S↓+SO2↑+2H2O
用途
高沸点——制取挥发性酸
吸水性——做干燥剂
脱水性——做催化剂
强氧化性——制炸药
酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥
D
1.下列说法正确的是( )
A.浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性
B.蔗糖和浓硫酸的“黑面包”实验中,主要体现了浓硫酸的强氧化性和吸水性
C.浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体
D.100 mL 18.0 mol·L-1的浓硫酸和足量铜反应生成SO2的物质的量小于0.9 mol
C
2.下列各组气体在通常情况下既能用浓硫酸又能用碱石灰干燥的是( )
A.SO2、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、O2、Cl2
3.下面是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯(CP)(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸的物质的量浓度18.0 mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4L H2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
C
硫酸
硫酸的制备
稀硫酸的性质
硫酸的物理性质
硫酸的用途
浓硫酸的性质
(1)吸水性
(2)脱水性
(3) 强氧化性
第3课时 硫酸
新人教版 化学 必修二
第一节 硫及其化合物
第3课时:硫酸
第五章
新人教版 化学 必修二
硫酸的工业制法
01
硫酸的性质
02
硫酸的工业制法
设备
(1)制备SO2:_______________________________
或________________________________;
原理
(2)制备SO3:___________________________;
SO3+H2O===H2SO4
4FeS2+11O2 2Fe2O3+8SO2
高温
===
2SO2+O2 2SO3
△
催化剂
点燃
S+O2===SO2
(3)吸收SO3:___________________________。
发烟硫酸
不用水吸收SO3的原因:
反应剧烈放热,
形成酸雾,
吸收效果差。
为什么不用水吸收?
硫酸的性质
物理性质
密度比水大
与水任意比例互溶,溶于水发出大量的热
纯净的硫酸是无色、粘稠、难挥发的油状液体
可用于制备易挥发性酸(HCl等)
2NaCl+H2SO4(浓)===Na2SO4+2HCl↑
△
与水等质量混合,浓度小于一半
与水等体积混合,质量分数大于一半
浓硫酸怎样稀释?
物理性质
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌。
微点拨
浓硫酸的稀释方法
稀硫酸的化学性质
硫酸是二元强酸,具有酸的通性。
(2) 酸的通性
与指示剂显色
如石蕊变红
与活泼金属反应
如Zn、Fe
与碱反应
如NaOH
与碱性氧化物反应
如CuO
与弱酸盐反应
如Na2CO3
(1) 电离方程式
稀硫酸
H2SO4===2H++SO42-
1. 写出下列反应的离子方程式:
(1)稀硫酸与活泼金属反应,如Zn:______________________。
(2)稀硫酸与金属氧化物反应,如CuO:______________________。
(3)稀硫酸与碱反应,如NaOH: ____________________________。
(4)稀硫酸与部分盐反应,如Na2CO3: _______________________。
Zn+2H+===Zn2++H2↑
CuO+2H+===Cu2++H2O
OH-+H+===H2O
+2H+===CO2↑+H2O
课堂检测
浓硫酸的化学性质
(1)浓硫酸能吸收存在于周围环境中的水分
常用做干燥剂
吸水性
可用来干燥与它不起反应的气体,
如 H2、O2、Cl2、CO2、CO、CH4、
SO2、N2、NO2、NO、HCl。
不能干燥NH3、H2S、HBr、HI
(2)浓硫酸能吸收结晶水合物的水
CuSO4·5H2O====CuSO4 + 5H2O
浓硫酸
浓硫酸的化学性质
将蔗糖、纸张、棉布和木材等有机物中的氢、氧元素按水的组成比脱去
脱水性
浓硫酸的化学性质
脱水性
现象:
蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
浓硫酸的化学性质
强氧化性
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
(1)与 非金属单质反应
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
①浓硫酸只体现氧化性
微提醒
②反应条件为加热
课堂检测
如何用实验方法证明木炭与浓硫酸 反应的产物?
提供以下试剂与装置(装置可多次使用):
KMnO4溶液
饱和NaHCO3
品红
澄清石灰水
无水硫酸铜
品红
澄清石灰水
课堂检测
证明含H2O
证明含SO2
除去SO2
证明无SO2
证明含CO2
浓硫酸的化学性质
强氧化性
(2)与 金属单质反应
大多数金属(Au、Pt除外)可被浓硫酸氧化
①常温下
与Fe、Al接触时,会使金属表面生成一层致密的氧化膜而钝化,阻止内部的金属继续与浓硫酸反应。
因此,冷的浓硫酸可以用铁制或铝制容器储存
化学变化
②加热下
实验5-2
实验5-2
实验现象
将a试管里的溶液慢慢倒入水中,溶液变为_____
a试管中铜丝表面_______________________
b试管中的品红溶液逐渐变为________
c试管中的紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
浓硫酸的化学性质
强氧化性
(2)与 金属单质反应
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
①浓硫酸体现氧化性和酸性
微提醒
②反应条件为加热
③浓硫酸与金属反应不生成氢气
浓硫酸的化学性质
如H2S、HI、HBr、FeCl2等
强氧化性
(1)与 非金属单质反应
(2)与 金属单质反应
(3)与具有还原性的化合物反应
H2S+H2SO4(浓) === S↓+SO2↑+2H2O
用途
高沸点——制取挥发性酸
吸水性——做干燥剂
脱水性——做催化剂
强氧化性——制炸药
酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥
D
1.下列说法正确的是( )
A.浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性
B.蔗糖和浓硫酸的“黑面包”实验中,主要体现了浓硫酸的强氧化性和吸水性
C.浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体
D.100 mL 18.0 mol·L-1的浓硫酸和足量铜反应生成SO2的物质的量小于0.9 mol
C
2.下列各组气体在通常情况下既能用浓硫酸又能用碱石灰干燥的是( )
A.SO2、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、O2、Cl2
3.下面是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯(CP)(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸的物质的量浓度18.0 mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4L H2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
C
硫酸
硫酸的制备
稀硫酸的性质
硫酸的物理性质
硫酸的用途
浓硫酸的性质
(1)吸水性
(2)脱水性
(3) 强氧化性
第3课时 硫酸
新人教版 化学 必修二
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
