【高效课堂】人教A版(2019)高中化学必修2--6.1.4热化学方程式(教学课件)
文档属性
| 名称 | 【高效课堂】人教A版(2019)高中化学必修2--6.1.4热化学方程式(教学课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 59.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 09:27:36 | ||
图片预览








文档简介
(共27张PPT)
第六章
第一节 化学反应与能量变化
第四课时 热化学方程式
新人教版 化学 必修第二册
01
目录
热化学方程式
02
燃烧热
01
一、热化学方程式
内容内容内容
如何表示化学反应的反应热呢?
H2 + Cl2 ==== 2HCl
点燃
③1个H2与1个Cl2在点燃的条件下反应生成2个HCl
①1 mol H2与1 mol Cl2在点燃的条件下反应生成2 mol HCl
②2 g的H2与71 g的Cl2在点燃的条件下反应生成73 g的HCl
H2 (g) + Cl2 (g) = 2HCl (g) H= -184.6kJ/mol
1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl, 放出184.6kJ 的热量。
只表明化学反应中的物质变化
没有表明其中的能量变化
物质变化
能量变化
内容内容内容
一、热化学方程式
表示参加反应的物质的量与反应热的关系的化学方程式。
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
热化学方程式的定义
热化学方程式的意义
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(l)===H2O(l) ΔH=-285.8 kJ·mol-1
(1)热化学方程式需注明反应时的温度和压强。
如不注明条件,即指: 25℃和101 kPa。其他反应条件可省略
微点拨
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
(2)热化学方程式中各物质需标聚集状态(s、l、g、aq)
微点拨
内容内容内容
为什么要标聚集状态?
热化学方程式
1g液态水
1g气态水
能量增加
熔化
蒸发
1g 冰
需要吸热:
熔化、气化、升华
可以放热:
液化、凝华、凝固
能量减小
因为物质的聚集状态不同时,
所具有的内能、焓也均不同。
同种物质
E(g)>E(l)>E(s)
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
(3)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
微点拨
内容内容内容
一、热化学方程式
2H2 (g) + O2 (g) = 2H2O (g) H=-483.6kJ/mol
H2 (g) + O2 (g) = H2O (g) H=-241.8kJ/mol
H2 (g) + O2 (g) = H2O (l) H=-285.8kJ/mol
2H2O (g) = 2H2 (g) + O2 (g) H=+483.6kJ/mol
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
微点拨
内容内容内容
一、热化学方程式
热化学方程式的注意事项
(1)热化学方程式需注明反应时的温度和压强,如不注明条件,即指: 25℃和101 kPa。其他反应条件可省略
(2)热化学方程式中各物质需标聚集状态(s、l、g、aq)
(3)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
内容内容内容
一、热化学方程式
热化学方程式的正误判断
“五查”法
看方程式是否配平
看各物质的聚集状态是否正确
看ΔH 变化的“+”、“-”是否正确
看反应热的单位是否为 kJ·mol-1
看反应热的数值与化学计量数是否相对应
下列热化学方程式书写正确的是( )
A.N2+3H22NH3 ΔH=-92.2 kJ/mol
B.H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ/mol
C.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ
D.C(石墨,s)+O2(g)===CO2(g)
ΔH=+393.5 kJ/mol
下列热化学方程式书写正确的是( )
A.N2+3H2 === 2NH3 ΔH=-92.2 kJ/mol
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ/mol
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(石墨,s)+O2(g)===CO2(g) ΔH=+393.5 kJ/mol
B
课堂检测
01
二、燃烧热
内容内容内容
二、燃烧热
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。
1.燃烧热
C → ;H → ;
S → ;N →_______。
CO2(g)
H2O(l)
SO2(g)
N2(g)
燃烧热通常可利用量热计由实验测得。
内容内容内容
二、燃烧热
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之
一是辛烷(C3H1g),天然气的主要成分是甲烷(CH2),它们燃烧的热化学方程式分别表示如下:
例如,实验测得在25℃和101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量,这就是H2的燃烧热。
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
1mol纯物质
指定产物
燃烧热
内容内容内容
二、燃烧热
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之一是辛烷(C8H18),天然气的主要成分是甲烷(CH4),它们燃烧的热化学方程式分别表示如下:
C(s)+)O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5518 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
1mol纯物质
指定产物
燃烧热
内容内容内容
某些物质的燃烧热(25 ℃,101 kPa)
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
内容内容内容
下列热化学方程式中ΔH的值能表示可燃物的燃烧热的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
B
课堂检测
课堂检测
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
1.下图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C. S(g)+O2(g)=SO2(g) △H1= - Q1 kJ/mol
S(s)+O2(g)=SO2(g) △H2= - Q2 kJ/mol △ H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
A
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
2.已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+2(1)O2(g)===H2O(g) ΔH2=-Q2
③H2(g)+2(1)O2(g)===H2O(l) ΔH3=-Q3
取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况下),经完全燃烧恢复到常温,放出的热量是( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
B
3.已知1 mol燃料完全燃烧的数据分别为:
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0 kJ·mol-1 -891.0 kJ·mol-1 -5461.0kJ·mol-1 -1366.8 kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是( )
A.一氧化碳 B.甲烷
C.异辛烷 D.乙醇
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
C
4.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1 B.1∶2 C.1∶1 D.2∶3
课堂总结
课堂总结
01
02
03
热化学方程式
热化学方程式的正误判断
燃烧热
THANKS
THANKS
感谢观看
第六章
第一节 化学反应与能量变化
第四课时 热化学方程式
新人教版 化学 必修第二册
01
目录
热化学方程式
02
燃烧热
01
一、热化学方程式
内容内容内容
如何表示化学反应的反应热呢?
H2 + Cl2 ==== 2HCl
点燃
③1个H2与1个Cl2在点燃的条件下反应生成2个HCl
①1 mol H2与1 mol Cl2在点燃的条件下反应生成2 mol HCl
②2 g的H2与71 g的Cl2在点燃的条件下反应生成73 g的HCl
H2 (g) + Cl2 (g) = 2HCl (g) H= -184.6kJ/mol
1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl, 放出184.6kJ 的热量。
只表明化学反应中的物质变化
没有表明其中的能量变化
物质变化
能量变化
内容内容内容
一、热化学方程式
表示参加反应的物质的量与反应热的关系的化学方程式。
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
热化学方程式的定义
热化学方程式的意义
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(l)===H2O(l) ΔH=-285.8 kJ·mol-1
(1)热化学方程式需注明反应时的温度和压强。
如不注明条件,即指: 25℃和101 kPa。其他反应条件可省略
微点拨
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
(2)热化学方程式中各物质需标聚集状态(s、l、g、aq)
微点拨
内容内容内容
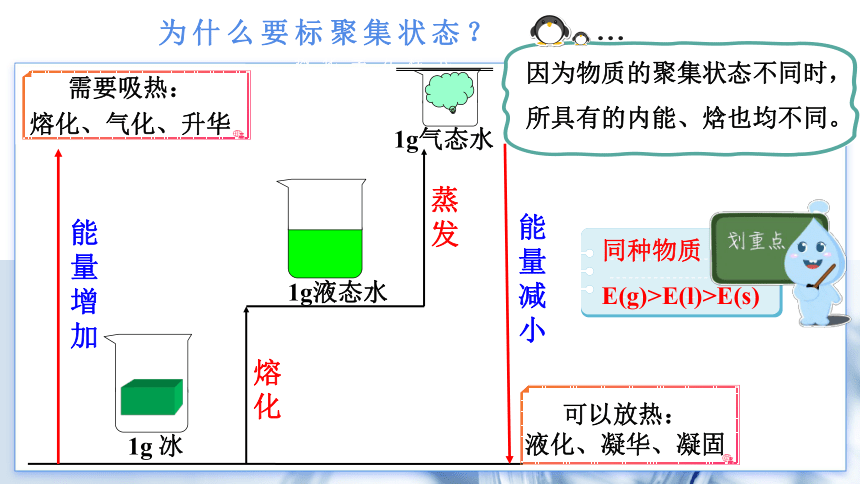
为什么要标聚集状态?
热化学方程式
1g液态水
1g气态水
能量增加
熔化
蒸发
1g 冰
需要吸热:
熔化、气化、升华
可以放热:
液化、凝华、凝固
能量减小
因为物质的聚集状态不同时,
所具有的内能、焓也均不同。
同种物质
E(g)>E(l)>E(s)
内容内容内容
一、热化学方程式
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol气态H2O时,放出241.8kJ的热量;
在25℃和101kPa下,1mol气态H2与0.5mol气态O2反应生成1mol液态H2O时,放出285.8kJ的热量。
热化学方程式为
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
热化学方程式为
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
(3)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
微点拨
内容内容内容
一、热化学方程式
2H2 (g) + O2 (g) = 2H2O (g) H=-483.6kJ/mol
H2 (g) + O2 (g) = H2O (g) H=-241.8kJ/mol
H2 (g) + O2 (g) = H2O (l) H=-285.8kJ/mol
2H2O (g) = 2H2 (g) + O2 (g) H=+483.6kJ/mol
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
微点拨
内容内容内容
一、热化学方程式
热化学方程式的注意事项
(1)热化学方程式需注明反应时的温度和压强,如不注明条件,即指: 25℃和101 kPa。其他反应条件可省略
(2)热化学方程式中各物质需标聚集状态(s、l、g、aq)
(3)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
内容内容内容
一、热化学方程式
热化学方程式的正误判断
“五查”法
看方程式是否配平
看各物质的聚集状态是否正确
看ΔH 变化的“+”、“-”是否正确
看反应热的单位是否为 kJ·mol-1
看反应热的数值与化学计量数是否相对应
下列热化学方程式书写正确的是( )
A.N2+3H22NH3 ΔH=-92.2 kJ/mol
B.H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ/mol
C.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ
D.C(石墨,s)+O2(g)===CO2(g)
ΔH=+393.5 kJ/mol
下列热化学方程式书写正确的是( )
A.N2+3H2 === 2NH3 ΔH=-92.2 kJ/mol
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ/mol
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(石墨,s)+O2(g)===CO2(g) ΔH=+393.5 kJ/mol
B
课堂检测
01
二、燃烧热
内容内容内容
二、燃烧热
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。
1.燃烧热
C → ;H → ;
S → ;N →_______。
CO2(g)
H2O(l)
SO2(g)
N2(g)
燃烧热通常可利用量热计由实验测得。
内容内容内容
二、燃烧热
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之
一是辛烷(C3H1g),天然气的主要成分是甲烷(CH2),它们燃烧的热化学方程式分别表示如下:
例如,实验测得在25℃和101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量,这就是H2的燃烧热。
H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
1mol纯物质
指定产物
燃烧热
内容内容内容
二、燃烧热
煤、石油、天然气是当今世界重要的化石燃料。煤的主要成分是碳单质(C),石油加工产品——汽油的成分之一是辛烷(C8H18),天然气的主要成分是甲烷(CH4),它们燃烧的热化学方程式分别表示如下:
C(s)+)O2(g) ===CO2(g) ΔH=-393.5 kJ·mol-1
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5518 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
1mol纯物质
指定产物
燃烧热
内容内容内容
某些物质的燃烧热(25 ℃,101 kPa)
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
内容内容内容
下列热化学方程式中ΔH的值能表示可燃物的燃烧热的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
B
课堂检测
课堂检测
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
1.下图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C. S(g)+O2(g)=SO2(g) △H1= - Q1 kJ/mol
S(s)+O2(g)=SO2(g) △H2= - Q2 kJ/mol △ H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
A
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
D
2.已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-Q1
②H2(g)+2(1)O2(g)===H2O(g) ΔH2=-Q2
③H2(g)+2(1)O2(g)===H2O(l) ΔH3=-Q3
取体积比为4∶1的甲烷和氢气的混合气体11.2 L(已折合成标准状况下),经完全燃烧恢复到常温,放出的热量是( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
B
3.已知1 mol燃料完全燃烧的数据分别为:
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0 kJ·mol-1 -891.0 kJ·mol-1 -5461.0kJ·mol-1 -1366.8 kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是( )
A.一氧化碳 B.甲烷
C.异辛烷 D.乙醇
内容内容内容
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
课堂检测
C
4.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH=-282.9 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1 B.1∶2 C.1∶1 D.2∶3
课堂总结
课堂总结
01
02
03
热化学方程式
热化学方程式的正误判断
燃烧热
THANKS
THANKS
感谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
