2025届高三一轮化学复习---化学反应的热效应(含解析)
文档属性
| 名称 | 2025届高三一轮化学复习---化学反应的热效应(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-21 17:54:45 | ||
图片预览



文档简介
2025届高三一轮化学复习---化学反应的热效应
一、单选题
1.碘在不同状态(固态或气态)下与氢气反应的热化学方程式如下:
①
②
下列判断正确的是
A.①中的为固态,②中的为气态 B.固态碘升华时将吸热
C.①的反应物总能量比②的反应物总能量高 D.比的热稳定性更好
2.已知:血红蛋白可与结合,血红蛋白更易与CO配位,血红蛋白与配位示意如图所示,血红蛋白(Hb)与、CO结合的反应可表示为① ;② 下列说法错误的是
A.已知反应 ,则
B.相同温度下,
C.血红蛋白结合后Fe的配位数为6
D.高压氧舱可治疗CO中毒
3.断开1molCl2(g)中的化学键需要吸收243kJ的能量。已知反应的能量变化如图所示,下列叙述错误的是
A.反应放出能量时,转移电子的物质的量为
B.反应为吸热反应
C.断开中的化学键需要吸收的能量为
D.共价键的稳定性:H—H>H—Cl>Cl—Cl
4.下列关于化学反应与能量的说法正确的是
A.已知正丁烷的燃烧热为2878,则表示正丁烷燃烧热的热化学方程式为
B.已知在一定条件下,2mol 与1mol 充分反应后,释放出98kJ的热量,则其热化学方程式为
C.已知稀盐酸与稀NaOH溶液反应的中和热为57.3,则表示稀硫酸与稀NaOH溶液反应的热化学方程式为
D.已知C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定
5.已知铬基催化剂下丙烷生产丙烯相关主要反应有: ,已知键能:E(C-H)=413.4kJ/mol,E(H-H)=436.0kJ/mol。C=C的键能与C-C的键能相差约多少kJ/mol
A.537.54 B.266.66 C.268.77 D.533.32
6.科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程,其示意图如下。下列说法正确的是
A.由状态I→状态III,既有旧键的断裂又有新键的形成
B.催化剂没有参与化学反应
C.CO和分子中都含有极性共价键
D.CO与O反应生成是吸热反应
7.化学反应中的能量变化,通常表现为热量的变化。从物质结构的角度看,化学反应的实质就是旧化学键的断裂和新化学键的形成,而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同导致发生了能量变化。已知:
下列关于上述反应焓变的判断正确的是
A., B.,
C. D.
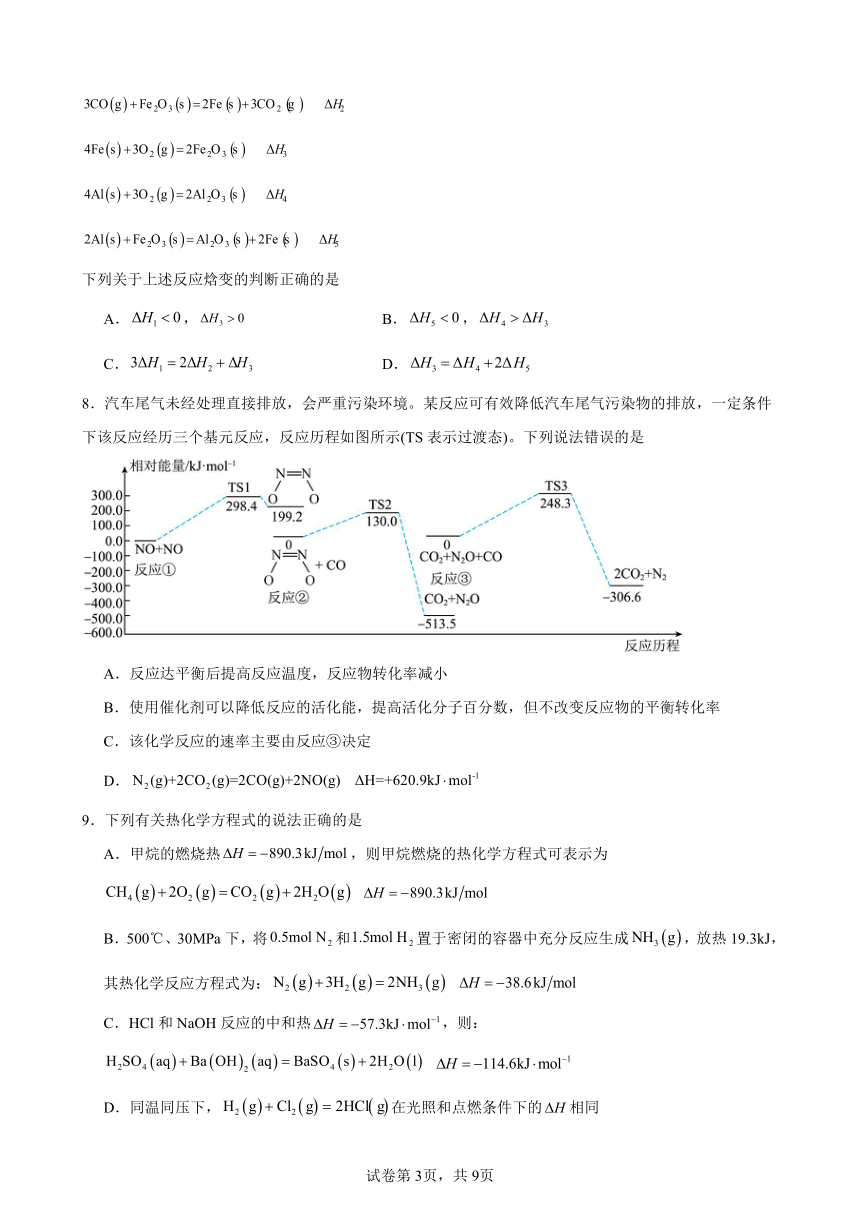
8.汽车尾气未经处理直接排放,会严重污染环境。某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应,反应历程如图所示(TS表示过渡态)。下列说法错误的是
A.反应达平衡后提高反应温度,反应物转化率减小
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,但不改变反应物的平衡转化率
C.该化学反应的速率主要由反应③决定
D.
9.下列有关热化学方程式的说法正确的是
A.甲烷的燃烧热,则甲烷燃烧的热化学方程式可表示为
B.500℃、30MPa下,将和置于密闭的容器中充分反应生成,放热19.3kJ,其热化学反应方程式为:
C.HCl和NaOH反应的中和热,则:
D.同温同压下,在光照和点燃条件下的相同
10.NH3易液化,能与多种物质发生反应。将金属钠投入液氨中有H2产生,NH 能与结合生成CaCl ·8NH3,加热条件下NH 能将CuO还原成Cu。工业合成氨的反应为放热92.4kJ。下列说法正确的是
A.金属钠与液氨反应体现了的氧化性
B.合成氨反应为放热反应,不需要加热就可以发生
C.NH4Cl受热易分解,可用作实验室中制取少量氨气
D.氨水能导电,所以氨气是电解质
11.化学反应在发生物质变化的同时伴随能量变化,是人类获取能量的重要途径。下列能量变化图与化学反应相对应的是
A.氢气在氧气中燃烧 B.碳酸氢钠受热分解
C.盐酸与氢氧化钠反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体反应
A.A B.B C.C D.D
12.和在催化剂表面合成氨的微观历程如图,用、、分别表示、、,已知:,该反应属于放热反应。下列说法错误的是
A.②→③过程,是吸热过程
B.③→④过程,原子和原子形成了含有极性键的
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.使用催化剂,可以加快合成氨反应的速率
13.室温下,往碳酸钠溶液中滴入盐酸,反应过程的能量变化如图所示。下列说法正确的是
A.吸热反应一定要加热才能发生 B.过程Ⅱ为放热反应
C.由图可知的能量比高 D.总反应为放热反应
14.根据如图能量关系示意图,下列说法正确的是
A.1molC(s)与1molO2(g)的能量之和等于393.5kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1,该方程式中的化学计量数不可表示分子个数
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH≈-10.1kJ·mol-1
二、非选择题
15.在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则△H= kJ mol-1。
(2)2SO2(g)+ O2(g) 2SO3(g)反应过程的能量变化如图所示。
已知:0.5molSO2(g)被氧化为0.5molSO3(g)的△H=-49.5 kJ mol-1。则:
①E的大小对该反应的反应热 (填“有”或“无”)影响。
②SO2氧化为SO3的热化学方程式为 。
(3)已知: △H=-566 kJ mol-1 ①
△H=-226 kJ mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为 。
(4)常压下,某铝热反应的温度与能量变化如图所示:
①101.3kPa、1538℃, △H= kJ mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为 。
16.肼()是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。
(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成,放出的热量,则该反应的热化学方程式为 ,消耗液态肼放出的热量为 。
(2)已知:,键能数据如下表:
化学键
键能/() 193 391 497 463
则氮氮三键的键能为 ;若,则的燃烧热为 。
(3)已知:,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为 。
17.请回答下列问题:
(1)硅是无机非金属材料里的明星,硅在元素周期表中的位置 ,硅的氧化物和硅酸盐约占地壳质量的90%以上,在中,硅原子和氧原子通过 (选填“极性共价键”、“非极性共价键”、“离子键”)连接形成立体网状结构,所以硬度大。建筑粘合剂和防火剂硅酸钠,可用溶解在溶液中制备,反应的离子方程式为 。
(2)氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的部分流程图如下
①已知断裂、、分别需要吸收、、的能量,在一定条件下消耗了和生成,该过程会 的能量。
②氧化炉中,标准状况下转化为时转移的电子数目为 。
③在模拟实验中,吸收塔中出来的尾气和,通过调节其体积比,可用溶液完全吸收,生成硝酸盐或亚硝酸盐。当时,发生反应的化学方程式为 。仅含和的混合气被完全吸收,且体积分数之比,则产物中亚硝酸盐和硝酸盐的比例为 。
18.化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H= kJ/mol。
(2)已知在微生物作用条件下,经过两步反应被氧化成,两步反应的能量变化示意图如下。
则1mon(aq)全部被氧化成(aq)的热化学方程式为: 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为 (填“吸热”或“放热”)反应。
已知破坏1 mol化学键需要吸收的热量如表所示,则该反应吸收或放出的热量为 kJ(用含a、b、c、d的代数式表示)。
化学键 C-H O-H C=O H-H
吸收热量(kJ/mol) a b c d
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:
①仪器a的名称为 ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热 (填“相等”或“不相等”),原因是 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H= kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】气态碘的能量比固态碘的能量高,所以气态碘和氢气反应生成气态HI放出热量,而固态碘和氢气反应生成气态HI会吸收热量,所以反应①中的碘为气体,反应②中的碘为固体,据此作答。
【详解】A.由以上分析可知,反应①中的碘为气态,反应②中的碘为固态,故A错误;
B.由以上分析可知,反应①中的碘为气体,反应②中的碘为固体,将反应②减去反应①,即可得到I2(s)= I2(g)的ΔH=+35.96kJ/mol,即1mol 固态碘升华时将吸热35.96 kJ,故B错误;
C.一般地,同一物质,气态能量高于固态能量,所以①的反应物总能量比②的反应物总能量高,故C正确;
D.一般地,能量越低越稳定,同一物质,固态能量低于液态能量,液态能量低于气态能量,所以HI(s)比 HI(g)热稳定性更好,故D错误;
答案选C。
2.A
【详解】A.由盖斯定律可知,反应②—①得到反应,则反应△H3=△H2—△H1<0,所以焓变,故A错误;
B.血红蛋白可与氧气结合,血红蛋白更易与一氧化碳配位说明反应②比反应①正向进行的程度大,所以相同温度下平衡常数K1小于K2,故B正确;
C.由图可知,血红蛋白中中心离子为亚铁离子,配位原子为氧原子,配位数为6,故C正确;
D.由盖斯定律可知,反应②—①得到反应,一氧化碳中毒患者进入高压氧舱治疗,氧气浓度增大,平衡向逆反应方向移动,Hb(CO)浓度减小,从而缓解一氧化碳中毒,故D正确;
答案选A。
3.A
【详解】A.由题干图示信息可知,H2(g)+Cl2(g)=2HCl(g) =680-865=-185kJ/mol,故反应放出370kJ能量时,即有2molH2完全反应,则转移电子的物质的量为4mol,A错误;
B.由A项分析可知,H2(g)+Cl2(g)=2HCl(g) =680-865=-185kJ/mol,则反应 =185kJ/mol大于0,则该反应为吸热反应,B正确;
C.由题干图示信息可知,断开中的化学键需要吸收的能量为680-243=437kJ,C正确;
D.由题干图示信息可知,H-Cl的键能为:=432.5kJ/mol,Cl-Cl的键能为243kJ/mol,H-H的键能为437kJ/mol,键能越大化学键越稳定,故共价键的稳定性:H—H>H—Cl>Cl—Cl,D正确;
故答案为:A。
4.C
【详解】A.燃烧热是指1mol可燃物完全燃烧生成指定产物放出的热量,则表示正丁烷燃烧热的热化学方程式为 ,A错误;
B.不知道该条件下物质的状态,该反应是可逆反应,2mol 与1mol 充分反应后,实际消耗多少不得而知,所以无法写出热化学方程式,B错误;
C.在稀溶液中强酸和强碱发生中和反应生成1mol 放出的热量是中和热,C正确;
D.石墨转化为金刚石吸收能量,则石墨能量低于金刚石,能量越低越稳定,故石墨比金刚石稳定,D错误;
答案选C。
5.B
【详解】已知键能:E(C-H)=413.4kJ/mol,E(H-H))=436.0kJ/mol,根据反应热等于反应物的键能总和减去生成物的键能总和,结合反应 有:8E(C-H)+2E(C-C) 6E(C-H) E(C=C) E(C-C) E(H-H))=2E(C-H)+E(C-C) E(C=C) E(H-H)=2×413.4 436+E(C-C) E(C=C)=+124.14kJ/mol,故得E(C-C) E(C=C)= 266.66kJ/mol,故C=C的键能与C-C的键能相差约266.66kJ/mol,故答案为:B。
6.C
【详解】A.状态Ⅰ→状态Ⅲ表示CO与O反应的过程,只有化学键的形成,没有化学键的断裂,故A错误;
B.催化剂在反应前后质量和化学性质不变,但催化剂参与反应,故B错误;
C.CO和都是共价化合物,都含有极性共价键,故C正确;
D.由图可知CO与O反应生成的反应中反应物总能量大于生成物总能量,即该反应为放热反应,故D错误;
故答案为:C。
7.C
【详解】A.物质氧化反应是放热反应,放热反应的反应热小于0;△H1<0;△H3<0,A错误;
B.铝热反应是一个放热反应,则△H5<0;已知③、④、⑤,由盖斯定律可知⑤=(④-③),则△H5=<0,则,B错误;
C.根据盖斯定律可知,3△H1=2△H2 +△H3,C正确;
D.根据盖斯定律可知,△H3=△H4-2△H5,D错误;
故合理选项是C。
8.C
【分析】
由题干反应历程图可知,整个反应分为三个基元反应阶段:①NO(g)+NO(g)=H=+199.2kJ mol-1,②+CO(g)=CO2(g)+N2O(g)H=-513.5kJ mol-1,③CO2(g)+N2O(g)+CO(g)=2CO2(g)+N2(g)H-306.6kJ mol-1,根据盖斯定律①+②+③可知:2CO(g)+2NO(g)=N2(g)+2CO2(g)ΔH=-620.9kJ mol-1,据此分析解题。
【详解】A.由分析可知,此反应为放热反应,提高反应温度,平衡逆向移动,则反应物转化率降低,A正确;
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,但催化剂不能使平衡发生移动,不能提高反应物的转化率,B正确;
C.由题干反应历程图可知,反应①的活化能最高,反应速率最慢,决定整个反应的反应速率,C错误;
D.由分析可知,反应2CO(g)+2NO(g)=N2(g)+2CO2(g)ΔH=-620.9kJ mol-1,则N2(g)+2CO2(g)═2CO(g)+2NO(g)ΔH=+620.9kJ mol-1,D正确;
故答案为:C。
9.D
【详解】A.根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,A错误;
B.0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,B错误;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,HCl和NaOH反应的中和热,1mol硫酸和1mol氢氧化钡反应生成2mol水和1mol硫酸钡沉淀,放出的热量不是114.6kJ,C错误;
D.反应的焓变与反应物和生成物的能量有关,与反应条件、变化过程无关,所以同温同压下,在光照和点燃条件的△H相同,D正确;
故选D。
10.A
【详解】A.钠与氨气反应生成氢气和NaNH2,H元素的化合价降低,则氨气具有氧化性,故A正确;
B.虽然该反应为放热反应,但需要加热条件才能发生,因为反应的吸放热与反应条件无关,故B错误;
C.氯化铵受热分解生成气体氯化氢和氨气,氨气和氯化氢相遇会发生反应生成固体氯化铵,不能用作实验室中制取少量氨气,故C错误;
D.氨气本身在水溶液或者熔融状态下,不能直接电离产生自由移动的离子,是非电解质,故D错误;
答案选A。
11.D
【详解】A.氢气在氧气中燃烧为放热反应,反应物的总能量大于生成物的总能量,A反应与图像不符;
B.碳酸氢钠受热分解为吸热反应,反应物的总能量小于生成物的总能量,B反应与图像不符;
C.氢氧化钠与盐酸的反应为放热反应,但是断裂化学键需要吸收能量,形成化学键需要放出能量,C反应与图像不符;
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应为吸热反应,反应物的总能量小于生成物的总能量,D反应与图像相符;
故选D。
12.C
【详解】A.②③过程,发生氮氮键、氢氢键的断开需要吸收能量,是吸热过程,A正确;
B.③④过程,原子和原子形成了含有极性键的,B正确;
C.合成氨反应为放热反应,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.使用催化剂,可以加快合成氨反应的速率,D正确。
答案选C。
13.D
【详解】A.反应是吸热还是放热与是否需要加热无关,有些吸热反应,常温下即可进行,不需要加热,如氯化铵和氢氧化钡的反应,A错误;
B.由图可知,CO2(g)+H2O(1)能量高于 (aq)+H+(aq),故过程II为吸热反应,B错误;
C.由图可知,能量(aq)+2H+(aq)高于(aq)+H+(aq),但无法得出的能量比高,C错误;
D.由图可知,能量(aq)+2H+(aq)高于CO2 (aq)+2H2O(l),总反应为放热反应,D正确;
故选D。
14.C
【详解】A.由图可知,1molC(s)与1molO2(g)的能量之和比1molCO2(g)的能量高393.5kJ,A错误;
B.由图可知,1molCO(g)和0.5mol的O2(g)生成1molCO2(g)放出282.9kJ的热量,所以反应2CO(g)+O2(g)=2CO2(g)中,反应物的总能量大于生成物的总能量,B错误;
C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=2×(282.9-393.5)=-221.2kJ·mol-1,该方程式中的化学计量数不可表示分子个数,C正确;
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= ≈-10.1kJ·g-1,单位不正确,D错误;
故选C。
15.(1)-1264.8
(2) 无 △H=-198 kJ mol-1
(3)2NA或1.204×1024
(4) +13.8
【详解】(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,4molNH3的质量为4mol×17g/mol=68g,则放出热量为68g×18.6kJ=1264.8 kJ,所以 △H=-1264.8 kJ mol-1。
(2)①E的大小对该反应的反应物总能量、生成物总能量都不产生影响,所以对反应热无影响;②SO2氧化为SO3时,若有2molSO2完全反应,则放出热量为49.5 kJ×4=198 kJ,热化学方程式为 △H=-198 kJ mol-1。
(3)△H=-566 kJ mol-1 ①, △H=-226 kJ mol-1②,利用盖斯定律,将反应①×+②得, △H=(-566 kJ mol-1) ×+(-226 kJ mol-1)=- 509 kJ mol-1,反应转移2mole-,若CO(g)与Na2O2(s)反应放出509kJ热量时,则电子转移数目为2NA(或1.204×1024)。
(4)①图中信息显示,101.3kPa、1538℃,2Fe(l)=2Fe(s) △H=-27.6kJ mol-1,则△H=+13.8kJ mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为 △H=(-732.5-27.6-91.0) kJ mol-1=-851.1kJ mol-1。
16.(1) N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH= -642kJ·mol-1 321kJ
(2) 946kJ·mol-1 632kJ·mol-1
(3)N2H4(g)+NO2(g)=N2(g)+2H2O(g) ΔH= -578kJ·mol-1
【详解】(1)若每生成,放出的热量,则每生成1molN2,放出642kJ的热量,则热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642kJ·mol-1,1mol液态肼质量为32g,放出的热量为642kJ,则16g液态肼反应放出的热量为321kJ;
(2)设氮氮三键的键能为x,则:193kJ·mol-1+4×391kJ·mol-1+497kJ·mol-1-x-4×463kJ·mol-1=-544kJ·mol-1,解得x=946kJ·mol-1,则氮氮三键的键能为946kJ·mol-1;反应①:;反应②:,根据盖斯定律可知,由①-②×2可得:,即的燃烧热是632kJ·mol-1;
(3)反应③:;根据盖斯定律,①-×③可得:N2H4(g)+NO2(g)=N2(g)+2H2O(g) ΔH= -578kJ·mol-1。
17.(1) 第三周期IVA族 极性共价键
(2) 放出93 2.5NA NO+NO2+2NaOH=2NaNO2+H2O 3∶l
【分析】工业合成氨的原料是N2和H2,合成塔中压缩的氮气和氢气反应生成氨气,反应原料N2和H2可从混合气体中分离出来循环使用,氨气在氧化炉中先发生催化氧化反应生成一氧化氮,一氧化氮会与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,以此解答。
【详解】(1)Si在元素周期表中第三周期IVA族;在中,硅原子和氧原子通过极性共价键连接形成立体网状结构,所以硬度大。建筑粘合剂和防火剂硅酸钠,可用溶解在溶液中制备,反应的离子方程式为。
(2)①已知断裂、、分别需要吸收、、的能量,可得热化学方程式: ,在一定条件下消耗了和生成,该过程会放出93的能量;
②氧化炉中发生反应:,N元素由-3价上升到+2价,由反应可知1molNH3反应转移5mol电子,标准状况下的物质的量为0.5mol,0.5mol NH3转化为时转移的电子数目为2.5NA;
③吸收塔中出来的尾气NO和NO2,通过调节其体积比,可用NaOH溶液完全吸收,生成硝酸盐或亚硝酸盐,当V(NO)=V(NO2)时,发生反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,仅含NO和NO2的混合气被完全吸收,且体积分数之比NO∶NO2=1∶3,反应的化学方程式为:NO+3NO2+4NaOH=3NaNO2+NaNO3+2H2O,则产物中亚硝酸盐和硝酸盐的比例为3∶ l。
18.(1)-342.4
(2)
(3) 吸热
(4) 环形玻璃搅拌棒 相等 在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关 3.2℃ -53.5
【分析】已知①,②,
③,④,由盖斯定律可知④=2×①+4×②-③,计算值;根据焓变=反应物的键能总和-生成物的键能总和,该反应焓变 ;在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关。
【详解】(1)已知①,②,
③,④,由盖斯定律可知④=2×①+4×②-③,计算
故答案为:-342.4;
(2)由图可知第一步反应的热化学方程式为:①,
第二步的热化学反应方程式为:②,则①+②得到:,故答案为:;
(3)根据焓变=反应物的键能总和-生成物的键能总和,该反应焓变 ,则吸收kJ,故答案为:吸热;;
(4)①仪器a为环形玻璃搅拌棒,保持其他条件不变,实验中改用100mL0.50mol L 1盐酸与100mL0.55mol L 1NaOH溶液进行反应,与上述实验相比,二者所测的中和热相等,因为在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关,故答案为:环形玻璃搅拌棒;相等;在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关;
②四组温度差中第二组误差较大,应该舍去,其他三组(T2 T1)的平均值为3.2℃,50mL0.50mol L 1盐酸与50mL0.55mol L 1NaOH溶液生成水的物质的量为0.025mol,放出的热量,则,故答案为:3.2℃;-53.5。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.碘在不同状态(固态或气态)下与氢气反应的热化学方程式如下:
①
②
下列判断正确的是
A.①中的为固态,②中的为气态 B.固态碘升华时将吸热
C.①的反应物总能量比②的反应物总能量高 D.比的热稳定性更好
2.已知:血红蛋白可与结合,血红蛋白更易与CO配位,血红蛋白与配位示意如图所示,血红蛋白(Hb)与、CO结合的反应可表示为① ;② 下列说法错误的是
A.已知反应 ,则
B.相同温度下,
C.血红蛋白结合后Fe的配位数为6
D.高压氧舱可治疗CO中毒
3.断开1molCl2(g)中的化学键需要吸收243kJ的能量。已知反应的能量变化如图所示,下列叙述错误的是
A.反应放出能量时,转移电子的物质的量为
B.反应为吸热反应
C.断开中的化学键需要吸收的能量为
D.共价键的稳定性:H—H>H—Cl>Cl—Cl
4.下列关于化学反应与能量的说法正确的是
A.已知正丁烷的燃烧热为2878,则表示正丁烷燃烧热的热化学方程式为
B.已知在一定条件下,2mol 与1mol 充分反应后,释放出98kJ的热量,则其热化学方程式为
C.已知稀盐酸与稀NaOH溶液反应的中和热为57.3,则表示稀硫酸与稀NaOH溶液反应的热化学方程式为
D.已知C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定
5.已知铬基催化剂下丙烷生产丙烯相关主要反应有: ,已知键能:E(C-H)=413.4kJ/mol,E(H-H)=436.0kJ/mol。C=C的键能与C-C的键能相差约多少kJ/mol
A.537.54 B.266.66 C.268.77 D.533.32
6.科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程,其示意图如下。下列说法正确的是
A.由状态I→状态III,既有旧键的断裂又有新键的形成
B.催化剂没有参与化学反应
C.CO和分子中都含有极性共价键
D.CO与O反应生成是吸热反应
7.化学反应中的能量变化,通常表现为热量的变化。从物质结构的角度看,化学反应的实质就是旧化学键的断裂和新化学键的形成,而旧化学键断裂所吸收的能量与新化学键形成所释放的能量不同导致发生了能量变化。已知:
下列关于上述反应焓变的判断正确的是
A., B.,
C. D.
8.汽车尾气未经处理直接排放,会严重污染环境。某反应可有效降低汽车尾气污染物的排放,一定条件下该反应经历三个基元反应,反应历程如图所示(TS表示过渡态)。下列说法错误的是
A.反应达平衡后提高反应温度,反应物转化率减小
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,但不改变反应物的平衡转化率
C.该化学反应的速率主要由反应③决定
D.
9.下列有关热化学方程式的说法正确的是
A.甲烷的燃烧热,则甲烷燃烧的热化学方程式可表示为
B.500℃、30MPa下,将和置于密闭的容器中充分反应生成,放热19.3kJ,其热化学反应方程式为:
C.HCl和NaOH反应的中和热,则:
D.同温同压下,在光照和点燃条件下的相同
10.NH3易液化,能与多种物质发生反应。将金属钠投入液氨中有H2产生,NH 能与结合生成CaCl ·8NH3,加热条件下NH 能将CuO还原成Cu。工业合成氨的反应为放热92.4kJ。下列说法正确的是
A.金属钠与液氨反应体现了的氧化性
B.合成氨反应为放热反应,不需要加热就可以发生
C.NH4Cl受热易分解,可用作实验室中制取少量氨气
D.氨水能导电,所以氨气是电解质
11.化学反应在发生物质变化的同时伴随能量变化,是人类获取能量的重要途径。下列能量变化图与化学反应相对应的是
A.氢气在氧气中燃烧 B.碳酸氢钠受热分解
C.盐酸与氢氧化钠反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体反应
A.A B.B C.C D.D
12.和在催化剂表面合成氨的微观历程如图,用、、分别表示、、,已知:,该反应属于放热反应。下列说法错误的是
A.②→③过程,是吸热过程
B.③→④过程,原子和原子形成了含有极性键的
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.使用催化剂,可以加快合成氨反应的速率
13.室温下,往碳酸钠溶液中滴入盐酸,反应过程的能量变化如图所示。下列说法正确的是
A.吸热反应一定要加热才能发生 B.过程Ⅱ为放热反应
C.由图可知的能量比高 D.总反应为放热反应
14.根据如图能量关系示意图,下列说法正确的是
A.1molC(s)与1molO2(g)的能量之和等于393.5kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1,该方程式中的化学计量数不可表示分子个数
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH≈-10.1kJ·mol-1
二、非选择题
15.在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则△H= kJ mol-1。
(2)2SO2(g)+ O2(g) 2SO3(g)反应过程的能量变化如图所示。
已知:0.5molSO2(g)被氧化为0.5molSO3(g)的△H=-49.5 kJ mol-1。则:
①E的大小对该反应的反应热 (填“有”或“无”)影响。
②SO2氧化为SO3的热化学方程式为 。
(3)已知: △H=-566 kJ mol-1 ①
△H=-226 kJ mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为 。
(4)常压下,某铝热反应的温度与能量变化如图所示:
①101.3kPa、1538℃, △H= kJ mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为 。
16.肼()是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。
(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成,放出的热量,则该反应的热化学方程式为 ,消耗液态肼放出的热量为 。
(2)已知:,键能数据如下表:
化学键
键能/() 193 391 497 463
则氮氮三键的键能为 ;若,则的燃烧热为 。
(3)已知:,则肼(g)和二氧化氮(g)反应生成氮气和水蒸气的热化学方程式为 。
17.请回答下列问题:
(1)硅是无机非金属材料里的明星,硅在元素周期表中的位置 ,硅的氧化物和硅酸盐约占地壳质量的90%以上,在中,硅原子和氧原子通过 (选填“极性共价键”、“非极性共价键”、“离子键”)连接形成立体网状结构,所以硬度大。建筑粘合剂和防火剂硅酸钠,可用溶解在溶液中制备,反应的离子方程式为 。
(2)氨和硝酸是重要的化工产品,工业合成氨及制备硝酸的部分流程图如下
①已知断裂、、分别需要吸收、、的能量,在一定条件下消耗了和生成,该过程会 的能量。
②氧化炉中,标准状况下转化为时转移的电子数目为 。
③在模拟实验中,吸收塔中出来的尾气和,通过调节其体积比,可用溶液完全吸收,生成硝酸盐或亚硝酸盐。当时,发生反应的化学方程式为 。仅含和的混合气被完全吸收,且体积分数之比,则产物中亚硝酸盐和硝酸盐的比例为 。
18.化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H= kJ/mol。
(2)已知在微生物作用条件下,经过两步反应被氧化成,两步反应的能量变化示意图如下。
则1mon(aq)全部被氧化成(aq)的热化学方程式为: 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为 (填“吸热”或“放热”)反应。
已知破坏1 mol化学键需要吸收的热量如表所示,则该反应吸收或放出的热量为 kJ(用含a、b、c、d的代数式表示)。
化学键 C-H O-H C=O H-H
吸收热量(kJ/mol) a b c d
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:
①仪器a的名称为 ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热 (填“相等”或“不相等”),原因是 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H= kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【分析】气态碘的能量比固态碘的能量高,所以气态碘和氢气反应生成气态HI放出热量,而固态碘和氢气反应生成气态HI会吸收热量,所以反应①中的碘为气体,反应②中的碘为固体,据此作答。
【详解】A.由以上分析可知,反应①中的碘为气态,反应②中的碘为固态,故A错误;
B.由以上分析可知,反应①中的碘为气体,反应②中的碘为固体,将反应②减去反应①,即可得到I2(s)= I2(g)的ΔH=+35.96kJ/mol,即1mol 固态碘升华时将吸热35.96 kJ,故B错误;
C.一般地,同一物质,气态能量高于固态能量,所以①的反应物总能量比②的反应物总能量高,故C正确;
D.一般地,能量越低越稳定,同一物质,固态能量低于液态能量,液态能量低于气态能量,所以HI(s)比 HI(g)热稳定性更好,故D错误;
答案选C。
2.A
【详解】A.由盖斯定律可知,反应②—①得到反应,则反应△H3=△H2—△H1<0,所以焓变,故A错误;
B.血红蛋白可与氧气结合,血红蛋白更易与一氧化碳配位说明反应②比反应①正向进行的程度大,所以相同温度下平衡常数K1小于K2,故B正确;
C.由图可知,血红蛋白中中心离子为亚铁离子,配位原子为氧原子,配位数为6,故C正确;
D.由盖斯定律可知,反应②—①得到反应,一氧化碳中毒患者进入高压氧舱治疗,氧气浓度增大,平衡向逆反应方向移动,Hb(CO)浓度减小,从而缓解一氧化碳中毒,故D正确;
答案选A。
3.A
【详解】A.由题干图示信息可知,H2(g)+Cl2(g)=2HCl(g) =680-865=-185kJ/mol,故反应放出370kJ能量时,即有2molH2完全反应,则转移电子的物质的量为4mol,A错误;
B.由A项分析可知,H2(g)+Cl2(g)=2HCl(g) =680-865=-185kJ/mol,则反应 =185kJ/mol大于0,则该反应为吸热反应,B正确;
C.由题干图示信息可知,断开中的化学键需要吸收的能量为680-243=437kJ,C正确;
D.由题干图示信息可知,H-Cl的键能为:=432.5kJ/mol,Cl-Cl的键能为243kJ/mol,H-H的键能为437kJ/mol,键能越大化学键越稳定,故共价键的稳定性:H—H>H—Cl>Cl—Cl,D正确;
故答案为:A。
4.C
【详解】A.燃烧热是指1mol可燃物完全燃烧生成指定产物放出的热量,则表示正丁烷燃烧热的热化学方程式为 ,A错误;
B.不知道该条件下物质的状态,该反应是可逆反应,2mol 与1mol 充分反应后,实际消耗多少不得而知,所以无法写出热化学方程式,B错误;
C.在稀溶液中强酸和强碱发生中和反应生成1mol 放出的热量是中和热,C正确;
D.石墨转化为金刚石吸收能量,则石墨能量低于金刚石,能量越低越稳定,故石墨比金刚石稳定,D错误;
答案选C。
5.B
【详解】已知键能:E(C-H)=413.4kJ/mol,E(H-H))=436.0kJ/mol,根据反应热等于反应物的键能总和减去生成物的键能总和,结合反应 有:8E(C-H)+2E(C-C) 6E(C-H) E(C=C) E(C-C) E(H-H))=2E(C-H)+E(C-C) E(C=C) E(H-H)=2×413.4 436+E(C-C) E(C=C)=+124.14kJ/mol,故得E(C-C) E(C=C)= 266.66kJ/mol,故C=C的键能与C-C的键能相差约266.66kJ/mol,故答案为:B。
6.C
【详解】A.状态Ⅰ→状态Ⅲ表示CO与O反应的过程,只有化学键的形成,没有化学键的断裂,故A错误;
B.催化剂在反应前后质量和化学性质不变,但催化剂参与反应,故B错误;
C.CO和都是共价化合物,都含有极性共价键,故C正确;
D.由图可知CO与O反应生成的反应中反应物总能量大于生成物总能量,即该反应为放热反应,故D错误;
故答案为:C。
7.C
【详解】A.物质氧化反应是放热反应,放热反应的反应热小于0;△H1<0;△H3<0,A错误;
B.铝热反应是一个放热反应,则△H5<0;已知③、④、⑤,由盖斯定律可知⑤=(④-③),则△H5=<0,则,B错误;
C.根据盖斯定律可知,3△H1=2△H2 +△H3,C正确;
D.根据盖斯定律可知,△H3=△H4-2△H5,D错误;
故合理选项是C。
8.C
【分析】
由题干反应历程图可知,整个反应分为三个基元反应阶段:①NO(g)+NO(g)=H=+199.2kJ mol-1,②+CO(g)=CO2(g)+N2O(g)H=-513.5kJ mol-1,③CO2(g)+N2O(g)+CO(g)=2CO2(g)+N2(g)H-306.6kJ mol-1,根据盖斯定律①+②+③可知:2CO(g)+2NO(g)=N2(g)+2CO2(g)ΔH=-620.9kJ mol-1,据此分析解题。
【详解】A.由分析可知,此反应为放热反应,提高反应温度,平衡逆向移动,则反应物转化率降低,A正确;
B.使用催化剂可以降低反应的活化能,提高活化分子百分数,但催化剂不能使平衡发生移动,不能提高反应物的转化率,B正确;
C.由题干反应历程图可知,反应①的活化能最高,反应速率最慢,决定整个反应的反应速率,C错误;
D.由分析可知,反应2CO(g)+2NO(g)=N2(g)+2CO2(g)ΔH=-620.9kJ mol-1,则N2(g)+2CO2(g)═2CO(g)+2NO(g)ΔH=+620.9kJ mol-1,D正确;
故答案为:C。
9.D
【详解】A.根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,A错误;
B.0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,B错误;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,HCl和NaOH反应的中和热,1mol硫酸和1mol氢氧化钡反应生成2mol水和1mol硫酸钡沉淀,放出的热量不是114.6kJ,C错误;
D.反应的焓变与反应物和生成物的能量有关,与反应条件、变化过程无关,所以同温同压下,在光照和点燃条件的△H相同,D正确;
故选D。
10.A
【详解】A.钠与氨气反应生成氢气和NaNH2,H元素的化合价降低,则氨气具有氧化性,故A正确;
B.虽然该反应为放热反应,但需要加热条件才能发生,因为反应的吸放热与反应条件无关,故B错误;
C.氯化铵受热分解生成气体氯化氢和氨气,氨气和氯化氢相遇会发生反应生成固体氯化铵,不能用作实验室中制取少量氨气,故C错误;
D.氨气本身在水溶液或者熔融状态下,不能直接电离产生自由移动的离子,是非电解质,故D错误;
答案选A。
11.D
【详解】A.氢气在氧气中燃烧为放热反应,反应物的总能量大于生成物的总能量,A反应与图像不符;
B.碳酸氢钠受热分解为吸热反应,反应物的总能量小于生成物的总能量,B反应与图像不符;
C.氢氧化钠与盐酸的反应为放热反应,但是断裂化学键需要吸收能量,形成化学键需要放出能量,C反应与图像不符;
D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应为吸热反应,反应物的总能量小于生成物的总能量,D反应与图像相符;
故选D。
12.C
【详解】A.②③过程,发生氮氮键、氢氢键的断开需要吸收能量,是吸热过程,A正确;
B.③④过程,原子和原子形成了含有极性键的,B正确;
C.合成氨反应为放热反应,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.使用催化剂,可以加快合成氨反应的速率,D正确。
答案选C。
13.D
【详解】A.反应是吸热还是放热与是否需要加热无关,有些吸热反应,常温下即可进行,不需要加热,如氯化铵和氢氧化钡的反应,A错误;
B.由图可知,CO2(g)+H2O(1)能量高于 (aq)+H+(aq),故过程II为吸热反应,B错误;
C.由图可知,能量(aq)+2H+(aq)高于(aq)+H+(aq),但无法得出的能量比高,C错误;
D.由图可知,能量(aq)+2H+(aq)高于CO2 (aq)+2H2O(l),总反应为放热反应,D正确;
故选D。
14.C
【详解】A.由图可知,1molC(s)与1molO2(g)的能量之和比1molCO2(g)的能量高393.5kJ,A错误;
B.由图可知,1molCO(g)和0.5mol的O2(g)生成1molCO2(g)放出282.9kJ的热量,所以反应2CO(g)+O2(g)=2CO2(g)中,反应物的总能量大于生成物的总能量,B错误;
C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=2×(282.9-393.5)=-221.2kJ·mol-1,该方程式中的化学计量数不可表示分子个数,C正确;
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= ≈-10.1kJ·g-1,单位不正确,D错误;
故选C。
15.(1)-1264.8
(2) 无 △H=-198 kJ mol-1
(3)2NA或1.204×1024
(4) +13.8
【详解】(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,4molNH3的质量为4mol×17g/mol=68g,则放出热量为68g×18.6kJ=1264.8 kJ,所以 △H=-1264.8 kJ mol-1。
(2)①E的大小对该反应的反应物总能量、生成物总能量都不产生影响,所以对反应热无影响;②SO2氧化为SO3时,若有2molSO2完全反应,则放出热量为49.5 kJ×4=198 kJ,热化学方程式为 △H=-198 kJ mol-1。
(3)△H=-566 kJ mol-1 ①, △H=-226 kJ mol-1②,利用盖斯定律,将反应①×+②得, △H=(-566 kJ mol-1) ×+(-226 kJ mol-1)=- 509 kJ mol-1,反应转移2mole-,若CO(g)与Na2O2(s)反应放出509kJ热量时,则电子转移数目为2NA(或1.204×1024)。
(4)①图中信息显示,101.3kPa、1538℃,2Fe(l)=2Fe(s) △H=-27.6kJ mol-1,则△H=+13.8kJ mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为 △H=(-732.5-27.6-91.0) kJ mol-1=-851.1kJ mol-1。
16.(1) N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH= -642kJ·mol-1 321kJ
(2) 946kJ·mol-1 632kJ·mol-1
(3)N2H4(g)+NO2(g)=N2(g)+2H2O(g) ΔH= -578kJ·mol-1
【详解】(1)若每生成,放出的热量,则每生成1molN2,放出642kJ的热量,则热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642kJ·mol-1,1mol液态肼质量为32g,放出的热量为642kJ,则16g液态肼反应放出的热量为321kJ;
(2)设氮氮三键的键能为x,则:193kJ·mol-1+4×391kJ·mol-1+497kJ·mol-1-x-4×463kJ·mol-1=-544kJ·mol-1,解得x=946kJ·mol-1,则氮氮三键的键能为946kJ·mol-1;反应①:;反应②:,根据盖斯定律可知,由①-②×2可得:,即的燃烧热是632kJ·mol-1;
(3)反应③:;根据盖斯定律,①-×③可得:N2H4(g)+NO2(g)=N2(g)+2H2O(g) ΔH= -578kJ·mol-1。
17.(1) 第三周期IVA族 极性共价键
(2) 放出93 2.5NA NO+NO2+2NaOH=2NaNO2+H2O 3∶l
【分析】工业合成氨的原料是N2和H2,合成塔中压缩的氮气和氢气反应生成氨气,反应原料N2和H2可从混合气体中分离出来循环使用,氨气在氧化炉中先发生催化氧化反应生成一氧化氮,一氧化氮会与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,以此解答。
【详解】(1)Si在元素周期表中第三周期IVA族;在中,硅原子和氧原子通过极性共价键连接形成立体网状结构,所以硬度大。建筑粘合剂和防火剂硅酸钠,可用溶解在溶液中制备,反应的离子方程式为。
(2)①已知断裂、、分别需要吸收、、的能量,可得热化学方程式: ,在一定条件下消耗了和生成,该过程会放出93的能量;
②氧化炉中发生反应:,N元素由-3价上升到+2价,由反应可知1molNH3反应转移5mol电子,标准状况下的物质的量为0.5mol,0.5mol NH3转化为时转移的电子数目为2.5NA;
③吸收塔中出来的尾气NO和NO2,通过调节其体积比,可用NaOH溶液完全吸收,生成硝酸盐或亚硝酸盐,当V(NO)=V(NO2)时,发生反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,仅含NO和NO2的混合气被完全吸收,且体积分数之比NO∶NO2=1∶3,反应的化学方程式为:NO+3NO2+4NaOH=3NaNO2+NaNO3+2H2O,则产物中亚硝酸盐和硝酸盐的比例为3∶ l。
18.(1)-342.4
(2)
(3) 吸热
(4) 环形玻璃搅拌棒 相等 在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关 3.2℃ -53.5
【分析】已知①,②,
③,④,由盖斯定律可知④=2×①+4×②-③,计算值;根据焓变=反应物的键能总和-生成物的键能总和,该反应焓变 ;在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关。
【详解】(1)已知①,②,
③,④,由盖斯定律可知④=2×①+4×②-③,计算
故答案为:-342.4;
(2)由图可知第一步反应的热化学方程式为:①,
第二步的热化学反应方程式为:②,则①+②得到:,故答案为:;
(3)根据焓变=反应物的键能总和-生成物的键能总和,该反应焓变 ,则吸收kJ,故答案为:吸热;;
(4)①仪器a为环形玻璃搅拌棒,保持其他条件不变,实验中改用100mL0.50mol L 1盐酸与100mL0.55mol L 1NaOH溶液进行反应,与上述实验相比,二者所测的中和热相等,因为在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关,故答案为:环形玻璃搅拌棒;相等;在稀溶液中,强酸与强碱发生中和反应生成1 mol水时的反应热叫做中和热,中和热与所取酸与碱的物质的量无关;
②四组温度差中第二组误差较大,应该舍去,其他三组(T2 T1)的平均值为3.2℃,50mL0.50mol L 1盐酸与50mL0.55mol L 1NaOH溶液生成水的物质的量为0.025mol,放出的热量,则,故答案为:3.2℃;-53.5。
答案第1页,共2页
答案第1页,共2页
同课章节目录
