浙江省杭州市教研联盟2023-2024学年高一下学期6月学考模拟考试化学试卷(含答案)
文档属性
| 名称 | 浙江省杭州市教研联盟2023-2024学年高一下学期6月学考模拟考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 364.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-22 17:06:53 | ||
图片预览



文档简介
绝密★启用前
2024年6月“桐 浦 富 兴”教研联盟学考模拟
高一年级化学学科 试题
考生须知:
1.本卷共 8 页满分 100 分,考试时间 60 分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Ca 40 Fe 56 Cu 64
选择题部分
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
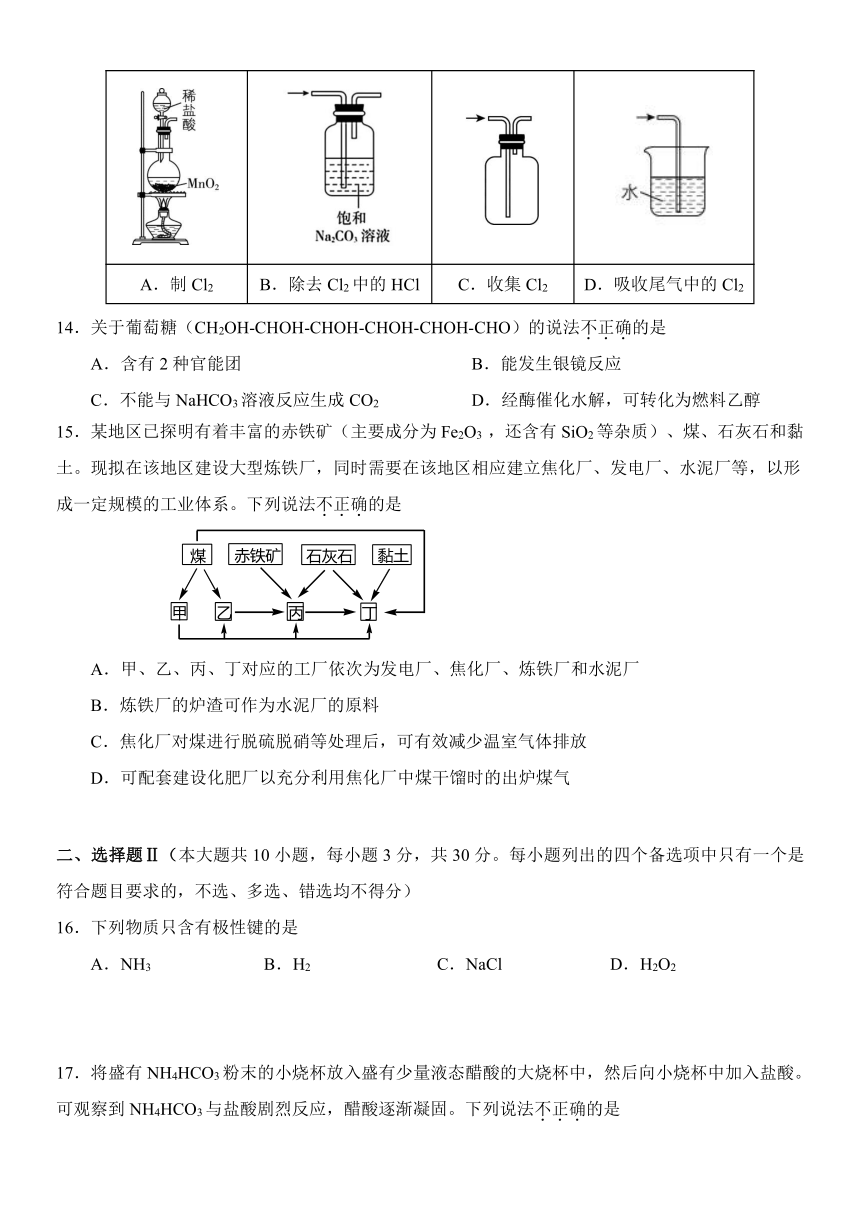
1.按物质的组成进行分类,SiO2属于
A.碱 B.氧化物 C.盐 D.有机物
2.下列与实验有关的图标或安全标识对应不正确的是
A.护目镜 B.洗手 C.易燃类物质 D.排风
3.下列仪器名称为“容量瓶”的是
A. B. C. D.
4.下列可以用来表示化学反应速率单位的是
A.mol/L B.g/mol C.mol/(L·s) D.g/L
5.黑火药爆炸时反应:S+2KNO3+3CK2S+N2↑+3CO2↑。该反应的氧化产物是
A.K2S B.N2 C.CO2 D.KNO3
6.当光束通过下列物质时,不会出现丁达尔效应的是
A.Fe(OH)3胶体 B.蛋白质溶液 C.云、雾 D.蔗糖溶液
7.下列物质的名称与化学式对应关系不正确的是
A.氯仿:CCl4 B.冰醋酸:CH3COOH
C.黄铁矿:FeS2 D.小苏打:NaHCO3
8.下列说法不正确的是
A.和互为同位素 B.石墨烯和丙烯互为同系物
C.氧气和臭氧互为同素异形体 D.乙酸甲酯和甲酸乙酯互为同分异构体
9.下列不能用作食品添加剂的是
A.氯化镁 B.亚硝酸钠 C.山梨酸钾 D.三聚氰胺
10.W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示。下列说法不正确的是
A.原子半径:X>Y B.W元素位于第二周期IVA族
C.最高价氧化物对应水化物的酸性:M>Z D.N元素的单质可作半导体材料
11.下列化学用语正确的是
A.氯酸钾的电离方程式:KClO3K+ + Cl5+ + 3O2-
B.氢氧化钡溶液与稀硫酸反应的离子方程式:Ba2++SOBaSO4↓
C.氧化铝溶于氢氧化钠溶液的化学方程式:Al2O3+2NaOH +3H2O 2Na[Al(OH)4]
D.甲烷与氯气在光照条件下生成二氯甲烷的化学方程式:CH4+Cl2CH2Cl2+H2
12.下列说法正确的是
A.氯化铁溶液具有氧化性,所以可用于制作印刷电路板
B.植物油中含碳碳双键,所以可用于生产甘油
C.硬铝强度高、密度大,所以是制造飞机的理想材料
D.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
13.下列关于实验室制备Cl2的描述均正确的是
A.制Cl2 B.除去Cl2中的HCl C.收集Cl2 D.吸收尾气中的Cl2
14.关于葡萄糖(CH2OH-CHOH-CHOH-CHOH-CHOH-CHO)的说法不正确的是
A.含有2种官能团 B.能发生银镜反应
C.不能与NaHCO3溶液反应生成CO2 D.经酶催化水解,可转化为燃料乙醇
15.某地区已探明有着丰富的赤铁矿(主要成分为Fe2O3 ,还含有SiO2等杂质)、煤、石灰石和黏土。现拟在该地区建设大型炼铁厂,同时需要在该地区相应建立焦化厂、发电厂、水泥厂等,以形成一定规模的工业体系。下列说法不正确的是
A.甲、乙、丙、丁对应的工厂依次为发电厂、焦化厂、炼铁厂和水泥厂
B.炼铁厂的炉渣可作为水泥厂的原料
C.焦化厂对煤进行脱硫脱硝等处理后,可有效减少温室气体排放
D.可配套建设化肥厂以充分利用焦化厂中煤干馏时的出炉煤气
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
16.下列物质只含有极性键的是
A.NH3 B.H2 C.NaCl D.H2O2
17.将盛有NH4HCO3粉末的小烧杯放入盛有少量液态醋酸的大烧杯中,然后向小烧杯中加入盐酸。可观察到NH4HCO3与盐酸剧烈反应,醋酸逐渐凝固。下列说法不正确的是
A.醋酸由液态转化为固态时放出热量
B.NH4HCO3与盐酸的反应中,热能转化为产物内部的能量
C.NH4HCO3与盐酸的反应中,反应物的总能量高于生成物的总能量
D.NH4HCO3和盐酸的反应中,涉及离子键、共价键的断裂
18.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。该电池总反应:
3Zn+2K2FeO4+5H2O = 3Zn(OH)2+Fe2O3+4KOH。下列说法正确的是
A.电池工作时OH-向负极迁移
B.正极反应式为2FeO+10H++6e- = Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电子由Zn电极流出,经KOH溶液流向正极
19.设NA为阿伏伽德罗常数的值。下列说法不正确的是
A.标准状况,2.24 L Cl2中含有的分子数目为0.1 NA
B.1 L 0.2 mo1/L的稀硫酸中,含有的氢原子数目为0.4 NA
C.2.3 g Na与O2完全反应,转移的电子数目为0.1 NA
D.常温常压下,3.0 g C2H6中含有的碳氢键数目为0.6 NA
20.汽车尾气脱硝脱碳的主要反应:2NO(g)+2CO(g)N2(g)+2CO2(g),该反应为放热反应。在一定温度、体积固定为2 L的密闭容器中,某兴趣小组模拟该反应,用传感器测得该反应在不同时刻的NO和CO浓度如表所示:
时间/s 0 1 2 3 4
c(NO)/(mol/L) 9.50×10-3 4.50×10-3 2.50×10-3 1.50×10-3 1.50×10-3
c(CO)/(mol/L) 9.00×10-3 4.00×10-3 2.00×10-3 1.00×10-3 1.00×10-3
下列说法不正确的是
A.前2 s内的化学反应速率v(N2)=1.75×10-3 mol/(L·s)
B.升高温度时,正反应速率和逆反应速率均增大
C.当密闭容器中气体压强不再发生变化时,反应达到平衡状态
D.当反应达到平衡时,密闭容器中气体浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2
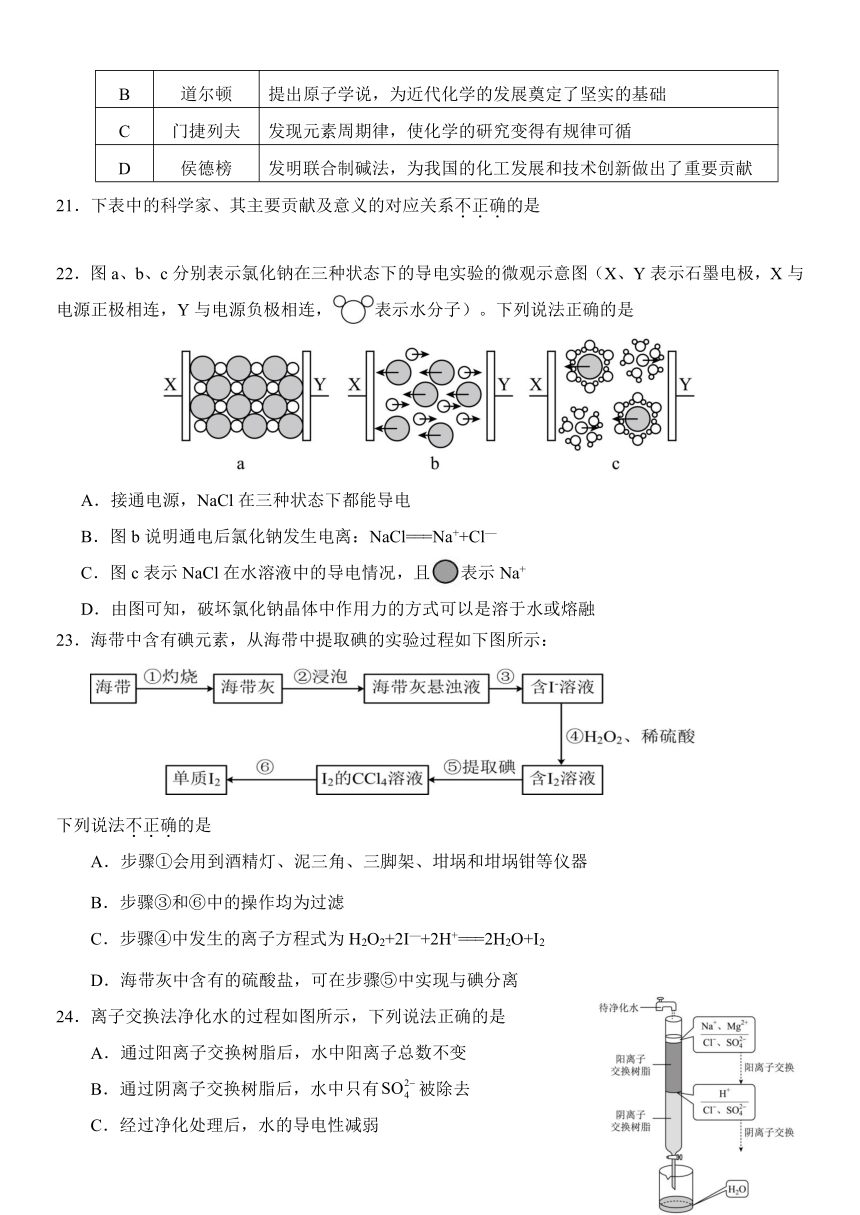
选项 科学家 主要贡献及意义
A 拉瓦锡 提出元素的概念,标志着近代化学的诞生
B 道尔顿 提出原子学说,为近代化学的发展奠定了坚实的基础
C 门捷列夫 发现元素周期律,使化学的研究变得有规律可循
D 侯德榜 发明联合制碱法,为我国的化工发展和技术创新做出了重要贡献
21.下表中的科学家、其主要贡献及意义的对应关系不正确的是
22.图a、b、c分别表示氯化钠在三种状态下的导电实验的微观示意图(X、Y表示石墨电极,X与电源正极相连,Y与电源负极相连,表示水分子)。下列说法正确的是
A.接通电源,NaCl在三种状态下都能导电
B.图b说明通电后氯化钠发生电离:NaClNa++Cl—
C.图c表示NaCl在水溶液中的导电情况,且表示Na+
D.由图可知,破坏氯化钠晶体中作用力的方式可以是溶于水或熔融
23.海带中含有碘元素,从海带中提取碘的实验过程如下图所示:
下列说法不正确的是
A.步骤①会用到酒精灯、泥三角、三脚架、坩埚和坩埚钳等仪器
B.步骤③和⑥中的操作均为过滤
C.步骤④中发生的离子方程式为H2O2+2I—+2H+2H2O+I2
D.海带灰中含有的硫酸盐,可在步骤⑤中实现与碘分离
24.离子交换法净化水的过程如图所示,下列说法正确的是
A.通过阳离子交换树脂后,水中阳离子总数不变
B.通过阴离子交换树脂后,水中只有被除去
C.经过净化处理后,水的导电性减弱
D.若将阳离子交换树脂与阴离子交换树脂位置互换,可提高水的净化效率
25.下列有机实验方案设计正确,且能达到预期目的的是
编号 目的 方案设计
A 除去乙烷中混有的少量乙烯 将混合气体通入盛有溴的四氯化碳溶液的洗气瓶中
B 比较水和乙醇中羟基氢活泼性强弱 向两支试管中分别加入2 mL H2O和C2H5OH水溶液,再同时向两支试管中加相同大小的金属Na,观察现象
C 探究淀粉是否完全水解 在0.5 g淀粉中加入4 mL 2 mol/L的硫酸溶液,加热一段时间,冷却后加入NaOH溶液调至碱性,再加入少量新制Cu(OH)2悬浊液加热,观察实验现象
D 制备乙酸乙酯 在一支试管中加入2 mL乙醇,边振荡边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。用小火加热,产生的蒸汽经导管通到饱和Na2CO3溶液的上方约0.5 cm处
非选择题部分
三、非选择题(本大题共5小题,共40分)
26.(8分)请回答:
(1)①氮气的电子式是 ▲ ,②乙醛的结构简式是 ▲ 。
(2)过氧化钠与水反应的化学方程式是 ▲ 。
(3)乙烯在空气中燃烧,可观察到的现象是 ▲ 。
27.(8分)汽油不仅是一种燃料,也是一种重要的化工原料。汽油通过裂解可以得到乙烯、丙烯等气态物质,乙烯、丙烯可进一步合成丙烯酸乙酯。有关物质转化关系如下:
请回答:
(1)丙烯酸乙酯的分子式是 ▲ 。
(2)有机物B中含氧官能团的名称是 ▲ 。
(3)久置的丙烯酸乙酯自身也会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。该聚合反应的化学方程式是 ▲ 。
(4)下列说法正确的是 ▲ 。
A.步骤①是石油的分馏,属于化学变化
B.步骤②的反应类型是加成反应
C.相同质量的乙烯、丙烯完全燃烧,消耗的氧气质量相等
D.仅用Na2CO3溶液无法鉴别有机物A、B和丙烯酸乙酯
28.(8分)氨是一种重要的化工产品和化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
请回答:
(1)物质A是 ▲ 。
(2)加热条件下氨能使黑色的氧化铜变红,体现了氨具有 ▲ 性。
(3)硝酸工业中的尾气NO2可用纯碱溶液吸收,生成NaNO2 、NaNO3和一种气体,写出该反应的化学方程式 ▲ 。
(4)下列说法不正确的是 ▲ 。
A.NH3能使湿润的蓝色石蕊试纸变红
B.合成氨反应中,使用催化剂能提高单位时间内氨的产量
C.工业生产中贮存浓硝酸,可选用金属铝做罐体材料
D.在一定条件下NH3与CO2转化为氮肥的过程,属于人工固氮
29.(10分)某化学兴趣小组用如图所示装置进行铁与水蒸气的反应。请回答:
(1)装置C的名称是 ▲ 。
(2)装置A的作用是 ▲ 。
(3)收集反应产生的气体应选用装置 ▲ (填“D”或“E”)。
(4)探究反应后装置B处硬质玻璃管中固体物质组成的方法:
①提出假设
假设i:固体物质只有Fe;
假设ii:固体物质只有 ▲ (填化学式);
假设iii:固体物质既有Fe,也有Fe3O4。
②请设计实验方案确定固体物质组成 ▲ 。
30.(6分)为测定空气中SO2的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的200 mL 0.100 mol/L的酸性KMnO4溶液。已知SO2与该溶液反应的离子方程式:
5SO2 +2MnO +2H2O5SO +2Mn2+ +4H+
若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定SO2可被溶液充分吸收。请计算:
KMnO4的物质的量是 ▲ mol。
(2)被KMnO4溶液吸收的SO2是 ▲ mol。
(3)该空气样品中SO2的含量是 ▲ mg/L(用含a、b的代数式表示)。
2024年6月“桐 浦 富 兴”教研联盟学考模拟
高一年级化学学科参考答案
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B B A C C D A B D B
题号 11 12 13 14 15
答案 C A C D C
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 16 17 18 19 20 21 22 23 24 25
答案 A C A B D A D B C D
三、非选择题(本大题共5小题,共40分)
26.(8分)
(1)(2分。写分子式不给分) CH3CHO(2分。写分子式不给分)
(2)2Na2O2+2H2O4NaOH+O2↑(2分。未配平得1分)
(3)火焰明亮(1分)且伴有黑烟(1分)
27.(8分)
(1)C5H8O2(2分)
(2)羧基(2分。有错别字不得分)
(3)(2分。写分子式不给分)
(4)BC(2分。少选且正确得1分,错选不得分)
28.(8分)
(1)空气或O2(2分)
(2)还原(2分)
(3)Na2CO3+2NO2NaNO2+NaNO3+CO2(2分。未配平得1分)
(4)AD(2分。少选且正确得1分,错选不得分)
29.(10分)
(1)(球形)干燥管(2分。有错别字不得分)
(2)产生水蒸气(2分)
(3)D(2分)
(4)①Fe3O4(2分)
②取少量固体物质,称量,计为m1 g;在高温下通足量的CO充分反应后恒重,固体质量计为m2 g(1分)。若m2=m1,则只有Fe;若m2 m1,则只有Fe3O4;若 m1 < m2 < m1,则既有Fe,也有Fe3O4(1分。其他合理答案也给分)
30.(6分)
(1)0.02(2分)
(2)0.05(2分)
(3)(2分)
2024年6月“桐 浦 富 兴”教研联盟学考模拟
高一年级化学学科 试题
考生须知:
1.本卷共 8 页满分 100 分,考试时间 60 分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Ca 40 Fe 56 Cu 64
选择题部分
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.按物质的组成进行分类,SiO2属于
A.碱 B.氧化物 C.盐 D.有机物
2.下列与实验有关的图标或安全标识对应不正确的是
A.护目镜 B.洗手 C.易燃类物质 D.排风
3.下列仪器名称为“容量瓶”的是
A. B. C. D.
4.下列可以用来表示化学反应速率单位的是
A.mol/L B.g/mol C.mol/(L·s) D.g/L
5.黑火药爆炸时反应:S+2KNO3+3CK2S+N2↑+3CO2↑。该反应的氧化产物是
A.K2S B.N2 C.CO2 D.KNO3
6.当光束通过下列物质时,不会出现丁达尔效应的是
A.Fe(OH)3胶体 B.蛋白质溶液 C.云、雾 D.蔗糖溶液
7.下列物质的名称与化学式对应关系不正确的是
A.氯仿:CCl4 B.冰醋酸:CH3COOH
C.黄铁矿:FeS2 D.小苏打:NaHCO3
8.下列说法不正确的是
A.和互为同位素 B.石墨烯和丙烯互为同系物
C.氧气和臭氧互为同素异形体 D.乙酸甲酯和甲酸乙酯互为同分异构体
9.下列不能用作食品添加剂的是
A.氯化镁 B.亚硝酸钠 C.山梨酸钾 D.三聚氰胺
10.W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示。下列说法不正确的是
A.原子半径:X>Y B.W元素位于第二周期IVA族
C.最高价氧化物对应水化物的酸性:M>Z D.N元素的单质可作半导体材料
11.下列化学用语正确的是
A.氯酸钾的电离方程式:KClO3K+ + Cl5+ + 3O2-
B.氢氧化钡溶液与稀硫酸反应的离子方程式:Ba2++SOBaSO4↓
C.氧化铝溶于氢氧化钠溶液的化学方程式:Al2O3+2NaOH +3H2O 2Na[Al(OH)4]
D.甲烷与氯气在光照条件下生成二氯甲烷的化学方程式:CH4+Cl2CH2Cl2+H2
12.下列说法正确的是
A.氯化铁溶液具有氧化性,所以可用于制作印刷电路板
B.植物油中含碳碳双键,所以可用于生产甘油
C.硬铝强度高、密度大,所以是制造飞机的理想材料
D.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
13.下列关于实验室制备Cl2的描述均正确的是
A.制Cl2 B.除去Cl2中的HCl C.收集Cl2 D.吸收尾气中的Cl2
14.关于葡萄糖(CH2OH-CHOH-CHOH-CHOH-CHOH-CHO)的说法不正确的是
A.含有2种官能团 B.能发生银镜反应
C.不能与NaHCO3溶液反应生成CO2 D.经酶催化水解,可转化为燃料乙醇
15.某地区已探明有着丰富的赤铁矿(主要成分为Fe2O3 ,还含有SiO2等杂质)、煤、石灰石和黏土。现拟在该地区建设大型炼铁厂,同时需要在该地区相应建立焦化厂、发电厂、水泥厂等,以形成一定规模的工业体系。下列说法不正确的是
A.甲、乙、丙、丁对应的工厂依次为发电厂、焦化厂、炼铁厂和水泥厂
B.炼铁厂的炉渣可作为水泥厂的原料
C.焦化厂对煤进行脱硫脱硝等处理后,可有效减少温室气体排放
D.可配套建设化肥厂以充分利用焦化厂中煤干馏时的出炉煤气
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
16.下列物质只含有极性键的是
A.NH3 B.H2 C.NaCl D.H2O2
17.将盛有NH4HCO3粉末的小烧杯放入盛有少量液态醋酸的大烧杯中,然后向小烧杯中加入盐酸。可观察到NH4HCO3与盐酸剧烈反应,醋酸逐渐凝固。下列说法不正确的是
A.醋酸由液态转化为固态时放出热量
B.NH4HCO3与盐酸的反应中,热能转化为产物内部的能量
C.NH4HCO3与盐酸的反应中,反应物的总能量高于生成物的总能量
D.NH4HCO3和盐酸的反应中,涉及离子键、共价键的断裂
18.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。该电池总反应:
3Zn+2K2FeO4+5H2O = 3Zn(OH)2+Fe2O3+4KOH。下列说法正确的是
A.电池工作时OH-向负极迁移
B.正极反应式为2FeO+10H++6e- = Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电子由Zn电极流出,经KOH溶液流向正极
19.设NA为阿伏伽德罗常数的值。下列说法不正确的是
A.标准状况,2.24 L Cl2中含有的分子数目为0.1 NA
B.1 L 0.2 mo1/L的稀硫酸中,含有的氢原子数目为0.4 NA
C.2.3 g Na与O2完全反应,转移的电子数目为0.1 NA
D.常温常压下,3.0 g C2H6中含有的碳氢键数目为0.6 NA
20.汽车尾气脱硝脱碳的主要反应:2NO(g)+2CO(g)N2(g)+2CO2(g),该反应为放热反应。在一定温度、体积固定为2 L的密闭容器中,某兴趣小组模拟该反应,用传感器测得该反应在不同时刻的NO和CO浓度如表所示:
时间/s 0 1 2 3 4
c(NO)/(mol/L) 9.50×10-3 4.50×10-3 2.50×10-3 1.50×10-3 1.50×10-3
c(CO)/(mol/L) 9.00×10-3 4.00×10-3 2.00×10-3 1.00×10-3 1.00×10-3
下列说法不正确的是
A.前2 s内的化学反应速率v(N2)=1.75×10-3 mol/(L·s)
B.升高温度时,正反应速率和逆反应速率均增大
C.当密闭容器中气体压强不再发生变化时,反应达到平衡状态
D.当反应达到平衡时,密闭容器中气体浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2
选项 科学家 主要贡献及意义
A 拉瓦锡 提出元素的概念,标志着近代化学的诞生
B 道尔顿 提出原子学说,为近代化学的发展奠定了坚实的基础
C 门捷列夫 发现元素周期律,使化学的研究变得有规律可循
D 侯德榜 发明联合制碱法,为我国的化工发展和技术创新做出了重要贡献
21.下表中的科学家、其主要贡献及意义的对应关系不正确的是
22.图a、b、c分别表示氯化钠在三种状态下的导电实验的微观示意图(X、Y表示石墨电极,X与电源正极相连,Y与电源负极相连,表示水分子)。下列说法正确的是
A.接通电源,NaCl在三种状态下都能导电
B.图b说明通电后氯化钠发生电离:NaClNa++Cl—
C.图c表示NaCl在水溶液中的导电情况,且表示Na+
D.由图可知,破坏氯化钠晶体中作用力的方式可以是溶于水或熔融
23.海带中含有碘元素,从海带中提取碘的实验过程如下图所示:
下列说法不正确的是
A.步骤①会用到酒精灯、泥三角、三脚架、坩埚和坩埚钳等仪器
B.步骤③和⑥中的操作均为过滤
C.步骤④中发生的离子方程式为H2O2+2I—+2H+2H2O+I2
D.海带灰中含有的硫酸盐,可在步骤⑤中实现与碘分离
24.离子交换法净化水的过程如图所示,下列说法正确的是
A.通过阳离子交换树脂后,水中阳离子总数不变
B.通过阴离子交换树脂后,水中只有被除去
C.经过净化处理后,水的导电性减弱
D.若将阳离子交换树脂与阴离子交换树脂位置互换,可提高水的净化效率
25.下列有机实验方案设计正确,且能达到预期目的的是
编号 目的 方案设计
A 除去乙烷中混有的少量乙烯 将混合气体通入盛有溴的四氯化碳溶液的洗气瓶中
B 比较水和乙醇中羟基氢活泼性强弱 向两支试管中分别加入2 mL H2O和C2H5OH水溶液,再同时向两支试管中加相同大小的金属Na,观察现象
C 探究淀粉是否完全水解 在0.5 g淀粉中加入4 mL 2 mol/L的硫酸溶液,加热一段时间,冷却后加入NaOH溶液调至碱性,再加入少量新制Cu(OH)2悬浊液加热,观察实验现象
D 制备乙酸乙酯 在一支试管中加入2 mL乙醇,边振荡边慢慢加入0.5 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。用小火加热,产生的蒸汽经导管通到饱和Na2CO3溶液的上方约0.5 cm处
非选择题部分
三、非选择题(本大题共5小题,共40分)
26.(8分)请回答:
(1)①氮气的电子式是 ▲ ,②乙醛的结构简式是 ▲ 。
(2)过氧化钠与水反应的化学方程式是 ▲ 。
(3)乙烯在空气中燃烧,可观察到的现象是 ▲ 。
27.(8分)汽油不仅是一种燃料,也是一种重要的化工原料。汽油通过裂解可以得到乙烯、丙烯等气态物质,乙烯、丙烯可进一步合成丙烯酸乙酯。有关物质转化关系如下:
请回答:
(1)丙烯酸乙酯的分子式是 ▲ 。
(2)有机物B中含氧官能团的名称是 ▲ 。
(3)久置的丙烯酸乙酯自身也会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。该聚合反应的化学方程式是 ▲ 。
(4)下列说法正确的是 ▲ 。
A.步骤①是石油的分馏,属于化学变化
B.步骤②的反应类型是加成反应
C.相同质量的乙烯、丙烯完全燃烧,消耗的氧气质量相等
D.仅用Na2CO3溶液无法鉴别有机物A、B和丙烯酸乙酯
28.(8分)氨是一种重要的化工产品和化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
请回答:
(1)物质A是 ▲ 。
(2)加热条件下氨能使黑色的氧化铜变红,体现了氨具有 ▲ 性。
(3)硝酸工业中的尾气NO2可用纯碱溶液吸收,生成NaNO2 、NaNO3和一种气体,写出该反应的化学方程式 ▲ 。
(4)下列说法不正确的是 ▲ 。
A.NH3能使湿润的蓝色石蕊试纸变红
B.合成氨反应中,使用催化剂能提高单位时间内氨的产量
C.工业生产中贮存浓硝酸,可选用金属铝做罐体材料
D.在一定条件下NH3与CO2转化为氮肥的过程,属于人工固氮
29.(10分)某化学兴趣小组用如图所示装置进行铁与水蒸气的反应。请回答:
(1)装置C的名称是 ▲ 。
(2)装置A的作用是 ▲ 。
(3)收集反应产生的气体应选用装置 ▲ (填“D”或“E”)。
(4)探究反应后装置B处硬质玻璃管中固体物质组成的方法:
①提出假设
假设i:固体物质只有Fe;
假设ii:固体物质只有 ▲ (填化学式);
假设iii:固体物质既有Fe,也有Fe3O4。
②请设计实验方案确定固体物质组成 ▲ 。
30.(6分)为测定空气中SO2的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的200 mL 0.100 mol/L的酸性KMnO4溶液。已知SO2与该溶液反应的离子方程式:
5SO2 +2MnO +2H2O5SO +2Mn2+ +4H+
若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定SO2可被溶液充分吸收。请计算:
KMnO4的物质的量是 ▲ mol。
(2)被KMnO4溶液吸收的SO2是 ▲ mol。
(3)该空气样品中SO2的含量是 ▲ mg/L(用含a、b的代数式表示)。
2024年6月“桐 浦 富 兴”教研联盟学考模拟
高一年级化学学科参考答案
一、选择题Ⅰ(本大题共15小题,每小题2分,共30分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B B A C C D A B D B
题号 11 12 13 14 15
答案 C A C D C
二、选择题Ⅱ(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
题号 16 17 18 19 20 21 22 23 24 25
答案 A C A B D A D B C D
三、非选择题(本大题共5小题,共40分)
26.(8分)
(1)(2分。写分子式不给分) CH3CHO(2分。写分子式不给分)
(2)2Na2O2+2H2O4NaOH+O2↑(2分。未配平得1分)
(3)火焰明亮(1分)且伴有黑烟(1分)
27.(8分)
(1)C5H8O2(2分)
(2)羧基(2分。有错别字不得分)
(3)(2分。写分子式不给分)
(4)BC(2分。少选且正确得1分,错选不得分)
28.(8分)
(1)空气或O2(2分)
(2)还原(2分)
(3)Na2CO3+2NO2NaNO2+NaNO3+CO2(2分。未配平得1分)
(4)AD(2分。少选且正确得1分,错选不得分)
29.(10分)
(1)(球形)干燥管(2分。有错别字不得分)
(2)产生水蒸气(2分)
(3)D(2分)
(4)①Fe3O4(2分)
②取少量固体物质,称量,计为m1 g;在高温下通足量的CO充分反应后恒重,固体质量计为m2 g(1分)。若m2=m1,则只有Fe;若m2 m1,则只有Fe3O4;若 m1 < m2 < m1,则既有Fe,也有Fe3O4(1分。其他合理答案也给分)
30.(6分)
(1)0.02(2分)
(2)0.05(2分)
(3)(2分)
同课章节目录
