【核心素养】第四章 第一节 原子结构与元素周期表 教学设计 (表格式)高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 【核心素养】第四章 第一节 原子结构与元素周期表 教学设计 (表格式)高中化学 人教版(2019) 必修 第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 123.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-23 10:44:18 | ||
图片预览


文档简介
教学设计
课 题 元素周期表
课时安排 课前准备
教材内容 分 析 本节内容是高中化学人教版(2019版)必修第一册第四章第一节《原子建构与元素周期表》内容。本课时是本节的第二课时“元素周期表 核素、同位素”的内容。在学习原子核外电子排布的基础上,了解元素周期表的绘制原则。在之前的学习中,学生已经知道了原子是由核外电子、质子和中子构成的,在初中也了解了元素周期表的简单概念,但是不清楚元素周期表的编写原则,对于族和周期的分类也不是非常清晰。通过本课时的学习,进一步理解元素周期表尤其是短周期元素的编写方式,为今后元素周期律的学习打下坚实的基础。
设计理念 本课时教学可以从化学史引入新课,创设问题情境,让线索带着问题去思考,去阅读。教师再利用课件及赣教云平台让学生熟悉并了解族、周期的概念及元素周期表的结构。既可以培养学生的自学能力,又能激发学习兴趣,促使学生在情境中主动探究科学的奥秘。
学情分析 学生在初中已经初步了解元素周期表,知道元素周期表的基本结构(横排和纵列),并会用元素周期表查找元素的部分知识,但对元素与原子结构的关系理解深度不够,不清楚族、周期等概念,特别是原子核外电子排布特点与族序数、周期数的关系等。
教学目标 1.了解元素周期表的编排原则,知道周期和族的表示方法。 2.了解元素周期表的基本结构,知道主族和副族的概念。 3.能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置。
教学重难点 重点:能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置 难点:能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置
教学过程
教学环节(一) 师生活动 【引入】播放有关元素周期表的发展历程化学视频(赣教云云资源中提前下载) [教师]通过观看视频,我们大致理了解的一下元素周期表的发展历程,那现行的元素周期表是怎么样的呢 今天我们就来了解一下。 [学生]观看视频并总结元素周期表发展历程中相应问题。 一、元素周期表发展历程
设计意图 采用视频引入,可以引发学生学习兴趣,了解元素周期表的发展历程,同时为现行元素周期表的讲解作准备。
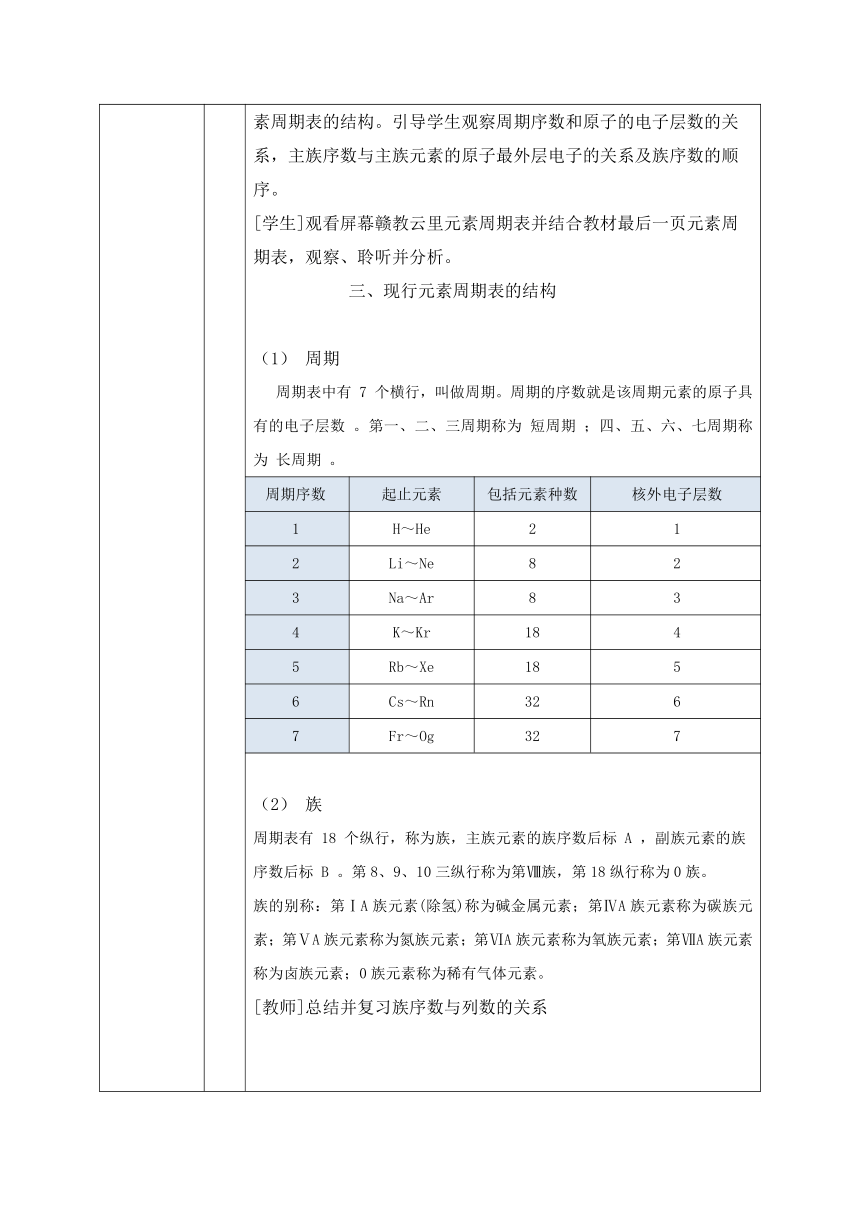
教学环节(二) 师生活动 [教师]打开赣教云里元素周期表中小程序,引导学生观察元素周期表中原子结构示意图,引导学生分析现行元素周期表的编排原则,后面PPT投影总结。 [学生]观察观察元素周期表中原子结构示意图,分析归纳出总结现行元素周期表的编排原则 二、现行元素周期表的编排原则 横行:把电子层数相同的元素,按原子序数递增顺序从左到右排列 纵行:把最外层电子数相同的元素,按电子层数递增的顺序自上而下排列 [教师] 继续利用赣教云里元素周期表中小程序,引导学生分析元素周期表的结构。引导学生观察周期序数和原子的电子层数的关系,主族序数与主族元素的原子最外层电子的关系及族序数的顺序。 [学生]观看屏幕赣教云里元素周期表并结合教材最后一页元素周期表,观察、聆听并分析。 三、现行元素周期表的结构 周期 周期表中有 7 个横行,叫做周期。周期的序数就是该周期元素的原子具有的电子层数 。第一、二、三周期称为 短周期 ;四、五、六、七周期称为 长周期 。 周期序数起止元素包括元素种数核外电子层数1H~He212Li~Ne823Na~Ar834K~Kr1845Rb~Xe1856Cs~Rn3267Fr~Og327
族 周期表有 18 个纵行,称为族,主族元素的族序数后标 A ,副族元素的族序数后标 B 。第8、9、10三纵行称为第Ⅷ族,第18纵行称为0族。 族的别称:第ⅠA族元素(除氢)称为碱金属元素;第ⅣA族元素称为碳族元素;第ⅤA族元素称为氮族元素;第ⅥA族元素称为氧族元素;第ⅦA族元素称为卤族元素;0族元素称为稀有气体元素。 [教师]总结并复习族序数与列数的关系 主族 副族
设计意图 元素周期表的结构和原子结构示意图有很大联系,可以利用信息技术中帮助学生直观地找到其中联系,便于学生理解和记忆。
教学环节 (三) 师生活动 [教师]提问:我们已经了解到了元素周期表的结构及其结构和原子结构之间的联系,那我们怎么能够迅速找到元素在原子周期表中的位置呢?又该如何表示呢? 以氯原子为例进行分析 [学生]分析并聆听 [教师]提问:如何确定元素在周期表中的位置? 四、元素位置的表示 1.给出原子结构示意图 (1)周期序数=原子的电子层数 (2)主族序数=最外层电子数 [练习] [学生]思考并展示答案。 2. 给出原子序数 ①. 原子序数少于18---熟记 ②.“0族”法确定元素在周期表中的位置 [练习] 推算原子序数为82的元素在周期表中的位置。
设计意图 元素位置的表示在学生已经了解了元素结构的前提下进行分析,在讲解这块内容时依靠PPT展示,投影学生的答案及教师讲解相结合。
教学环节 (四) 师生活动 五、元素周期表中的方格中的符号的意义 [练习].元素周期表中铊元素的数据如图,下列说法正确的是( ) A.铊元素的质量数是204.4 B.铊原子的中子数为81 C.铊对应的氢氧化物有两性 D.铊元素位于第ⅢA族 [教师]以练习带出问题,利用手中元素周期表分析方格中的符号的意义 [学生]解答从素周期表中的方格中的符号所获得的信息
设计意图 学生对于这块知识点比较熟悉,因此学生学生展示从素周期表中的方格中的符号所获得的信息。同时这块内容比较单间,因此就简单带过。
板书设计 元素周期表 结构 7个周期 周期序数 = 核外电子层数 18列 16族 主族,副族,Ⅷ族,0族 元素位置表示 1.给出原子结构示意图 (1)周期序数=原子的电子层数 (2)主族序数=最外层电子数 2.稀有气体定位法
教学反思 首先是利用赣教云平台中视频引入,在介绍元素周期表中同时起到了引发学生学习兴趣和为元素周期表的介绍为铺垫。在介绍元素周期表的结构,也充分利用到信息技术,将元素周期表结构的编排原则及周期,主族序数和最外层电子数的关系直观化,学生能发现其规律,便于学生理解和掌握。本节课充分利用到赣教云平台,将信息技术融入教学中。利用信息技术更好引导学生理解所学内容,同时结合知识内容本身采用合适的教学方法,将知识简单化。
课 题 元素周期表
课时安排 课前准备
教材内容 分 析 本节内容是高中化学人教版(2019版)必修第一册第四章第一节《原子建构与元素周期表》内容。本课时是本节的第二课时“元素周期表 核素、同位素”的内容。在学习原子核外电子排布的基础上,了解元素周期表的绘制原则。在之前的学习中,学生已经知道了原子是由核外电子、质子和中子构成的,在初中也了解了元素周期表的简单概念,但是不清楚元素周期表的编写原则,对于族和周期的分类也不是非常清晰。通过本课时的学习,进一步理解元素周期表尤其是短周期元素的编写方式,为今后元素周期律的学习打下坚实的基础。
设计理念 本课时教学可以从化学史引入新课,创设问题情境,让线索带着问题去思考,去阅读。教师再利用课件及赣教云平台让学生熟悉并了解族、周期的概念及元素周期表的结构。既可以培养学生的自学能力,又能激发学习兴趣,促使学生在情境中主动探究科学的奥秘。
学情分析 学生在初中已经初步了解元素周期表,知道元素周期表的基本结构(横排和纵列),并会用元素周期表查找元素的部分知识,但对元素与原子结构的关系理解深度不够,不清楚族、周期等概念,特别是原子核外电子排布特点与族序数、周期数的关系等。
教学目标 1.了解元素周期表的编排原则,知道周期和族的表示方法。 2.了解元素周期表的基本结构,知道主族和副族的概念。 3.能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置。
教学重难点 重点:能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置 难点:能从整体上把握元素周期表的结构,会正确表示元素在周期表中的位置
教学过程
教学环节(一) 师生活动 【引入】播放有关元素周期表的发展历程化学视频(赣教云云资源中提前下载) [教师]通过观看视频,我们大致理了解的一下元素周期表的发展历程,那现行的元素周期表是怎么样的呢 今天我们就来了解一下。 [学生]观看视频并总结元素周期表发展历程中相应问题。 一、元素周期表发展历程
设计意图 采用视频引入,可以引发学生学习兴趣,了解元素周期表的发展历程,同时为现行元素周期表的讲解作准备。
教学环节(二) 师生活动 [教师]打开赣教云里元素周期表中小程序,引导学生观察元素周期表中原子结构示意图,引导学生分析现行元素周期表的编排原则,后面PPT投影总结。 [学生]观察观察元素周期表中原子结构示意图,分析归纳出总结现行元素周期表的编排原则 二、现行元素周期表的编排原则 横行:把电子层数相同的元素,按原子序数递增顺序从左到右排列 纵行:把最外层电子数相同的元素,按电子层数递增的顺序自上而下排列 [教师] 继续利用赣教云里元素周期表中小程序,引导学生分析元素周期表的结构。引导学生观察周期序数和原子的电子层数的关系,主族序数与主族元素的原子最外层电子的关系及族序数的顺序。 [学生]观看屏幕赣教云里元素周期表并结合教材最后一页元素周期表,观察、聆听并分析。 三、现行元素周期表的结构 周期 周期表中有 7 个横行,叫做周期。周期的序数就是该周期元素的原子具有的电子层数 。第一、二、三周期称为 短周期 ;四、五、六、七周期称为 长周期 。 周期序数起止元素包括元素种数核外电子层数1H~He212Li~Ne823Na~Ar834K~Kr1845Rb~Xe1856Cs~Rn3267Fr~Og327
族 周期表有 18 个纵行,称为族,主族元素的族序数后标 A ,副族元素的族序数后标 B 。第8、9、10三纵行称为第Ⅷ族,第18纵行称为0族。 族的别称:第ⅠA族元素(除氢)称为碱金属元素;第ⅣA族元素称为碳族元素;第ⅤA族元素称为氮族元素;第ⅥA族元素称为氧族元素;第ⅦA族元素称为卤族元素;0族元素称为稀有气体元素。 [教师]总结并复习族序数与列数的关系 主族 副族
设计意图 元素周期表的结构和原子结构示意图有很大联系,可以利用信息技术中帮助学生直观地找到其中联系,便于学生理解和记忆。
教学环节 (三) 师生活动 [教师]提问:我们已经了解到了元素周期表的结构及其结构和原子结构之间的联系,那我们怎么能够迅速找到元素在原子周期表中的位置呢?又该如何表示呢? 以氯原子为例进行分析 [学生]分析并聆听 [教师]提问:如何确定元素在周期表中的位置? 四、元素位置的表示 1.给出原子结构示意图 (1)周期序数=原子的电子层数 (2)主族序数=最外层电子数 [练习] [学生]思考并展示答案。 2. 给出原子序数 ①. 原子序数少于18---熟记 ②.“0族”法确定元素在周期表中的位置 [练习] 推算原子序数为82的元素在周期表中的位置。
设计意图 元素位置的表示在学生已经了解了元素结构的前提下进行分析,在讲解这块内容时依靠PPT展示,投影学生的答案及教师讲解相结合。
教学环节 (四) 师生活动 五、元素周期表中的方格中的符号的意义 [练习].元素周期表中铊元素的数据如图,下列说法正确的是( ) A.铊元素的质量数是204.4 B.铊原子的中子数为81 C.铊对应的氢氧化物有两性 D.铊元素位于第ⅢA族 [教师]以练习带出问题,利用手中元素周期表分析方格中的符号的意义 [学生]解答从素周期表中的方格中的符号所获得的信息
设计意图 学生对于这块知识点比较熟悉,因此学生学生展示从素周期表中的方格中的符号所获得的信息。同时这块内容比较单间,因此就简单带过。
板书设计 元素周期表 结构 7个周期 周期序数 = 核外电子层数 18列 16族 主族,副族,Ⅷ族,0族 元素位置表示 1.给出原子结构示意图 (1)周期序数=原子的电子层数 (2)主族序数=最外层电子数 2.稀有气体定位法
教学反思 首先是利用赣教云平台中视频引入,在介绍元素周期表中同时起到了引发学生学习兴趣和为元素周期表的介绍为铺垫。在介绍元素周期表的结构,也充分利用到信息技术,将元素周期表结构的编排原则及周期,主族序数和最外层电子数的关系直观化,学生能发现其规律,便于学生理解和掌握。本节课充分利用到赣教云平台,将信息技术融入教学中。利用信息技术更好引导学生理解所学内容,同时结合知识内容本身采用合适的教学方法,将知识简单化。
