人教A版化学2023-2024学年度高一下学期化学期末适应性考试模拟卷(二)(含解析)
文档属性
| 名称 | 人教A版化学2023-2024学年度高一下学期化学期末适应性考试模拟卷(二)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-24 10:07:14 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
人教A版化学2023-2024学年度高一下学期化学期末适应性考试模拟卷(含答案)
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
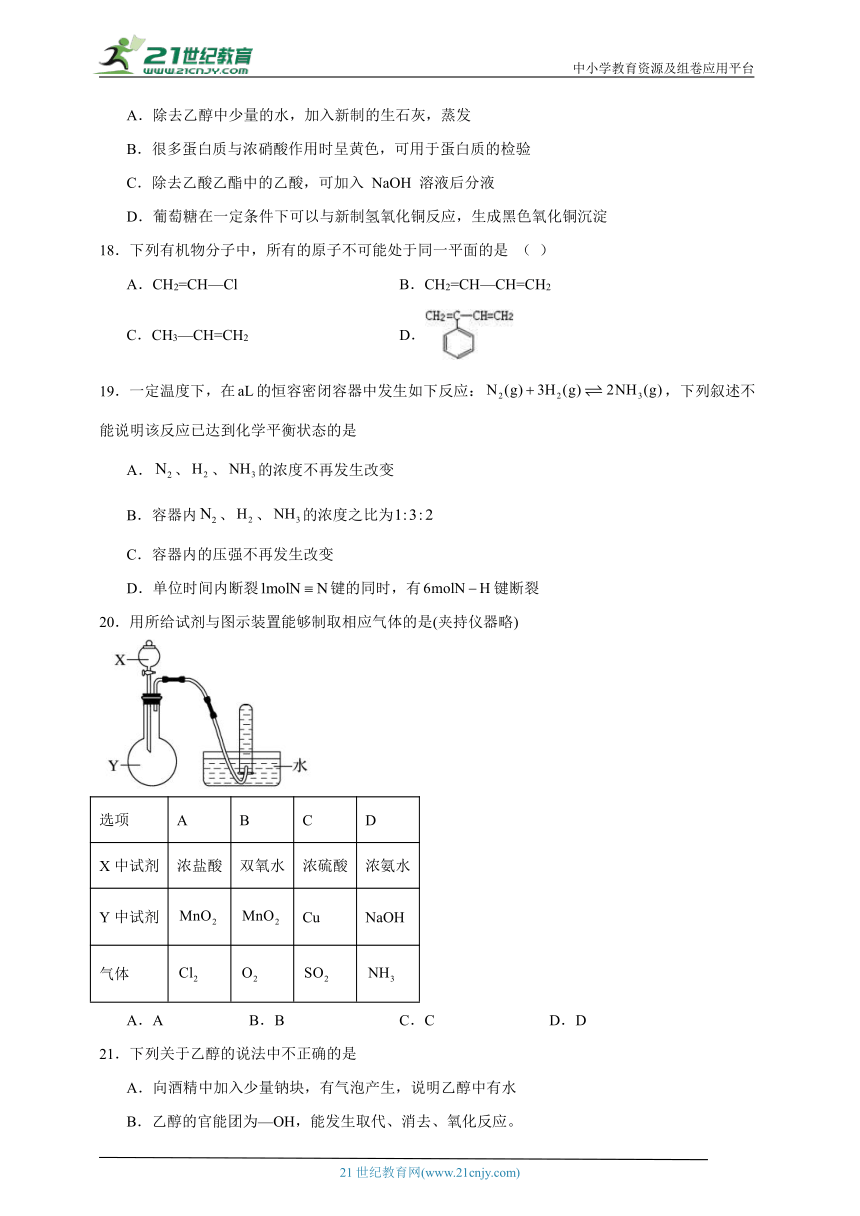
可能用到的相对原子质量:H1 C12 O16 Fe56 Zn65
第I卷(选择题)
一、选择题:本题共25小题,每小题2分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
A.九霄环佩木古琴 B.裴李岗文化骨笛 C.商朝后期陶埙 D.曾侯乙青铜编钟
A.A B.B C.C D.D
2.下列措施会使平衡向左移动的是
A.恒温时,增大平衡体系N2(g)+3H2(g) 2NH3(g)的压强
B.恒压下,降低平衡体系H2(g)+I2(g) 2HI(g) ΔH<0的温度
C.向FeCl3+3KSCN Fe(SCN)3+3KCl中加入少量固体KCl
D.恒温恒压下向平衡体系N2(g)+3H2(g) 2NH3(g)中充入氦气
3.下列关于硅及其化合物的说法不正确的是
A.高温下石英坩埚会被烧碱腐蚀 B.玻璃、陶瓷和水泥都是传统硅酸盐材料
C.自然界中不存在硅单质 D.太阳能电池板主要成分为
4.2019年3月召开的“两会”指出,当前我国城乡居民正在进入生活质量全面提升时期,人们对生态环境质量非常关注,迫切希望生态环境越来越好。下列做法有利于环境保护的是( )
A.市区禁止自行车通行
B.自己尽量不做饭,多叫外卖
C.提倡将生活垃圾进行分类处理
D.将工业废水注入地下岩石层,减少排放量
5.胶体区别于其它分散系的本质特征是
A.胶体的分散质粒子能透过滤纸 B.胶体能产生丁达尔效应
C.分散质粒子的直径在1~100nm之间 D.胶体是纯净物,其它分散系是混合物
6.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是
A.AlS B.AgS C.CuS D.FeS
7.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。右图为硫及其部分 化合物的“价类二维图'',下列说法正确的是
A.S与O2在点燃下一步反应生成Y B.Z参加氧化还原反应时只作还原剂
C.X、Y属于非电解质 D.X的水溶液在空气中放置,易被氧化
8.化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.天然气、石油、流水、风力、氢气为一次能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.垃圾是放错地方的资源,应分类回收利用
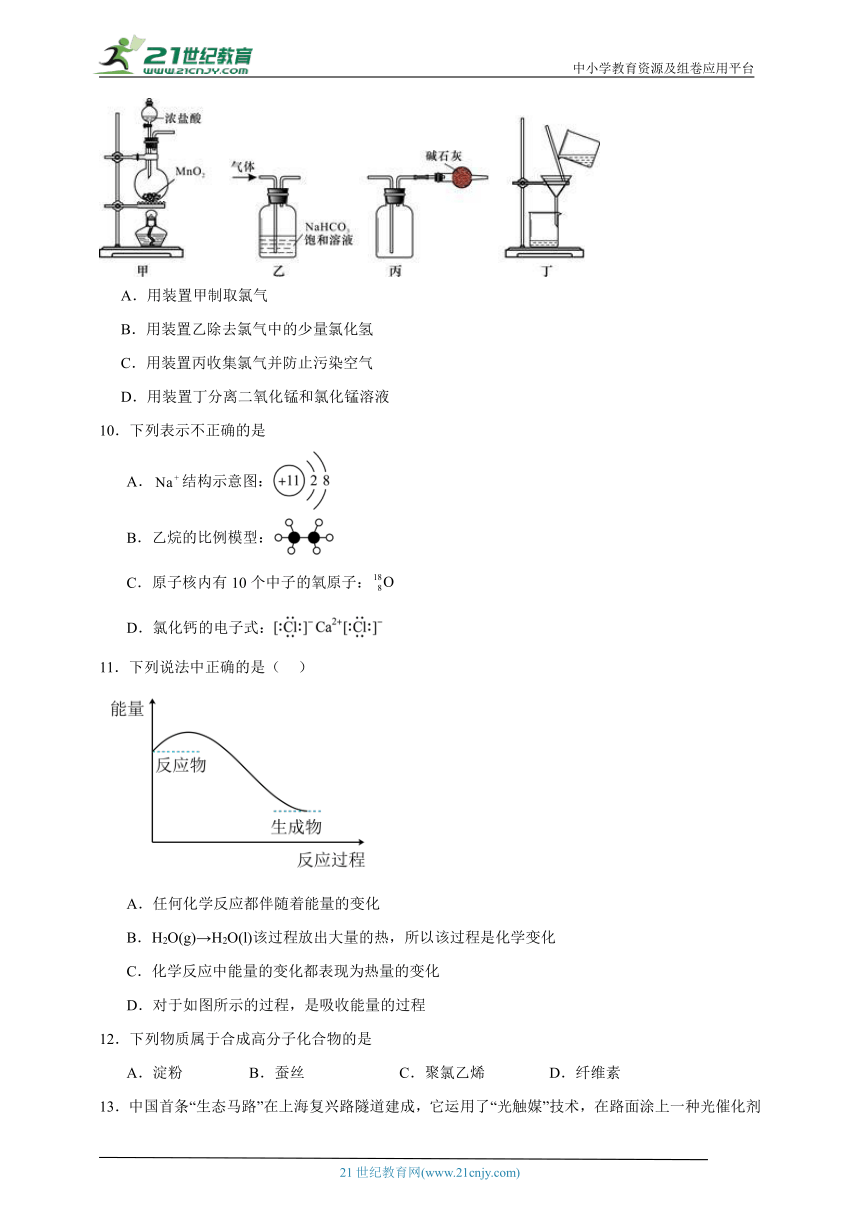
9.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙收集氯气并防止污染空气
D.用装置丁分离二氧化锰和氯化锰溶液
10.下列表示不正确的是
A.结构示意图:
B.乙烷的比例模型:
C.原子核内有10个中子的氧原子:
D.氯化钙的电子式:
11.下列说法中正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
12.下列物质属于合成高分子化合物的是
A.淀粉 B.蚕丝 C.聚氯乙烯 D.纤维素
13.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2 和CO2。下列对此反应的叙述中正确的是
A.使用光催化剂不改变反应速率
B.该“光触媒”技术可以杜绝“光化学烟雾”的产生
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
14.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是
A.负极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极
C.电池工作时,OH-向Cu电极移动
D.电池工作时,OH-浓度增大
15.属于人工固氮的是
A.用N2和H2合成氨 B.闪电将空气中N2转化为NO
C.用NH3和CO2合成尿素 D.固氮菌将氮气变成氨
16.关于下列各装置图的叙述中,正确的是
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可验证碳酸氢钠受热分解
17.下列分离提纯及其性质鉴别方法正确的是
A.除去乙醇中少量的水,加入新制的生石灰,蒸发
B.很多蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验
C.除去乙酸乙酯中的乙酸,可加入 NaOH 溶液后分液
D.葡萄糖在一定条件下可以与新制氢氧化铜反应,生成黑色氧化铜沉淀
18.下列有机物分子中,所有的原子不可能处于同一平面的是 ( )
A.CH2=CH—Cl B.CH2=CH—CH=CH2
C.CH3—CH=CH2 D.
19.一定温度下,在的恒容密闭容器中发生如下反应:,下列叙述不能说明该反应已达到化学平衡状态的是
A.、、的浓度不再发生改变
B.容器内、、的浓度之比为
C.容器内的压强不再发生改变
D.单位时间内断裂键的同时,有键断裂
20.用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
选项 A B C D
X中试剂 浓盐酸 双氧水 浓硫酸 浓氨水
Y中试剂 Cu NaOH
气体
A.A B.B C.C D.D
21.下列关于乙醇的说法中不正确的是
A.向酒精中加入少量钠块,有气泡产生,说明乙醇中有水
B.乙醇的官能团为—OH,能发生取代、消去、氧化反应。
C.除去乙醇中的少量水,方法是加入新制生石灰,经蒸馏后即得乙醇
D.乙醇是一种很好的溶剂,能溶解许多无机物和有机物,人们用白酒浸泡中药制成药酒就是利用了这一性质
22.某有机物,其可能具有的性质是
①能发生加成反应
②能使酸性高锰酸钾溶液褪色
③能发生取代反应
④能发生中和反应
⑤能发生氧化反应
A.全部 B.只能发生①③④
C.除⑤外都能 D.除④⑤外都能
23.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
24.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是
A.NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B.汽车尾气中的主要大气污染物为NO、SO2和PM2.5
C.植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
D.工业废气中的SO2可采用石灰法进行脱除
25.下列实验操作正确的是
A.检查容量瓶是否漏水 B.给液体加热
C.称量 D.过滤
第II卷(非选择题)
本部分共5小题,每小题10分,共50分。
26.下表列出了A~R9种元素在周期表中的位置:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E F
3 A C D G R
4 B H
(1)在这9种元素中化学性质最不活泼的是
A.E B.D C.R D.H
(2)A、B、C三种元素按原子半径由大到小的顺序排列为
A.r(A)>r(B)>r(C) B.r(B)>r(A)>r(C)
C.r(A)>r(C)>r(B) D.r(B)>r(C)>r(A)
(3)F元素氢化物在常温下跟A发生反应所得溶液的pH 7
A.< B.> C.= D.无法确定
(4)在此周期表中,9种元素所形成的最高价氧化物对应的水化物,其中酸性最强和碱性最强的化学式是
A.H2SO4,NaOH B.H2SO4,KOH
C.HClO4,NaOH D.HClO4,KOH
(5)G元素和H元素两者核电荷数之差是
A.8 B.10 C.18 D.26
(6)H元素和A元素形成化合物的化学式以及高温灼烧该化合物时,火焰颜色
A.NaBr 黄 B.NaCl 黄 C.KBr 紫 D.KCl 紫
27.回答下列问题
(1)已知:
化学键 H-H O=O O-H
键能(kJ·mol-1) 436 496 463
则2H2(g)+O2(g) =2H2O(g) ΔH= kJ·mol-1。
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
①N2(g)+O2(g) =2NO(g) ΔH1=
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 。
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
(4)下图是锌锰干电池基本构造图,
该电池的负极材料是 ,工作时NH在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ;电路中每通过0.2 mol e-,负极质量减少 。
28.乙烯是重要有机化工原料。结合以下路线回答:
已知: ;其中F为高分子化合物
(1)物质B所含官能团的名称为 ;
(2)D的结构简式为 ;
(3)反应①、⑥所涉及的反应类型是 、 ;
(4)写出反应④的化学方程式为 ;
(5)写出反应⑦的化学方程式为 ;
(6)关于CH2=CH2的说法正确的是___________;
A.易溶于水 B.是平面结构的分子
C.能被高锰酸钾氧化 D.在一定条件下能发生加聚反应
(7)在实验室里可以用如图所示的装置来制取G,乙中所盛的试剂为 ,该装置图中有一个明显的错误是 。
29.实验室可用图中装置(略去部分夹持仪器)制取并验证其性质。
(1)装置F中盛放溶液的仪器名称为 ,装置A中发生反应的化学方程式为 。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。
(3)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择 (填序号)。
a.蒸馏水 b.饱和溶液 c.饱和溶液 d.饱和溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为 。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入溶液,有白色沉淀生成;
方案II:向第二份溶液中加入溶液,有白色沉淀生成;
方案III:向第三份溶液中加入溶液,有产生白色沉淀。
上述方案中合理的是方案 (填“I”“II”或“III”)。
30.某温度下,体积为1L恒容密闭容器中,X、Y两种气体物质的量随时间的变化曲线如图所示。请回答下列问题:
(1)由图中数据分析,该反应的化学方程式为 。
(2)2min时容器内的压强与起始压强之比为 。
(3)在0~2min内,用Y表示的反应速率为 。
(4)不能说明该反应达到平衡状态的是___________(填正确选项的字母编号)。
A.容器内压强不再变化
B.混合气体的密度不再变化
C.X气体与Y气体的浓度不再变化
D.容器内混合气体平均摩尔质量不再变化
参考答案:
1.C
【详解】A.九霄环佩木古琴主要构成是木材,动物筋制得,A错误;
B.裴李岗文化骨笛由动物骨骼构成,B错误;
C.商朝后期陶埙属于陶瓷,由硅酸盐制成,C正确;
D.曾侯乙青铜编钟主要由合金材料制成,D错误;
故选C。
2.D
【详解】A.增大压强,反应向气体体积减小的方向进行,反应正向移动,A错误;
B.反应焓变小于0,为放热反应,降低温度,反应向放热反应方向进行,反应正向进行,B错误;
C.FeCl3+3KSCN Fe(SCN)3+3KCl中KCl不参与反应,故加入少量固体KCl,平衡不移动,C错误;
D.恒温恒压下向平衡体系中充入氦气,体系的体积增大,浓度减小,向总浓度增大的左反应方向移动,D正确;
故选D。
3.D
【详解】A.高温下,二氧化硅和氢氧化钠反应生成硅酸钠和水,石英坩埚会被烧碱腐蚀,故A正确;
B.玻璃、陶瓷和水泥都是传统硅酸盐材料,故B正确;
C.自然界中不存在硅单质,硅元素主要以二氧化硅和硅酸盐的形式存在,故C正确;
D.太阳能电池板主要成分为单质硅,故D错误;
选D。
4.C
【详解】A.自行车出行不需要消耗汽油等化石能源,有利于环境保护。A项错误;
B.多叫外卖会增加外卖的包装材料的消耗,会引起更多的资源浪费,产生白色污染等,B项错误;
C.提倡垃圾分类更加有利于废物的回收利用,减少不必要的垃圾的产生,C项正确;
D.工业废水注入地下岩石层,会污染地下水,D项错误;
本题答案选C。
5.C
【详解】A.胶体的分散质粒子能透过滤纸,但不属于胶体的本质特征,A项不符合题意;
B.胶体能产生丁达尔效应,是区别于溶液的特征,但不是本质特征,B项不符合题意;
C.分散质粒子的直径在1~100nm之间,属于胶体的本质特征,C项符合题意;
D.胶体跟其它分散系一样,都是混合物,D项不符合题意;
故答案选C。
6.D
【详解】Al形成的化合物中只显+3价,S氧化Al应该转化为Al2S3,选项A是不可能的。
S单质的氧化性比较弱,所以只能将金属氧化为低价,所以将Cu、Ag、Fe氧化为+1、+1、+2,转化为Cu2S、Ag2S、FeS,所以选项B、C不可能、选项D有可能;
答案选D。
7.D
【分析】X为-2价硫的氢化物,即H2S;Y为+6价硫的氧化物,即SO3;Z为+4价硫形成的盐,即亚硫酸盐。
【详解】A.S与O2只能反应生成SO2,SO2和O2在高温、高压、催化剂的条件下生成SO3,A错误;
B.亚硫酸盐可以和H2S发生归中反应生成S单质,该反应中Z体现氧化性,B错误;
C.X为H2S,为一种弱电解质,C错误;
D.X为H2S,其水溶液易被空气中的氧气氧化,D正确;
综上所述答案为D。
8.D
【分析】
【详解】A、一次能源是自然界中以原有形式存在的、未经加工转换的能量资源.包括化石燃料(如原煤、原油、天然气等)、核燃料、生物质能、水能、风能、太阳能、地热能、海洋能、潮汐能等,氢能属于二次能源,故A错误;
B、风力发电是将风能转化为电能,火力发电是将化学能转化为电能,故B错误;
C、铅、镉、铬、钒属于金属元素,砷属于非金属元素,故C错误;
D、垃圾回收利用可以节约资源,应分类回收利用,故D正确;
故选D。
9.B
【详解】A、实验室用MnO2、浓盐酸共热制取Cl2:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,A能达到实验目的;
B、实验室除去氯气中的氯化氢是通过饱和氯化钠溶液,B不能达到实验目的;
C、氯气的密度大于空气的密度,收集时用向上排空气法收集,且氯气有毒,注意尾气的处理,一般用碱吸收,C能达到实验目的;
D、二氧化锰不溶于水,氯化锰溶于水,采用过滤法分离,D能达到实验目的。
故选B。
10.B
【详解】A.钠为11号元素,核外11个电子,失去一个电子变为,其结构示意图:,故A正确;
B.乙烷的球棍模型,不是比例模型,故B错误;
C.氧原子的质子数为8,原子核内有10个中子,则质量数为8+10=18,则该氧原子可表示为:,故C正确;
D.氯化钙是离子化合物,其电子式:,故D正确;
答案选B。
11.A
【详解】A.任何化学反应都伴随着能量的变化,A正确;
B.没有新物质生产,不属于化学反应,B错误;
C.化学反应中能量的变化有多种转化形式,如化学能转化为热能、光能等,C错误;
D.图中生成物的总能量比反应物的总能量低,所以如图所示的过程,是放出能量的过程, D错误;
答案选A。
12.C
【详解】A、淀粉是天然高分子化合物,故A错误;
B、蚕丝成分是蛋白质,蛋白质是天然高分子化合物,故B错误;
C、聚氯乙烯属于合成高分子化合物,故C正确;
D、纤维素是天然高分子化合物,故D错误。
答案选C。
13.C
【详解】A.使用光催化剂改变反应速率可以加快化学反应速率,A错误;
B.“光触媒”可将45%的NO和CO转化为无毒无害的N2和CO2,故“光触媒”技术可以减少“光化学烟雾”,但不能杜绝,B错误;
C.升高温度能提高活化分子的百分数,故能加快反应速率,C正确;
D.该反应中的所有组分均为气体,故改变压强对反应速率有影响,D错误;
故选C。
14.C
【分析】反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,Cu作负极,发生氧化反应,电极反应式为:,Ag2O/Ag电极作正极,发生还原反应,电极反应式为:。
【详解】A.由分析可知,Cu为负极,发生氧化反应,,A错误;
B.Cu作负极,Ag2O/Ag电极作正极,电子由从Cu经导线流向Ag2O/Ag电极,电子不能通过电解质溶液,B错误;
C.电池工作时,阴离子移向负极,则OH-向Cu电极移动,C正确;
D.反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,电池工作时,OH-浓度不变,D错误;
故选C。
15.A
【分析】将空气中的游离氮转化为化合态氮的过程,称为固氮。分为自然固氮(雷雨固氮和生物固氮)和人工固氮。
【详解】A.工业上通常用H2和N2在催化剂、高温、高压下合成氨,属于人工固氮,故A正确;
B.闪电能使空气里的氮气转化为一氧化氮,称为天然固氮(又称高能固氮),故B错误;
C.是氮的化合物之间的转换,不属于氮的固定,故C错误;
D.生物固氮是指固氮微生物将大气中的氮还原成氨的过程,不属于人工固氮,故D错误;
故选A。
16.D
【详解】A.装置①可以收集氯气。若除去氯气中的氯化氢,导气管应该“长进短出”,故A错误;
B.若用装置②制取氨气,试管口应略向下倾斜,故B错误;
C.氢氧化亚铁易被氧气氧化,制备氢氧化亚铁并观察其颜色,需要隔绝空气,故C错误;
D.烧杯中澄清石灰水变浑浊,说明碳酸氢钠受热分解,故D正确;
选D。
17.B
【详解】A.氧化钙和水反应生成氢氧化钙,加入新制的生石灰、蒸馏,可除去乙醇中少量的水,故A错误;
B.很多蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验,故B正确;
C.除去乙酸乙酯中的乙酸,可加入饱和碳酸钠溶液后分液,故C错误;
D.葡萄糖在一定条件下可以与新制氢氧化铜反应,生成砖红色氧化亚铜沉淀,故D错误;
选B。
18.C
【详解】A. CH2=CH—Cl相当于乙烯分子中的一个氢原子被一个氯原子取代,不改变原来的平面结构,所以所有原子可能都处在同一平面上,选项A错误;
B.CH2=CH-CH=CH2相当于乙烯分子中的一个氢原子被乙烯基取代,不改变原来的平面结构,乙烯基的所有原子在同一个面上,这两个平面可以是一个平面,所以所有原子可能都处在同一平面上,选项B错误;
C. CH3—CH=CH2相当于乙烯分子中的一个氢原子被一个甲基所取代,根据甲烷的正四面体结构,甲基上的三个氢原子与乙烯基不在同一平面上,所以所有原子不可能都处在同一平面上,选项C正确;
D. 根据选项B的分析,可看成是CH2=CH-CH=CH2中第2个碳上的一个氢原子被苯基所取代,且苯分子中12个原子共平面,三个面可以是一个平面,所以所有原子可能都处在同一平面上,选项D错误;
答案选C。
19.B
【详解】A.、、的浓度不再发生改变,反应达到平衡状态,A不选;
B.容器内、、的浓度之比为,不能判断反应达到平衡状态,B选;
C.该反应为气体物质的量减小的反应,容器内的压强不再发生改变,说明反应达到平衡状态,C不选;
D.单位时间内断裂键表示正反应速率,有键断裂表示逆反应速率,根据化学计量数关系,此时正逆反应速率相等,反应达到平衡,D不选;
故选B。
20.B
【详解】A.浓盐酸与二氧化锰反应制氯气必须在加热条件下,且氯气可溶于水,收集氯气不能用排水法,选项A错误;
B.双氧水分解制氧气制取装置用固液不加热制气体,收集氧气可用排水法,选项B正确;
C.浓硫酸与铜加热条件下反应生成二氧化硫,选项C错误;
D.氨气极易溶于水,不能用排水法收集,选项D错误;
答案选B。
21.A
【详解】A.乙醇能与钠反应生成氢气,有气泡产生不能说明乙醇中含有水,A错误;
B.乙醇的官能团为羟基,能发生酯化反应(取代反应)、能发生消去反应生成乙烯,能发生催化氧化生成乙醛,B正确;
C.除去乙醇中的少量水,可加入新制生石灰,生石灰与水反应除去水,再经过蒸馏得到乙醇,C正确;
D.乙醇是一种很好的溶剂,能溶解很多无机物和有机物,因此人们用白酒浸泡中药制成药酒,D正确;
故答案选A。
22.A
【详解】①该物质分子中含有不饱和的碳碳双键,因此能发生加成反应,①正确;
②该物质含有不饱和碳碳双键,并且与苯环连接的C原子上含有H原子,因此能够被酸性高锰酸钾氧化,因而能使酸性高锰酸钾溶液褪色,②正确;
③该物质分子中含有羧基、醇羟基,因此能发生取代反应,③正确;
④该物质分子中含有羧基,具有酸的通性,因此能与碱发生中和反应,④正确;
⑤该物质分子中含有醇羟基、含有不饱和的碳碳双键,因此能发生氧化反应,⑤正确;
综上所述可知:所有说法都正确;
答案选A。
23.D
【详解】A.煤中含有硫元素燃烧后产生二氧化硫污染空气,推广使用燃煤脱硫技术,防治SO2污染,有利于“蓝天工程”的建设;故A正确;
B.实施绿化工程,大量植树造林,能够起到净化空气的作用,也防治了扬尘的污染,故B正确;
C.机动车尾气中含有一氧化碳、一氧化氮等污染物,研制开发燃料电池汽车,消除了机动车尾气污染,有利于“蓝天工程”的建设,故C正确;
D.化石燃料的燃烧能产生大量的空气污染物,加大石油、煤炭的开采速度,增加化石燃料的供应量,不利于“蓝天工程”建设,故D错误。
故选:D。
24.D
【详解】A.是红棕色且有刺激性气味的气体,而是无色有刺激性气味的气体,A错误;
B.汽车尾气的主要大气污染物为C与N的氧化物,如NOx和CO等,B错误;
C.氮的固定是指将游离态的氮元素转化为化合态,且植物可吸收土壤中的铵根离子或硝酸根离子作为肥料,不能直接吸收空气中的氮氧化物,C错误;
D.工业废气中的可采用石灰法进行脱除,如加入石灰石或石灰乳均可进行脱硫处理,D正确;
故选D。
25.A
【详解】
A.检查容量瓶是否漏水的方法是:左手托住瓶底,右手食指压住玻璃塞,将容量瓶倒立,如果不漏水,再正立过来,将玻璃塞旋转180度,再倒立,如果不漏水,说明容量瓶是完好的,A正确;
B.试管中的液体加热时应不超过试管容积的三分之一,题中试管中的液体过多,B错误;
C.NaOH固体腐蚀纸片和托盘,应在小烧杯中称量,C错误;
D.漏斗下端应紧靠烧杯内壁,D错误;
故选A。
26. C B B D C A
【分析】根据元素在周期表中的位置可知,A为Na元素,B为K元素,C为Mg元素,D为Al元素,E为C元素,F为O元素,G为Cl元素,H为Br元素,R为Ar,据此分析结合元素性质解答。
【详解】(1)在这9种元素中化学性质最不活泼的是稀有气体Ar,答案选C;
(2)A为Na元素,B为K元素,C为Mg元素,电子层数越多,半径越大,同周期元素随核电荷数增大,半径减小,则三种元素按原子半径由大到小的顺序排列为:r(B)>r(A)>r(C),答案选B;
(3)F为O元素,其氢化物为水,A为Na元素,钠与水反应生成氢氧化钠和氢气,反应后的溶液显碱性,pH.>7,答案选B;
(4)在此周期表中,非金属性越强,最高价氧化物对应水化物的酸性越强,金属性越强,其最高价氧化物对应水化物碱性越强,9种元素中,非金属性最强的为Cl元素,金属性最强的为K元素,则所形成的最高价氧化物对应的水化物酸性最强的为HClO4,最高价氧化物对应的水化物碱性最强的是KOH,答案选D;
(5)G为Cl元素,为17号元素,H为Br元素,为35号元素,G元素和H元素两者核电荷数之差是18,答案选C;
(6)H为Br元素,A为Na元素,二者形成化合物的化学式为NaBr,高温灼烧该化合物时,火焰颜色黄色,答案选A。
27.(1)-484
(2) +183 kJ·mol-1 2CO(g)+2NO(g) =2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
(3)CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH=(3n+m-p) kJ·mol-1
(4) Zn 2NH+2e- =2NH3↑+H2↑ 6.5 g
【详解】(1)焓变=反应物总键能-生成物总键能,则2H2(g)+O2(g) =2H2O(g) ΔH=436 kJ·mol-1×2+496 kJ·mol-1-463 kJ·mol-1×4=-484kJ·mol-1。
(2)①N2(g)+O2(g) =2NO(g) ΔH1=945kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1;
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,根据盖斯定律②-①得2CO(g)+2NO(g) =2CO2(g)+N2(g) ΔH=-565 kJ·mol-1-183 kJ·mol-1=-748 kJ·mol-1。
(3)根据图示,①H2(g)+O2(g)=H2O(g) ΔH= -nkJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH= -mkJ·mol-1
③CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) ΔH= -pkJ·mol-1
根据盖斯定律③-②-①×3得CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH=(3n+m-p) kJ·mol-1。
(4)电子流出的一极为负极,该电池的负极材料是Zn,工作时NH在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,可知正极生成氨气和氢气,正极的电极反应式是2NH+2e- =2NH3↑+H2↑;负极发生反应Zn-2e-=Zn2+,电路中每通过0.2 mol e-,消耗0.1molZn,负极质量减少6.5g。
28.(1)羟基
(2)CH3CH2OH
(3) 加成反应 酯化反应或(取代反应)
(4)2CH3CH2OH+O22CH3CHO+2H2O
(5)nCH2=CH2
(6)BCD
(7) 饱和碳酸钠溶液 导气管的出口伸入到了液面以下
【分析】
乙烯和水发生加成反应生成乙醇,D是CH3CH2OH;乙醇发生催化氧化生成乙醛,乙醛氧化为乙酸,E是CH3COOH,乙醇和乙酸发生酯化反应生成乙酸乙酯,G是CH3COOCH2CH3;乙烯发生加聚反应生成高分子化合物聚乙烯,F是聚乙烯。
【详解】(1)根据物质B的结构简式,可知所含官能团的名称为羟基;
(2)乙烯和水发生加成反应生成乙醇,D是CH3CH2OH;
(3)反应①是乙烯和溴发生加成反应生成1,2-二溴乙烷,反应类型是加成反应;⑥是乙醇和乙酸发生酯化反应生成乙酸乙酯和水,反应类型是取代反应(酯化反应);
(4)反应④是乙醇发生催化氧化生成乙醛和水,反应的化学方程式为2CH3CH2OH+O22CH3CHO+2H2O;
(5)
反应⑦是乙烯发生加聚反应生成高分子化合物聚乙烯,反应的化学方程式为nCH2=CH2
(6)A. 乙烯难溶于水,故A错误;
B. CH2=CH2是平面结构的分子,6个原子共平面,故B正确;
C. CH2=CH2含有碳碳双键,能被高锰酸钾氧化,故C正确;
D. CH2=CH2含有碳碳双键,在一定条件下能发生加聚反应生成聚乙烯,故D正确;
选BCD。
(7)饱和碳酸钠溶液能降低乙酸乙酯的溶解度,溶解乙醇,中和乙酸,乙收集乙酸乙酯,所盛的试剂为饱和碳酸钠溶液,为防止倒吸,导气管的出口应在液面以上,该装置图中有一个明显的错误是导气管的出口伸入到了液面以下。
29.(1) 锥形瓶 H2SO4(浓)+Na2SO3=Na2SO4+SO2+H2O[或2H2SO4(浓)+Na2SO3=2NaHSO4+SO2+H2O]
(2)液柱高度保持不变
(3)c
(4)有浅黄色沉淀生成
(5)III
【分析】70%的硫酸与亚硫酸钠反应生成二氧化硫,B装置通过观察气泡的多少判断SO2生成速率,二氧化硫与硫化钠反应生成硫单质,二氧化硫与新制氯水反应生成硫酸根离子和氯离子使新制氯水褪色,装置E的作用为防止倒吸,F中为碱液用于吸收二氧化硫。
【详解】(1)装置F中盛放溶液的仪器名称为锥形瓶。装置A中硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,化学方程式为H2SO4(浓)+Na2SO3=Na2SO4+SO2+H2O[或2H2SO4(浓)+Na2SO3=2NaHSO4+SO2+H2O]。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗中注入液体至形成一段液柱,若液柱高度保持不变,说明整个装置的气密性较好。
(3)a.二氧化硫能溶于水,盛装的液体不适合为水,a错误;
b.饱和亚硫酸钠能与二氧化硫反应从而吸收二氧化硫,b错误;
c.饱和NaHSO3溶液不与SO2反应且不会吸收SO2,可选择该溶液,c正确;
d.NaOH溶液与SO2反应从而吸收SO2,d错误;
故答案选c。
(4)C试管中二氧化硫与硫化钠反应生成硫单质,二氧化硫得电子体现氧化性,实验现象为有浅黄色沉淀生成。
(5)方案Ⅰ中新制氯水中本来就存在氯离子,即使没发生反应加入AgNO3也会生成AgCl白色沉淀,方案Ⅰ错误;
方案ⅡSO2可与氢氧化钡反应生成亚硫酸钡白色沉淀,即使没有发生反应,也能生成白色沉淀,方案Ⅱ错误;
方案Ⅲ加入氯化钡生成白色沉淀,说明有硫酸根离子生成,则SO2被氧化为硫酸根离子,SO2体现还原性,方案Ⅲ正确;
上述方案中合理的是方案Ⅲ。
30.(1)4Y(g)X(g)
(2)3:4
(3)2mol·L-1·min-1
(4)B
【分析】从图中可知,X物质的量增大为生成物,Y物质的量减小为反应物,且根据两者的反应速率之比计算化学计量数,7min后反应达到平衡,该反应为可逆反应。
【详解】(1)从图中可知,0-7min内,Y物质的量减少8mol,X物质的量增加2mol,两者的反应速率之比为4:1,则化学方程式为4Y(g)X(g)。
(2)2min时消耗Y4mol,则生成X1mol,此时Y有6mol,X有3mol,气体总物质的量为9mol,起始时气体总物质的量为12mol,则2min时压强与起始压强之比为9:12=3:4。
(3)0-2min内,Y物质的量减少了4mol,反应速率==2mol·L-1·min-1。
(4)A.该反应在恒容密闭容器中进行,且不是等体积反应,随着反应进行,容器内压强不断变化,压强不变说明反应达到平衡,A正确;
B.反应在恒容密闭容器中进行,且反应物和生成物都是气体,无论是否达到平衡,混合气体的密度始终不变,B错误;
C.随着反应进行,X气体和Y气体的浓度不断变化,两种气体浓度不变说明反应达到平衡,C正确;
D.反应不是等体积反应,随着反应进行,气体总物质的量不断变化,平均摩尔质量也不断变化,平均摩尔质量不变说明反应达到平衡,D正确;
故答案选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
人教A版化学2023-2024学年度高一下学期化学期末适应性考试模拟卷(含答案)
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 O16 Fe56 Zn65
第I卷(选择题)
一、选择题:本题共25小题,每小题2分,共50分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
A.九霄环佩木古琴 B.裴李岗文化骨笛 C.商朝后期陶埙 D.曾侯乙青铜编钟
A.A B.B C.C D.D
2.下列措施会使平衡向左移动的是
A.恒温时,增大平衡体系N2(g)+3H2(g) 2NH3(g)的压强
B.恒压下,降低平衡体系H2(g)+I2(g) 2HI(g) ΔH<0的温度
C.向FeCl3+3KSCN Fe(SCN)3+3KCl中加入少量固体KCl
D.恒温恒压下向平衡体系N2(g)+3H2(g) 2NH3(g)中充入氦气
3.下列关于硅及其化合物的说法不正确的是
A.高温下石英坩埚会被烧碱腐蚀 B.玻璃、陶瓷和水泥都是传统硅酸盐材料
C.自然界中不存在硅单质 D.太阳能电池板主要成分为
4.2019年3月召开的“两会”指出,当前我国城乡居民正在进入生活质量全面提升时期,人们对生态环境质量非常关注,迫切希望生态环境越来越好。下列做法有利于环境保护的是( )
A.市区禁止自行车通行
B.自己尽量不做饭,多叫外卖
C.提倡将生活垃圾进行分类处理
D.将工业废水注入地下岩石层,减少排放量
5.胶体区别于其它分散系的本质特征是
A.胶体的分散质粒子能透过滤纸 B.胶体能产生丁达尔效应
C.分散质粒子的直径在1~100nm之间 D.胶体是纯净物,其它分散系是混合物
6.据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是
A.AlS B.AgS C.CuS D.FeS
7.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。右图为硫及其部分 化合物的“价类二维图'',下列说法正确的是
A.S与O2在点燃下一步反应生成Y B.Z参加氧化还原反应时只作还原剂
C.X、Y属于非电解质 D.X的水溶液在空气中放置,易被氧化
8.化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.天然气、石油、流水、风力、氢气为一次能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.垃圾是放错地方的资源,应分类回收利用
9.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的的是
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙收集氯气并防止污染空气
D.用装置丁分离二氧化锰和氯化锰溶液
10.下列表示不正确的是
A.结构示意图:
B.乙烷的比例模型:
C.原子核内有10个中子的氧原子:
D.氯化钙的电子式:
11.下列说法中正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
12.下列物质属于合成高分子化合物的是
A.淀粉 B.蚕丝 C.聚氯乙烯 D.纤维素
13.中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2 和CO2。下列对此反应的叙述中正确的是
A.使用光催化剂不改变反应速率
B.该“光触媒”技术可以杜绝“光化学烟雾”的产生
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
14.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是
A.负极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极
C.电池工作时,OH-向Cu电极移动
D.电池工作时,OH-浓度增大
15.属于人工固氮的是
A.用N2和H2合成氨 B.闪电将空气中N2转化为NO
C.用NH3和CO2合成尿素 D.固氮菌将氮气变成氨
16.关于下列各装置图的叙述中,正确的是
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可验证碳酸氢钠受热分解
17.下列分离提纯及其性质鉴别方法正确的是
A.除去乙醇中少量的水,加入新制的生石灰,蒸发
B.很多蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验
C.除去乙酸乙酯中的乙酸,可加入 NaOH 溶液后分液
D.葡萄糖在一定条件下可以与新制氢氧化铜反应,生成黑色氧化铜沉淀
18.下列有机物分子中,所有的原子不可能处于同一平面的是 ( )
A.CH2=CH—Cl B.CH2=CH—CH=CH2
C.CH3—CH=CH2 D.
19.一定温度下,在的恒容密闭容器中发生如下反应:,下列叙述不能说明该反应已达到化学平衡状态的是
A.、、的浓度不再发生改变
B.容器内、、的浓度之比为
C.容器内的压强不再发生改变
D.单位时间内断裂键的同时,有键断裂
20.用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
选项 A B C D
X中试剂 浓盐酸 双氧水 浓硫酸 浓氨水
Y中试剂 Cu NaOH
气体
A.A B.B C.C D.D
21.下列关于乙醇的说法中不正确的是
A.向酒精中加入少量钠块,有气泡产生,说明乙醇中有水
B.乙醇的官能团为—OH,能发生取代、消去、氧化反应。
C.除去乙醇中的少量水,方法是加入新制生石灰,经蒸馏后即得乙醇
D.乙醇是一种很好的溶剂,能溶解许多无机物和有机物,人们用白酒浸泡中药制成药酒就是利用了这一性质
22.某有机物,其可能具有的性质是
①能发生加成反应
②能使酸性高锰酸钾溶液褪色
③能发生取代反应
④能发生中和反应
⑤能发生氧化反应
A.全部 B.只能发生①③④
C.除⑤外都能 D.除④⑤外都能
23.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
24.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是
A.NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B.汽车尾气中的主要大气污染物为NO、SO2和PM2.5
C.植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
D.工业废气中的SO2可采用石灰法进行脱除
25.下列实验操作正确的是
A.检查容量瓶是否漏水 B.给液体加热
C.称量 D.过滤
第II卷(非选择题)
本部分共5小题,每小题10分,共50分。
26.下表列出了A~R9种元素在周期表中的位置:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E F
3 A C D G R
4 B H
(1)在这9种元素中化学性质最不活泼的是
A.E B.D C.R D.H
(2)A、B、C三种元素按原子半径由大到小的顺序排列为
A.r(A)>r(B)>r(C) B.r(B)>r(A)>r(C)
C.r(A)>r(C)>r(B) D.r(B)>r(C)>r(A)
(3)F元素氢化物在常温下跟A发生反应所得溶液的pH 7
A.< B.> C.= D.无法确定
(4)在此周期表中,9种元素所形成的最高价氧化物对应的水化物,其中酸性最强和碱性最强的化学式是
A.H2SO4,NaOH B.H2SO4,KOH
C.HClO4,NaOH D.HClO4,KOH
(5)G元素和H元素两者核电荷数之差是
A.8 B.10 C.18 D.26
(6)H元素和A元素形成化合物的化学式以及高温灼烧该化合物时,火焰颜色
A.NaBr 黄 B.NaCl 黄 C.KBr 紫 D.KCl 紫
27.回答下列问题
(1)已知:
化学键 H-H O=O O-H
键能(kJ·mol-1) 436 496 463
则2H2(g)+O2(g) =2H2O(g) ΔH= kJ·mol-1。
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
①N2(g)+O2(g) =2NO(g) ΔH1=
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式: 。
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
(4)下图是锌锰干电池基本构造图,
该电池的负极材料是 ,工作时NH在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ;电路中每通过0.2 mol e-,负极质量减少 。
28.乙烯是重要有机化工原料。结合以下路线回答:
已知: ;其中F为高分子化合物
(1)物质B所含官能团的名称为 ;
(2)D的结构简式为 ;
(3)反应①、⑥所涉及的反应类型是 、 ;
(4)写出反应④的化学方程式为 ;
(5)写出反应⑦的化学方程式为 ;
(6)关于CH2=CH2的说法正确的是___________;
A.易溶于水 B.是平面结构的分子
C.能被高锰酸钾氧化 D.在一定条件下能发生加聚反应
(7)在实验室里可以用如图所示的装置来制取G,乙中所盛的试剂为 ,该装置图中有一个明显的错误是 。
29.实验室可用图中装置(略去部分夹持仪器)制取并验证其性质。
(1)装置F中盛放溶液的仪器名称为 ,装置A中发生反应的化学方程式为 。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。
(3)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择 (填序号)。
a.蒸馏水 b.饱和溶液 c.饱和溶液 d.饱和溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为 。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入溶液,有白色沉淀生成;
方案II:向第二份溶液中加入溶液,有白色沉淀生成;
方案III:向第三份溶液中加入溶液,有产生白色沉淀。
上述方案中合理的是方案 (填“I”“II”或“III”)。
30.某温度下,体积为1L恒容密闭容器中,X、Y两种气体物质的量随时间的变化曲线如图所示。请回答下列问题:
(1)由图中数据分析,该反应的化学方程式为 。
(2)2min时容器内的压强与起始压强之比为 。
(3)在0~2min内,用Y表示的反应速率为 。
(4)不能说明该反应达到平衡状态的是___________(填正确选项的字母编号)。
A.容器内压强不再变化
B.混合气体的密度不再变化
C.X气体与Y气体的浓度不再变化
D.容器内混合气体平均摩尔质量不再变化
参考答案:
1.C
【详解】A.九霄环佩木古琴主要构成是木材,动物筋制得,A错误;
B.裴李岗文化骨笛由动物骨骼构成,B错误;
C.商朝后期陶埙属于陶瓷,由硅酸盐制成,C正确;
D.曾侯乙青铜编钟主要由合金材料制成,D错误;
故选C。
2.D
【详解】A.增大压强,反应向气体体积减小的方向进行,反应正向移动,A错误;
B.反应焓变小于0,为放热反应,降低温度,反应向放热反应方向进行,反应正向进行,B错误;
C.FeCl3+3KSCN Fe(SCN)3+3KCl中KCl不参与反应,故加入少量固体KCl,平衡不移动,C错误;
D.恒温恒压下向平衡体系中充入氦气,体系的体积增大,浓度减小,向总浓度增大的左反应方向移动,D正确;
故选D。
3.D
【详解】A.高温下,二氧化硅和氢氧化钠反应生成硅酸钠和水,石英坩埚会被烧碱腐蚀,故A正确;
B.玻璃、陶瓷和水泥都是传统硅酸盐材料,故B正确;
C.自然界中不存在硅单质,硅元素主要以二氧化硅和硅酸盐的形式存在,故C正确;
D.太阳能电池板主要成分为单质硅,故D错误;
选D。
4.C
【详解】A.自行车出行不需要消耗汽油等化石能源,有利于环境保护。A项错误;
B.多叫外卖会增加外卖的包装材料的消耗,会引起更多的资源浪费,产生白色污染等,B项错误;
C.提倡垃圾分类更加有利于废物的回收利用,减少不必要的垃圾的产生,C项正确;
D.工业废水注入地下岩石层,会污染地下水,D项错误;
本题答案选C。
5.C
【详解】A.胶体的分散质粒子能透过滤纸,但不属于胶体的本质特征,A项不符合题意;
B.胶体能产生丁达尔效应,是区别于溶液的特征,但不是本质特征,B项不符合题意;
C.分散质粒子的直径在1~100nm之间,属于胶体的本质特征,C项符合题意;
D.胶体跟其它分散系一样,都是混合物,D项不符合题意;
故答案选C。
6.D
【详解】Al形成的化合物中只显+3价,S氧化Al应该转化为Al2S3,选项A是不可能的。
S单质的氧化性比较弱,所以只能将金属氧化为低价,所以将Cu、Ag、Fe氧化为+1、+1、+2,转化为Cu2S、Ag2S、FeS,所以选项B、C不可能、选项D有可能;
答案选D。
7.D
【分析】X为-2价硫的氢化物,即H2S;Y为+6价硫的氧化物,即SO3;Z为+4价硫形成的盐,即亚硫酸盐。
【详解】A.S与O2只能反应生成SO2,SO2和O2在高温、高压、催化剂的条件下生成SO3,A错误;
B.亚硫酸盐可以和H2S发生归中反应生成S单质,该反应中Z体现氧化性,B错误;
C.X为H2S,为一种弱电解质,C错误;
D.X为H2S,其水溶液易被空气中的氧气氧化,D正确;
综上所述答案为D。
8.D
【分析】
【详解】A、一次能源是自然界中以原有形式存在的、未经加工转换的能量资源.包括化石燃料(如原煤、原油、天然气等)、核燃料、生物质能、水能、风能、太阳能、地热能、海洋能、潮汐能等,氢能属于二次能源,故A错误;
B、风力发电是将风能转化为电能,火力发电是将化学能转化为电能,故B错误;
C、铅、镉、铬、钒属于金属元素,砷属于非金属元素,故C错误;
D、垃圾回收利用可以节约资源,应分类回收利用,故D正确;
故选D。
9.B
【详解】A、实验室用MnO2、浓盐酸共热制取Cl2:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,A能达到实验目的;
B、实验室除去氯气中的氯化氢是通过饱和氯化钠溶液,B不能达到实验目的;
C、氯气的密度大于空气的密度,收集时用向上排空气法收集,且氯气有毒,注意尾气的处理,一般用碱吸收,C能达到实验目的;
D、二氧化锰不溶于水,氯化锰溶于水,采用过滤法分离,D能达到实验目的。
故选B。
10.B
【详解】A.钠为11号元素,核外11个电子,失去一个电子变为,其结构示意图:,故A正确;
B.乙烷的球棍模型,不是比例模型,故B错误;
C.氧原子的质子数为8,原子核内有10个中子,则质量数为8+10=18,则该氧原子可表示为:,故C正确;
D.氯化钙是离子化合物,其电子式:,故D正确;
答案选B。
11.A
【详解】A.任何化学反应都伴随着能量的变化,A正确;
B.没有新物质生产,不属于化学反应,B错误;
C.化学反应中能量的变化有多种转化形式,如化学能转化为热能、光能等,C错误;
D.图中生成物的总能量比反应物的总能量低,所以如图所示的过程,是放出能量的过程, D错误;
答案选A。
12.C
【详解】A、淀粉是天然高分子化合物,故A错误;
B、蚕丝成分是蛋白质,蛋白质是天然高分子化合物,故B错误;
C、聚氯乙烯属于合成高分子化合物,故C正确;
D、纤维素是天然高分子化合物,故D错误。
答案选C。
13.C
【详解】A.使用光催化剂改变反应速率可以加快化学反应速率,A错误;
B.“光触媒”可将45%的NO和CO转化为无毒无害的N2和CO2,故“光触媒”技术可以减少“光化学烟雾”,但不能杜绝,B错误;
C.升高温度能提高活化分子的百分数,故能加快反应速率,C正确;
D.该反应中的所有组分均为气体,故改变压强对反应速率有影响,D错误;
故选C。
14.C
【分析】反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,Cu作负极,发生氧化反应,电极反应式为:,Ag2O/Ag电极作正极,发生还原反应,电极反应式为:。
【详解】A.由分析可知,Cu为负极,发生氧化反应,,A错误;
B.Cu作负极,Ag2O/Ag电极作正极,电子由从Cu经导线流向Ag2O/Ag电极,电子不能通过电解质溶液,B错误;
C.电池工作时,阴离子移向负极,则OH-向Cu电极移动,C正确;
D.反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,电池工作时,OH-浓度不变,D错误;
故选C。
15.A
【分析】将空气中的游离氮转化为化合态氮的过程,称为固氮。分为自然固氮(雷雨固氮和生物固氮)和人工固氮。
【详解】A.工业上通常用H2和N2在催化剂、高温、高压下合成氨,属于人工固氮,故A正确;
B.闪电能使空气里的氮气转化为一氧化氮,称为天然固氮(又称高能固氮),故B错误;
C.是氮的化合物之间的转换,不属于氮的固定,故C错误;
D.生物固氮是指固氮微生物将大气中的氮还原成氨的过程,不属于人工固氮,故D错误;
故选A。
16.D
【详解】A.装置①可以收集氯气。若除去氯气中的氯化氢,导气管应该“长进短出”,故A错误;
B.若用装置②制取氨气,试管口应略向下倾斜,故B错误;
C.氢氧化亚铁易被氧气氧化,制备氢氧化亚铁并观察其颜色,需要隔绝空气,故C错误;
D.烧杯中澄清石灰水变浑浊,说明碳酸氢钠受热分解,故D正确;
选D。
17.B
【详解】A.氧化钙和水反应生成氢氧化钙,加入新制的生石灰、蒸馏,可除去乙醇中少量的水,故A错误;
B.很多蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验,故B正确;
C.除去乙酸乙酯中的乙酸,可加入饱和碳酸钠溶液后分液,故C错误;
D.葡萄糖在一定条件下可以与新制氢氧化铜反应,生成砖红色氧化亚铜沉淀,故D错误;
选B。
18.C
【详解】A. CH2=CH—Cl相当于乙烯分子中的一个氢原子被一个氯原子取代,不改变原来的平面结构,所以所有原子可能都处在同一平面上,选项A错误;
B.CH2=CH-CH=CH2相当于乙烯分子中的一个氢原子被乙烯基取代,不改变原来的平面结构,乙烯基的所有原子在同一个面上,这两个平面可以是一个平面,所以所有原子可能都处在同一平面上,选项B错误;
C. CH3—CH=CH2相当于乙烯分子中的一个氢原子被一个甲基所取代,根据甲烷的正四面体结构,甲基上的三个氢原子与乙烯基不在同一平面上,所以所有原子不可能都处在同一平面上,选项C正确;
D. 根据选项B的分析,可看成是CH2=CH-CH=CH2中第2个碳上的一个氢原子被苯基所取代,且苯分子中12个原子共平面,三个面可以是一个平面,所以所有原子可能都处在同一平面上,选项D错误;
答案选C。
19.B
【详解】A.、、的浓度不再发生改变,反应达到平衡状态,A不选;
B.容器内、、的浓度之比为,不能判断反应达到平衡状态,B选;
C.该反应为气体物质的量减小的反应,容器内的压强不再发生改变,说明反应达到平衡状态,C不选;
D.单位时间内断裂键表示正反应速率,有键断裂表示逆反应速率,根据化学计量数关系,此时正逆反应速率相等,反应达到平衡,D不选;
故选B。
20.B
【详解】A.浓盐酸与二氧化锰反应制氯气必须在加热条件下,且氯气可溶于水,收集氯气不能用排水法,选项A错误;
B.双氧水分解制氧气制取装置用固液不加热制气体,收集氧气可用排水法,选项B正确;
C.浓硫酸与铜加热条件下反应生成二氧化硫,选项C错误;
D.氨气极易溶于水,不能用排水法收集,选项D错误;
答案选B。
21.A
【详解】A.乙醇能与钠反应生成氢气,有气泡产生不能说明乙醇中含有水,A错误;
B.乙醇的官能团为羟基,能发生酯化反应(取代反应)、能发生消去反应生成乙烯,能发生催化氧化生成乙醛,B正确;
C.除去乙醇中的少量水,可加入新制生石灰,生石灰与水反应除去水,再经过蒸馏得到乙醇,C正确;
D.乙醇是一种很好的溶剂,能溶解很多无机物和有机物,因此人们用白酒浸泡中药制成药酒,D正确;
故答案选A。
22.A
【详解】①该物质分子中含有不饱和的碳碳双键,因此能发生加成反应,①正确;
②该物质含有不饱和碳碳双键,并且与苯环连接的C原子上含有H原子,因此能够被酸性高锰酸钾氧化,因而能使酸性高锰酸钾溶液褪色,②正确;
③该物质分子中含有羧基、醇羟基,因此能发生取代反应,③正确;
④该物质分子中含有羧基,具有酸的通性,因此能与碱发生中和反应,④正确;
⑤该物质分子中含有醇羟基、含有不饱和的碳碳双键,因此能发生氧化反应,⑤正确;
综上所述可知:所有说法都正确;
答案选A。
23.D
【详解】A.煤中含有硫元素燃烧后产生二氧化硫污染空气,推广使用燃煤脱硫技术,防治SO2污染,有利于“蓝天工程”的建设;故A正确;
B.实施绿化工程,大量植树造林,能够起到净化空气的作用,也防治了扬尘的污染,故B正确;
C.机动车尾气中含有一氧化碳、一氧化氮等污染物,研制开发燃料电池汽车,消除了机动车尾气污染,有利于“蓝天工程”的建设,故C正确;
D.化石燃料的燃烧能产生大量的空气污染物,加大石油、煤炭的开采速度,增加化石燃料的供应量,不利于“蓝天工程”建设,故D错误。
故选:D。
24.D
【详解】A.是红棕色且有刺激性气味的气体,而是无色有刺激性气味的气体,A错误;
B.汽车尾气的主要大气污染物为C与N的氧化物,如NOx和CO等,B错误;
C.氮的固定是指将游离态的氮元素转化为化合态,且植物可吸收土壤中的铵根离子或硝酸根离子作为肥料,不能直接吸收空气中的氮氧化物,C错误;
D.工业废气中的可采用石灰法进行脱除,如加入石灰石或石灰乳均可进行脱硫处理,D正确;
故选D。
25.A
【详解】
A.检查容量瓶是否漏水的方法是:左手托住瓶底,右手食指压住玻璃塞,将容量瓶倒立,如果不漏水,再正立过来,将玻璃塞旋转180度,再倒立,如果不漏水,说明容量瓶是完好的,A正确;
B.试管中的液体加热时应不超过试管容积的三分之一,题中试管中的液体过多,B错误;
C.NaOH固体腐蚀纸片和托盘,应在小烧杯中称量,C错误;
D.漏斗下端应紧靠烧杯内壁,D错误;
故选A。
26. C B B D C A
【分析】根据元素在周期表中的位置可知,A为Na元素,B为K元素,C为Mg元素,D为Al元素,E为C元素,F为O元素,G为Cl元素,H为Br元素,R为Ar,据此分析结合元素性质解答。
【详解】(1)在这9种元素中化学性质最不活泼的是稀有气体Ar,答案选C;
(2)A为Na元素,B为K元素,C为Mg元素,电子层数越多,半径越大,同周期元素随核电荷数增大,半径减小,则三种元素按原子半径由大到小的顺序排列为:r(B)>r(A)>r(C),答案选B;
(3)F为O元素,其氢化物为水,A为Na元素,钠与水反应生成氢氧化钠和氢气,反应后的溶液显碱性,pH.>7,答案选B;
(4)在此周期表中,非金属性越强,最高价氧化物对应水化物的酸性越强,金属性越强,其最高价氧化物对应水化物碱性越强,9种元素中,非金属性最强的为Cl元素,金属性最强的为K元素,则所形成的最高价氧化物对应的水化物酸性最强的为HClO4,最高价氧化物对应的水化物碱性最强的是KOH,答案选D;
(5)G为Cl元素,为17号元素,H为Br元素,为35号元素,G元素和H元素两者核电荷数之差是18,答案选C;
(6)H为Br元素,A为Na元素,二者形成化合物的化学式为NaBr,高温灼烧该化合物时,火焰颜色黄色,答案选A。
27.(1)-484
(2) +183 kJ·mol-1 2CO(g)+2NO(g) =2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
(3)CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH=(3n+m-p) kJ·mol-1
(4) Zn 2NH+2e- =2NH3↑+H2↑ 6.5 g
【详解】(1)焓变=反应物总键能-生成物总键能,则2H2(g)+O2(g) =2H2O(g) ΔH=436 kJ·mol-1×2+496 kJ·mol-1-463 kJ·mol-1×4=-484kJ·mol-1。
(2)①N2(g)+O2(g) =2NO(g) ΔH1=945kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1;
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,根据盖斯定律②-①得2CO(g)+2NO(g) =2CO2(g)+N2(g) ΔH=-565 kJ·mol-1-183 kJ·mol-1=-748 kJ·mol-1。
(3)根据图示,①H2(g)+O2(g)=H2O(g) ΔH= -nkJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH= -mkJ·mol-1
③CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) ΔH= -pkJ·mol-1
根据盖斯定律③-②-①×3得CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH=(3n+m-p) kJ·mol-1。
(4)电子流出的一极为负极,该电池的负极材料是Zn,工作时NH在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,可知正极生成氨气和氢气,正极的电极反应式是2NH+2e- =2NH3↑+H2↑;负极发生反应Zn-2e-=Zn2+,电路中每通过0.2 mol e-,消耗0.1molZn,负极质量减少6.5g。
28.(1)羟基
(2)CH3CH2OH
(3) 加成反应 酯化反应或(取代反应)
(4)2CH3CH2OH+O22CH3CHO+2H2O
(5)nCH2=CH2
(6)BCD
(7) 饱和碳酸钠溶液 导气管的出口伸入到了液面以下
【分析】
乙烯和水发生加成反应生成乙醇,D是CH3CH2OH;乙醇发生催化氧化生成乙醛,乙醛氧化为乙酸,E是CH3COOH,乙醇和乙酸发生酯化反应生成乙酸乙酯,G是CH3COOCH2CH3;乙烯发生加聚反应生成高分子化合物聚乙烯,F是聚乙烯。
【详解】(1)根据物质B的结构简式,可知所含官能团的名称为羟基;
(2)乙烯和水发生加成反应生成乙醇,D是CH3CH2OH;
(3)反应①是乙烯和溴发生加成反应生成1,2-二溴乙烷,反应类型是加成反应;⑥是乙醇和乙酸发生酯化反应生成乙酸乙酯和水,反应类型是取代反应(酯化反应);
(4)反应④是乙醇发生催化氧化生成乙醛和水,反应的化学方程式为2CH3CH2OH+O22CH3CHO+2H2O;
(5)
反应⑦是乙烯发生加聚反应生成高分子化合物聚乙烯,反应的化学方程式为nCH2=CH2
(6)A. 乙烯难溶于水,故A错误;
B. CH2=CH2是平面结构的分子,6个原子共平面,故B正确;
C. CH2=CH2含有碳碳双键,能被高锰酸钾氧化,故C正确;
D. CH2=CH2含有碳碳双键,在一定条件下能发生加聚反应生成聚乙烯,故D正确;
选BCD。
(7)饱和碳酸钠溶液能降低乙酸乙酯的溶解度,溶解乙醇,中和乙酸,乙收集乙酸乙酯,所盛的试剂为饱和碳酸钠溶液,为防止倒吸,导气管的出口应在液面以上,该装置图中有一个明显的错误是导气管的出口伸入到了液面以下。
29.(1) 锥形瓶 H2SO4(浓)+Na2SO3=Na2SO4+SO2+H2O[或2H2SO4(浓)+Na2SO3=2NaHSO4+SO2+H2O]
(2)液柱高度保持不变
(3)c
(4)有浅黄色沉淀生成
(5)III
【分析】70%的硫酸与亚硫酸钠反应生成二氧化硫,B装置通过观察气泡的多少判断SO2生成速率,二氧化硫与硫化钠反应生成硫单质,二氧化硫与新制氯水反应生成硫酸根离子和氯离子使新制氯水褪色,装置E的作用为防止倒吸,F中为碱液用于吸收二氧化硫。
【详解】(1)装置F中盛放溶液的仪器名称为锥形瓶。装置A中硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,化学方程式为H2SO4(浓)+Na2SO3=Na2SO4+SO2+H2O[或2H2SO4(浓)+Na2SO3=2NaHSO4+SO2+H2O]。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗中注入液体至形成一段液柱,若液柱高度保持不变,说明整个装置的气密性较好。
(3)a.二氧化硫能溶于水,盛装的液体不适合为水,a错误;
b.饱和亚硫酸钠能与二氧化硫反应从而吸收二氧化硫,b错误;
c.饱和NaHSO3溶液不与SO2反应且不会吸收SO2,可选择该溶液,c正确;
d.NaOH溶液与SO2反应从而吸收SO2,d错误;
故答案选c。
(4)C试管中二氧化硫与硫化钠反应生成硫单质,二氧化硫得电子体现氧化性,实验现象为有浅黄色沉淀生成。
(5)方案Ⅰ中新制氯水中本来就存在氯离子,即使没发生反应加入AgNO3也会生成AgCl白色沉淀,方案Ⅰ错误;
方案ⅡSO2可与氢氧化钡反应生成亚硫酸钡白色沉淀,即使没有发生反应,也能生成白色沉淀,方案Ⅱ错误;
方案Ⅲ加入氯化钡生成白色沉淀,说明有硫酸根离子生成,则SO2被氧化为硫酸根离子,SO2体现还原性,方案Ⅲ正确;
上述方案中合理的是方案Ⅲ。
30.(1)4Y(g)X(g)
(2)3:4
(3)2mol·L-1·min-1
(4)B
【分析】从图中可知,X物质的量增大为生成物,Y物质的量减小为反应物,且根据两者的反应速率之比计算化学计量数,7min后反应达到平衡,该反应为可逆反应。
【详解】(1)从图中可知,0-7min内,Y物质的量减少8mol,X物质的量增加2mol,两者的反应速率之比为4:1,则化学方程式为4Y(g)X(g)。
(2)2min时消耗Y4mol,则生成X1mol,此时Y有6mol,X有3mol,气体总物质的量为9mol,起始时气体总物质的量为12mol,则2min时压强与起始压强之比为9:12=3:4。
(3)0-2min内,Y物质的量减少了4mol,反应速率==2mol·L-1·min-1。
(4)A.该反应在恒容密闭容器中进行,且不是等体积反应,随着反应进行,容器内压强不断变化,压强不变说明反应达到平衡,A正确;
B.反应在恒容密闭容器中进行,且反应物和生成物都是气体,无论是否达到平衡,混合气体的密度始终不变,B错误;
C.随着反应进行,X气体和Y气体的浓度不断变化,两种气体浓度不变说明反应达到平衡,C正确;
D.反应不是等体积反应,随着反应进行,气体总物质的量不断变化,平均摩尔质量也不断变化,平均摩尔质量不变说明反应达到平衡,D正确;
故答案选B。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
