专题2《化学反应速率与化学平衡》练习题(含解析)高中化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》练习题(含解析)高中化学苏教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 917.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-24 00:00:00 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》练习题
一、单选题
1.某温度下,在体积为1L的密闭容器中按下式分解:,由实验测得浓度随时间变化如下表所示,下列说法正确的是
0 1 2 3 4 5
1.00 0.71 0.50 0.35 0.25 0.17
A.内,生成的平均速率为
B.第时,一定为
C.上述条件下的反应,达到平衡时,混合气体的平均摩尔质量可能为
D.上述条件下的反应,达到平衡时,再向容器中充入,达到新平衡时的转化率减小
2.下图为可逆反应A(g)+2B(g)nC(g),△H<0中,生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1,p2 的关系正确的是
A.p2>p1,n<3 B.p2>p1,n>3
C.p2<p1,n<3 D.p2<p1,n>3
3.某密闭容器中充入等物质的量的A和B,一定温度下发生反应:,达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是
A.30~40min间该反应使用了催化剂
B.30min时增大压强,平衡逆向移动
C.40min时升高温度,平衡正向移动
D.反应方程式中的,正反应为放热反应
4.下列有关有效碰撞理论和活化能的认识,不正确的是
A.增大压强(对于气体反应),单位体积活化分子数增大,增加了碰撞频率,故反应速率增大
B.温度升高,分子动能增加,活化分子百分数增大,增加了碰撞频率,故反应速率增大
C.选用适当的催化剂,降低活化能,活化分子百分数增加,故反应速率增大
D.增大反应物浓度,使活化分子的百分数增大,碰撞频率增加,故反应速率增大
5.在一定条件下,碳与水蒸气可发生的化学反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH>0。下列有关说法正确的是
A.当反应达平衡时,恒温恒压条件下通入Ar,H2O的转化率不变
B.在一定条件下达平衡时,使用催化剂能加快反应速率,增加生成物的产量
C.当反应达平衡时,其他条件不变,降低温度可使该反应的平衡常数减小
D.其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
6.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-904kJ mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法正确的是
A.该反应只有在高温条件下能自发进行
B.该反应的正反应的活化能小于逆反应的活化能
C.达到平衡时,升高温度,v(正)减小、v(逆)增加
D.c(NH3):c(O2):c(NO):c(H2O)=4:5:4:6时,说明反应达到平衡
7.在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g) 2B(g)+C(g)。该反应达到平衡的标志是
A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化
8.N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g)4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s 0 500 1 000 1 500
c(N2O5)/mol·L-1 5.00 3.52 2.50 2.50
下列说法中不正确的是
A.500 s内,N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.T1时,4NO2(g)+O2(g)2N2O5(g)的平衡常数为
9.Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示为 。关于Deacon提出的制的反应,下列有关说法正确的是
A.该反应的△S>0
B.每生成标准状况下22.4L ,放出58kJ的热量
C.升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动
D.断裂4mol H-Cl键的同时,有4mol H-O键生成,说明该反应达到平衡状态
10.可逆反应:在反应过程中的反应速率(v)与时间(t)的关系如图所示。下列叙述不正确的是
A.,反应正向进行
B.,增大
C.时,反应停止
D.,各物质的浓度不再发生变化
11.某密闭容器中,按物质的量之比1:1充入X、Y两种气体,发生反应,达到平衡后,下列有关说法正确的是
A.继续通入少量物质的量之比为1:1的X、Y气体,保持容器容积不变,达到新平衡时,Z的体积分数增大
B.其他条件不变,升高温度,正逆反应速率都增大,平衡时Z的体积分数比原平衡的体积分数大,平衡常数增大
C.其他条件不变,将容积压缩至原来的一半,平衡逆向移动,平衡时X的体积分数比原平衡的体积分数大,平衡常数减小
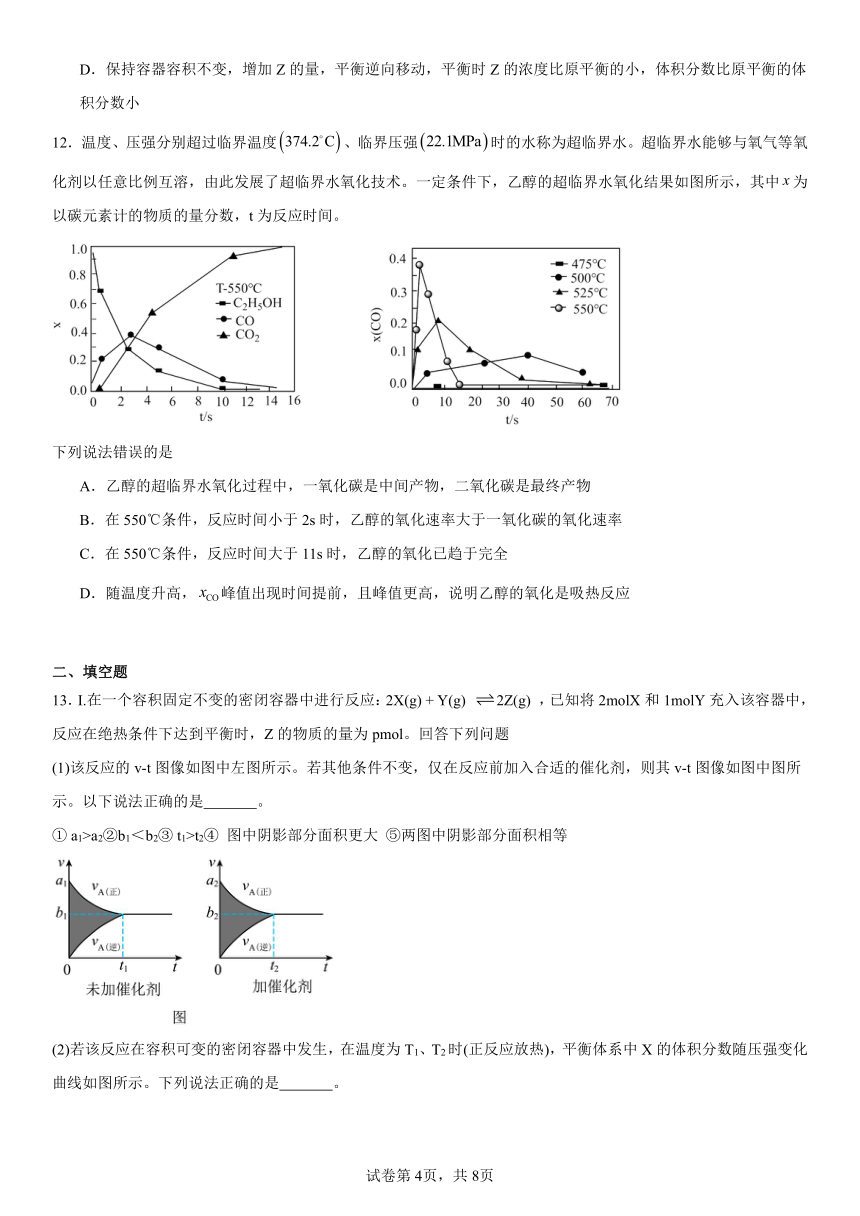
D.保持容器容积不变,增加Z的量,平衡逆向移动,平衡时Z的浓度比原平衡的小,体积分数比原平衡的体积分数小
12.温度、压强分别超过临界温度、临界压强时的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定条件下,乙醇的超临界水氧化结果如图所示,其中为以碳元素计的物质的量分数,t为反应时间。
下列说法错误的是
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件,反应时间小于2s时,乙醇的氧化速率大于一氧化碳的氧化速率
C.在550℃条件,反应时间大于11s时,乙醇的氧化已趋于完全
D.随温度升高,峰值出现时间提前,且峰值更高,说明乙醇的氧化是吸热反应
二、填空题
13.I.在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是 。
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等
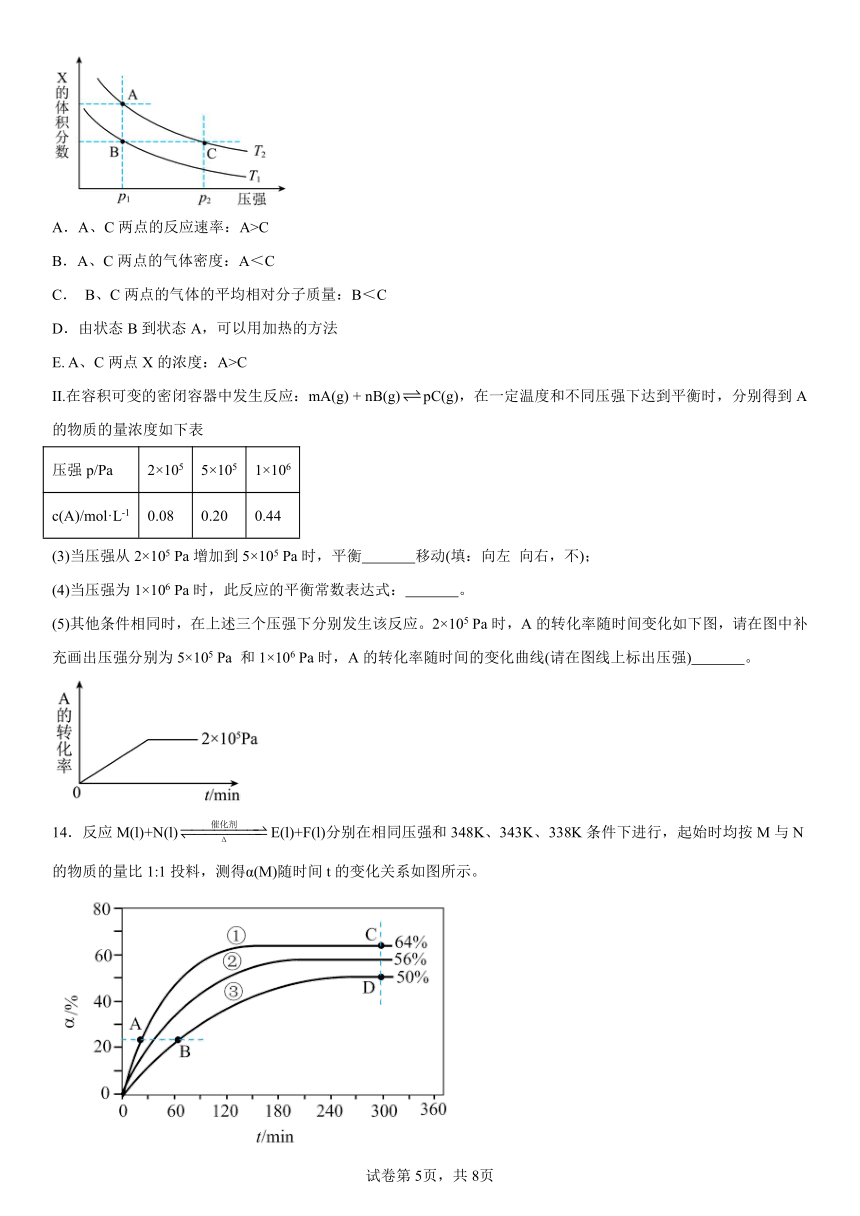
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g)pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa 2×105 5×105 1×106
c(A)/mol·L-1 0.08 0.20 0.44
(3)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左 向右,不);
(4)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强) 。
14.反应M(l)+N(l)E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx= (保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为 时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx 。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是 点,v逆最大的是 点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是 。
15.汽车尾气的污染不容忽视,对汽车尾气中污染气体NO和CO的转化是研究热点。回答下列问题:
(1)汽车尾气中的CO是由于汽油在气缸内不均匀、不充分燃烧导致的,而生成NO的可能原因是 。
(2)利用铑催化处理汽车尾气中的NO与CO的化学反应方程式为。
①已知该反应的,逆反应活化能为,则其正反应活化能为
。
②一定温度下,在恒容密闭容器中充入1mol CO和1mol NO发生上述反应,部分物质的体积分数()随时间(t)的变化如图所示。下列说法错误的是 (填选项字母)。
A.上述反应的正反应在高温下才能自发进行
B.曲线b表示随时间的变化
C.时,反应达到平衡状态
D.气体的平均相对分子质量:
③CO还原NO的反应路径如图1所示,其中(s)指的是物质吸附在铑催化剂上,图2所示为随温度升高NO(s)的解离速率、(s)的生成速率、的生成速率以及的生成速率变化曲线,根据图1可知生成的基元反应有两个(、代表生成的两种不同路径),结合两图写出温度在550K时生成的主要基元反应方程式: 。
(3)某研究小组探究催化剂对CO、NO转化率的影响。将NO和CO按物质的量之比1∶1以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是 。
②a点是否为对应温度下的平衡脱氮率,说明其理由: 。
③450℃时,平衡脱氮率为50%,压强恒为p,则 (为以分压表示的平衡常数,用含p的代数式表示)。
16.温度为 T 时,向某恒容密闭容器中充入 1mol O2,只改变反应物 n(SO2),测得反应2SO2 (g) O2 (g) 2SO3 (g) 中平衡时 SO3的体积分数变化如图所示。
回答下列问题:
(1)a、b、c 三点对应的 SO2的转化率 a 、b、c的大小关系 ;a、b、c 三点对应的反应速率va、vb、vc的大小关系 ;a、b、c 三点对应的平衡常数 Ka、Kb、 Kc的大小关系 。
(2)b 点时,起始时 n(SO2)= ;达到平衡时 SO2的转化率 。
三、计算题
17.在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H22NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
(1)2min内的平均速率υ(NH3)= ;
(2)反应前后容器中气体压强之比 ;
(3)NH3的分解率 ?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.2min内,N2O5的消耗速率为v(N2O5)==0.25mol L-1 min-1,则生成NO2的平均速率为2v(N2O5)=0.5mol L-1 min-1,故A错误;
B.由表格数据可知,第4s到第5s时,N2O5的浓度减少量为(0.25-0.17)mol/L=0.08mol/L,随着反应的进行,N2O5的分解速率逐渐减慢,即第5s到第6min时,N2O5的浓度减少量小于0.08mol/L,所以(0.17-0.08)mol/L<c(N2O5)<0.17mol/L,具体值是无法确定的,故B错误;
C.假设N2O5完全分解,所得气体是NO2与O2按照4:1组成的混合气体,其平均摩尔质量==43.2g/mol,又可逆反应不可能完全转化,所以所得混合气体的平均摩尔质量在43.2g/mol~108g/mol,故C错误;
D.上述条件下的反应,达到平衡时,再向容器中充入1molN2O5,相当于2个体积为1L的密闭容器中达到平衡时合二为一,此时容器内的压强增大,平衡逆向移动,N2O5的转化率减小,故D正确;
故选:D。
2.D
【详解】从图中可以看出,压强为p1时反应先达平衡,则p1>p2;压强为p2时,C的浓度大,则减小压强,平衡正向移动,则n>3;
故选D。
3.D
【详解】A.30~40min间该反应中物质的浓度发生了改变,说明该阶段不是使用了催化剂,故A错误;
B.30min时物质的浓度减小,反应速率减慢,说明是30min时减小压强,而30~40min间浓度不变,说明平衡不向移动,即该反应是等体积反应,故B错误;
C.40min时反应速率增大,说明是升高温度,平衡逆向移动,故C错误;
D.根据B选项分析得到反应方程式中的,根据C选项分析升高温度,平衡逆向移动,逆向是吸热反应,则正反应为放热反应,故D正确。
综上所述,答案为D。
4.D
【详解】A.增大压强,体积减小,活化分子总数不变,但单位体积内活化分子总数增大,增加了碰撞频率,故反应速率增大,故A正确;
B.温度升高,更多分子吸收能量成为活化分子,活化分子百分数增大,增加了碰撞频率,反应速率增大,故B正确;
C.使用催化剂,降低活化能,使更多分子成为活化分子,活化分子百分数增加,反应速率增大,故C正确;
D.增大反应物浓度,单位体积内活化分子数增加,但活化分子百分数不变,故D错误;
故答案选D。
5.C
【详解】A.恒温恒压条件下通入Ar,体积增大,参加反应气体的分压减小,平衡正向移动,则水的转化率增大,故A错误;
B.催化剂不改变平衡移动,加入催化剂可增大反应速率,生成物的产量不变,故B错误;
C.降低温度,平衡逆向移动,则平衡常数减小,故C正确;
D.升高温度,正逆反应速率都增大,平衡正向移动,故D错误;
故选:C。
6.B
【详解】A.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-904kJ mol-1,△S> 0,则复合判据△H - T△S < 0,该反应任何温度都能自发进行,故A错误;
B.该反应的△H =正反应的活化能-逆反应的活化能= - 904 kJ mol-1< 0 ,说明正反应的活化能小于逆反应的活化能,故B正确;
C.达到平衡时,温度升高v(正)和v(逆)均增加,故C错误;
D.各物质的浓度不在变化达到平衡,浓度比等于化学计量数之比不能说明达到平衡,故D错误;
故答案为B。
7.D
【详解】A.反应是可逆反应,所以2mol的A不可能完全转化为B和C,所以容器内压强一定小于开始时的1.5倍,A不正确;
B.平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,B不能说明;
C.反应速率的方向是相同的,则共计反应速率之比是相应的化学计量数之比可知,所以选项C是总是成立的,不正确;
D.在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D正确。
因此答案选D。
8.C
【详解】A.N2O5的浓度变化量为(5.00-3.52)mol/L=1.48 mol/L,N2O5的分解速率==2.96×10-3 mol·L-1·s-1,A正确;
B.B项分析如下:,K1=,平衡时N2O5的转化率为50%,B正确;
C.该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2,C错误;
D.T1时,4NO2(g)+O2(g)2N2O5(g)与2N2O5(g)4NO2(g)+O2(g)互为可逆反应,故平衡常数互为倒数,4NO2(g)+O2(g)2N2O5(g)的平衡常数为,D正确;
故选C。
9.B
【详解】A.熵表示混乱度,气体物质的量越大,熵越大。该反应是气体系数之和减小的反应,所以该反应的熵减小,即△S<0,A项错误;
B.根据热化学方程式可知,每生成2mol Cl2,放出116kJ的热量,所以每生成标准状况下22.4L(即1mol)Cl2,放出58kJ的热量,B项正确;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,升高温度,正逆反应速率都增大,C项错误;
D.HCl是反应物,H2O是生成物,断裂4mol H-Cl键的同时,一定同时有4mol H-O键生成,所以该说法不能说明该反应达到平衡状态,D项错误;
答案选B。
10.C
【详解】A.正反应速率大于逆反应速率,所以,反应正向进行,故A正确;
B.反应正向进行,所以增大,故B正确;
C.时,达化学平衡状态,而化学平衡是动态平衡,所以反应未停止,故C错误;
D.是平衡状态,正逆反应速率相等,所以各物质的浓度不再发生变化,故D正确;
故选C。
11.B
【详解】A.此反应的正反应为气体分子数增大的反应,继续通入少量物质的量之比为1:1的X、Y气体,保持容器容积不变,相当于加压,平衡逆向移动,达到新平衡时,Z的体积分数减小,故A错误;
B.由题意可知该反应为吸热反应,所以当其他条件不变,升高温度,正逆反应速率都增大,平衡时Z的体积分数比原平衡的体积分数大,平衡常数增大,故B正确;
C.平衡常数只与温度有关,所以当他条件不变,将容积压缩至原来的一半,平衡逆向移动,平衡时X的体积分数比原平衡的体积分数大,但平衡常数不变,故C错误;
D.保持容器容积不变,增加Z的量,相当于加压,平衡逆向移动,平衡时Z的浓度比原平衡的大,体积分数比原平衡的体积分数小,故D错误。
答案选B。
12.D
【详解】A.乙醇的超临界水氧化过程中,一氧化碳从0开始增大到一定程度减小最后为0,一氧化碳是中间产物,二氧化碳从0开始逐渐增大到一定程度不变,二氧化碳是最终产物,故A正确;
B.由图像可知,在550℃条件,反应时间小于2s时,乙醇的氧化速率大于一氧化碳的氧化速率,故B正确;
C.图4中曲线变化可知,在550℃条件下,反应时间大于11s时,减小接近0,乙醇氧化为二氧化碳已趋于完全,故C正确;
D.分析图象中曲线的变化,随温度升高,峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大,不能说明反应为吸热反应,故D错误;
故答案为D。
13.(1)②③⑤
(2)BD
(3)不
(4)
(5)
【详解】(1)加入催化剂,反应速率加快,所以a1(2)A.A、C两点都在等温线上,C点压强大于A点压强,压强越大反应速率越快,所以反应速率:A<C,A错误;
B.A、C两点都在等温线上,压强越大,容器的容积越小,而混合气体的总质量不变,所以气体密度:A<C,B正确;
C.B、C两点X的体积分数相等,则混合气体的物质的量相等,所以气体的平均相对分子质量相等,C错误;
D.由状态B到状态A,压强相同,温度不同,X的体积分数增大,反应应该向逆反应方向进行,正方应是放热反应,因此可以用加热的方法,D正确;
E.C点压强大于A点压强,则C点容积小于A点容积,则根据勒夏特列原理可知A、C两点X的浓度:A<C,E错误;
答案选B、D。
(3)根据表格数据,压强从2×105Pa增加到5×105 Pa时,A的浓度是原来的2.5倍,又因为==2.5,说明平衡未发生移动,故答案为:不;
(4)当压强从5×105Pa增加到1×106 Pa时,A的浓度变为原来的2.2倍>=2,说明平衡向逆反应方向移动,即B变成了非气态,因此当压强为1×106 Pa时,此反应的平衡常数表达式为,故答案为:;
(5)2×105 Pa 和5×105 Pa时,A的转化率不变,反应时间缩短,1×106 Pa时,平衡逆移,A的转化率减小,反应速率增大,时间缩短,依此作图为: ,故答案为: 。
14. 3.2 1:2 不变 A C ①
【分析】根据α(M)随时间t的变化关系可知,温度越高,反应速率越快,越先达到拐点,根据图象说明①、②、③对应的温度分别为348K、343K、338K,温度越高,M的转化率越高,说明正反应为吸热反应,由此分析。
【详解】(1)348K时,对于反应:M(l)+N(l)E(l)+F(l),起始时均按M与N的物质的量比1:1投料,设M和N的初始物质的量为1mol,列出三段式;
总的物质的量等于0.36mol+0.36mol+0.64mol+0.64mol=2mol
Kx=≈3.2;
在其它条件不变时,增大某种反应物的浓度,化学平衡正向移动,可提高其它物质的转化率,而该物质本身的转化率反而降低,所以M、N初始投料比为1:2时,反应达到平衡M的转化率最大;
由于化学平衡常数Kx只与温度有关,以其它外界条件无关,所以改变反应物的配比,化学平衡常数Kx不变;
(2)根据v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),A、B点平衡正向移动,C、D处于平衡状态,温度A=C>B=D,因此A点v正最大,C点的k逆·x(E) x(F)大且温度高,因此C点v逆最大;
(3)k正、k逆是温度的函数,根据分析,正反应是吸热的,根据平衡移动的规律,k正受温度影响更大,因此温度升高,k正增大的程度大于k逆,因此,k正 k逆值最大的曲线是①。
【点睛】计算以物质的量分数表示的化学平衡常数时为易错点,计算各物质的物质的量分数容易出错。
15.(1)高温或放电环境下,空气中的氮气和氧气反应生成的
(2) (a-746.5) AC
(3) 温度较低时,催化剂的活性偏低 否,该反应为放热反应,温度越低平衡转化率越高,根据曲线II可知,a点对应的温度低于450℃,其平衡转化率应该高于450℃下的平衡转化率
【详解】(1)因为汽油中基本不含氮元素,所以NO主要来自于和氧气的反应;
(2)①根据△H=正反应活化能-逆反应活化能可得,正反应活化能=△H+逆反应活化能=(a-746.5)。
②反应为放热的熵减反应,则上述反应的正反应在低温下才能自发进行,A项错误;由化学方程式可知,一氧化氮、一氧化碳、二氧化碳的系数相同,且为氮气系数的2倍,结合图像比较物质的体积分数的变化量可知,曲线b表示物质的变化量较小,故b表示的是随时间的变化,B项正确;时,正逆反应速率不相等,反应没有达到平衡状态,C项错误;混合气体的平均摩尔质量为,气体质量不变,但是气体的总物质的量随反应进行而减小,故气体平均相对分子质量逐渐变大,所以气体的平均相对分子质量:,D项正确。
③由图2可知,550K时主要生成结合图1可知,主要来源于的解离;
(3)①温度低于200℃时,图中曲线Ⅰ的脱氮率随温度升高变化不大,说明反应温度较低,催化剂的活性偏低,化学反应速率较慢,反应消耗一氧化氮的量较少。
②a点不是对应温度下的平衡脱氮率,理由是该反应为放热反应,温度越低平衡转化率越高,根据曲线Ⅱ可知,a点对应的温度低于450℃,其平衡转化率应该高于450℃下的平衡转化率。
③设450℃时,一氧化氮和一氧化碳的起始物质的量都为2mol,由一氧化氮的平衡脱氮率为50%可知,平衡时一氧化氮、一氧化碳、氮气、二氧化碳的物质的量分别为2mol-2mol×50%=1mol、2mol-2mol×50%=1mol、2mol×50%×=0.5mol、2mol×50%=1mol,由压强恒为p可知,一氧化氮、一氧化碳、氮气、二氧化碳的平衡分压分别为、、、,则分压平衡常数。
16. a>b>c va < vb < vc Ka = Kb = Kc 2mol 50%
【详解】(1) a、b、c 三点都是平衡点。多种物质做反应物,增加一种反应物的浓度平衡正向移动该物质的转化率降低,其他物质的转化率升高,则a、b、c 三点对应的 SO2的转化率a>b>c;反应物的浓度大反应速率大,达到平衡时反应速率也大,则a、b、c 三点对应的反应速率va 、vb 、vc 的大小关系va < vb < vc;平衡常数仅是温度的函数,a、b、c 三点对应的温度相同,因此 Ka = Kb = Kc 。
(2)相同条件下投料之比等于计量系数比,达到平衡是产物的体积分数最大,因此 b 点时,SO2起始物质的量为 2mol。有三段式,,,故b 点时,达到平衡时 SO2的转化率。
17. 0.4 mol/(L.min) P前:P后=5:7 40%
【详解】利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.
2NH3 N2 +3H2,
开始(mol):10 0 0
变化(mol):4 2 6
2min时(mol):6 2 6
(1)2min时的N2的浓度c( N2)==0.4mol/L;
(2)反应前后容器中气体压强之比为P前︰P后=10mol︰(6+2+6)mol=5︰7;
(3)NH3的分解率为×100%=40%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某温度下,在体积为1L的密闭容器中按下式分解:,由实验测得浓度随时间变化如下表所示,下列说法正确的是
0 1 2 3 4 5
1.00 0.71 0.50 0.35 0.25 0.17
A.内,生成的平均速率为
B.第时,一定为
C.上述条件下的反应,达到平衡时,混合气体的平均摩尔质量可能为
D.上述条件下的反应,达到平衡时,再向容器中充入,达到新平衡时的转化率减小
2.下图为可逆反应A(g)+2B(g)nC(g),△H<0中,生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强p1,p2 的关系正确的是
A.p2>p1,n<3 B.p2>p1,n>3
C.p2<p1,n<3 D.p2<p1,n>3
3.某密闭容器中充入等物质的量的A和B,一定温度下发生反应:,达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是
A.30~40min间该反应使用了催化剂
B.30min时增大压强,平衡逆向移动
C.40min时升高温度,平衡正向移动
D.反应方程式中的,正反应为放热反应
4.下列有关有效碰撞理论和活化能的认识,不正确的是
A.增大压强(对于气体反应),单位体积活化分子数增大,增加了碰撞频率,故反应速率增大
B.温度升高,分子动能增加,活化分子百分数增大,增加了碰撞频率,故反应速率增大
C.选用适当的催化剂,降低活化能,活化分子百分数增加,故反应速率增大
D.增大反应物浓度,使活化分子的百分数增大,碰撞频率增加,故反应速率增大
5.在一定条件下,碳与水蒸气可发生的化学反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH>0。下列有关说法正确的是
A.当反应达平衡时,恒温恒压条件下通入Ar,H2O的转化率不变
B.在一定条件下达平衡时,使用催化剂能加快反应速率,增加生成物的产量
C.当反应达平衡时,其他条件不变,降低温度可使该反应的平衡常数减小
D.其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
6.氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-904kJ mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法正确的是
A.该反应只有在高温条件下能自发进行
B.该反应的正反应的活化能小于逆反应的活化能
C.达到平衡时,升高温度,v(正)减小、v(逆)增加
D.c(NH3):c(O2):c(NO):c(H2O)=4:5:4:6时,说明反应达到平衡
7.在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g) 2B(g)+C(g)。该反应达到平衡的标志是
A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化
8.N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g)4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s 0 500 1 000 1 500
c(N2O5)/mol·L-1 5.00 3.52 2.50 2.50
下列说法中不正确的是
A.500 s内,N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.T1时,4NO2(g)+O2(g)2N2O5(g)的平衡常数为
9.Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示为 。关于Deacon提出的制的反应,下列有关说法正确的是
A.该反应的△S>0
B.每生成标准状况下22.4L ,放出58kJ的热量
C.升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动
D.断裂4mol H-Cl键的同时,有4mol H-O键生成,说明该反应达到平衡状态
10.可逆反应:在反应过程中的反应速率(v)与时间(t)的关系如图所示。下列叙述不正确的是
A.,反应正向进行
B.,增大
C.时,反应停止
D.,各物质的浓度不再发生变化
11.某密闭容器中,按物质的量之比1:1充入X、Y两种气体,发生反应,达到平衡后,下列有关说法正确的是
A.继续通入少量物质的量之比为1:1的X、Y气体,保持容器容积不变,达到新平衡时,Z的体积分数增大
B.其他条件不变,升高温度,正逆反应速率都增大,平衡时Z的体积分数比原平衡的体积分数大,平衡常数增大
C.其他条件不变,将容积压缩至原来的一半,平衡逆向移动,平衡时X的体积分数比原平衡的体积分数大,平衡常数减小
D.保持容器容积不变,增加Z的量,平衡逆向移动,平衡时Z的浓度比原平衡的小,体积分数比原平衡的体积分数小
12.温度、压强分别超过临界温度、临界压强时的水称为超临界水。超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定条件下,乙醇的超临界水氧化结果如图所示,其中为以碳元素计的物质的量分数,t为反应时间。
下列说法错误的是
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件,反应时间小于2s时,乙醇的氧化速率大于一氧化碳的氧化速率
C.在550℃条件,反应时间大于11s时,乙醇的氧化已趋于完全
D.随温度升高,峰值出现时间提前,且峰值更高,说明乙醇的氧化是吸热反应
二、填空题
13.I.在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g) 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题
(1)该反应的v-t图像如图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图中图所示。以下说法正确的是 。
① a1>a2②b1<b2③ t1>t2④ 图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(2)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时(正反应放热),平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E. A、C两点X的浓度:A>C
II.在容积可变的密闭容器中发生反应:mA(g) + nB(g)pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa 2×105 5×105 1×106
c(A)/mol·L-1 0.08 0.20 0.44
(3)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左 向右,不);
(4)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(5)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强) 。
14.反应M(l)+N(l)E(l)+F(l)分别在相同压强和348K、343K、338K条件下进行,起始时均按M与N的物质的量比1:1投料,测得α(M)随时间t的变化关系如图所示。
已知:v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),其中v正、v逆分别为正、逆反应的反应速率,k正、k逆分别为正、逆反应的速率常数,x为各组分的物质的量分数。回答下列问题:
(1)348K时,以物质的量分数表示的化学平衡常数Kx= (保留2位有效数字)。该温度下,分别按M与N物质的量之比1:1、1:2和2:1进行初始投料,则达到平衡后,初始投料比为 时,M的转化率最大;与按1:1投料相比,按2:1投料时化学平衡常数Kx 。(填“增大”“减小”或“不变”)。
(2)A、B、C、D四点中,v正最大的是 点,v逆最大的是 点。
(3)在曲线①、②、③中,正、逆反应的速率常数值k正-k逆最大的曲线是 。
15.汽车尾气的污染不容忽视,对汽车尾气中污染气体NO和CO的转化是研究热点。回答下列问题:
(1)汽车尾气中的CO是由于汽油在气缸内不均匀、不充分燃烧导致的,而生成NO的可能原因是 。
(2)利用铑催化处理汽车尾气中的NO与CO的化学反应方程式为。
①已知该反应的,逆反应活化能为,则其正反应活化能为
。
②一定温度下,在恒容密闭容器中充入1mol CO和1mol NO发生上述反应,部分物质的体积分数()随时间(t)的变化如图所示。下列说法错误的是 (填选项字母)。
A.上述反应的正反应在高温下才能自发进行
B.曲线b表示随时间的变化
C.时,反应达到平衡状态
D.气体的平均相对分子质量:
③CO还原NO的反应路径如图1所示,其中(s)指的是物质吸附在铑催化剂上,图2所示为随温度升高NO(s)的解离速率、(s)的生成速率、的生成速率以及的生成速率变化曲线,根据图1可知生成的基元反应有两个(、代表生成的两种不同路径),结合两图写出温度在550K时生成的主要基元反应方程式: 。
(3)某研究小组探究催化剂对CO、NO转化率的影响。将NO和CO按物质的量之比1∶1以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:
①温度低于200℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是 。
②a点是否为对应温度下的平衡脱氮率,说明其理由: 。
③450℃时,平衡脱氮率为50%,压强恒为p,则 (为以分压表示的平衡常数,用含p的代数式表示)。
16.温度为 T 时,向某恒容密闭容器中充入 1mol O2,只改变反应物 n(SO2),测得反应2SO2 (g) O2 (g) 2SO3 (g) 中平衡时 SO3的体积分数变化如图所示。
回答下列问题:
(1)a、b、c 三点对应的 SO2的转化率 a 、b、c的大小关系 ;a、b、c 三点对应的反应速率va、vb、vc的大小关系 ;a、b、c 三点对应的平衡常数 Ka、Kb、 Kc的大小关系 。
(2)b 点时,起始时 n(SO2)= ;达到平衡时 SO2的转化率 。
三、计算题
17.在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H22NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
(1)2min内的平均速率υ(NH3)= ;
(2)反应前后容器中气体压强之比 ;
(3)NH3的分解率 ?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.2min内,N2O5的消耗速率为v(N2O5)==0.25mol L-1 min-1,则生成NO2的平均速率为2v(N2O5)=0.5mol L-1 min-1,故A错误;
B.由表格数据可知,第4s到第5s时,N2O5的浓度减少量为(0.25-0.17)mol/L=0.08mol/L,随着反应的进行,N2O5的分解速率逐渐减慢,即第5s到第6min时,N2O5的浓度减少量小于0.08mol/L,所以(0.17-0.08)mol/L<c(N2O5)<0.17mol/L,具体值是无法确定的,故B错误;
C.假设N2O5完全分解,所得气体是NO2与O2按照4:1组成的混合气体,其平均摩尔质量==43.2g/mol,又可逆反应不可能完全转化,所以所得混合气体的平均摩尔质量在43.2g/mol~108g/mol,故C错误;
D.上述条件下的反应,达到平衡时,再向容器中充入1molN2O5,相当于2个体积为1L的密闭容器中达到平衡时合二为一,此时容器内的压强增大,平衡逆向移动,N2O5的转化率减小,故D正确;
故选:D。
2.D
【详解】从图中可以看出,压强为p1时反应先达平衡,则p1>p2;压强为p2时,C的浓度大,则减小压强,平衡正向移动,则n>3;
故选D。
3.D
【详解】A.30~40min间该反应中物质的浓度发生了改变,说明该阶段不是使用了催化剂,故A错误;
B.30min时物质的浓度减小,反应速率减慢,说明是30min时减小压强,而30~40min间浓度不变,说明平衡不向移动,即该反应是等体积反应,故B错误;
C.40min时反应速率增大,说明是升高温度,平衡逆向移动,故C错误;
D.根据B选项分析得到反应方程式中的,根据C选项分析升高温度,平衡逆向移动,逆向是吸热反应,则正反应为放热反应,故D正确。
综上所述,答案为D。
4.D
【详解】A.增大压强,体积减小,活化分子总数不变,但单位体积内活化分子总数增大,增加了碰撞频率,故反应速率增大,故A正确;
B.温度升高,更多分子吸收能量成为活化分子,活化分子百分数增大,增加了碰撞频率,反应速率增大,故B正确;
C.使用催化剂,降低活化能,使更多分子成为活化分子,活化分子百分数增加,反应速率增大,故C正确;
D.增大反应物浓度,单位体积内活化分子数增加,但活化分子百分数不变,故D错误;
故答案选D。
5.C
【详解】A.恒温恒压条件下通入Ar,体积增大,参加反应气体的分压减小,平衡正向移动,则水的转化率增大,故A错误;
B.催化剂不改变平衡移动,加入催化剂可增大反应速率,生成物的产量不变,故B错误;
C.降低温度,平衡逆向移动,则平衡常数减小,故C正确;
D.升高温度,正逆反应速率都增大,平衡正向移动,故D错误;
故选:C。
6.B
【详解】A.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-904kJ mol-1,△S> 0,则复合判据△H - T△S < 0,该反应任何温度都能自发进行,故A错误;
B.该反应的△H =正反应的活化能-逆反应的活化能= - 904 kJ mol-1< 0 ,说明正反应的活化能小于逆反应的活化能,故B正确;
C.达到平衡时,温度升高v(正)和v(逆)均增加,故C错误;
D.各物质的浓度不在变化达到平衡,浓度比等于化学计量数之比不能说明达到平衡,故D错误;
故答案为B。
7.D
【详解】A.反应是可逆反应,所以2mol的A不可能完全转化为B和C,所以容器内压强一定小于开始时的1.5倍,A不正确;
B.平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,B不能说明;
C.反应速率的方向是相同的,则共计反应速率之比是相应的化学计量数之比可知,所以选项C是总是成立的,不正确;
D.在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D正确。
因此答案选D。
8.C
【详解】A.N2O5的浓度变化量为(5.00-3.52)mol/L=1.48 mol/L,N2O5的分解速率==2.96×10-3 mol·L-1·s-1,A正确;
B.B项分析如下:,K1=,平衡时N2O5的转化率为50%,B正确;
C.该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2,C错误;
D.T1时,4NO2(g)+O2(g)2N2O5(g)与2N2O5(g)4NO2(g)+O2(g)互为可逆反应,故平衡常数互为倒数,4NO2(g)+O2(g)2N2O5(g)的平衡常数为,D正确;
故选C。
9.B
【详解】A.熵表示混乱度,气体物质的量越大,熵越大。该反应是气体系数之和减小的反应,所以该反应的熵减小,即△S<0,A项错误;
B.根据热化学方程式可知,每生成2mol Cl2,放出116kJ的热量,所以每生成标准状况下22.4L(即1mol)Cl2,放出58kJ的热量,B项正确;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,升高温度,正逆反应速率都增大,C项错误;
D.HCl是反应物,H2O是生成物,断裂4mol H-Cl键的同时,一定同时有4mol H-O键生成,所以该说法不能说明该反应达到平衡状态,D项错误;
答案选B。
10.C
【详解】A.正反应速率大于逆反应速率,所以,反应正向进行,故A正确;
B.反应正向进行,所以增大,故B正确;
C.时,达化学平衡状态,而化学平衡是动态平衡,所以反应未停止,故C错误;
D.是平衡状态,正逆反应速率相等,所以各物质的浓度不再发生变化,故D正确;
故选C。
11.B
【详解】A.此反应的正反应为气体分子数增大的反应,继续通入少量物质的量之比为1:1的X、Y气体,保持容器容积不变,相当于加压,平衡逆向移动,达到新平衡时,Z的体积分数减小,故A错误;
B.由题意可知该反应为吸热反应,所以当其他条件不变,升高温度,正逆反应速率都增大,平衡时Z的体积分数比原平衡的体积分数大,平衡常数增大,故B正确;
C.平衡常数只与温度有关,所以当他条件不变,将容积压缩至原来的一半,平衡逆向移动,平衡时X的体积分数比原平衡的体积分数大,但平衡常数不变,故C错误;
D.保持容器容积不变,增加Z的量,相当于加压,平衡逆向移动,平衡时Z的浓度比原平衡的大,体积分数比原平衡的体积分数小,故D错误。
答案选B。
12.D
【详解】A.乙醇的超临界水氧化过程中,一氧化碳从0开始增大到一定程度减小最后为0,一氧化碳是中间产物,二氧化碳从0开始逐渐增大到一定程度不变,二氧化碳是最终产物,故A正确;
B.由图像可知,在550℃条件,反应时间小于2s时,乙醇的氧化速率大于一氧化碳的氧化速率,故B正确;
C.图4中曲线变化可知,在550℃条件下,反应时间大于11s时,减小接近0,乙醇氧化为二氧化碳已趋于完全,故C正确;
D.分析图象中曲线的变化,随温度升高,峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大,不能说明反应为吸热反应,故D错误;
故答案为D。
13.(1)②③⑤
(2)BD
(3)不
(4)
(5)
【详解】(1)加入催化剂,反应速率加快,所以a1
B.A、C两点都在等温线上,压强越大,容器的容积越小,而混合气体的总质量不变,所以气体密度:A<C,B正确;
C.B、C两点X的体积分数相等,则混合气体的物质的量相等,所以气体的平均相对分子质量相等,C错误;
D.由状态B到状态A,压强相同,温度不同,X的体积分数增大,反应应该向逆反应方向进行,正方应是放热反应,因此可以用加热的方法,D正确;
E.C点压强大于A点压强,则C点容积小于A点容积,则根据勒夏特列原理可知A、C两点X的浓度:A<C,E错误;
答案选B、D。
(3)根据表格数据,压强从2×105Pa增加到5×105 Pa时,A的浓度是原来的2.5倍,又因为==2.5,说明平衡未发生移动,故答案为:不;
(4)当压强从5×105Pa增加到1×106 Pa时,A的浓度变为原来的2.2倍>=2,说明平衡向逆反应方向移动,即B变成了非气态,因此当压强为1×106 Pa时,此反应的平衡常数表达式为,故答案为:;
(5)2×105 Pa 和5×105 Pa时,A的转化率不变,反应时间缩短,1×106 Pa时,平衡逆移,A的转化率减小,反应速率增大,时间缩短,依此作图为: ,故答案为: 。
14. 3.2 1:2 不变 A C ①
【分析】根据α(M)随时间t的变化关系可知,温度越高,反应速率越快,越先达到拐点,根据图象说明①、②、③对应的温度分别为348K、343K、338K,温度越高,M的转化率越高,说明正反应为吸热反应,由此分析。
【详解】(1)348K时,对于反应:M(l)+N(l)E(l)+F(l),起始时均按M与N的物质的量比1:1投料,设M和N的初始物质的量为1mol,列出三段式;
总的物质的量等于0.36mol+0.36mol+0.64mol+0.64mol=2mol
Kx=≈3.2;
在其它条件不变时,增大某种反应物的浓度,化学平衡正向移动,可提高其它物质的转化率,而该物质本身的转化率反而降低,所以M、N初始投料比为1:2时,反应达到平衡M的转化率最大;
由于化学平衡常数Kx只与温度有关,以其它外界条件无关,所以改变反应物的配比,化学平衡常数Kx不变;
(2)根据v正=k正·x(M) x(N),v逆=k逆·x(E) x(F),A、B点平衡正向移动,C、D处于平衡状态,温度A=C>B=D,因此A点v正最大,C点的k逆·x(E) x(F)大且温度高,因此C点v逆最大;
(3)k正、k逆是温度的函数,根据分析,正反应是吸热的,根据平衡移动的规律,k正受温度影响更大,因此温度升高,k正增大的程度大于k逆,因此,k正 k逆值最大的曲线是①。
【点睛】计算以物质的量分数表示的化学平衡常数时为易错点,计算各物质的物质的量分数容易出错。
15.(1)高温或放电环境下,空气中的氮气和氧气反应生成的
(2) (a-746.5) AC
(3) 温度较低时,催化剂的活性偏低 否,该反应为放热反应,温度越低平衡转化率越高,根据曲线II可知,a点对应的温度低于450℃,其平衡转化率应该高于450℃下的平衡转化率
【详解】(1)因为汽油中基本不含氮元素,所以NO主要来自于和氧气的反应;
(2)①根据△H=正反应活化能-逆反应活化能可得,正反应活化能=△H+逆反应活化能=(a-746.5)。
②反应为放热的熵减反应,则上述反应的正反应在低温下才能自发进行,A项错误;由化学方程式可知,一氧化氮、一氧化碳、二氧化碳的系数相同,且为氮气系数的2倍,结合图像比较物质的体积分数的变化量可知,曲线b表示物质的变化量较小,故b表示的是随时间的变化,B项正确;时,正逆反应速率不相等,反应没有达到平衡状态,C项错误;混合气体的平均摩尔质量为,气体质量不变,但是气体的总物质的量随反应进行而减小,故气体平均相对分子质量逐渐变大,所以气体的平均相对分子质量:,D项正确。
③由图2可知,550K时主要生成结合图1可知,主要来源于的解离;
(3)①温度低于200℃时,图中曲线Ⅰ的脱氮率随温度升高变化不大,说明反应温度较低,催化剂的活性偏低,化学反应速率较慢,反应消耗一氧化氮的量较少。
②a点不是对应温度下的平衡脱氮率,理由是该反应为放热反应,温度越低平衡转化率越高,根据曲线Ⅱ可知,a点对应的温度低于450℃,其平衡转化率应该高于450℃下的平衡转化率。
③设450℃时,一氧化氮和一氧化碳的起始物质的量都为2mol,由一氧化氮的平衡脱氮率为50%可知,平衡时一氧化氮、一氧化碳、氮气、二氧化碳的物质的量分别为2mol-2mol×50%=1mol、2mol-2mol×50%=1mol、2mol×50%×=0.5mol、2mol×50%=1mol,由压强恒为p可知,一氧化氮、一氧化碳、氮气、二氧化碳的平衡分压分别为、、、,则分压平衡常数。
16. a>b>c va < vb < vc Ka = Kb = Kc 2mol 50%
【详解】(1) a、b、c 三点都是平衡点。多种物质做反应物,增加一种反应物的浓度平衡正向移动该物质的转化率降低,其他物质的转化率升高,则a、b、c 三点对应的 SO2的转化率a>b>c;反应物的浓度大反应速率大,达到平衡时反应速率也大,则a、b、c 三点对应的反应速率va 、vb 、vc 的大小关系va < vb < vc;平衡常数仅是温度的函数,a、b、c 三点对应的温度相同,因此 Ka = Kb = Kc 。
(2)相同条件下投料之比等于计量系数比,达到平衡是产物的体积分数最大,因此 b 点时,SO2起始物质的量为 2mol。有三段式,,,故b 点时,达到平衡时 SO2的转化率。
17. 0.4 mol/(L.min) P前:P后=5:7 40%
【详解】利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.
2NH3 N2 +3H2,
开始(mol):10 0 0
变化(mol):4 2 6
2min时(mol):6 2 6
(1)2min时的N2的浓度c( N2)==0.4mol/L;
(2)反应前后容器中气体压强之比为P前︰P后=10mol︰(6+2+6)mol=5︰7;
(3)NH3的分解率为×100%=40%。
答案第1页,共2页
答案第1页,共2页
