【高效备课】人教A版(2019)高中化学选必修1同步课件 3.4.1沉淀溶解平衡(共15张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 3.4.1沉淀溶解平衡(共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:10:17 | ||
图片预览




文档简介
(共15张PPT)
第四节 沉淀溶解平衡
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
第一课时
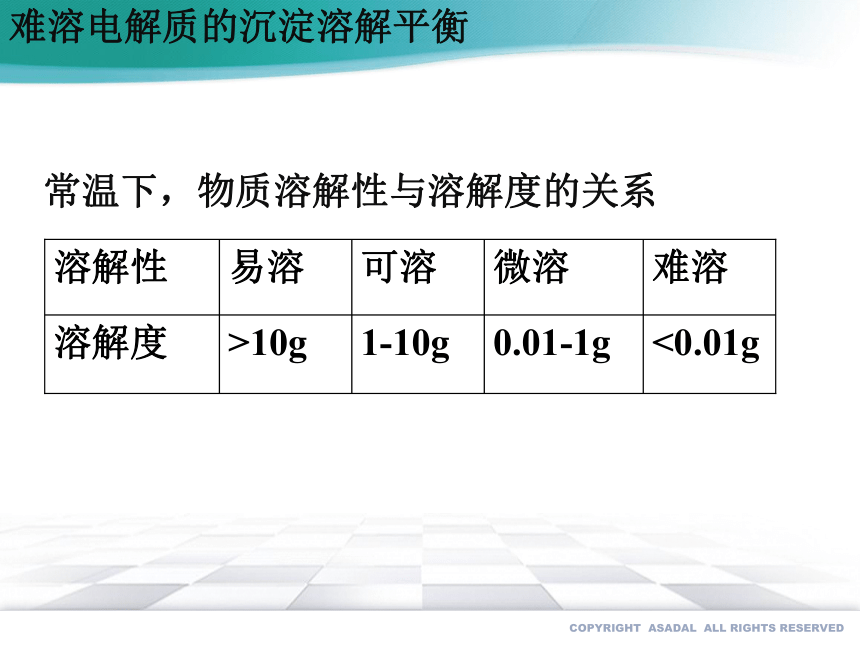
常温下,物质溶解性与溶解度的关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10g 1-10g 0.01-1g <0.01g
难溶电解质的沉淀溶解平衡
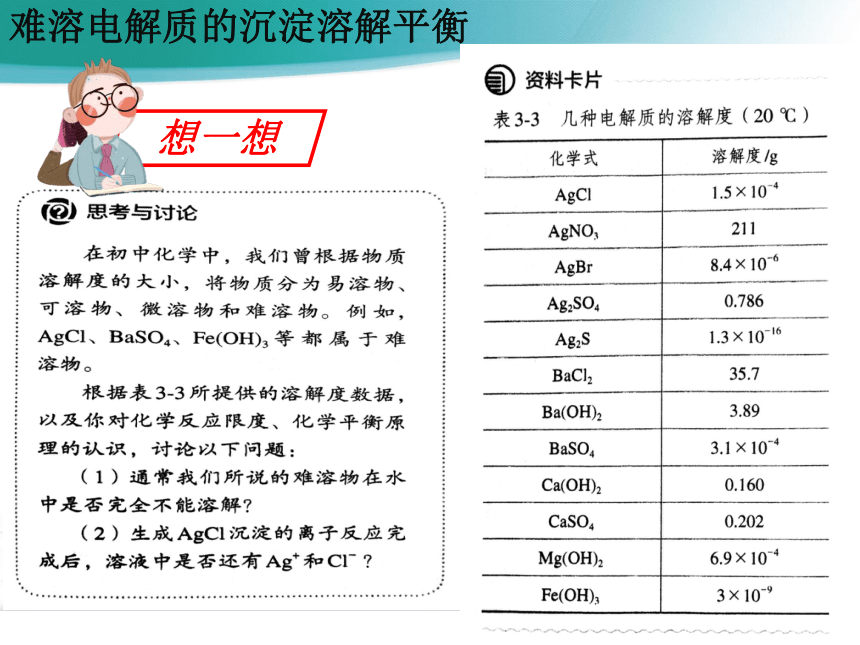
想一想
难溶电解质的沉淀溶解平衡
(1)通常所说的难溶物是指在常温下,其溶解度小于0.01g,并不是在水中完全不能溶解。
(2)生成AgCl沉淀的离子反应是指进行到一定限度,并不能完全进行到底,此时溶液中还有Ag+和Cl-。
思考解答
Ag+(aq)+Cl-(aq) AgCl(s)
难溶电解质的沉淀溶解平衡
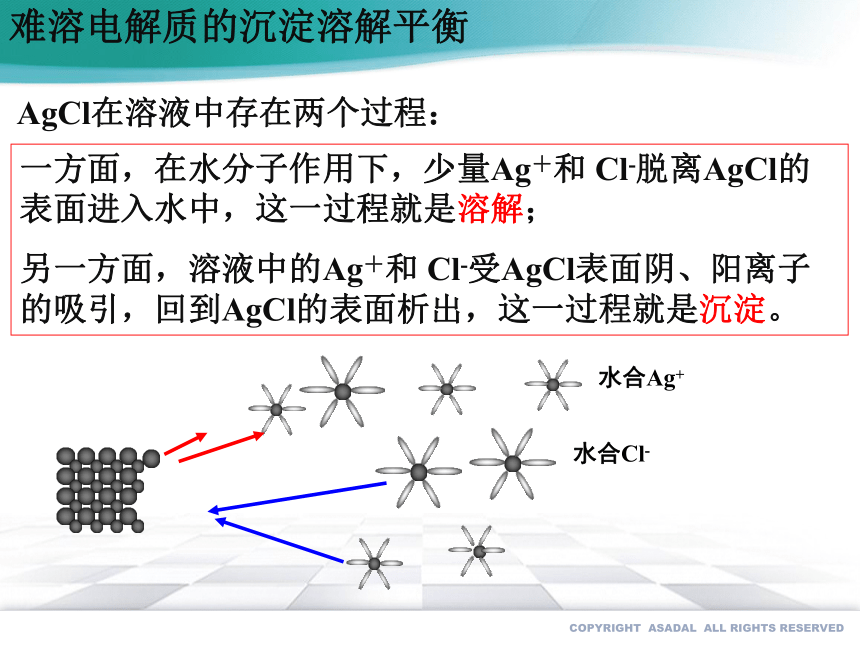
一方面,在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中,这一过程就是溶解;
另一方面,溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,这一过程就是沉淀。
水合Ag+
水合Cl-
AgCl在溶液中存在两个过程:
难溶电解质的沉淀溶解平衡
1.沉淀溶解平衡
AgCl(s) Ag+(aq)+Cl-(aq)
溶解
沉淀
在一定温度下,当沉淀和溶解的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:
人们把这种平衡称为沉淀溶解平衡
在一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学上通常认为生成沉淀的反应就进行完全了
难溶电解质的沉淀溶解平衡
(1)内因:难溶电解质本身的性质
(2)外因:
①浓度:加水,平衡向溶解方向移动
②温度:
升温,多数平衡向溶解方向移动(原因:溶解吸热);但少数向沉淀方向移动 (例:Ca(OH)2)
③同离子效应:
加入相同的离子,平衡向沉淀方向移动
④加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向溶解的方向移动
2.沉淀溶解平衡的影响因素
难溶电解质的沉淀溶解平衡
3.溶度积
对于溶解平衡:MmAn(s)
mMn+(aq)+nAm-(aq) 反应,
Ksp=[c(Mn+)]m·[c(Am-)]n
例:Ag2S(s)
2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
与电离平衡、水解平衡一样,难溶电解质的沉淀溶解平衡也存在平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
例:AgCl(s)
Ag+(aq)+Cl-(aq) Ksp=c(Ag+)·c(Cl-)
固体纯物质一般不列入平衡常数
定义
难溶电解质的沉淀溶解平衡
Ksp反映了难溶电解质在水中的溶解能力,
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15
说明S(AgCl)> S(AgBr)
意义
对于同类型(阴、阳离子个数相同)的难溶电解质,
在相同温度下,Ksp越大→S(溶解度)越大
影响因素
Ksp与难溶电解质的性质和温度有关
升温,多数平衡向溶解方向移动, Ksp 增大。
特例:Ca(OH)2升温 Ksp 减小。
难溶电解质的沉淀溶解平衡
判断有无沉淀——溶度积规则
Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>Ksp时,溶液中有沉淀析出
Q=Ksp时,沉淀与溶解处于平衡状态
QKsp的应用
难溶电解质的沉淀溶解平衡
1.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
A
c(Cl-)=(0.01×0.1) ÷0.101=9.9×10-3mol/L
c(Ag+)=(0.01×0.001) ÷0.101=9.9×10-5mol/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
课堂练习
2. 在1L含1.0×10-3mol L-1 的SO42-溶液中,注入0.01mol BaCl2溶液(假设溶液体积不变)能否有效除去SO42- 已知:Ksp(BaSO4)= 1.1×10-10
解:c(Ba2+)=0.01mol/L,c(SO42-)=0.001mol/L,生成BaSO4沉淀后,Ba2+过量,剩余的 c(Ba2+)=0.01-0.001=0.009mol/L.c(SO42-)=Ksp/c(Ba2+)= 1.1×10-10/9.0×10-3=1.2×10-8(mol/L)因为,剩余的c(SO42-)=1.2×10-8mol/L<1.0×10-5mol/L。所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。
课堂练习
课堂练习
3.若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
已知:Ksp [Fe(OH)3]= 4×10-39 Ksp [Mg(OH)2]= 1.8×10-11
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的c(OH-)为:
pH = -lg c(H+) = 3.2
Mg2+开始沉淀的pH值为:
pH = -lg c(H+) = 9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
第四节 沉淀溶解平衡
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
第一课时
常温下,物质溶解性与溶解度的关系
溶解性 易溶 可溶 微溶 难溶
溶解度 >10g 1-10g 0.01-1g <0.01g
难溶电解质的沉淀溶解平衡
想一想
难溶电解质的沉淀溶解平衡
(1)通常所说的难溶物是指在常温下,其溶解度小于0.01g,并不是在水中完全不能溶解。
(2)生成AgCl沉淀的离子反应是指进行到一定限度,并不能完全进行到底,此时溶液中还有Ag+和Cl-。
思考解答
Ag+(aq)+Cl-(aq) AgCl(s)
难溶电解质的沉淀溶解平衡
一方面,在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中,这一过程就是溶解;
另一方面,溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,这一过程就是沉淀。
水合Ag+
水合Cl-
AgCl在溶液中存在两个过程:
难溶电解质的沉淀溶解平衡
1.沉淀溶解平衡
AgCl(s) Ag+(aq)+Cl-(aq)
溶解
沉淀
在一定温度下,当沉淀和溶解的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:
人们把这种平衡称为沉淀溶解平衡
在一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学上通常认为生成沉淀的反应就进行完全了
难溶电解质的沉淀溶解平衡
(1)内因:难溶电解质本身的性质
(2)外因:
①浓度:加水,平衡向溶解方向移动
②温度:
升温,多数平衡向溶解方向移动(原因:溶解吸热);但少数向沉淀方向移动 (例:Ca(OH)2)
③同离子效应:
加入相同的离子,平衡向沉淀方向移动
④加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向溶解的方向移动
2.沉淀溶解平衡的影响因素
难溶电解质的沉淀溶解平衡
3.溶度积
对于溶解平衡:MmAn(s)
mMn+(aq)+nAm-(aq) 反应,
Ksp=[c(Mn+)]m·[c(Am-)]n
例:Ag2S(s)
2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
与电离平衡、水解平衡一样,难溶电解质的沉淀溶解平衡也存在平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
例:AgCl(s)
Ag+(aq)+Cl-(aq) Ksp=c(Ag+)·c(Cl-)
固体纯物质一般不列入平衡常数
定义
难溶电解质的沉淀溶解平衡
Ksp反映了难溶电解质在水中的溶解能力,
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15
说明S(AgCl)> S(AgBr)
意义
对于同类型(阴、阳离子个数相同)的难溶电解质,
在相同温度下,Ksp越大→S(溶解度)越大
影响因素
Ksp与难溶电解质的性质和温度有关
升温,多数平衡向溶解方向移动, Ksp 增大。
特例:Ca(OH)2升温 Ksp 减小。
难溶电解质的沉淀溶解平衡
判断有无沉淀——溶度积规则
Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>Ksp时,溶液中有沉淀析出
Q=Ksp时,沉淀与溶解处于平衡状态
Q
难溶电解质的沉淀溶解平衡
1.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列说法正确的是(AgCl Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
A
c(Cl-)=(0.01×0.1) ÷0.101=9.9×10-3mol/L
c(Ag+)=(0.01×0.001) ÷0.101=9.9×10-5mol/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
课堂练习
2. 在1L含1.0×10-3mol L-1 的SO42-溶液中,注入0.01mol BaCl2溶液(假设溶液体积不变)能否有效除去SO42- 已知:Ksp(BaSO4)= 1.1×10-10
解:c(Ba2+)=0.01mol/L,c(SO42-)=0.001mol/L,生成BaSO4沉淀后,Ba2+过量,剩余的 c(Ba2+)=0.01-0.001=0.009mol/L.c(SO42-)=Ksp/c(Ba2+)= 1.1×10-10/9.0×10-3=1.2×10-8(mol/L)因为,剩余的c(SO42-)=1.2×10-8mol/L<1.0×10-5mol/L。所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。
课堂练习
课堂练习
3.若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
已知:Ksp [Fe(OH)3]= 4×10-39 Ksp [Mg(OH)2]= 1.8×10-11
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的c(OH-)为:
pH = -lg c(H+) = 3.2
Mg2+开始沉淀的pH值为:
pH = -lg c(H+) = 9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
THANK YOU
Asadal has been running one of the biggest domain and web hosting sites in Korea since March 1998. More than 3,000,000 people have.visited our website, www. for domain registration and web hosting
