【高效备课】人教A版(2019)高中化学选必修1同步课件 1.1.2 热化学方程式(共19张PPT)
文档属性
| 名称 | 【高效备课】人教A版(2019)高中化学选必修1同步课件 1.1.2 热化学方程式(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-26 08:12:06 | ||
图片预览






文档简介
(共19张PPT)
热化学方程式燃烧热
xx老师
热化学方程式
PART 01
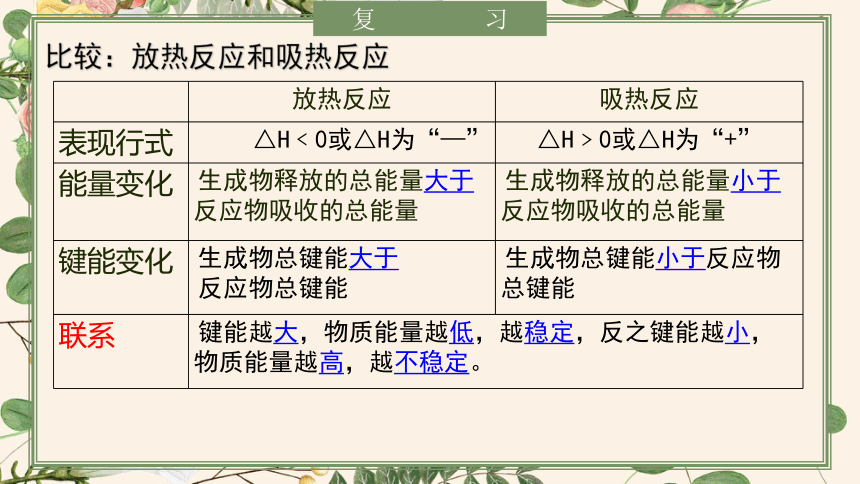
复习
放热反应 吸热反应
表现行式 △H﹤0或△H为“—” △H﹥0或△H为“+”
能量变化 生成物释放的总能量大于反应物吸收的总能量 生成物释放的总能量小于反应物吸收的总能量
键能变化 生成物总键能大于 反应物总键能 生成物总键能小于反应物总键能
联系 键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定。 比较:放热反应和吸热反应
热化学方程式
请对比分析以下两个化学方程式所表达的意义。
(1)H2 + Cl2 == 2HCl
点燃
(2)H2 (g) + Cl2 (g) = 2HCl (g) H= -184.6kJ/mol
含义:
①1 mol H2与1 mol Cl2在点燃的条件下反应生成2 mol HCl,
②2 g的H2与71 g的Cl2在点燃的条件下反应生成73 g的HCl,
③1个H2与1个Cl2在点燃的条件下反应生成2个HCl。
含义:1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl,
放出184.6kJ 的热量。
热化学方程式
2H2 (g) + O2 (g) = 2H2O (g) H=-483.6kJ/mol
H2 (g) + O2 (g) = H2O (g) H=-241.8kJ/mol
H2 (g) + O2 (g) = H2O (l) H=-285.8kJ/mol
1.概念
表示参加反应的物质的量与反应热的关系的化学方程式。
2.意义
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
比较①和②、①和③、③和④
并请归纳书写热化学方程式的要点?
2H2O (g) = 2H2 (g) + O2 (g) H=+483.6kJ/mol
热化学方程式
3、书写热化学方程式的注意事项
(3)化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
(1)需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa。
(2)各物质需标聚集状态(s、l、g、aq)。
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
热化学方程式
(2)0.5molCu(s) 与适量O2(g) 反应, 生成CuO(s), 放出78.5 kJ的热量
(1)1molC(s)与适量H2O(g) 反应,生成CO(g)和H2(g),吸收131.3kJ的热量
写出下列热化学方程式
C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ/mol
Cu(s)+ O2(g)= CuO(s) △H= - 78.5 kJ/mol
2Cu(s)+O2(g)= 2CuO(s) △H= - 314 kJ/mol
H的值与化学方程式中的计量系数有关,即对于相同的反应,
当化学计量数不同时,其 H不同。
热化学方程式
3.下图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C. S(g)+O2(g)=SO2(g) △H1= - Q1 kJ/mol
S(s)+O2(g)=SO2(g) △H2= - Q2 kJ/mol △ H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
Q1﹥Q2
△H1 <△H2
A
热化学方程式
1g液态水
1g气态水
能量增加
熔化
蒸发
1g 冰
需要吸热:
熔化、气化、升华
可以放热:
液化、凝华、凝固
2H2(g)+O2(g)=2H2O(g) △H1= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2= -Q2kJ/mol
请比较Q1和 Q2的大小。
Q1△H1 >△H2
热化学方程式
2H2(g)+O2(g)=2H2O(l) △H1= -Q1kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H2= -Q2kJ/mol
特别提醒:热量比较比数值,△H 的比较要带符号
Q1﹥Q2
△H1 <△H2
热化学方程式
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =-4b kJ
B. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H =-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =+4b kJ/mol
4.已知充分燃烧a g 乙炔气体时生成1mol CO2气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
B
练习:
热化学方程式
小结:“五看”法判断热化学方程式正误:
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH 变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应。
热化学方程式
普通化学方程式 热化学方程式
化学计量数
聚集状态
ΔH
表达式
意义
整数,既表示微粒个数
又表示物质的量
整数或分数,只表示物质的量
不要求注明
必须注明
无
必须注明
化学计量数唯一
化学计量数不唯一
表明了物质变化
不仅表明了物质变化,也表明了能量变化
燃烧热
PART 02
燃烧热
101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
研究条件
限定可燃物的量
生成物不能再燃烧
燃烧热通常可利用仪器由实验测得。
C→CO2,而不是CO
S→SO2,而不是SO3
H2→H2O(l)
1. 概念:
△H<0
燃烧热
(1)H2(g)+ O2(g)=H2O(g) H=- 241.8kJ/mol
(2)H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) H=- 571.6kJ/mol
哪一个H2燃烧热的热化学方程式? ————
⑵
燃烧热规定了可燃物的物质的量为1mol
其热化学方程式应以1mol可燃物为标准来配平其余物质的化学计量数(故常出现分数)。
强调:
练一练
燃烧热
名称 化学式 H/kJ/mol 25 ℃、101 kPa时燃烧热的热化学方程式
▲石墨 C(s) -393.5
金刚石 C(s) -395.0
▲氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
▲甲烷 CH4(g) -890.31
▲甲醇 CH3OH(l) -726.51
燃烧热
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和热 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热
反应特点 任何反应 中和反应 在氧气中燃烧的燃烧反应
方程式配平标准 任意物质的量 以生成1 mol H2O为标准 以燃烧1 mol纯物质为标准
ΔH符号 放热为“-”,吸热为“+” “-” “-”
举例 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol 25 ℃、101 kPa时,
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8kJ/mol
燃烧热
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
[特别提醒]
热化学方程式燃烧热
xx老师
热化学方程式
PART 01
复习
放热反应 吸热反应
表现行式 △H﹤0或△H为“—” △H﹥0或△H为“+”
能量变化 生成物释放的总能量大于反应物吸收的总能量 生成物释放的总能量小于反应物吸收的总能量
键能变化 生成物总键能大于 反应物总键能 生成物总键能小于反应物总键能
联系 键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定。 比较:放热反应和吸热反应
热化学方程式
请对比分析以下两个化学方程式所表达的意义。
(1)H2 + Cl2 == 2HCl
点燃
(2)H2 (g) + Cl2 (g) = 2HCl (g) H= -184.6kJ/mol
含义:
①1 mol H2与1 mol Cl2在点燃的条件下反应生成2 mol HCl,
②2 g的H2与71 g的Cl2在点燃的条件下反应生成73 g的HCl,
③1个H2与1个Cl2在点燃的条件下反应生成2个HCl。
含义:1 mol气态H2与1 mol气态Cl2反应生成2 mol气态HCl,
放出184.6kJ 的热量。
热化学方程式
2H2 (g) + O2 (g) = 2H2O (g) H=-483.6kJ/mol
H2 (g) + O2 (g) = H2O (g) H=-241.8kJ/mol
H2 (g) + O2 (g) = H2O (l) H=-285.8kJ/mol
1.概念
表示参加反应的物质的量与反应热的关系的化学方程式。
2.意义
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
比较①和②、①和③、③和④
并请归纳书写热化学方程式的要点?
2H2O (g) = 2H2 (g) + O2 (g) H=+483.6kJ/mol
热化学方程式
3、书写热化学方程式的注意事项
(3)化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol 。
(1)需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa。
(2)各物质需标聚集状态(s、l、g、aq)。
(4)热化学方程式中各物质前的化学计量数不表示微粒数目,只表示物质的量,它可以是整数也可以是分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。若反应逆向进行,则△H 改变符号,但绝对值不变。
热化学方程式
(2)0.5molCu(s) 与适量O2(g) 反应, 生成CuO(s), 放出78.5 kJ的热量
(1)1molC(s)与适量H2O(g) 反应,生成CO(g)和H2(g),吸收131.3kJ的热量
写出下列热化学方程式
C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ/mol
Cu(s)+ O2(g)= CuO(s) △H= - 78.5 kJ/mol
2Cu(s)+O2(g)= 2CuO(s) △H= - 314 kJ/mol
H的值与化学方程式中的计量系数有关,即对于相同的反应,
当化学计量数不同时,其 H不同。
热化学方程式
3.下图分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C. S(g)+O2(g)=SO2(g) △H1= - Q1 kJ/mol
S(s)+O2(g)=SO2(g) △H2= - Q2 kJ/mol △ H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
Q1﹥Q2
△H1 <△H2
A
热化学方程式
1g液态水
1g气态水
能量增加
熔化
蒸发
1g 冰
需要吸热:
熔化、气化、升华
可以放热:
液化、凝华、凝固
2H2(g)+O2(g)=2H2O(g) △H1= -Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2= -Q2kJ/mol
请比较Q1和 Q2的大小。
Q1
热化学方程式
2H2(g)+O2(g)=2H2O(l) △H1= -Q1kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H2= -Q2kJ/mol
特别提醒:热量比较比数值,△H 的比较要带符号
Q1﹥Q2
△H1 <△H2
热化学方程式
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =-4b kJ
B. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =-4b kJ/mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g) △H =-4b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H =+4b kJ/mol
4.已知充分燃烧a g 乙炔气体时生成1mol CO2气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
B
练习:
热化学方程式
小结:“五看”法判断热化学方程式正误:
①看方程式是否配平;
②看各物质的聚集状态是否正确;
③看ΔH 变化的“+”、“-”是否正确;
④看反应热的单位是否为 kJ·mol-1;
⑤看反应热的数值与化学计量数是否相对应。
热化学方程式
普通化学方程式 热化学方程式
化学计量数
聚集状态
ΔH
表达式
意义
整数,既表示微粒个数
又表示物质的量
整数或分数,只表示物质的量
不要求注明
必须注明
无
必须注明
化学计量数唯一
化学计量数不唯一
表明了物质变化
不仅表明了物质变化,也表明了能量变化
燃烧热
PART 02
燃烧热
101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
研究条件
限定可燃物的量
生成物不能再燃烧
燃烧热通常可利用仪器由实验测得。
C→CO2,而不是CO
S→SO2,而不是SO3
H2→H2O(l)
1. 概念:
△H<0
燃烧热
(1)H2(g)+ O2(g)=H2O(g) H=- 241.8kJ/mol
(2)H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) H=- 571.6kJ/mol
哪一个H2燃烧热的热化学方程式? ————
⑵
燃烧热规定了可燃物的物质的量为1mol
其热化学方程式应以1mol可燃物为标准来配平其余物质的化学计量数(故常出现分数)。
强调:
练一练
燃烧热
名称 化学式 H/kJ/mol 25 ℃、101 kPa时燃烧热的热化学方程式
▲石墨 C(s) -393.5
金刚石 C(s) -395.0
▲氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
▲甲烷 CH4(g) -890.31
▲甲醇 CH3OH(l) -726.51
燃烧热
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和热 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热
反应特点 任何反应 中和反应 在氧气中燃烧的燃烧反应
方程式配平标准 任意物质的量 以生成1 mol H2O为标准 以燃烧1 mol纯物质为标准
ΔH符号 放热为“-”,吸热为“+” “-” “-”
举例 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol 25 ℃、101 kPa时,
H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8kJ/mol
燃烧热
(2)“中和热的热化学方程式”与“中和反应的热化学方程式”的书写不同。书写中和热的热化学方程式时生成的水必须为1mol,书写中和反应的热化学方程式时生成的水的量可为任意值。
(1)“燃烧热的热化学方程式”与“燃烧的热化学方程式”的书写不同。写燃烧热的热化学方程式时可燃物必须为1mol,燃烧的热化学方程式不强调可燃物的物质的量,可为任意值。
[特别提醒]
